文章信息
- 罗钧秋, 陈代文, 余冰, 张峻豪, 刘杰
- LUO Junqiu, CHEN Daiwen, YU Bing, ZHANG Junhao, LIU Jie
- 支链氨基酸和胰岛素对大鼠骨骼肌细胞蛋白质代谢的分子调控机制研究
- The effect of branched chain amino acid and insulin on protein synthesis and proteolysis in L6 myotubes
- 南京农业大学学报, 2016, 39(6): 1010-1016
- Journal of Nanjing Agricultural University, 2016, 39(6): 1010-1016.
- http://dx.doi.org/10.7685/jnau.201512004
-
文章历史
- 收稿日期: 2015-12-04
氨基酸模式是引起营养代谢效应发生变化的主要原因, 且主要体现为以亮氨酸(Leu)为主的支链氨基酸对蛋白质代谢产生的效应。研究表明, Leu或以Leu为主的支链氨基酸混合液能够在有效地促进骨骼肌蛋白质合成代谢的同时, 抑制蛋白质降解, 并通过细胞表面氨基酸转运载体(受体)识别和介导, 将胞外氨基酸信号分子转运入细胞内, 影响PI3K/Akt-Foxo途径和mTOR信号途径, 由mTOR分子作为合成和分解代谢的共同作用点, 实现对蛋白质代谢的分子调控[1]。细胞氨基酸转运载体活性受到mTOR途径和GCN2途径的调控[2]。胰岛素(Ins)和类胰岛素生长因子Ⅰ(IGF-Ⅰ)能够通过促进mTOR活性提高氨基酸转运载体活性[3], 但目前还没有有关氨基酸影响氨基酸转运载体活性的分子调控机制的研究。本研究的假设是:支链氨基酸参与调控骨骼肌细胞表面氨基酸转运载体活性的分子机制依赖于mTOR途径。因此, 本研究目的:研究支链氨基酸影响氨基酸转运载体(转运系统A和转运系统L)表达是否依赖于mTOR途径, 并考察GCN2途径在此调控过程中的分子作用; 比较mTOR途径在细胞蛋白质合成代谢和降解代谢调控机制中的分子作用。
1 材料与方法 1.1 细胞培养L6大鼠骨骼肌成肌细胞购自于中国科学院细胞库。用高糖型DMEM (Thermo Scientific Hyclone, Inc., 含10%胎牛血清1×105 IU · L-1、青霉素、100 mg链霉素)对大鼠骨骼肌成肌细胞系L6进行常规培养。待细胞长至80%汇合度时, 以每孔2.5×104的细胞量接种至6孔培养板中, 待6孔板细胞生长至每孔105个以上细胞量(即为80%左右汇合度)时, 进行正式试验。分别考察在胰岛素和无胰岛素条件下, 先后添加mTOR抑制剂(雷帕霉素)和支链氨基酸(BCAA), 测定mTOR信号途径相关的氨基酸转运分子和蛋白质代谢调控因子的表达量。
1.2 试验设计和方法待6孔板中细胞汇合至80%时进行换液, 用含有2%胎牛血清的DMEM维持液继续培养细胞2 d, 待90%的成肌细胞分化成肌管后, 用10 μmol · L-1阿糖胞苷(Invitrogen)处理细胞24 h, 以去除未分化的成肌细胞。用缺失支链氨基酸(Leu-、Ile-、Val-)的无血清高糖型DMEM培养液培养L6肌管细胞, 使其饥饿6 h, 在培养基质中添加100 nmol · L-1雷帕霉素(Rapamycin, Invitrogen), 作用30 min后, 在培养液中添加相应的支链氨基酸(Leu+、Ile+、Val+, Invitrogen)和胎牛胰岛素(100 nmol · L-1 Insulin, Invitrogen), 使氨基酸终浓度与DMEM基础培养基浓度一致, 继续培养30 min后, 将细胞消化(0.25% typsin-EDTA, GIBCO)吹打后转移至5 mL离心管中, 500 r · min-1离心2 min, 倒去上清液, 加入3 mL PBS打匀后分装至2个1.5 mL EP管中, 800 r · min-1离心5 min, 分别用于RNA抽提、蛋白含量及Western-blot测定。本试验分为8个处理组, 每个处理6个重复孔。
1.3 考察指标及测定方法 1.3.1 检测蛋白代谢调控因子和细胞表面氨基酸转运载体mRNA表达量根据GenBank相应基因序列, 采用引物设计软件(Primer Premier 5.0)设计相关引物(表 1)。
| 基因名 Gene name |
基因功能 Gene function |
引物对序列(5′→3′) Primer pairs sequence (5′ to 3′) |
目的片段长度/bp Size |
NCBI收录号 NCBI No. |
| Atrogin-1MuRF | 调控蛋白降解 Proteolysis |
ccatcaggagaagtggatctatgtt/gcttcccccaaagtgcagta tgttctggtaggtcgtttccg/atgccggtccatgatcactt |
73355 | AY059628AY059627 |
| LAT1CD98SNAT2 | 识别并转运胞外氨基酸, 作用mTOR途径调控蛋白合成 Amino acid transportation and protein synthesis |
gaccctgatgtacgccttct/gcaggccaggataaagaaca acttggctgagtggcagaat/agatcgctggtggattcaag aatggaatccttgggctttc/gccagaccgtatgccttatg |
181118176 | AB015432NM_019283NM_181090 |
| ATF4 | 调控氨基酸转运载体表达 Amino acid transporters expression |
gctatggatgggttggtcag/agctcatctggcatggtttc | 149 | BC158588 |
| GCN2 | 调控氨基酸转运载体表达和蛋白合成 Amino acid transporters expression and protein synthesis |
agaactcaatcacgccaaca/ataaagaggcaccgggtctt | 123 | NM_019335 |
| β-actin | 内参Reference | tcgtaccactggcattgtgat/cgaagtctagggcaacatagca | 233 | NM_031144 |
总RNA用Trizol试剂(Invitrogen公司)提取, 按PrimeScriptTM反转录试剂盒(TaKaRa)说明书进行操作, 经反转录酶作用生成cDNA。实时荧光定量PCR扩增采用SYBR® Green PCR试剂盒(TaKaRa), 在Opticon DNA Engine上进行, PCR反应体系为20 μL。反应条件:95 ℃ 10 s; 95 ℃ 5 s, 60 ℃ 25 s, 共40个循环。熔解曲线分析:65~95 ℃, 每升高0.5 ℃保持1 s, 读板1次。取PCR产物, 10 g · L-1琼脂糖凝胶电泳(90 V, 15 min), 用凝胶成像系统观察结果。PCR结果采用双标法进行计算, 结果以目的基因与内参基因(β-actin)的起始浓度的比值表示, 数据进行归一化处理。
1.3.2 细胞蛋白质印迹分析在收集的细胞管中加400 μL裂解液(含1% PMSF), 裂解30 min, 期间不断来回摇动EP管, 使细胞充分裂解。裂解完后, 于4 ℃、12 000 r · min-1离心5 min。将上清液分装待测。ATF4和磷酸化S6K1(Thr389)一抗分别购自Santa Cruz Biotechnology, USA和Cell Signalling Technology, Inc., USA。
1.4 统计分析试验数据用SAS 6.12软件包的一般线性模型(GLM)进行统计分析, 并用Duncan′s法进行多重比较。数据用x±SE表示。
2 结果与分析 2.1 BCAA与胰岛素对骨骼肌细胞表面氨基酸转运载体及氨基酸调控因子表达的影响 2.1.1 BCAA与胰岛素对骨骼肌细胞表面氨基酸转运载体LAT 1、CD98和SNAT2表达的影响从图 1可见:BCAA能够提高细胞表面氨基酸转运载体LAT 1和CD98 mRNA表达水平(P < 0.05);在与胰岛素的共同作用下, LAT 1和CD98 mRNA表达量达到最高水平(P < 0.05)。在无胰岛素作用下, 雷帕霉素使LAT 1和CD98 mRNA表达水平降低至对照组水平(P>0.05);在胰岛素参与下, 雷帕霉素使LAT 1和CD98 mRNA表达量显著低于对照组水平(P < 0.05), 与Rap+/Ins+组水平相当。相对于单独添加BCAA组而言, 胰岛素可以进一步促进LAT 1和CD98 mRNA表达水平(P < 0.05)。
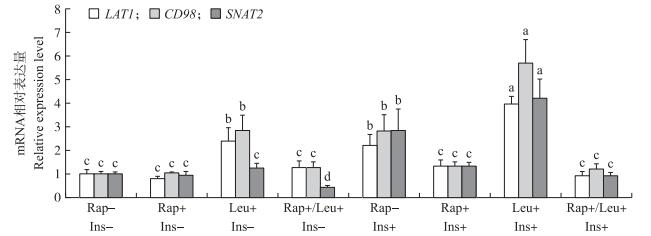
|
图 1 BCAA与胰岛素对L6细胞表面氨基酸转运载体LAT 1、CD98和SNAT2 mRNA表达量的影响 Figure 1 Effect of BCAA and insulin on mRNA expression level of LAT 1, CD98 and SNAT2 in L6 myotubes 1) Rap:雷帕霉素Rapamycin, Ins:胰岛素Insulin, Leu:亮氨酸Leucine; 2)+, -:分别表示添加、不添加; 3)不同小写字母表示差异显著(P < 0.05)。 Different lowercase letters indicate significant difference at 0.05 level. The same as follows. |
BCAA在有、无胰岛素作用下分别表现出对SNAT 2不同的作用。在无胰岛素作用下, SNAT2表达没有受到BCAA的影响, 但雷帕霉素能够显著削弱BCAA对SNAT 2的表达(P < 0.05)。在有胰岛素作用下, 胰岛素、胰岛素+BCAA能够显著增加SNAT 2的表达水平(P < 0.05), 添加雷帕霉素显著减弱SNAT 2表达, 使SNAT2表达量低于对照组水平(P < 0.05)。胰岛素能够显著提高SNAT 2的表达(P < 0.05)。
2.1.2 BCAA与胰岛素对骨骼肌细胞氨基酸调控因子GCN 2和ATF4基因表达的影响由图 2可见:BCAA对GCN 2 mRNA基因表达并没有产生显著影响(P>0.05), 雷帕霉素也没有使GCN 2 mRNA表达发生显著变化(P>0.05);ATF 4 mRNA水平也未受到BCAA和雷帕霉素的影响(P>0.05)。但是ATF4蛋白表达水平受到BCAA的调控, BCAA显著提高ATF4蛋白表达量(P < 0.05), 在胰岛素参与下, 促进效应更为显著(P < 0.05);无论胰岛素参与作用与否, BCAA促进ATF4蛋白表达都会受到雷帕霉素的明显抑制(图 3)。

|
图 2 BCAA与胰岛素对L6细胞GCN 2和ATF4 mRNA表达量的影响 Figure 2 Effect of BCAA and insulin on mRNA expression level of GCN 2 and ATF4 in L6 myotubes |

|
图 3 BCAA与胰岛素对L6细胞ATF4蛋白表达量的影响 Figure 3 Effect of BCAA and insulin on expression level of ATF4 in L6 myotubes |
由图 4可见:BCAA显著引起磷酸化S6K1蛋白表达量升高(P < 0.05), 在胰岛素协同作用下, 磷酸化S6K1蛋白表达水平增加幅度达到单独添加BCAA时的85%(P < 0.05)。雷帕霉素能显著抑制BCAA促磷酸化S6K1蛋白表达的作用。与单独添加BCAA相比较, 胰岛素可以进一步提高磷酸化S6K1蛋白表达水平(P < 0.05)。
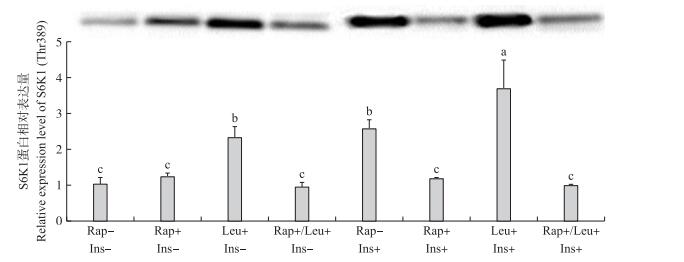
|
图 4 BCAA与胰岛素对L6细胞磷酸化S6K1(Thr389)蛋白表达量的影响 Figure 4 Effect of BCAA and insulin on expression level of S6K1 phosphorylation in L6 myotubes |
由图 5可见:MuRF1和MAFbx虽然同为肌肉分解调控蛋白因子, 但二者受到BCAA的调控途径并不完全一致。无胰岛素作用下, BCAA不会影响MuRF 1和MAFbx mRNA表达(P>0.05), 雷帕霉素也不会改变二者的表达水平(P>0.05)。在胰岛素参与下, BCAA对MuRF 1表达没有产生显著影响(P>0.05), 但能显著抑制MAFbx表达(P < 0.05), 雷帕霉素也并没有显著抑制BCAA对MAFbx表达的抑制作用(P>0.05)。在BCAA组中添加胰岛素能够显著抑制MuRF 1和MAFbx mRNA表达水平(P < 0.05)。
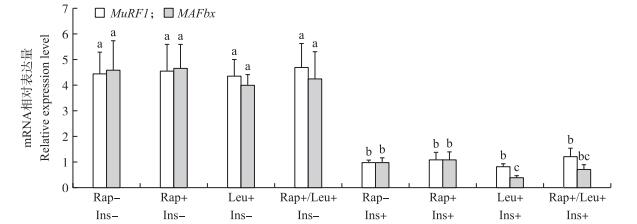
|
图 5 BCAA与胰岛素对L6细胞MuRF 1和MAFbx mRNA表达量的影响 Figure 5 Effect of BCAA and insulin on mRNA expression level of MuRF 1 and MAFbx in L6 myotubes |
细胞表面氨基酸转运受体在感应细胞内外营养状态及调控营养信号中发挥重要作用, 本研究表明这种营养调控作用依赖于mTOR信号途径。一方面, BCAA通过细胞表面活性转运载体SNAT2和LAT1-CD98诱导激活mTOR, 表现为磷酸化S6K1(Thr389)蛋白表达量增强, 在胰岛素诱导下作用更加明显。表明氨基酸转运系统A和L识别氨基酸信号分子, 细胞mTOR信号转导与细胞表面氨基酸转运载体SNAT 2、LAT1和CD98 mRNA表达量增强显著相关。另一方面, mTOR蛋白酶参与氨基酸转运受体活性或表达调控, 将胞内信号反馈给细胞表面蛋白分子。此外, 本研究发现, BCAA能独立于胰岛素作用, 促进LAT 1、CD98和SNAT2表达依赖于mTOR途径; 与胰岛素协同作用时, LAT 1、CD98和SNAT2表达进一步增加。但由于BCAA单独作用对SNAT 2表达并没有产生诱导作用, 因此mTOR信号增强是否需要氨基酸转运载体参与有待于进一步证实。
参与调控细胞蛋白质代谢和细胞表面氨基酸转运载体的分子机制有mTOR途径和GCN途径。细胞内氨基酸数量减少抑制mTOR信号转导的同时, 由于胞内未甲酰化的tRNA数量增多, 促进GCN2信号转导[4]。GCN2途径激活选择性的抑制整体蛋白合成, 但是能够促进转录因子ATF 4表达, 使细胞对营养状态发生适应性改变[5]。早期试验表明, ATF 4被认为是细胞应激效应基因[6]。RNA干扰试验证明, GCN 2和ATF4在上调编码氨基酸生物合成酶(天冬氨酸合成酶)和氨基酸转运载体(ASCT 1、CAT1、LAT1、SNAT2)相关基因的过程中发挥极其重要的作用。近期试验结果表明, ATF 4的上调可独立于GCN2, 而依赖于胰岛素介导的mTOR途径[7-8], 并且GCN2和胰岛素在促进ATF 4表达及促进氨基酸摄入和合成等方面具有协同和(或)加和效应[8]。可见, ATF 4是维持细胞氨基酸“稳态”的核心调控位点。本试验结果表明, GCN2途径并没有在BCAA信号转导过程中起到显著作用。该结果与胰岛素和氨基酸促进ATF 4表达, 而对GCN2途径并未产生影响的结论一致[9]。由于ATF4蛋白表达较ATF 4 mRNA表达具有时间滞后效应, 本试验发现ATF 4的转录水平并没有发生改变, 而其转录后水平受到BCAA的调控影响, 但是我们并不能否定ATF 4在BCAA调控氨基酸转运载体分子途径中的核心地位。但BCAA通过mTOR途径促进ATF 4表达是否与细胞表面氨基酸转运载体直接有关, 有待于进一步研究证实。此外, mTOR是否还受到GCN2途径的调控目前还不清楚。但在某些特殊情况下, 肝脏mTOR下调需要GCN2途径参与[10]。
研究证实当哺乳动物细胞整体氨基酸缺失时, SNAT 2的转运活性得以提高[11], 在本试验条件下, SNAT 2表达量并没有在BCAA单独作用下发生变化, 但在胰岛素参与下, BCAA能够明显促进SNAT 2表达, 并依赖于mTOR信号途径。表明SNAT 2表达调控与PI3K-PKB/Akt及mTOR途径有关, 与Evans等[12]研究结果一致。SNAT 2表达是ATF4调控的结果, 在氨基酸缺失和氨基酸充足情况下都能够使SNAT 2表达增强, 但两者的信号途径不同[13]。当氨基酸缺失时(饥饿)导致GCN 2活化及eIF2α磷酸化, 下调翻译起始和蛋白合成过程[14-15]。在此过程中GCN2使ATF 4表达增加, 促进氨基酸转运载体基因转录[9, 16], 这是维持细胞生命的一种适应性机制。当氨基酸满足甚至超过需要时, 氨基酸通过细胞表面转运受体介导, 作用于mTOR途径, ATF 4表达增加, 进一步促进氨基酸转运载体基因转录[9, 16], 最终导致胞内氨基酸数量增加, 促进肌肉蛋白质合成。细胞处于两种不同的状态使得氨基酸转运受体表达增加, 能够满足细胞能量的需要。但目前, 并不清楚氨基酸转运入和转运出细胞是否分别依赖于mTOR和GCN2信号途径。
3.2 BCAA与胰岛素对骨骼肌蛋白代谢调控因子表达的影响体内外研究表明, 胰岛素和氨基酸, 尤其是Leu能够活化mTOR, 促进骨骼肌蛋白质合成代谢, 分子机制在于:mTOR在胰岛素和Leu调控翻译起始过程中起到关键的作用。胰岛素与靶器官胰岛素受体(InR)结合, 活化的胰岛素受体与胰岛素受体底物1(IRS-1)结合, 从而激活磷脂酰肌醇3-激酶(PI3K), 进一步激活的蛋白激酶B (PKB/AKT)通过抑制TSC1/2复合物激活mTOR的上游因子Rheb, 从而激活mTOR。Leu并非通过PI3K途径, 而是直接通过抑制TSC1/2复合物激活mTOR[17]。可见, 氨基酸与胰岛素可以通过共同的靶位点mTOR调控蛋白质代谢。但是氨基酸转运机制与mTOR信号转导途径之间的确切关系目前仍不清楚[18]。mTOR的营养调控通过L型(LAT 1和CD98)和A型(SNAT 2)氨基酸转运系统实现[19]。本研究证实, 添加BCAA使L6细胞表面氨基酸转运载体SNAT 2、LAT1和CD98表达增强。这一结果与口服Leu为主的EAA导致人体骨骼肌LAT 1、CD98、SNAT2和PAT1表达增强, 以及Leu增强L6细胞SNAT 2转运活性的结果一致[20-21]。说明SNAT 2、LAT1和CD98能识别以Leu为主的BCAA, 将信号传递至细胞内的氨基酸转运受体[22], 影响蛋白合成代谢。转运载体表达增强可能是mTORC1途径信号转导和骨骼肌蛋白质合成的结果。这种适应性改变的结果有利于mTORC1途径信号转导和骨骼肌蛋白质合成。大量研究证实, BCAA的调控作用主要体现为Leu的分子作用[23]。
本试验以mTOR下游调控因子S6K1(Thr389)发生磷酸化的蛋白表达量来标识mTOR途径的激活程度, 发现LAT 1、CD98和SNAT2表达水平与mTOR活化程度有关。抑制SNAT 2和CD98表达水平会降低mTOR活性及蛋白合成[24]。提示:SNAT 2、LAT1和CD98可能作为研究肌肉蛋白质代谢疾病的靶位点。MuRF 1和MAFbx作为泛素-蛋白酶降解途径(UPP)中参与调控骨骼肌蛋白降解的关键调控因子, 二者共同受到插头转录因子Foxo的调控, 但Foxo的活性受到Ins-PI3K-AKT途径调控的抑制[25]。本试验发现, BCAA对MuRF 1和MAFbx产生的调控影响并不一致, 其原因可能与二者参与蛋白代谢的信号途径不完全相同有关。在无胰岛素作用下, MAFbx与MuRF 1一样, 二者的表达量并未受到BCAA的调控而发生变化; 与MuRF 1不同的是, MAFbx虽然作为mTOR的下游调控分子, 在受到胰岛素抑制效应的同时, 被BCAA激活的mTOR所抑制, 其表达量下降幅度最大, 但mTOR活性被抑制后, MAFbx表达水平并没有发生显著变化, 表明胰岛素在参与其表达的调控过程中发挥的作用可能大于BCAA发挥的作用。本研究发现, BCAA调控蛋白质降解需要依赖于胰岛素而发挥抑制蛋白分解的作用, BCAA参与蛋白降解调控主要由MAFbx在代谢调控中的变化来体现, 这可能与MAFbx在蛋白质代谢途径中的信号转导作用相关。
| [1] | Appuhamy J A D R N, Nayananjalie W A, England E M, et al. Effects of AMP-activated protein kinase (AMPK) signaling and essential amino acids on mammalian target of rapamycin (mTOR) signaling and protein synthesis rates in mammary cells[J]. Journal of Dairy Science, 2014,97: 419–429. DOI: 10.3168/jds.2013-7189 |
| [2] | Taylor P M. Role of amino acid transporters in amino acid sensing[J]. The American Journal of Clinical Nutrition, 2014,99: 223–230. DOI: 10.3945/ajcn.113.070086 |
| [3] | Hsu P P, Kang S A, Rameseder J, et al. The mTOR-regulated phosphoproteome reveals a mechanism of mTORC1-mediated inhibition of growth factor signaling[J]. Science, 2011,332: 1317–1322. DOI: 10.1126/science.1199498 |
| [4] | She P, Bunpo P, Cundiff J K, et al. General Control Nonderepressible 2(GCN2) kinase protects oligodendrocytes and white mater during branched-chain amino acid deficiency in mice[J]. The Journal of Biological Chemistry, 2013,288: 31250–31260. DOI: 10.1074/jbc.M113.498469 |
| [5] | Fujiki K, Inamura H, Matsuoka M. PI3K signaling mediates diverse regulation of ATF4 expression for the survival of HK-2 cells exposed to cadmium[J]. Archives of Toxicology, 2014,88: 403–414. DOI: 10.1007/s00204-013-1129-y |
| [6] | Chaveroux C, Carraro V, Canaple L, et al. In vivo imaging of the spatiotemporal activity of the eIF2α-ATF4 signaling pathway:insights into stress and related disorders[J]. Science Signaling, 2015,8: 269–276. DOI: 10.1126/scisignal.aad4850 |
| [7] | Zhang Q, Yu J, Liu B. Central activating transcription factor 4(ATF4) regulates hepatic insulin resistance in mice via S6K1 signaling and the vagus nerve[J]. Diabetes, 2013,62: 2230–2239. DOI: 10.2337/db12-1050 |
| [8] | Malmberg S E, Adams C M. Insulin signaling and the general amino acid control response. Two distinct pathways to amino acid synthesis and uptake[J]. Journal of Biological Chemistry, 2008,283: 19229–19234. DOI: 10.1074/jbc.M801331200 |
| [9] | Dickinson J M, Drummond M J, Coben J R, et al. Aging differentially affects human skeletal muscle amino acid transporter expression when essential amino acids are ingested after exercise[J]. Clinical Nutrition, 2013,32: 273–280. DOI: 10.1016/j.clnu.2012.07.009 |
| [10] | Xiao F, Huang Z, Li H, et al. Leucine deprivation increases hepatic insulin sensitivity via GCN2/mTOR/S6K1 and AMPK pathway[J]. Diabetes, 2011,60: 746–756. DOI: 10.2337/db10-1246 |
| [11] | Dickinson J M, Rasmussen B B. Amino acid transporters in the regulation of human skeletal muscle protein metabolism[J]. Current Opinion in Clinical Nutrition and Metabolic Care, 2013,16: 638–644. DOI: 10.1097/MCO.0b013e3283653ec5 |
| [12] | Evans K, Nasim Z, Brown J, et al. Inhibition of SNAT2 by metabolic acidosis enhances proteolysis in skeletal muscle[J]. Clinical Journal of the American Society of Nephrology, 2008,19: 2119–2129. DOI: 10.1681/ASN.2007101108 |
| [13] | Nadege P, Taylor P M. The role of amino acid transporters in nutrition[J]. Current Opinion in Clinical Nutrition and Metabolic Care, 2013,16: 57–65. DOI: 10.1097/MCO.0b013e32835a885c |
| [14] | Wek R C, Cavener D R. Translational control and the unfolded protein response[J]. Antioxid and Redox Signaling, 2007,9: 2357–2371. DOI: 10.1089/ars.2007.1764 |
| [15] | Baird T D, Wek R C. Eukaryotic initiation factor 2 phosphorylation and translational control in metabolism[J]. Advances in Nutrition, 2012,3: 307–321. DOI: 10.3945/an.112.002113 |
| [16] | Wang C, Guo F. Effects of activating transcription factor 4 deficiency on carbohydrate and lipid metabolism in mammals[J]. IUBMB Life, 2012,64: 226–230. DOI: 10.1002/iub.v64.3 |
| [17] | Wu G. Functional amino acids in nutrition and health[J]. Amino Acids, 2013,45: 407–411. DOI: 10.1007/s00726-013-1500-6 |
| [18] | Jewell J L, Russell R C, Guan K. Amino acid signalling upstream of mTOR[J]. Nature Reviews Molecular Cell Biology, 2013,14: 133–139. DOI: 10.1038/nrm3522 |
| [19] | Hundal H S, Taylor P M. Amino acid transceptors:gate keepers of nutrient exchange and regulators of nutrient signaling[J]. American Journal of Physiology-Endocrinology and Metabolism, 2009,296: 603–613. DOI: 10.1152/ajpendo.91002.2008 |
| [20] | Drummond M J, Glynn E L, Fry C S, et al. An increase in essential amino acid availability upregulates amino acid transporter expression in human skeletal muscle[J]. American Journal of Physiology-Endocrinology and Metabolism, 2010,298: 1011–1018. DOI: 10.1152/ajpendo.00690.2009 |
| [21] | Drummond M J, Fry C S, Glynn E L, et al. Skeletal muscle amino acid transporter expression is increased in young and older adults following resistance exercise[J]. Journal of Applied Physiology, 2011,111: 135–142. DOI: 10.1152/japplphysiol.01408.2010 |
| [22] | Reynolds B, Laynes R, Ogmundsdottir M H, et al. Amino acid transporters and nutrient sensing mechanisms:new targets for treating insulin-linked disorders[J]. Biochemical Society Transactions, 2007,35: 1215–1217. DOI: 10.1042/BST0351215 |
| [23] | Gran P, Cameron-Smith D. The actions of exogenous leucine on mTOR signalling and amino acid transporters in human myotubes[J]. BMC Physiology, 2011,11: 10–19. DOI: 10.1186/1472-6793-11-10 |
| [24] | Kavitha J V, Rosario F J, Nijland M J, et al. Down-regulation of placental mTOR, insulin/IGF-Ⅰ signaling, and nutrient transporters inresponse to maternal nutrient restriction in the baboon[J]. The FASEB Journal, 2014,28: 1294–1305. DOI: 10.1096/fj.13-242271 |
| [25] | Senf S M, Dodd S L, Judge A R. FOXO signaling is required for disuse muscle atrophy and is directly regulated by Hsp70[J]. American Journal of Physiology-Cell Physiology, 2010,298: C38–C45. DOI: 10.1152/ajpcell.00315.2009 |




