文章信息
- 李晓丹, 程丽, 夏冰, 汪仁
- LI Xiaodan, CHENG Li, XIA Bing, WANG Ren
- 石蒜根际拮抗细菌HH1的筛选鉴定及其抑菌活性研究
- Screening and identification of antagonistic bacteria HH1 from rhizosphere soil of Lycoris radiata (L'Her.) Herb and its antifungal activity
- 南京农业大学学报, 2016, 39(6): 939-946
- Journal of Nanjing Agricultural University, 2016, 39(6): 939-946.
- http://dx.doi.org/10.7685/jnau.201605033
-
文章历史
- 收稿日期: 2016-05-20
农业生产中, 真菌病害是阻碍植物生长、影响作物产量的主要病害。其中, 主要由禾谷镰刀菌(Fusarium gramiuearum)引起的小麦赤霉病(Fusarium head blight, FHB)是一种典型的土传病害, 主要危害小麦的穗部, 使穗籽粒变色皱缩, 粒质量下降, 可使小麦减产达40%~60%[1]。另外, 病原菌侵染过程中产生的赤霉菌毒素存留于籽粒中, 严重影响人畜健康[2], 特别是脱氧雪腐镰刀菌烯醇(DON)对人和动物的免疫功能会产生明显的影响。
小麦赤霉病的控制目前主要靠田间药物防治, 大量农药的施用导致了严重的环境污染和生态问题。另外, 随着农药的不断使用, 病原菌的抗药性逐渐增强。利用拮抗微生物来防治植物病原菌的优势在于多种成分发挥作用可以避免抗药性问题, 而且对环境、人和动物的安全性也更好。新的拮抗微生物资源及其代谢产物成为目前研究的热点, 关于小麦赤霉病拮抗菌分离相关研究也较多[3-4]。目前筛选到的小麦赤霉病菌拮抗菌多为细菌, 包括假单胞菌、芽孢杆菌和放线菌等[5-8]。
药用植物有效成分多存在于植物根部, 活性物质可分泌到根际土壤中, 根际微生物长期生长于这个环境中, 其产生的活性物质比例和种类均高于其他土壤微生物[9]。石蒜属(Lycoris)植物是传统的药用植物, 近年来发现该属植物具有调节中枢神经、心血管系统的作用, 同时还具有抗癌抗肿瘤、抗菌和抗病毒作用等[10]。本研究对石蒜(Lycoris radiata(L′Her.) Herb)根际细菌HH1进行了分离鉴定, 并研究了菌株HH1的抗真菌活性, 为今后该菌株在小麦赤霉病的田间生物防治提供理论依据。
1 材料与方法 1.1 病原菌及培养基病原菌:小麦赤霉病病原真菌禾谷镰刀菌(F.gramiuearum) F201521由江苏省农业科学院提供。
PDA固体培养基:沸水煮去皮土豆200.0 g, 取滤液, 加入20.0 g蔗糖, 定容至1 L, 自然pH, 分装至每瓶100 mL, 每瓶加1.8 g琼脂粉, 121 ℃灭菌15 min。
NA培养基:牛肉浸膏5.0 g, 蛋白胨10.0 g, NaCl 10.0 g, 定容至1 L, pH7.0, 分装至三角瓶中, 每瓶分装100 mL, 固体培养基每瓶需加入1.8 g琼脂粉, 121 ℃灭菌15 min。
摇瓶基础培养基:Na2HPO4 · 12H2O 14.6 g, KH2PO43.0 g, NaCl 0.5 g, pH7.0, 根据需要加入碳源、氮源等培养基成分, 121 ℃灭菌15 min。
1.2 根际微生物的分离称取石蒜植株根部土10.0 g (采集自南京中山植物园), 加入装有90 mL无菌水的250 mL三角瓶中, 充分混匀。梯度稀释后取10-6、10-7、10-8稀释液涂布于NA固体培养基, 30 ℃培养箱中倒置培养。在平板上, 根据菌落的形状、大小、颜色等培养特征初步分类, 分别挑出, 划线纯化并保藏。
1.3 拮抗菌的活性筛选以小麦赤霉病菌F201521为筛选靶标进行初筛。在PDA平板中央接种小麦赤霉病菌菌饼, 28 ℃培养1~2 d, 待长到直径2 cm左右时, 在菌落四周点接4种待测根际菌, 重复3次, 于28 ℃培养3~5 d, 观察待测菌对小麦赤霉病菌是否具有有抑制作用。将初筛获得的有抑菌作用的菌株作进一步筛选。在平板中央接种小麦赤霉病菌菌饼, 在距离该菌饼约3 cm处, 点接待测菌, 28 ℃培养, 以只接种小麦赤霉病菌的PDA平板为对照, 待对照长满平板时测量抑菌圈直径, 重复3次。将经过复筛确定了抑菌效果的菌株在平板上划线转接20次后, 验证其抑菌活性与初代是否有差异。
1.4 拮抗菌的鉴定划线培养观察菌体形态, 并进行革兰氏染色及芽孢染色, 参考《常见细菌系统鉴定手册》[11]对菌株进行生理生化鉴定。将获得的16S rRNA基因序列进行BLAST比对, 根据比对结果, 采用邻接法(neighbour-joining methods, NJ)利用Mega 6.0软件构建系统发育树。
1.5 拮抗菌无菌发酵液对小麦赤霉病菌生长的影响 1.5.1 拮抗菌无菌发酵液的制备取活化后的拮抗菌至装有50 mL NA液体培养基的250 mL三角瓶中, 30 ℃震荡培养24 h后作为种子液, 按照5%(体积分数, 下同)的接种量转接于NA液体培养基, 30 ℃振荡培养48 h, 培养液10 000 r · min-1离心10 min, 去除菌体, 取上清液, 0.22 μm微孔滤膜过滤除菌后备用。
1.5.2 孢子悬液的制备接种小麦赤霉病菌至PDA固体培养基, 28 ℃培养至菌丝长满整个平板, 加无菌水5 mL, 洗下孢子, 稀释成105 mL-1的孢子悬液, 备用。
1.5.3 小麦赤霉病菌孢子生长的测定在小麦赤霉病菌孢子悬液中按照10%、25%和50%的比例分别加入拮抗菌无菌发酵液, 以相应比例的NA液体培养基与小麦赤霉病菌孢子悬液的混合液作为对照, 28 ℃培养12 h后, 观察孢子的生长情况。
1.5.4 小麦赤霉病菌菌丝生长的测定在PDA培养基中加入拮抗菌无菌发酵液, 使滤液浓度分别为10%、20%和30%。将小麦赤霉病菌菌饼接种至PDA平板中央, 重复3次, 28 ℃培养5 d后镜检, 观察菌丝形态。
1.6 拮抗物质的硫酸铵沉淀拮抗菌发酵液于4 ℃、10 000 r · min-1离心10 min, 去除菌体。在发酵上清液中加入硫酸铵粉末至硫酸铵饱和度分别为20%、40%、60%、70%和80%, 4 ℃冰箱中冷藏过夜后, 10 000 r · min-1离心20 min, 加入等体积的PBS缓冲液(pH7.0)溶解沉淀, 透析袋透析过夜, 以小麦赤霉病菌为指示菌, 采用牛津杯法测其抑菌活性, 以相同方法处理的NA液体培养基作为对照, 重复3次。
1.7 拮抗菌产抗菌物质的摇瓶培养基及培养条件优化分别采用单因素试验优化摇瓶培养基碳源、氮源、微量金属离子及培养条件。
1.7.1 碳源以10 g · L-1蛋白胨为氮源, 在基础培养基中以多种不同的单糖、二糖及多糖作为唯一碳源, 包括葡萄糖、果糖、乳糖、麦芽糖、蔗糖、甘露醇、甘油、玉米粉、可溶性淀粉, 浓度为10 g · L-1。种子液以接种量1%接入装有100 mL不同碳源的培养基(250 mL三角瓶)中。30 ℃、180 r · min-1震荡培养48 h, 测定D600值, 取50 mL发酵液, 8 000 r · min-1离心10 min, 保留上清液, 拮抗物质的硫酸铵沉淀及抑菌活性测定同1.6节。
1.7.2 氮源基础培养基中加入确定的最适碳源, 加入不同氮源, 包括尿素、蛋白胨、NH4Cl、(NH4)2SO4、NH4NO3、KNO3、NaNO3, 浓度为10 g · L-1。后续操作同1.7.1节。
1.7.3 金属离子基础培养基中分别添加二价金属离子的硫酸盐, 包括Mg2+、Mn2+、Ca2+、Cu2+、Co2+、Fe2+和Zn2+, 浓度为50 mg · L-1。后续操作同1.7.1节。
1.7.4 培养条件采用优化后的培养基配方培养拮抗菌, 对拮抗菌发酵时间、温度、初始pH值、转速、装液量、接种量进行优化。发酵时间选取24、36、48、60、72和84 h。温度选取20、25、30、35和40 ℃。初始pH值选择3.0、4.0、5.0、6.0、7.0、8.0、9.0和10.0。转速选取50、100、150和200 r · min-1。装液量选取30、60、90、120和150 mL (250 mL三角瓶)。接种量选取1%、5%、10%和15%。
1.8 拮抗物质的稳定性测定抗菌粗提物的制备:将拮抗菌接种到NA液体培养基中, 30 ℃、180 r · min-1震荡培养48 h后, 10 000 r · min-1离心10 min, 上清液中加入硫酸铵粉末至饱和度为60%, 4 ℃冰箱中放置过夜, 10 000 r · min-1离心20 min, PBS缓冲液(pH7.0)溶解沉淀, 透析袋透析24 h, 检测蛋白浓度, 并根据需要用缓冲液稀释至所需浓度。
1.8.1 热稳定性测定选取30、40、50、60、70、80、90、100、110和121 ℃, 将经硫酸铵沉淀的1.0 mg · mL-1粗提液分别置于不同温度条件下处理20 min, 以未经处理的粗提物作为对照, 采用牛津杯法测定温度处理后粗提物对小麦赤霉病菌的抑菌活性, 重复3次。
1.8.2 pH稳定性测定分别选取pH值3.0、4.0、5.0、6.0、7.0、8.0、9.0和10.0, 将等量的粗提物分别加入相应pH值的缓冲液中, 37 ℃水浴60 min, 调节pH至中性, 用PBS缓冲液(pH 7.0)调节至粗蛋白浓度为1.0 mg · mL-1, 以未经处理的1.0 mg · mL-1的粗提液为对照, 采用牛津杯法测定不同pH值处理后粗提物对小麦赤霉病菌的抑菌活性, 重复3次。
1.8.3 对蛋白酶K稳定性测定取1.0 mg · mL-1粗提液0.9 mL, 加入蛋白酶K (10 mg · mL-1)100 μL, 37 ℃水浴处理60 min, 以加入100 μL PBS缓冲液(pH7.0)的0.9 mL粗提液(浓度1.0 mg · mL-1)和浓度为1 mg · mL-1蛋白酶K 1.0 mL作为对照, 牛津杯法测定对小麦赤霉病菌的抑菌活性, 重复3次。
2 结果与分析 2.1 拮抗菌的分离及抑菌活性分析从石蒜根际采集的3份土样中共分离到43株细菌, 经抑菌活性的初筛、复筛获得7株对小麦赤霉病菌具有拮抗效果的菌株(表 1)。稳定性试验结果表明:7株菌的抑菌活性是可以稳定保持的。抑菌圈直径大代表其抑菌活性强, 生长快有利于菌株发酵, 考虑其可应用性, 其中一株抑菌圈直径大且生长速度较快的菌株HH1被选作进一步研究的对象。
| 菌株 Strains | 菌落最大直径/mm Colony diameter | 抑菌圈直径/mm Inhibitory zone diameter |
| HH1 | 34.0±1.4b | 10.0±1.4a |
| HH3 | 36.5±2.1b | 4.8±0.4bc |
| HH9 | 23.0±2.8c | 4.5±0.7bc |
| HH11 | 43.5±0.7a | 7.0±1.4b |
| HH18 | 14.0±1.4d | 2.5±0.7cd |
| HH24 | 25.5±0.7c | 6.5±0.7b |
| HH33 | 33.0±1.4b | 1.3±0.8d |
| 注:同列不同小写字母表示处理间差异显著(P < 0.05)。 Note: Different letters in the same column indicate significant difference at 0.05 level. | ||
菌落形态观察发现菌株HH1菌落为浅黄色, 边缘不整齐, 表面湿润; 显微观察发现其细胞呈短杆状, 革兰氏染色阳性, 芽孢椭圆形中生或端生。将菌株HH1的16S rRNA序列提交GenBank (登录号KX101072)。BLAST分析发现与HH1的16S rRNA同源性较高的菌株均属于芽孢杆菌属(Bacillus)。16S rRNA进行系统发育分析结果显示其与Bacillus pumilus BDH24聚在一支(图 1)。

|
图 1 基于菌株HH1及相关菌株的16S rRNA序列采用邻接法建立的系统发育树 Figure 1 Phylogenetic tree established using neighbour-joining method based on 16S rRNA sequence of strain HH1 and related strains |
常规生理生化试验表明菌株HH1是好氧菌, 生理生化反应呈阳性的是:过氧化氢酶、VP、产H2S、明胶液化试验; 呈阴性的反应为:淀粉水解、产NH3、甲基红、吲哚试验。
最终, 结合形态特征、生理生化试验[11]和16S rRNA序列分析结果, 将菌株HH1鉴定为短小芽孢杆菌(Bacillus pumilus)。
2.3 菌株HH1发酵滤液对小麦赤霉病菌孢子和菌丝生长发育的抑制通过显微镜计算萌发孢子数量发现, 在孢子悬液中加入菌株HH1的发酵上清液可抑制小麦赤霉病菌孢子的萌发。当上清液的浓度为10%时, 即可抑制小麦赤霉病菌孢子的萌发, 抑制率为70%左右, 当发酵上清液所占比例增加时, 抑制作用增强, 上清液比例为50%时, 抑制率可达90%。
PDA平板上观察菌株HH1不同浓度的无菌发酵滤液对小麦赤霉病菌菌丝生长的抑制效果(图 2)。小麦赤霉病菌菌丝生长受到抑制, 生长变缓慢, 并出现菌丝生长稀疏的现象。

|
图 2 不同浓度的菌株HH1无菌发酵液对小麦赤霉病菌的抑制效果 Figure 2 Inhibitory effect of strain HH1 fermentation filtrate against Fusarium gramiuearum |
用硫酸铵沉淀菌株HH1的发酵上清液, 检测不同饱和度下获得粗提物对小麦赤霉病菌的抑制能力。从图 3可以看出:粗提物的拮抗活性随着硫酸铵饱和度的提高而增加, 在饱和度达到60%后基本处于平衡, 确定60%硫酸铵饱和度即为菌株HH1所产拮抗物质的最佳沉淀条件。沉淀后上清液进行活性检测, 发现活性物质基本沉淀完全。
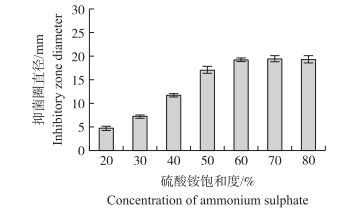
|
图 3 不同饱和度硫酸铵沉淀获得粗提物对小麦赤霉病菌的抑制活性 Figure 3 Antifungal activity of crude extract at different concentration of ammonium sulphate |
从表 2可见, 以抑菌活性来看, 葡萄糖作为唯一碳源时抑菌活性最好。玉米粉作为唯一碳源时菌体密度最大, 但是葡萄糖作为唯一碳源时抑菌圈直径最大, 最终选择葡萄糖作为碳源。在葡萄糖浓度为0~25 g · L-1的范围内进行浓度梯度试验, 结果发现在浓度为20 g · L-1时, 最适合抑菌物质的产生。
| 碳源 Carbon source | 抑菌圈直径/mm Inhibitory zone diameter | 菌体密度 Bacteria density |
| 葡萄糖Glucose | 13.1±0.42a | 4.55±0.07a |
| 果糖Fructose | 8.3±0.14c | 2.81±0.14c |
| 蔗糖Sucrose | 9.8±0.57b | 3.50±0.31b |
| 麦芽糖Maltose | 7.2±0.14c | 2.73±0.10c |
| 乳糖Lactose | 8.2±0.42c | 2.89±0.11c |
| 可溶性淀粉Soluble starch | 7.7±0.14c | 2.67±0.14c |
| 甘露醇Mannitol | 6.9±0.28c | 2.61±0.31c |
| 玉米粉Corn flour | 10.5±1.30b | 4.65±0.30a |
| 注:同列不同小写字母表示处理间差异显著(P < 0.05)。下表同。 Note: Different letters in the same column indicate significant difference at 0.05 level.The same as follows. | ||
从表 3可见, 以蛋白胨作为氮源时的抑菌圈直径最大, 同时菌体密度较高, 最终选用蛋白胨作为氮源。分别添加浓度为0~25 g · L-1蛋白胨进行浓度梯度试验, 结果发现蛋白胨浓度为10 g · L-1时, 菌株HH1的生长和抗菌物质的产生达到最佳。
| 氮源 Nitrogen source | 抑菌圈直径/mm Inhibitory zone diameter | 菌体密度 Bacteria density |
| NH4Cl | 9.5±0.42c | 2.29±0.13d |
| (NH4)2SO4 | 8.7±0.28cd | 2.14±0.06d |
| NaNO3 | 8.1±0.28de | 2.35±0.21d |
| KNO3 | 9.2±0.07c | 2.87±0.42c |
| NH4NO3 | 7.7±0.14e | 2.26±0.08d |
| 尿素Urea | 11.2±0.21b | 3.71±0.16b |
| 蛋白胨Peptone | 15.3±0.42a | 5.35±0.21a |
分别添加7种不同的二价金属离子的硫酸盐(50 mg · L-1), 抑菌圈直径和菌体浓度见表 4。发现Co2+对菌体生长不利, 其他金属离子对菌体生长和所产抑菌物质并没有太大影响, 其中添加Mg2+时抑菌圈直径最大, 说明Mg2+的加入可以促进菌株HH1产生抑菌物质。分别添加25~100 mg · L-1 MgSO4, 结果显示加入50 mg · L-1 MgSO4最适合菌株HH1产生抗菌物质的最佳浓度。
| 金属离子 Metalion | 抑菌圈直径/mm Inhibitory zone diameter | 菌体密度 Bacteria density |
| Ca2+ | 18.7±0.71b | 5.95±0.35a |
| Fe2+ | 15.5±0.42c | 4.22±0.17b |
| Zn2+ | 13.2±0.14e | 3.85±0.27b |
| Mn2+ | 14.3±0.42d | 3.93±0.10b |
| Cu2+ | 11.2±0.28f | 3.72±0.31b |
| Mg2+ | 22.7±0.49a | 5.82±0.45a |
| Co2+ | 4.6±0.14g | 1.26±0.08c |
随着培养时间的延长, 发酵液菌浓度上升, 产生的抑菌物质在72 h时达到最高(图 4-A)。温度梯度试验发现:30 ℃为菌株HH1中抑菌物质产生的最适温度(图 4-B)。发酵液初始pH值为7.0时抑菌效果最好(图 4-C)。在250 mL三角瓶中装入不同体积的培养基, 在相同的转速下培养, 装液量为60 mL时抑菌物质的产生达到最高值(图 4-D)。随着转速增大, 抑菌物质产生量增加, 当转速达到150 r · min-1时达到最大(图 4-E)。接种量为5%时, 最适合菌株HH1产生抑菌物质(图 4-F)。

|
图 4 拮抗菌株HH1发酵条件优化 Figure 4 The optimization of HH1 fermentation condition |
将硫酸铵沉淀获得的粗提物分别在不同温度下处理60 min后, 检测反应液对小麦赤霉病菌的拮抗活性。从图 5可见:温度低于60 ℃时, 该拮抗物质较稳定, 能够保持在90%以上的抑菌活性, 但是当温度上升到70 ℃时, 粗蛋白的抑菌活性只有对照的68.32%, 110 ℃时已经完全丧失抑菌活性。表明该拮抗物质对高温较敏感。
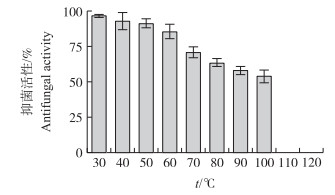
|
图 5 温度对粗提物抗小麦赤霉病菌活性的影响 Figure 5 Effects of temperature on antifungal activity of the crude extract |
将粗提物在不同pH值的缓冲液中37 ℃处理60 min后, 测定不同pH值处理后其对小麦赤霉病菌的抑菌活性。从图 6可以看出:抗菌物质在pH值中性范围内较稳定, 在酸性和碱性条件下活性不稳定, 当pH值上升到11.0后, 抑菌能力下降至30%左右。说明该拮抗物质对酸碱较敏感。
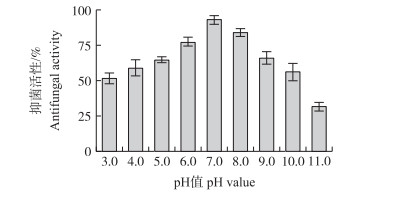
|
图 6 pH值对粗提物抗小麦赤霉病菌活性的影响 Figure 6 Effects of pH value on antifungal activity of the crude extract |
粗提物经蛋白酶K在37 ℃处理60 min后, 检测其对小麦赤霉病菌的抑菌活性。结果显示:蛋白酶K本身对小麦赤霉病菌并没有拮抗作用。经蛋白酶K处理后的粗提物的抑菌活性有所下降, 抑菌圈直径从22.3 mm下降至7.2 mm, 下降67.7%。
3 结论与讨论本研究从石蒜根际土壤中筛选到7株可拮抗小麦赤霉病菌的根际细菌, 其中菌株HH1的拮抗效果较好, 鉴定其为短小芽孢杆菌(B.pumilus)。芽孢杆菌属具有很好的抗逆和抗菌防病能力, 其抑菌范围很广, 对人畜无致病性, 是目前生防细菌中研究较多的一类细菌。芽孢杆菌属细菌可以分泌各种抗真菌物质, 比如抗生素[12]、挥发性有机化合物[13]、次生代谢物[14]、细胞壁降解酶[15]、脂肽[16]和抗真菌蛋白[7-8, 17]。抗真菌物质发挥作用一般通过3种形式:破坏真菌细胞膜[18], 破坏真菌细胞壁完整性[19], 通过抑制DNA合成引起真菌细胞死亡[20]。近几年, 许多研究结果显示因作用细胞的种类不同, 单一多肽即可发挥上述3种形式中1种或更多作用[21]。从芽孢杆菌属细菌中还分离出了一系列新的抗菌物质[22-23], 已成为发掘新的抗真菌物质的重要来源。
菌株HH1的无菌发酵滤液可抑制小麦赤霉病菌孢子的萌发, 对菌丝的生长也具有抑制作用。硫酸铵沉淀法沉淀上清液中的粗蛋白, 发现硫酸铵饱和度60%左右, 活性物质基本沉淀完全, 由此可以初步推断菌株HH1所产拮抗物质可能是一种蛋白类或肽类物质。在对菌株HH1产拮抗物质的最佳培养基和培养条件进行优化的基础上, 对其稳定性进行了研究, 发现拮抗物质在pH中性和低于70 ℃的条件下较稳定, 在70 ℃以上温度处理60 min和蛋白酶K处理60 min后, 粗提物拮抗活性明显降低, 以上结果与之前的研究有一定的相似性, 枯草芽孢杆菌B9601-Y2的硫酸铵蛋白沉淀物用蛋白酶K处理后其抑菌活性下降, 80 ℃处理30min后抑菌活性显著下降[24], 枯草芽孢杆菌B38分泌的抑菌活性物质对高于80 ℃的温度和蛋白酶K敏感, 产生的胞外抗菌物质具有与蛋白质类似的性质[25], 枯草芽孢杆菌B29中活性抗菌物质可由硫酸铵沉淀获得且对蛋白酶K部分敏感[26]。菌株HH1的抑菌活性物质同样具有对蛋白酶K敏感的特性, 结合硫酸铵沉淀后活性检测的结果推测菌株HH1产生的拮抗物质可能为蛋白质, 对菌株HH1抗菌蛋白有待进一步开展纯化和特性研究。
本研究可为小麦赤霉病生防菌剂的研发提供材料, 为拮抗蛋白相关基因的克隆和转基因植物的研究提供有效的材料, 也可为石蒜属植物根际微生物的科学利用提供新思路。
| [1] | McMullen M, Jones R, Gallenberg D. Scab of wheat and barley:areemerging disease of devastating impact[J]. Plant Disease, 1997,81: 1340–1348. DOI: 10.1094/PDIS.1997.81.12.1340 |
| [2] | Pirgozliev S R, Edwards S G, Hare M C, et al. Strategies for the control of Fusariumhead blight in cereals[J]. European Journal of Plant Pathology, 2003,109: 731–742. DOI: 10.1023/A:1026034509247 |
| [3] | Xu X M, Parry D W, Nicholson P, et al. Within-field variability of Fusariumhead blight pathogens and their associated mycotoxins[J]. European Journal of Plant Pathology, 2008,120: 21–34. |
| [4] | 韩青梅, 曹丽华. 小麦赤霉病的生物防治研究进展[J]. 麦类作物学报, 2003, 23(3): 128–131. Han Q M, Cao L H. Progress of the biological control on Fusarium graminearum Schw.of wheat[J]. Journal of Triticeae Crops, 2003,23(3): 128–131. (in Chinese) |
| [5] | 辛海峰, 孟艳艳, 李建宏, 等. 一株萎缩芽孢杆菌在小麦中的定植及对赤霉病的防治[J]. 生态学杂志, 2013, 32(6): 1490–1496. Xin H F, Meng Y Y, Li J H, et al. Bacillus atrophaeus strain's colonization in wheat plant and its inhibition efficiency to Fusarium head blight[J]. Chinese Journal of Ecology, 2013,32(6): 1490–1496. (in Chinese) |
| [6] | Palazzinia J M, Ramirez M L, Torres A M, et al. Potential biocontrol agents for Fusarium head blight and deoxynivalenol production in wheat[J]. Crop Protection, 2007,26(11): 1702–1710. DOI: 10.1016/j.cropro.2007.03.004 |
| [7] | 裴韬, 任大明, 石皎. 小麦赤霉病拮抗菌P72抗菌物质的分离纯化和性质研究[J]. 安徽农业科学, 2009, 37(6): 2576–2577. Pei T, Ren D M, Shi J. Study on property and purification of antagonistic bacteria P72 against wheat scab[J]. Journal of Anhui Agricultural Sciences, 2009,37(6): 2576–2577. (in Chinese) |
| [8] | 胡晓丹, 王建伟, 李孝敬, 等. 赤霉病菌拮抗菌Bacillus subtilis AF0907抗菌物质研究[J]. 中国生物防治学报, 2015, 31(3): 378–385. Hu X D, Wang J W, Li X J, et al. Study of antagonistic substance from Bacillus subtilis AF0907 against Fusarium graminearum[J]. Chinese Journal of Biological Control, 2015,31(3): 378–385. (in Chinese) |
| [9] | Basil A J, Strap J L, Knotek-Smith H M, et al. Studies on themicrobial populations of the rhizosphere of big sagebrush (Artemisia tridentata)[J]. Journal of Industrial Microbiology and Biotechnology, 2004,31: 278–288. DOI: 10.1007/s10295-004-0140-y |
| [10] | 贾献慧, 周铜水, 郑颖, 等. 石蒜科植物生物碱成分的药理学研究[J]. 中医药学刊, 2001, 19(6): 573–574. Jia X H, Zhou T S, Zheng Y, et al. Pharmacological study on alkaloids of amaryllidaceae medicinal plants[J]. Study Journal of Traditional Chinese Medicine, 2001,19(6): 573–574. (in Chinese) |
| [11] | 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001 . Dong X Z, Cai M Y. The Manual of Determinative Bacteriology[M]. Beijing: Science Press, 2001 . (in Chinese) |
| [12] | Stein T. Bacillus subtilis antibiotics:structures, synthesis and specific functions[J]. Molecular Microbiology, 2005,56: 845–857. DOI: 10.1111/j.1365-2958.2005.04587.x |
| [13] | Fiddaman P J, Rossall S. The production of antifungal volatiles by Bacillus subtilis[J]. Journal of Applied Bacteriology, 1993,74: 119–126. DOI: 10.1111/jam.1993.74.issue-2 |
| [14] | Gao X N, Han Q M, Chen Y F, et al. Biological control of oilseed rape Sclerotinia stem rot by Bacillus subtilis strain Em7[J]. Biocontrol Science and Technology, 2014,24: 39–52. DOI: 10.1080/09583157.2013.844223 |
| [15] | Pane C, Villecco D, Campnile F, et al. Novel strainsof Bacillus, isolated from compost and compost amended soils, as biological control agents against soil-borne phytopathogenic fungi[J]. Biocontrol Science and Technology, 2012,22: 1373–1388. DOI: 10.1080/09583157.2012.729143 |
| [16] | 史翠娟.防治脱氧雪腐镰刀烯醇毒素污染的脂肽类抗菌物质的研究[D].哈尔滨:哈尔滨工业大学, 2014:52-71. Shi C J. Research on lipopeptide antibiotics for control of deoxynivalenol pollution[D]. Harbin:Harbin Institute of Technology, 2014:52-71(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-10213-1014085063.htm |
| [17] | Ren J J, Shi G L, Wang X Q, et al. Identification and characterization of a novel Bacillus subtilis strain with potentant agonistic activity of a flagellin-like protein[J]. World Journal of Microbiology and Biotechnology, 2013,29: 2343–2352. DOI: 10.1007/s11274-013-1401-6 |
| [18] | Emrick D, Ravichandran A, Gosai J, et al. The antifungal occidiofungin triggers an apoptotic mechanism of cell death in yeast[J]. Journal of Natural Products, 2013,76: 829–838. DOI: 10.1021/np300678e |
| [19] | Onishi J, Meinz M, Thompson J, et al. Discovery of novel antifungal (1, 3)-beta-D-glucan synthase inhibitors[J]. Antimicrobial Agents and Chemotherapy, 2000,44: 368–377. DOI: 10.1128/AAC.44.2.368-377.2000 |
| [20] | Gopinathan S. Detection of FUR1 gene in 5-flucytosine resistant Candida isolates in vaginal candidiasis patients[J]. Journal of Clinical and Diagnostic Research, 2013,7(11): 2452–2455. |
| [21] | van der Weerden N L, Bleackley M R, Anderson M A. Properties and mechanisms of action of naturally occurring antifungal peptides[J]. Cellular and Molecular Life Sciences, 2013,70: 3545–3570. DOI: 10.1007/s00018-013-1260-1 |
| [22] | Yang L R, Quan X, Xue B G, et al. Isolation and identification of Bacillus subtilis strain YB-05 and its antifungal substances showing antagonismagainst Gaeumannomyces graminis var.tritici[J]. Biological Control, 2015,85: 52–58. DOI: 10.1016/j.biocontrol.2014.12.010 |
| [23] | Slimene I B, Tabbene O, Gharbi D, et al. Isolation of a chitinolytic Bacillus licheniformis S213 strain exerting a biological control against phoma medicaginis infection[J]. Applied Biochemistry and Biotechnology, 2015,175: 3494–3506. DOI: 10.1007/s12010-015-1520-7 |
| [24] | 汪澈, 何月秋, 张永庆, 等. 枯草芽孢杆菌B9601-Y2抑菌蛋白活性及产生条件的研究[J]. 植物病理学报, 2005, 35(1): 30–36. Wang C, He Y Q, Zhang Y Q, et al. Antifungal activity and production condition of crude protein by Bacillus subtilis B9601-Y2[J]. Acta Phytopathologica Sinica, 2005,35(1): 30–36. (in Chinese) |
| [25] | Tabbene O, Karkouch I, Slimene I B, et al. Triggering of the antibacterial activity of Bacillus subtilis B38 strain against methicillin-resistant Staphylococcus aureus[J]. Applied Biochemistry and Biotechnology, 2011,164(1): 34–44. DOI: 10.1007/s12010-010-9112-z |
| [26] | 李晶, 杨谦, 赵丽华, 等. 生防枯草芽孢杆菌B29菌株抗菌物质的初步研究[J]. 中国生物工程杂志, 2008, 28(2): 59–65. Li J, Yang Q, Zhao L H. Antifungal substance from biocontrol Bacillus subtilis B29 strain[J]. China Biotechnology, 2008,28(2): 59–65. (in Chinese) |




