文章信息
- 李针针, 刘兆磊, 陈发棣, 蒋甲福, 陈素梅
- LI Zhenzhen, LIU Zhaolei, CHEN Fadi, JIANG Jiafu, CHEN Sumei
- 荷花R2R3-MYB转录因子NnMYB4对拟南芥木质素合成的影响
- Effect of Nelumbo nucifera R2R3-MYB transcription factor NnMYB4 on lignin biosynthesis in Arabidopsis thaliana
- 南京农业大学学报, 2016, 39(6): 932-938
- Journal of Nanjing Agricultural University, 2016, 39(6): 932-938.
- http://dx.doi.org/10.7685/jnau.201603041
-
文章历史
- 收稿日期: 2016-03-19
MYB转录因子作为植物中最大的一类转录因子, 广泛参与植物生长发育调控和环境胁迫应答。MYB转录因子DNA结合域包含1~3个由50~53个氨基酸残基组成的不完全重复的MYB结构域(R), 根据所含MYB结构域位置与数目的不同, 可大致将植物MYB转录因子分为3个亚类:R1/2-MYB或R3-MYB、R2R3-MYB、3R-MYB[1]。R2R3-MYB蛋白在植物MYB家族中占绝大多数, 在调控植物木质素合成和次生壁形成过程中起重要作用[2-3]。根据C末端保守基序的差异, 可将植物R2R3-MYB分为22个亚组[4], 同一亚组成员之间往往具有相似的功能[5]。
木质素是一类广泛存在于维管束植物细胞壁中的芳香族化合物, 与多糖类化合物(纤维素、半纤维素)相互共价结合, 增加维管束植物组织的机械强度, 在植物抵抗外界非生物胁迫过程中发挥着重要作用[3]。近年来关于R2R3-MYB转录因子对木质素合成影响的研究结果表明, 一些R2R3-MYB蛋白通过和ACⅠ、ACⅡ、ACⅢ等顺势作用元件结合, 从而促进或抑制木质素的合成[6-10]。到目前为止, 与木质素合成相关的R2R3-MYB负调控因子大多出现在G4亚组。
荷花(Nelumbo nucifera)是多年生水生植物, 也是品种资源最丰富、栽培面积最大的水生观赏性植物和经济作物。荷花的观赏性状不仅包含“花型”“花色”等外观性状, 也包括“株形”“叶径”等性状, 而后者这些性状往往离不开组织中木质素的机械支撑作用, 因此研究荷花中木质素合成对改良某些观赏性状具有重要意义。目前, 关于转录因子对荷花木质素合成途径的调控作用鲜有报道。本研究从荷花中克隆得到1个与拟南芥AtMYB 4高度同源的R2R3-MYB转录因子G4亚组成员NnMYB 4, 并利用模式植物拟南芥对该基因进行功能分析, 旨在了解NnMYB 4在木质素合成过程中的作用, 为进一步深入研究荷花NnMYB 4基因调控植物木质素合成的分子机制奠定了基础。
1 材料与方法 1.1 植物材料与试剂供试荷花(Nelumbo nucifera)品种‘黑龙江红莲’取自南京艺莲苑有限公司。拟南芥选用哥伦比亚型(Columbia-0, Col-0), 栽植于光照培养箱(8 h黑暗/16 h光照, 17 ℃/22 ℃)中。
RNA提取试剂购于原平皓生物公司; 大肠杆菌感受态、农杆菌EHA105和植物表达载体pMDC43为本实验室保存; Real-Time PCR Kit (SYBR Green)、反转录试剂盒、pMD19-T载体和聚合酶等均购自TaKaRa公司。引物合成和测序由上海捷瑞生物工程有限公司协助完成。
1.2 荷花NnMYB 4的克隆与生物信息学分析荷花总RNA的提取按照试剂盒说明书进行。利用Primer Premier 5.0设计荷花NnMYB 4全长ORF (XP_010266817)特异性引物NnMYB 4-F (5′ATGGGGAGGTCTCCTTGCTG 3′)和NnMYB 4-R (5′TTATTTCA-TTTCCAGGCTTCTATAATCC3′), 以‘黑龙江红莲’叶片cDNA为模板, 高保真PCR扩增ORF全长。PCR产物回收、纯化后, 连接到pMD19-T载体上, 挑取阳性克隆、测序。
利用ORF finder查找相关基因的开放阅读框, 通过BLAST进行序列的同源性分析, 采用DNAMAN 2.6和MEGA 5.0分别进行氨基酸序列比对和系统进化树构建。
1.3 荷花NnMYB 4的表达分析根据荷花NnMYB 4开放阅读框设计荧光定量引物, 对荷花根、茎、叶柄、剑叶、幼叶、成熟叶等组织部位进行基因表达分析。参照SYBR Premix Ex Taq试剂盒说明, 实时荧光定量PCR反应程序为:95 ℃ 60 s; 95 ℃ 15 s, 60 ℃ 15 s, 72 ℃ 45 s, 40个循环。相对定量采用2-ΔΔCT表示[11]。每个样品3次生物学重复。以荷花NnACTIN为内参基因[12], 内参基因引物序列:NnACTIN-F: 5′ACCACTGCTGACGGGAAAT3′, NnACTIN-R: 5′ATGGCTGGAATAGAACCTCA3′; 荷花NnMYB 4引物序列:NnMYB 4-QTF:5′TTCAGATTAGCCTTCCTTATCAACA3′, NnMYB 4-QTR:5′TCCAGGCTTCTATAATCCAAA3′。
1.4 NnMYB 4过表达载体的构建与转化拟南芥在NnMYB 4全长ORF特异性引物的上、下游分别添加SalⅠ和NotⅠ酶切位点, NnMYB 4-SalⅠ:5′GCGTCGACATGGGGAGGTCTCCTTG3′; NnMYB 4-NotⅠ:5′TTGCGGCCGCGATTATTTCATTTCCAGGCTTC-TATAA3′, 高保真PCR产物与入门载体pENTR1A质粒同时进行SalⅠ和NotⅠ双酶切, 连接、测序后单酶切使重组质粒pENTR1A-NnMYB 4线性化, 将线性化产物和pMDC43质粒进行LR重组, 最后得到pMDC43-NnMYB 4载体。
采用冻融法将已构载体导入根癌农杆菌, 在加入Silwet L-77的1/2MS液体培养基中扩大培养, 将拟南芥花序置于其中浸泡[13], 收集种子置于含有50 mg · L-1潮霉素的培养基上筛选阳性植株, 利用引物NnMYB 4-F和NnMYB 4-R进行PCR验证, 获得T1代转基因植株, 将上述T1代植株种子继续在潮霉素培养基上筛选, 并利用引物NnMYB 4-QTF和NnMYB 4-QTR进行qRT-PCR验证, 最终获得T2代转基因植株。
1.5 木质素含量测定及拟南芥横截面切片观察利用乙酰溴法[14]测定总木质素含量, 首先分离拟南芥花序茎细胞壁, 取1.5 mg脱淀粉植物细胞壁, 加入100 μL 25%(体积分数)乙酰溴-冰醋酸溶液, 50 ℃加热3 h, 再加入400 μL 2 mol · L-1 NaOH和0.5 mol · L-1盐酸羟胺, 280 nm下测定样品吸光值, 利用Foster等[14]的公式计算出木质素含量。每个样品3次重复。
野生型和NnMYB 4转基因拟南芥各选10株, 在花序茎基部切取70 μm厚的横截面, 在横截面上滴几滴6 mol · L-1 HCl, 保持3 min, 然后滴加5%(体积分数)的间苯三酚, 2 min后放于光学显微镜下观察。
1.6 木质素、纤维素合成关键基因的表达分析提取拟南芥花序茎RNA, 反转录成cDNA, 采用qRT-PCR测定拟南芥中香豆酸-3-羟化酶基因(C 3H)、4-香豆酸辅酶A连接酶基因(4CL1)、阿魏酸-5-羟化酶基因(F 5H)、咖啡酸-O-甲基转移酶基因(COMT 1)、肉桂醇脱氢酶基因(CAD 6)、肉桂酰CoA还原酶基因(CCR 1)、肉桂酸-4-羟化酶基因(C 4H)、咖啡酰辅酶A-O-甲基转移酶基因(CCoAOMT 1)、苯丙氨酸裂解酶基因(PAL 1)等木质素合成关键酶基因的表达量。所用引物见表 1。
| 引物Primer | 序列Sequence (5′→3′) |
| AtC3H-F/R | CCAACGGTCTGAAGCTAGGTG/GCAAACGCCTTCTCATCAGC |
| At4CL1-F/R | CTCCGGTGTCTGGATCAACT/GAAATCTGGTGCTGCTCCTC |
| AtF5H-F/R | TCGTGTGATGATCAACGCGT/CGGTTCCAAAAACCTCGATG |
| AtCOMT-F/R | CGTCGCAGACAACTTTGATG/TGATCTCCCACATGTCATCG |
| AtCAD6-F/R | CGAGTCTCTCAAACGCAGTG/GTTAGGTGGAGTCGGTCACA |
| AtCCR1-F/R | GTGCAAAGCAGATCTTCAGG/GCCGCAGCATTAATTACAAA |
| AtC4H-F/R | GCAAGCTGAATTGTCCACCT/CACATCCTTGAAGCTGAGCA |
| AtCCoAOMT1-F/R | CATCATCGACCAATGGAGAA/TCGATCAAACGCTTGTGGTA |
| AtPAL1-F/R | AAGATTGGAGCTTTCGAGGA/TCTGTTCCAAGCTCTTCCCT |
| AtCesA1-F/R | GGTATTTATTGCGGCAACCT/ATCCAACCAATCTCTTTGCC |
| AtCesA7-F/R | CAGGCGTACTCACAAATGCT/TGTCAATGCCATCAAACCTT |
| AtCesA8-F/R | ACGGAGAGTTCTTTGTGGCT/GGTCTGTGTTGGAACAATGG |
| AtIRX8-F/R | GTGGTCACAGGGAAAGGATT/AGCAAGAGAGGAGCAAGGAG |
通过与拟南芥木质素相关基因AtMYB 4比对, 在荷花基因组[15]中找到与其同源性最高(73.6%)的荷花MYB基因, 根据其全长ORF设计特异性引物, 以‘黑龙江红莲’幼叶cDNA为模板扩增, 得到该基因全长ORF序列。ORF为726 bp, 编码241个氨基酸的多肽, 将该基因命名为NnMYB 4。同源多序列比对(图 1)显示, NnMYB 4在9~61位氨基酸和62~116位氨基酸处含有2个MYB保守结构域, 故可判断其为典型R2R3-MYB转录因子, 在C端含有特征基序LLsrGIDPX[T/S]HRX[I/L]、pdLNL[D/E]LXi[G/S]、GYDFLG[L/M]X4-7LX[Y/F][R/S]XLEMK及CX1-2CX7-12CX1-2C保守锌指结构蛋白, 推测NnMYB 4属于荷花R2R3-MYB的G4亚组。

|
图 1 NnMYB 4基因氨基酸序列与其他物种比对 Figure 1 Alignment of the derived amino acid sequences from NnMYB 4 with other MYBs R2、R3、C1、C2、C4、Zing finger为保守结构域。R2, R3, C1, C2, C4 and Zing finger are conserved domains. NnMYB4:荷花Nelumbo nucifera XP_010266817;AtMYB4:拟南芥Arabidopsis thaliana AAS10085;GhMYB9:陆地棉Gossypium hirsutum AAK19619;ZmMYB31:玉米Zea mays NP_001105949;CmMYB1:菊花Chrysanthemum morifolium DK942906;McMYB1:观赏海棠Malus crabapples NC_024253;PgMYB1:白云杉Picea glauca AJD79907;SmMYB39:丹参Salvia miltiorrhiza NC_023209 |
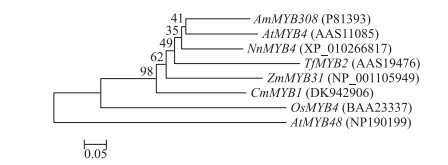
进化树分析(图 2)结果显示:荷花NnMYB 4与同属于G4亚组的拟南芥AtMYB 4、菊花CmMYB1、玉米ZmMYB31亲缘关系较近, 上述基因已被证实在木质素合成途径中起负调控作用, 故推测荷花NnMYB4在木质素合成过程中也具有相似功能。
|
图 2 NnMYB 4基因进化树分析 Figure 2 The phylogeny of NnMYB 4 and related MYBs Am:金鱼草Antirrhinum majus; At:拟南芥Arabidopsis thaliana; Nn:荷花Nelumbo nucifera; Tf:紫露草Tradescantia fluminensis; Zm:玉米Zea mays; Cm:菊花Chrysanthemum morifolium; Os:水稻Oryza sativa |
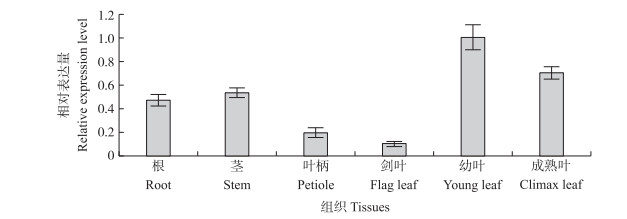
从图 3可以看出:NnMYB 4基因在荷花根、茎、叶柄、剑叶、幼叶、成熟叶中均有表达, 其中在幼叶中表达量最高, 成熟叶次之, 在剑叶中表达量最低。
|
图 3 NnMYB 4在荷花不同组织的表达分析 Figure 3 NnMYB 4 expression profiles of Nelumbo nucifera in different tissues |
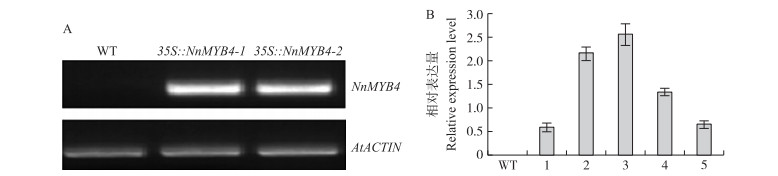
构建pMDC43-NnMYB 4过表达载体, 采用蘸花法来实现农杆菌介导转化拟南芥。转化后的拟南芥通过潮霉素(hygromycin B)筛选, RT-PCR鉴定(图 4-A)以及qRT-PCR鉴定(图 4-B), 最后选出2个荷花NnMYB 4基因表达量相对较高的转基因株系35S ∷ NnMYB4-1和35S ∷ NnMYB4-2用于后续试验。在相同生长条件下, 对转NnMYB 4基因的T2代拟南芥进行表型观察发现:转基因株系35S ∷ NnMYB4-1和35S ∷ NnMYB4-2播种后(45±2) d开花, 而野生拟南芥播种后(38±2) d开花, 即转基因株系比野生型开花晚, 且花序茎变矮(表 2), 叶片与花朵大小无明显差异(图 5)。说明NnMYB 4过表达能够抑制拟南芥花序茎生长并延迟开花。
|
图 4 转基因株系RT-PCR (A)和qRT-PCR (B)鉴定
Figure 4 RT-PCR (A) and qRT-PCR (B) demonstrate the heterologous expression of NnMYB 4 in the transgenic line
A:WT:野生型拟南芥Wild type Col-0; 35S ∷ NnMYB4-1和35S ∷ NnMYB4-2:转基因株系Transgenic lines; AtACTIN:拟南芥内参基因Internal control; B:1~5:转基因拟南芥株系Transgenic lines (2:35S ∷ NnMYB4-1;3: 35S ∷ NnMYB4-2) |

|
图 5 转基因拟南芥表型 Figure 5 Transgenic Arabidopsis phenotype 1:野生型拟南芥Wild type Col-0;2:35S ∷ NnMYB4-1;3: 35S ∷ NnMYB4-2 |
| WT | 35S∷NnMYB4-1 | 35S∷NnMYB4-2 | |
| 花序茎长度/cm Inflorescence stem length | 21.73±2.32a | 17.32±2.51b | 16.81±1.35b |
| 木质素含量/(mg·g-1) Lignin content | 207.35±3.31a | 181.33±2.35b | 175.25±2.75b |
| 注:不同小写字母表示差异显著(P < 0.05)。Different small letters indicate significant difference at 0.05 level. | |||
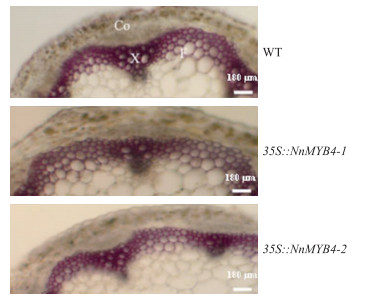
为初步确定荷花NnMYB 4基因是否参与木质素的合成, 在NnMYB4转基因株系及野生型植株花序茎基部切取70 μm厚的横截面, 染色后观察, 发现转基因株系35S ∷ NnMYB4-1和35S ∷ NnMYB4-2比对照植株茎木质部染色面积小、染色程度浅, 木质部细胞排列更疏松(图 6)。为进一步明确荷花转录因子NnMYB 4的功能, 对拟南芥细胞壁中的木质素含量进行了测定。由表 2可知:转基因拟南芥株系35 ∷ NnMYB4-1和35 ∷ NnMYB4-2较野生型木质素含量显著降低, 分别降低了12.6%和15.4%。说明荷花NnMYB 4基因对拟南芥木质素合成具有抑制作用。
|
图 6 拟南芥横截面切片染色观察图 Figure 6 Observation of the cross-sectional slice staining of Arabidopsis Co:皮层Cortex; X:木质部Xylem; F:维管束纤维Interfascicular fibres |
为明确荷花NnMYB 4如何调控木质素合成相关基因的表达, 对拟南芥木质素合成过程中关键酶基因进行qRT-PCR分析。定量结果(图 7)显示, 转基因株系木质素合成关键基因AtC 3H、At4CL1、AtF5H、AtCOMT1、AtC4H、AtCCR1表达量降低, AtCAD6表达量略微升高, AtCCoAOMT1、AtPAL1表达量变化不明显。说明NnMYB 4可能参与调控木质素合成, 是木质素合成过程中的一个负调控因子。
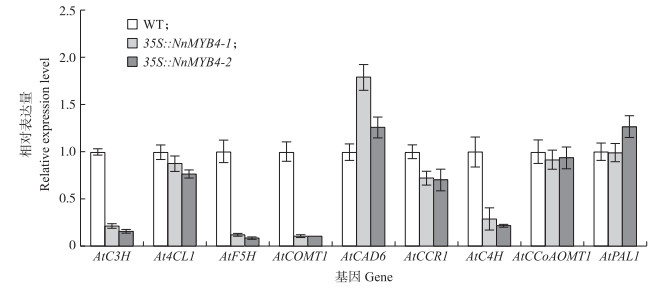
|
图 7 木质素合成关键酶基因在转基因拟南芥中的表达分析 Figure 7 Expression analysis of genes involved in lignin synthesis in wild type and transgenic A.thaliana plants heterologously expressing NnMYB 4 |
以往研究发现, 大部分参与植物次生壁代谢的R2R3-MYB在调节次生壁合成过程中起正调控作用, 但多数R2R3-MYB第4亚组成员在木质素合成中表现为负调控作用[16-18]。本研究从荷花中分离得到1个转录因子即NnMYB 4, 经序列比对、进化树分析, 确定其属于R2R3-MYB转录因子G4亚组。与其他G4亚组木质素相关负调控转录因子一样, 荷花NnMYB 4基因C端也含有C2:pdLNL[D/E]LXi[G/S]氨基酸基序, 这一特征基序已被证明具有转录抑制活性[19], 间接证明了荷花NnMYB 4转录因子是木质素合成过程中的一个负调控因子。
本研究中, 对转荷花NnMYB 4拟南芥进行表型观察, 发现植株出现矮化, 花序茎缩短, 花期推迟, 这一现象与金鱼草AmMYB308和AmMYB330在烟草, 拟南芥AtMYB4和玉米ZmMYB31在拟南芥中过表达表型观察结果一致[17, 20]。但不同的是, 转NnMYB 4拟南芥植株叶片及花朵大小与对照相比无明显差异, 成熟叶片也未出现白斑, 可能是不同植物的该类基因对不同表型性状作用强度有所不同, 荷花NnMYB4对拟南芥花朵和成熟叶白斑大小调控作用较小导致的。转NnMYB4拟南芥横截面切片观察和木质素含量测定结果直接说明了, NnMYB4能够抑制木质部细胞形成和降低木质素含量。
木质素合成关键酶基因在木质素代谢过程中发挥着关键作用。松树PtMYB 4在烟草中过表达, 能够使PAL表达量降低, CCR、COMT、C3H、CCoAOMT表达量提高, 同时转基因烟草木质素含量提高, 髓部和韧皮部细胞发生木质化[7-8]; 玉米木质素负调控转录因子ZmMYB 31与F5H、COMT启动子区域顺式作用元件AC-Ⅱ(CCT/CAC/AC)结合, 能够降低转基因拟南芥F 5H和COMT基因表达量[20]; 在拟南芥中, 使C 3H、4CL1、F5H、COMT表达量降低, 结果导致木质素总含量和单体含量降低[21-23]; 异源表达菊花CmMYB 1, 转基因拟南芥多数木质素、纤维素合成关键酶基因下调, 木质素含量下降[24]。本研究分子检测结果证实了转荷花NnMYB 4拟南芥AtC3H、At4CL1、AtF5H、AtCOMT1等关键酶基因表达量降低, 与上述研究结果类似, 从分子角度证明荷花NnMYB4基因负调控木质素合成。以上研究结果, 为进一步深入了解荷花NnMYB4对木质素合成调控的分子机制以及荷花的遗传改良奠定了理论基础。
| [1] | Jin H, Martin C. Multifunctionality and diversity within the plant MYB gene family[J]. Plant Mol Biol, 1999,41: 577–585. DOI: 10.1023/A:1006319732410 |
| [2] | Demura T, Fukuda H. Transcriptional regulation in wood formation[J]. Trends Plant Sci, 2007,12: 64–70. |
| [3] | Zhong R, Taylor J J, Ye Z H. Disruption of interfascicular fiber differentiation in an Arabidopsis mutant[J]. Plant Cell, 1997,12: 2159–2170. |
| [4] | Kranz H D, Denekamp M, Greco R, et al. Towards functional characterisation of the numbers of the R2R3-MYB gene faminly from Arabidopsis thaliana[J]. Plant J, 1998,16: 263–276. DOI: 10.1046/j.1365-313x.1998.00278.x |
| [5] | Lee M M, Schiefelbein J. Developmentally distinct MYB genes encode functionally equivalent proteins in Arabidopsis[J]. Development, 2001,128: 1539–1546. |
| [6] | Borevitz J O, Xia Y, Dixon R A, et al. Activation tagging identifies a conserved MYB regulator of phenylpropanoid biosynthesis[J]. Plant Cell, 2000,12: 2383–2394. DOI: 10.1105/tpc.12.12.2383 |
| [7] | Patzlaff A, Mcinnis S, Courtenay A, et al. Characterisation of a pine MYB that regulates lignification[J]. Plant J, 2003,36: 743–754. DOI: 10.1046/j.1365-313X.2003.01916.x |
| [8] | Patzlaff A, Newman L J, Dubos C, et al. Characterisation of PtMYB1, an R2R3-MYB from pine xylem[J]. Plant Mol Biol, 2003,53: 597–608. DOI: 10.1023/B:PLAN.0000019066.07933.d6 |
| [9] | Deluc L, Barrieu F, Marchive C, et al. Characterization of a grapevine R2R3-MYB transcription factor that regulates the phenylpropanoid pathway[J]. Plant Physiol, 2006,140: 499–511. DOI: 10.1104/pp.105.067231 |
| [10] | Goicoechea M, Lacombe E, Legay S, et al. EgMYB2, a new transcriptional activator from Eucalyptus xylem, regulates secondary cell wall formation and lignin biosynthesis[J]. Plant J, 2005,43: 553–567. DOI: 10.1111/tpj.2005.43.issue-4 |
| [11] | Shan H, Chen S, Jiang J, et al. Heterologous expression of the Chrysanthemum R2R3-MYB transcription factor CmMYB2 enhances drought and salinity tolerance, increases hypersensitivity to ABA and delays flowering in Arabidopsis thaliana[J]. Mol Biotechnol, 2012,51: 160–173. DOI: 10.1007/s12033-011-9451-1 |
| [12] | Liu Z, Gu C, Chen F, et al. Heterologous expression of a Nelumbo nucifera phytochelatin synthase gene enhances cadmium tolerance in Arabidopsis thaliana[J]. Appl Biochem Biotech, 2012,166: 722–734. DOI: 10.1007/s12010-011-9461-2 |
| [13] | Clough S J, Ben A F. Floral dip:a simplified method for Agrobacterium-mediated transformation of Arabidopsis thaliana[J]. Plant J, 1998,16: 735–743. DOI: 10.1046/j.1365-313x.1998.00343.x |
| [14] | Foster C E, Martin T M, Pauly M. Comprehensive compositional analysis of plant cell walls (lignocellulosic biomass) part Ⅰ:Lignin[J]. Journal of Visualized Experiments, 2010,37: e1745. |
| [15] | Ming R, van Buren R, Liu Y, et al. Genome of the long-living sacred lotus (Nelumbo nucifera Gaertn.)[J]. Genome Biology, 2013,14: R41. DOI: 10.1186/gb-2013-14-5-r41 |
| [16] | Tamagnone L, Merida A, Stacey N, et al. Inhibition of phenolic acid metabolism results in precocious cell death and altered cell morphology in leaves of transgenic tobacco plants[J]. Plant Cell, 1998,10: 1801–1816. DOI: 10.1105/tpc.10.11.1801 |
| [17] | Jin H, Cominelli E, Bailey P, et al. Transcriptional repression by AtMYB4 controls production of UV-protecting sunscreens in Arabidopsis[J]. The EMBO Journal, 2000,19(22): 6150–6161. DOI: 10.1093/emboj/19.22.6150 |
| [18] | Legay S, Sivadon P, Blervacq A S, et al. EgMYB1, an R2R3-MYB transcription factor from eucalyptus negatively regulates secondary cell wall formation in Arabidopsis and poplar[J]. New Phytol, 2010,188: 774–786. DOI: 10.1111/j.1469-8137.2010.03432.x |
| [19] | Kazan K. Negative regulation of defence and stress genes by EAR-motif containing repressors[J]. Trends Plant Sci, 2006,11: 109–112. DOI: 10.1016/j.tplants.2006.01.004 |
| [20] | Fornalé S, Sonbol F M, Maes T, et al. Down-regulation of the maize and Arabidopsis thaliana caffeic acid O-methyl-transferase genes by two new maize R2R3-MYB transcription factors[J]. Plant Mol Biol, 2006,62: 809–823. DOI: 10.1007/s11103-006-9058-2 |
| [21] | Chapple C, Vogt T, Ellis B E, et al. An Arabidopsis mutant defective in the general phenylpropanoid pathway[J]. Plant Cell, 1992,4: 1413–1424. DOI: 10.1105/tpc.4.11.1413 |
| [22] | Lee D, Meyer K, Chapple C, et al. Antisense suppression of 4-coumarate:coenzyme A ligase activity in Arabidopsis leads to altered lignin subunit composition[J]. Plant Cell, 1997,9: 1985–1998. DOI: 10.1105/tpc.9.11.1985 |
| [23] | Goujon T, Sibout R, Pollet B, et al. A new Arabidopsis thaliana mutant deficient in the expression of O-methyl-transferase impacts lignins and sinapoyl esters[J]. Plant Mol Biol, 2003,51: 973–989. DOI: 10.1023/A:1023022825098 |
| [24] | Zhu L, Shan H, Chen S, et al. The heterologous expression of the Chrysanthemum R2R3-MYB transcription factor CmMYB1 alters lignin composition and represses flavonoid synthesis in Arabidopsis thaliana[J]. PLoS ONE, 2013,8: e65680. DOI: 10.1371/journal.pone.0065680 |




