文章信息
- 沈直, 唐设, 张海祥, 陈文珠, 丁艳锋, 王绍华
- SHEN Zhi, TANG She, ZHANG Haixiang, CHEN Wenzhu, DING Yanfeng, WANG Shaohua
- 灌浆期开放式增温对水稻强势粒和弱势粒淀粉代谢关键酶相关基因表达水平的影响
- Effect of T-FACE high temperature on genes expression level of key enzymes involved in starch metabolism in superior spikelets and inferior spikelets of rice during grain filling period
- 南京农业大学学报, 2016, 39(6): 898-906
- Journal of Nanjing Agricultural University, 2016, 39(6): 898-906.
- http://dx.doi.org/10.7685/jnau.201604047
-
文章历史
- 收稿日期: 2016-04-18
水稻胚乳中90%的干物质为淀粉, 籽粒的充实过程主要是蔗糖的分解和淀粉的合成过程, 所以淀粉的合成是影响水稻产量和品质形成的主要因子[1]。研究表明高温是影响水稻产量的主要逆境之一, 高温热害不仅影响水稻的千粒质量、结实率、灌浆速率、空瘪率等产量构成因素[2], 也会影响水稻的垩白率、垩白度、整精米率等品质因素[3]。开花期和灌浆期是水稻对温度最敏感的时期也是高温对产量影响最大的时期, 此时高温热害对结实率和千粒质量的影响最大[4-5]。在水稻灌浆过程中, 强势粒灌浆速度快、充实度好, 而弱势粒灌浆速率慢、充实度差, 最终导致强、弱势籽粒间质量和品质差异的出现[6]。Yang等[7]研究表明, 弱势粒灌浆差是影响水稻产量的主要原因之一, 尤其对大穗型水稻品种的影响更大。
参与籽粒淀粉代谢的关键酶包括蔗糖合成酶(SuSase)、腺苷二磷酸葡萄糖焦磷酸化酶(AGPase)、可溶性淀粉合成酶(SSS)、颗粒结合型淀粉合成酶(GBSS)、淀粉分支酶(SBE)。SuSase主要将籽粒中的蔗糖分解, 形成果糖和尿苷二磷酸葡萄糖(UDPG), UDPG经过一系列生化反应形成1-磷酸葡萄糖(G-1-P), 腺苷二磷酸葡萄糖焦磷酸化酶(AGPase)是淀粉合成途径中关键的限速酶, 它是一个异源四聚体, 由2个大亚基和2个小亚基组成, 它是一个变构调节酶, 其主要活性中心为小亚基。AGPase的作用是将G-1-P催化形成ADPG。SSS催化ADPG中的葡萄糖分子转移到α-1, 4-葡萄糖非还原性末端, 形成直链淀粉[8]。SSS活性的大小与淀粉积累量相一致[9]。SBE又称Q酶, 在淀粉合成中通过形成α-1, 6-糖苷键, 从而形成分支的糖链[10]; SBE不仅参与合成支链淀粉, 而且通过产生新的非还原末端产物作为α-葡萄糖的受体, 有利于AGPase和SSS的催化反应, 提高淀粉的生物合成速率[11]。其中, SSS、GBSS和SBE调控淀粉合成过程中直链淀粉链长与支链淀粉精细结构[12]。
在水稻、小麦等植物中已发现了SuSase、AGPase、SBE和SSS的多种同工酶[13-15], 在水稻中有7个编码SuSase的基因。Hirose等[15]研究表明, SuS3和SuS4在发育的籽粒中表达水平较高。植物AGPase为异源酶, 由2个小亚基和4个大亚基构成, 其编码基因分别为AGPS 1、AGPS2、AGPL1、AGPL2、AGPL3和AGPL4。水稻SSS可分为5个亚族10个基因, 包括2个GBSS基因GBSS Ⅰ、GBSS Ⅱ, 8个SSS基因SSS Ⅰ、SSS Ⅱ -1、SSS Ⅱ -2、SSS Ⅱ -3、SSS Ⅲ -1、SSS Ⅲ -2、SSS Ⅳ -1、SSS Ⅳ -2 [12-13]; SSS Ⅰ、SSS Ⅱ -3、SSS Ⅲ -2是灌浆水稻胚乳中SSS的主要表现形式[16]。Yamanouchi等[17]研究表明, 水稻胚乳中表达的SBE的同工型基因主要有SBE Ⅰ、SBE Ⅲ 和SBE Ⅳ , 且不同基因的功能有差异。
本试验采用大田开放式增温处理, 模拟全球气候变暖对水稻灌浆期强、弱势粒中淀粉合成关键酶相关基因表达水平的影响, 为气候变暖情况下, 采取的水稻栽培相关的应对措施提供科学依据。
1 材料与方法 1.1 增温设施水稻抽穗以后开始增温处理(HT), 以自然温度为对照(CK), 至水稻成熟收获后结束。增温采用红外线辐射器, 型号为FTE-1000-240-0-L10-Y, 功率1 000 W, 电压240 V。每小区增温面积为7.01 m2, 设置12盏加热器, 全方位覆盖加热, 加热高度为2 m, 全天24 h增温处理。采用美国HOBO公司的U23-001温湿度传感器实时监控并记录温度数据, 每15 min测定一次温度, 利用HOBOwaire Pro软件读取所记录温度, 并进行温度数据的处理。
1.2 试验材料试验于2015年在南京农业大学的丹阳试验基地进行。供试材料为大穗型粳稻品系CJ03和中穗型粳稻品种‘宁粳3号’(简称:N3), 供试水稻品种品系均来源于南京农业大学作物遗传与种质创新国家重点实验室。播种时间为2015年5月28日, 移栽时间为6月23日, 按照常规田间管理, 及时防治虫灾、病灾。水稻抽穗时间为8月27日, 于抽穗时开启开放式增温设备。肥料全田相同, 磷、钾肥全部作基肥1次施用, 氮肥分基肥、促花肥(倒4叶期施)和保花肥(倒2叶期施)3次施用, 分别占总施氮量的50%、30%和20%。其他管理方式同当地常规高产栽培。在抽穗期选取已抽穗且上部开花时间一致的穗子挂牌标记。
1.3 取样与产量指标测定从花后0~55 d对标记的植株每隔5 d取1次样。取样时间为上午9时。鲜样取样后分为强、弱势粒, 液氮中冷冻后于-70 ℃冰箱保存, 用于基因表达水平等指标的测定。取105 ℃杀青、烘干的稻穗, 用于籽粒质量动态、干物质积累等指标的测定。成熟期取挂牌标记的2个处理各200穗, 烘干称质量, 测定穗粒数、千粒质量、结实率。
1.4 淀粉含量测定取成熟期稻穗105 ℃杀青, 烘干, 脱壳处理, 将脱壳的籽粒碾磨, 参照《GB/T 17891-1999优质稻谷》测定直链和总淀粉含量。
1.5 粒质量和灌浆速率测定每个品种设3个田间重复, 取2个品种灌浆期不同生育时期籽粒, 置于105 ℃烘箱中杀青1.5 h, 之后置于80 ℃烘箱烘干, 脱水。将样品分为强、弱势粒并称取200粒质量, 然后换算成千粒质量, 重复3次。用Richards方程对籽粒灌浆过程进行拟合, 计算灌浆速率。
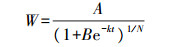
|
(1) |
对方程(1)求导, 得灌浆速率(R):
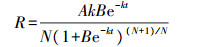
|
(2) |
式中:W为粒质量(mg); A为最终粒质量(mg); t为开花后时间(d); B、k、N为回归方程所确定的参数, 活跃灌浆期定义为W达到最终粒质量A的5%(t1)和95%(t2)所经历的时间。这段时间内籽粒增加的质量除以灌浆时间(t2-t1)为平均灌浆速率(GRmean)。
1.6 基因表达水平测定取-70 ℃冷冻保存的籽粒剥去外颖壳使用E.Z.N.A.®Plant RNA Kit (Omega Bio-tek, Inc, USA)提取籽粒RNA, 并除去基因组DNA。用NANODROP 2000紫外可见分光光度计测定RNA浓度和质量, 合格后按PrimScriptTM RT Reagent Kit (TaKaRa, Kyoto, Japan)说明书进行反转录。反转录仪为美国Bio-Rad公司的PTC-0200 DNA Engine Cycler。反转之后, 使用SYBR Premix Ex TaqTM(TaKaRa, Kyoto, Japan)试剂盒和ABI7300荧光定量PCR仪进行Real-time PCR反应, 按试剂盒说明书进行操作, 先配制RT反应液, 再进行RT-PCR反应, 以Actin基因作为内参基因, 各基因PCR引物序列见表 1, 所有样品设3次重复, 结果采用ΔΔCT法分析。
基因名称Gene name | 登录号Accession No. | 上游引物Up-primer (5′→3′) | 上游引物Down-primer (5′→3′) |
| Actin | AK100267 | CAGCACATTCCAGCAGATGT | TAGGCCGGTTGAAAACTTTG |
| SuS1 | D16202 | CTCTTCGTGGTCATCGTGT | GCAATCCCAGGTCAGGATA |
| SuS2 | AK072074 | GAGGCTGATGACCTTGACTGG | CCCTCCATTACTTGGATGTGCT |
| SuS3 | AK100306 | TCAGCGCATCGAGGAGAAGT | GGCCAATGGAACGGTGGTAG |
| SuS4 | AK102158 | TCCGTGAACTGGCGAAGACT | CCCAAGTTCGTCACTTGCTG |
| AGPS1 | AK073146 | ATATGGTGATCTGATCTCCAGTGC | CATCAAAATACCCACATTTCAGACACGG |
| AGPS2 | AK103906 | TCTTTTGTTGCCCATTCATCTGG | TGATTCCAAGCACACTCTCATCGAC |
| AGPL1 | AK069296 | GGAAAGGTTCCTATTGGAATCG | GGAGGGCTTTATTCCACCTCAG |
| AGPL2 | AK071497 | TAGATAGGCCTTGGAATCGCACC | TAGAGTTCCCATTCCAAAACAAACC |
| SSSⅠ | D16202 | CTCTTCGTGGTCATCGTGT | GCAATCCCAGGTCAGGATA |
| SSSⅡ-3 | AF419099 | AGGTGGGCTTGGAGATGTT | CAGATAAACAGGCAGGAGTG |
| SSSⅢ-2 | AY100469 | CGCAGGACTTTACGACAC | CTCTTGCCACCGTTGGAT |
| GBSSⅠ | EU735072 | GATGAGATACGGAACGCCCT | GCCCATGTGGAAACCAGTCT |
| GBSSⅡ | AY069940 | AACGTGGCTGCTCCTTGAA | TTGGCAATAAGCCACACACA |
| SBEⅠ | AK065121 | CGAGGGAATGCCAGGAGT | GCGATAGTAAGCCACACAGGT |
| SBEⅢ | AB023498 | AGCCAGGGAAATATAAGGTGGT | GTCATGTGAACAATCGGCAG |
| SBEⅣ | D16201 | CTCACGTGTAAAGATTCGGATG | GTATTTCACCTGGAGCCTGC |
采用Microsoft Excel 2003整理数据和作图, 用SPSS 16.0软件对试验数据进行分析。
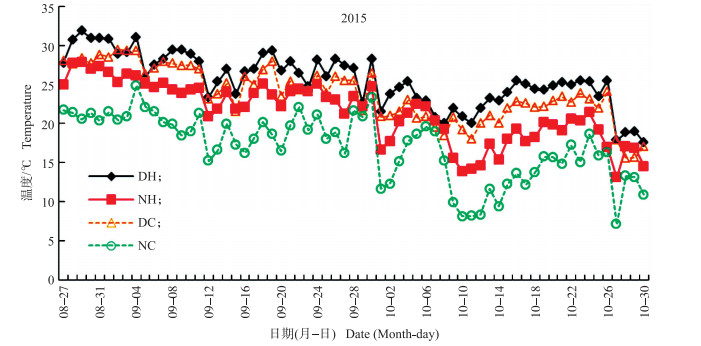
2 结果与分析 2.1 温度变化从图 1可见:采用增温系统后日间平均增温1.68 ℃, 夜间平均增温4.57 ℃, 符合全球气候变暖情况下, 夜间增温相对于日间增温高的现象, 能够模拟全球气候变暖带来的温度差异。
|
图 1 灌浆期开放式增温后的温度变化 Figure 1 The changes of temperature under the treatment of T-FACE high temperature during grain filling period DH:日间增温Daytime high temperature; NH:夜间增温Night high temperature; DC:日间常温Daytime control temperature; NC:夜间常温Night control temperature |
如表 2所示:开放式增温对水稻千粒质量、结实率和产量有一定的影响。增温处理千粒质量增加, 结实率降低, 进而导致产量降低, 但是千粒质量、结实率以及产量差异均没有达到显著水平。但开放式增温系统对于强、弱势粒粒质量的影响更明显, 如图 2所示, 增温处理弱势粒的千粒质量增加, 尤其是对常温强、弱势粒灌浆差异明显的大穗型品种CJ03, 开放式增温更明显地促进了弱势粒灌浆, 但开放式增温对于强势粒的影响较小。

|
图 2 2个品种强、弱势粒籽粒质量差异 Figure 2 Grains weight differences of superior spikelets and inferior spikelets between the two varieties CS:对照强势粒Control check superior spikelets;CI:对照弱势粒Control check inferior spikelets;HS:高温强势粒High temperature superior spikelets;HI:高温对照High temperature inferior spikelets. The same as follows. |
| 年份 Year | 品种 Variety | 处理 Treatment | 有效穗数/104 hm-2 Panicles | 穗粒数 Spikelets per panile | 千粒质量/g 1 000-grain weight | 结实率/% Seed-setting rate | 产量/(t·hm-2) Yield |
| 2014 | N3 | CK | 290.9 | 136.3 | 24.5 | 97.8 | 9.5 |
| HT | 288.9 | 139.0 | 24.9 | 96.1 | 9.7 | ||
| W24 | CK | 273.3 | 150.5 | 25.6 | 96.4 | 10.2 | |
| HT | 277.5 | 148.7 | 25.8 | 96.8 | 10.3 | ||
| 2015 | N3 | CK | 307.4 | 132.8 | 25.0 | 95.5 | 9.9 |
| HT | 309.9 | 130.2 | 25.7 | 93.3 | 9.6 | ||
| CJ03 | CK | 265.7 | 276.8 | 24.4 | 92.0 | 11.0 | |
| HT | 268.2 | 269.7 | 23.5 | 89.3 | 10.3 | ||
| 注: 1) N3:宁粳3号Ningjing 3, W24:武运粳24号Wuyunjing 24, CJ03:品系CJ03 Strain CJ03;2) CK:对照Control; HT:增温处理High temperature treatment. The same as follows. | |||||||
从图 3可见:2个品种的总淀粉含量在增温处理下与对照相比无显著的变化, 但直链淀粉含量下降, 尤其是大穗型品种CJ03在增温处理下直链淀粉含量下降。

|
图 3 在开放式增温处理下CJ03和N3成熟期籽粒淀粉含量(A)和直链淀粉含量(B) Figure 3 The starch (A) and amylose (B) content of grains in CJ03 and N3 in mature period under T-FACE high temperature treatment |
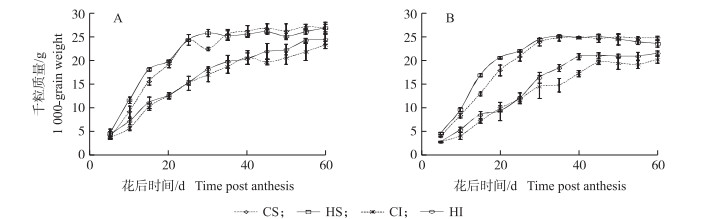
从图 4和图 5可以看出:增温处理促进前期强势粒发育, 尤其是CJ03强势粒在增温处理条件下灌浆速率峰值出现提前5 d, 灌浆速率增加迅速且灌浆起始速率大于对照, 最大灌浆速率高于对照, 说明增温处理在前期明显促进强势粒灌浆。增温处理下CJ03弱势粒灌浆速率前期略低于对照, 但是到20 d时速率增加, 且灌浆速率峰值远大于对照, 综合来看增温处理前期促进弱势粒灌浆。增温处理30 d后N3的强、弱势粒灌浆速率均下降明显, 而CJ03在花后20 d增温处理强势粒灌浆速率迅速下降, 花后40 d增温处理弱势粒灌浆速率也迅速下降。说明增温处理在后期会降低灌浆速率, 但由于弱势粒在花后40 d之前基本完成灌浆进入完熟期, 因此最后的结果是增温处理弱势粒粒质量增加, 而强势粒粒质量降低。最终强、弱势粒的粒质量差异如图 2所示, 明显看出2个品种的增温处理强势粒千粒质量均下降, 尤其是CJ03下降明显, 而增温处理的弱势粒千粒质量明显增加。
|
图 4 开放式增温处理下N3(A)和CJ03(B)的籽粒质量变化 Figure 4 The grain weight change of N3(A) and CJ03(B) under the T-FACE high temperature |

|
图 5 在开放式增温处理下N3(A)和CJ03(B)强、弱势粒的灌浆速率 Figure 5 The grain filling rate of SS and IS in N3(A) and CJ03(B) under the T-FACE high temperature |
从表 3可以看出:2个品种强、弱势粒增温处理的最大灌浆速率和平灌浆速率均大于对照, 但是灌浆活跃期明显短于对照。强势粒平均灌浆速率大于弱势粒, 但是强势粒的活跃灌浆期均小于弱势粒。
| 品种Variety | 籽粒Spikelets | R0/(g·1 000-grain-1) | GRmean/(g·1 000-grain-1·d-1) | GRmax/(g·1 000-grain-1·d-1) | D/d |
| CJ03 | CS | 0.13 | 0.72 | 1.44 | 33.83 |
| CI | 0.49 | 0.35 | 0.69 | 62.85 | |
| HS | 0.28 | 0.89 | 1.78 | 27.65 | |
| HI | 0.06 | 0.43 | 0.86 | 49.47 | |
| N3 | CS | 1.22 | 0.82 | 1.64 | 32.64 |
| CI | 0.55 | 0.42 | 0.50 | 66.10 | |
| HS | 1.26 | 0.93 | 1.85 | 28.28 | |
| HI | 0.37 | 0.39 | 0.77 | 53.40 | |
| 注: R0:起始生长势Initial grain filling potential; GRmean:平均灌浆速率Mean grain filling rate; GRmax:最大灌浆速率Maximum grain filling rate; D:活跃灌浆期The time of grain filling reaching 99% | |||||
对强、弱势粒粒质量以及灌浆速率对比发现, CJ03相对于N3对温度敏感, 因此测定花后10 d和花后20 d CJ03调控灌浆相关酶基因表达水平。花后10 d CJ03灌浆期淀粉合成相关基因的表达差异如图 6所示。SuS 2、SuS3和SuS4为主效基因。强势粒中SuS2相对于对照降低了12.84%, SuS 3提高了15.02%;弱势粒增温处理SuS 2增加了30.30%, SuS 3增加了42.15%, SuS 4增加了11.91%, 弱势粒粒中主效基因表达水平均上调。
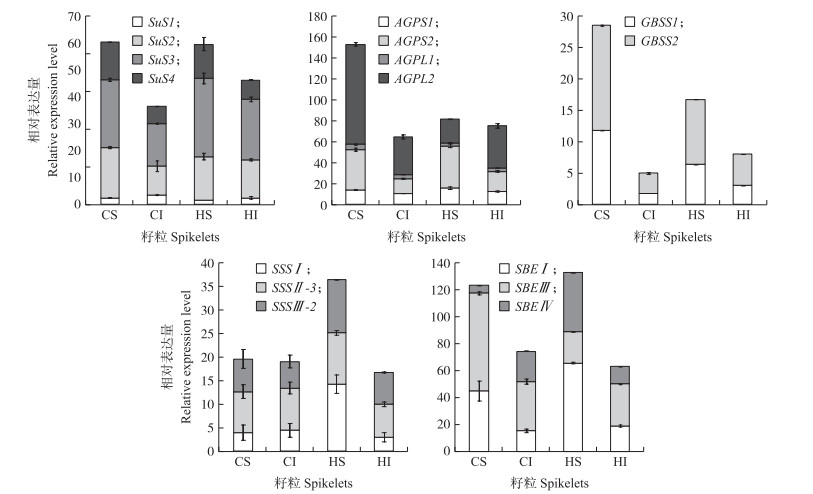
|
图 6 CJ03淀粉代谢关键酶相关基因在花后10 d的表达水平 Figure 6 The gene expression level of key enzymes which involved in starch metabolism in CJ03 at 10 days post anthesis |
AGPase酶的活性中心为小亚基, 即由AGPS 1和AGPS2调控。结果显示其主效基因为AGPS2。增温处理中AGPS1和AGPS2强势粒表达水平比对照分别提高了10.54%和5.87%, 而弱势粒中表达水平分别提高了15.69%和39.63%。
调控SSS合成的主效基因为SSS Ⅰ、SSS Ⅱ -3、SSS Ⅲ -2。增温处理使得强势粒中3个基因表达水平均上调, 其中受温度影响最大的为SSS Ⅰ, SSS Ⅰ的表达水平比对照提高了2.6倍; SSS Ⅱ -3受温度影响较小, 在强、弱势粒中表达水平几乎没有差异。
在增温处理下, 强势粒中调控GBSS合成的基因GBSS 1和GBSS2表达水平分别降低了46.07%和38.81%, 弱势粒中2个基因的表达水平增加, 比对照分别增加了71.83%和56.90%。
SBE合成的相关基因在增温处理下强势粒的表达水平高于常温对照, 其中SBE Ⅳ 的表达水平提高了7.05倍; 在弱势粒中的表达水平低于对照。这5种酶的相关基因表达总量在花后10 d强势粒均高于弱势粒。
花后20 d CJ03中与淀粉合成相关基因的表达水平如图 7所示。调控SuSase合成的基因在弱势粒中的表达水平明显上升且基本与强势粒一致, 增温处理的各个基因表达水平均低于对照。主效基因为SuS 2和SuS4, 增温处理使得强势粒SuS2和SuS4的表达水平降低了15.23%和14.15%, 在弱势粒中主效基因为SuS 4, 相对于对照降低了37.72%。
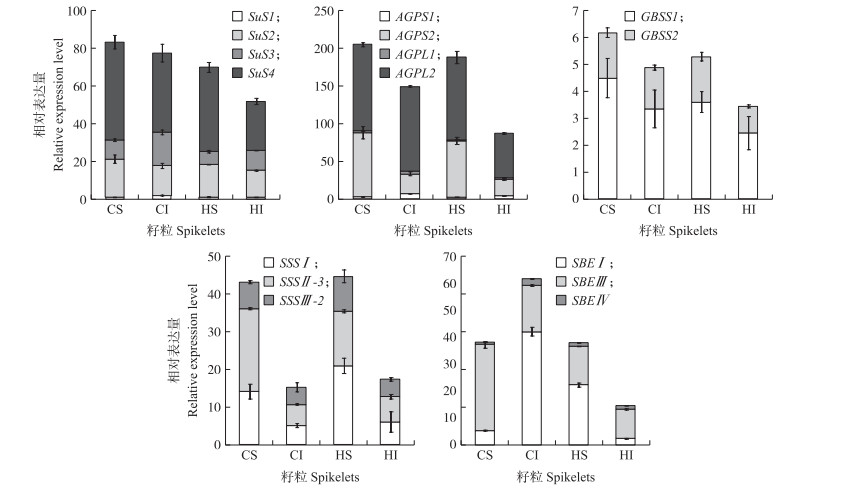
|
图 7 CJ03淀粉代谢关键酶相关基因在花后20 d的表达水平 Figure 7 The gene expression level of key enzymes which involved in starch metabolism in CJ03 at 20 days post anthesis |
调控AGPase合成的基因表达水平在强势粒中高于弱势粒。增温处理条件下的强、弱势粒的基因表达水平均低于对照。差异最明显的为弱势粒中AGPS 1, 表达水平下调了32.91%。
弱势粒中SSS合成相关基因的表达水平低于强势粒, 但其的主效基因在强、弱势粒中有显著差异。强势粒中SSS Ⅰ、SSS Ⅱ -3为主效基因, 而弱势粒中3个基因的表达水平差异不明显。在增温处理下, 强势粒中SSS Ⅱ -3表达水平下调33.68%, 其他2个基因均上调, 但幅度不大; 而弱势粒中3个基因表达水平均上调。
弱势粒中GBSS合成相关的基因表达水平在增温和常温下相对于强势粒均明显上调。强、弱势粒中GBSS的主效基因均为GBSS 1, 在增温处理下其表达水平相对于对照均下调。
SBE合成相关的基因表达水平在弱势粒中的表达上调, 常温下, 弱势粒中SBE合成相关的基因表达水平的比强势粒的高。其中, SBE Ⅰ 的表达水平在强、弱势粒间差异显著, 与对照强势粒相比, 增温处理的强势粒SBE Ⅰ表达水平提高了3.18倍。调控SBE合成的其他基因表达水平差异不明显。
3 结论与讨论本试验表明, 增温处理使得水稻籽粒强势粒和弱势粒灌浆时间均提前, 平均灌浆速率和最大灌浆速率均大于对照, 可能是增温促进了淀粉相关合成关键酶的表达, 导致灌浆前期水稻平均灌浆速率和最大灌浆速率增加。2个品种灌浆时间均明显短于对照, 说明增温使得灌浆活跃期缩短, 其原因可能是灌浆中后期光合速率以及呼吸作用的影响导致叶片中同化物合成以及向籽粒运输减少, 导致同化物供给不足, 淀粉合成减少, 灌浆时间缩短。花后开放式增温导致成熟期2个品种的直链淀粉含量均下降, 而弱势粒的千粒质量均明显增加, 虽然弱势粒的千粒质量增加但是由于弱势粒的空瘪粒居多, 其对产量的影响小于强势粒, 导致增温处理的产量仍低于常温对照, 这一结果与Fu等[18]的研究结果一致, 增温处理对2个品种的影响具有一致性。
有研究表明水稻由供给源合成蔗糖运输到籽粒中供淀粉合成[19], 稻米中约有33种酶参与这一生化反应, 其中SuSase、AGPase、SSS和SBE在淀粉合成中起重要作用[20]。Yang等[21]的研究表明强、弱势粒之间差异主要由淀粉合成相关蛋白差异引起。控制SuSase合成的主效基因为SuS 2、SuS3和SuS4。前人研究表明高温会降低SuSase活性[22], 但本试验的结果显示花后10 d增温使得控制SuSase的基因表达水平增加, 尤其在弱势中表达水平增加明显, 但花后20 d强势粒控制SuSase合成的基因表达水平高温低于常温。说明增温处理前期能够促进SuSase合成相关基因的表达, 即促进蔗糖的分解, 为后续淀粉的合成提供同化物。
本研究可以看出经过高温处理使得调控AGPase的2个基因表达水平均上调促进灌浆, 并且花后10 d和花后20 d强势粒的基因表达水平明显高于弱势粒。这是强势粒灌浆速率明显高于弱势粒的一个主要原因, 这与Ishimaru等[23]的研究结果一致。但是调控AGPase合成基因表达水平受温度影响较小, 说明温度对淀粉合成的影响可能是影响其他酶合成的基因表达水平差异造成。
GBSS是参与直链和支链的合成, 调控支链淀粉的结构差异的主要酶[20]。GBSS 1和GBSS2均对温度比较敏感花后10 d和花后20 d的基因表达水平差异均表明高温明显降低了其表达水平, 而且主效基因为GBSS 2。调控GBSS合成的基因表达水平下降, 淀粉合成可能是导致直链淀粉含量下降的主要原因。SSS主要控制支链淀粉的合成, 支链淀粉含量上升, 其主要原因可能是增温处理的强势粒中调控SSS合成的基因表达水平明显高于对照强势粒且SSS 1在强势粒中受温度影响大, 出现了明显的表达水平增加。强、弱势粒之间控制GBSS和SSS合成的基因表达水平出现差异是导致其直链和支链淀粉含量出现差异的主要原因之一。
SBE在灌浆后期起主要作用, 调控支链淀粉精细结构的形成[24]。Wei等[25]研究表明在高温处理下SBE Ⅰ 和SBE Ⅲ 基因表达水平下调, 而SBE Ⅳ 的表达水平上调。本试验结果表明经过高温处理使得控制SBE的基因表达水平上调, 而且SBE Ⅰ相对于SBE Ⅲ和SBE Ⅳ 对温度敏感, 而SBE参与支链淀粉的合成。这可能是高温使得支链淀粉含量上升的主要原因之一, 但与Jiang等[26]的研究结果不一致。
本研究中, 增温处理和常温对照在花后10 d调控淀粉合成关键酶合成的基因表达水平强势粒均高于弱势粒, 与强势粒相比弱势粒花后20 d灌浆相关酶基因表达水平相对于花后10 d有明显的上升说明弱势粒灌浆高峰期出现时间相对于强势粒滞后, 这可能是弱势粒灌浆出现滞育期的根本原因。GBSS的表达水平均受增温影响下调, 使得直链淀粉含量下降。其中控制SSS合成的主效基因发生改变。试验结果显示控制SBE合成的基因表达水平在花后20 d仍然是明显的上调。
从试验得到的结果分析, 花后开放式增温, 能够通过影响与直链淀粉合成相关酶的调控基因从而降低水稻籽粒中直链淀粉含量的下降。另一方面开放式增温在前期明显的促进强、弱势粒灌浆, 增温使得调控淀粉合成关键酶基因表达水平上调, 对于强势粒灌浆前期起促进作用, 但增温后期强势粒灌浆乏力, 说明增温处理对灌浆产生不利影响。增温使得前期弱势与灌浆相关基因表达水平增加, 进而灌浆速率增加, 但灌浆活跃期缩短, 最终导致产量下降, 这是增温对灌浆期水稻产量影响的主要原因。本试验意在模拟全球气候变暖对水稻灌浆期水稻生理及调控灌浆相关酶的基因表达水平的影响, 为以研究全球气候变暖的应对措施提供的理论基础。
| [1] | 莫惠栋. 我国稻米品质的改良[J]. 中国农业科学, 1993, 26(4): 8–14. Mo H D. Quality improvement of rice grain in China[J]. Agritural Science in China, 1993,26(4): 8–14. (in Chinese) |
| [2] | Matsui T, Omasa K. Rice (Oryza sativa L.) cultivars tolerant to high temperature at flowering:anther characteristics[J]. Annals of Botany, 2002,89(6): 683–687. DOI: 10.1093/aob/mcf112 |
| [3] | Prasad P V V, Boote K J, Allen L H, et al. Species, ecotype and cultivar differences in spikelet fertility and harvest index of rice in response to high temperature stress[J]. Field Crops Research, 2006,95(2): 398–411. |
| [4] | 曹云英.高温对水稻产量与品质的影响及其生理机制[D].扬州:扬州大学, 2009. Cao Y Y. Effect of high temperature on the quality and yield of rice and its physiological mechanism[D]. Yangzhou:Yangzhou University, 2009(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-11117-2009193064.htm |
| [5] | 董明辉, 谢裕林, 乔中英, 等. 水稻不同粒位籽粒淀粉与蛋白质累积动态差异[J]. 中国水稻科学, 2011, 25(3): 297–306. Dong M H, Xie Y L, Qiao Z Y, et al. Variation in carbohydrate and protein accumulation between spikelets at different positions within a rice panicle during grain filling[J]. Chinese Journal of Rice Science, 2011,25(3): 297–306. (in Chinese) |
| [6] | 谢光辉, 杨建昌, 王志琴, 等. 水稻籽粒灌浆特性及其与籽粒生理活性的关系[J]. 作物学报, 2001, 27(5): 558–565. Xie G H, Yang J C, Wang Z Q, et al. Grain filling characteristics of rice and their relationships to physiological activities of grains[J]. Acta Agronomica Sinica, 2001,27(5): 558–565. (in Chinese) |
| [7] | Yang J C, Zhang J H. Grain filling problem in "super" rice[J]. J Exp Bot, 2009,61: 1–5. |
| [8] | Keeling P L, Bacon P J, Holt D C. Elevated temperature reduces starch deposition in wheat endosperm by reducing the activity of soluble starch synthase[J]. Planta, 1993,191: 342–348. |
| [9] | Schaffer A A, Petreikov M. Sucrose-to-starch metabolism in tomato fruit undergoing transientstarch accumulation[J]. Plant Physiol, 1997,113: 739–746. DOI: 10.1104/pp.113.3.739 |
| [10] | Mizuno K, Kimura K, Arai Y, et al. Starch branching enzymes from immature rice seeds[J]. J Biochem, 1992,112: 643–651. |
| [11] | Vandeputte G E, Delcour J A. From sucrose to starch granule to starch physical behavior:a focus on rice starch[J]. Carbohydrate Polymers, 2004,58: 245–266. DOI: 10.1016/j.carbpol.2004.06.003 |
| [12] | Duan M, Sun S S. Profiling the expression of genes controlling rice grain quality[J]. Plant Molecular Biology, 2005,59: 165–178. DOI: 10.1007/s11103-004-7507-3 |
| [13] | Takemoto-Kuno Y, Suzuki K, Nakamura S, et al. Soluble starch synthase:Ⅰ.Effects differences in amylopectin structure between indica and japonica rice varieties[J]. Journal of Agricultural and Food Chemistry, 2006,54: 9234–9240. DOI: 10.1021/jf061200i |
| [14] | Fujita N, Toyosawa Y, Utsumi Y, et al. Characterization of pullulanase (PUL)-deficient mutants of rice (Oryza sativa L.) and the function of PUL on starch biosynthesis in the developing rice endosperm[J]. Journal of Experimental Botany, 2009,60: 1009–1023. DOI: 10.1093/jxb/ern349 |
| [15] | Hirose T, Scofield G N, Terao T. An expression analysis profile for the entire sucrose synthase gene family in rice[J]. Plant Science, 2008,174: 534–543. DOI: 10.1016/j.plantsci.2008.02.009 |
| [16] | Yamakawa H, Hirose T, Kuroda M, et al. Comprehensive expression profiling of rice grain filling-related genes under high temperature using DNA microarray[J]. Plant Physiology, 2007,144: 258–277. DOI: 10.1104/pp.107.098665 |
| [17] | Yamanouchi H, Nakamura Y. Organ specificity of isoforms of starch branching enzyme (Q-enzyme) in rice[J]. Plant Cell Physiol, 1992,33: 985–991. |
| [18] | Fu J, Xu Y J, Chen L, et al. Changes in enzyme activities involved in starch synthesis and hormone concentrations in superior and inferior spikelets and their association with grain filling of super rice[J]. Rice Science, 2013,20(2): 120–128. DOI: 10.1016/S1672-6308(13)60116-X |
| [19] | James M G, Denyer K, Myers A M. Starch synthesis in the cereal endosperm[J]. Current Opinion in Plant Biology, 2003,6(3): 215–222. DOI: 10.1016/S1369-5266(03)00042-6 |
| [20] | Mohapatra P K, Sarkar R K, Kuanar S R. Starch synthesizing enzymes and sink strength of grains of contrasting rice cultivars[J]. Plant Science, 2009,176: 256–263. DOI: 10.1016/j.plantsci.2008.11.001 |
| [21] | Yang J, Peng S, Gu S, et al. Changes in activities of three enzymes associated with starch synthesis in rice grains during grain-filling[J]. Acta Agronomica Sinica, 2001,27: 157–164. |
| [22] | Zhang Z, Zhao H, Tang J, et al. A proteomic study on molecular mechanism of poor grain-filling of rice (Oryza sativa L.) inferior spikelets[J]. PloS ONE, 2014,9(2): e89140. DOI: 10.1371/journal.pone.0089140 |
| [23] | Ishimaru T, Hirose T, Matsuda T, et al. Expression patterns of genes encoding carbohydrate-metabolizing enzymes and their relationship to grain filling in rice (Oryza sativa L.):comparison of caryopses located at different positions in a panicle[J]. Plant and Cell Physiology, 2005,46(4): 620–628. DOI: 10.1093/pcp/pci066 |
| [24] | Umemoto T, Terashima K, Nakamura Y, et al. Differences in amylopectin structure between two rice varieties in relation to the effects of temperature during grain-filling[J]. Starch-Stärke, 1999,51(2/3): 58–62. |
| [25] | Wei K S, Cheng F M, Zhang Q F, et al. Differential response of three isoform genes encoding starch branching enzymes (SBE) in rice endosperms to high temperature stress at the filling stage[J]. Chinese Journal of Rice Science, 2009,23(1): 19–24. |
| [26] | Jiang H, Dian W, Wu P. Effect of high temperature on fine structure of amylopectin in rice endosperm by reducing the activity of the starch branching enzyme[J]. Phytochemistry, 2003,63(1): 53–59. DOI: 10.1016/S0031-9422(03)00005-0 |




