文章信息
- 蒋悦, 孙娟, 韩思迪, 范磊, 许凯文, 江玲, 王春明
- JIANG Yue, SUN Juan, HAN Sidi, FAN Lei, XU Kaiwen, JIANG Ling, WANG Chunming
- 水稻黄叶突变体yl的遗传分析与基因定位
- Genetic analysis and gene mapping of a yellow leaf mutant yl in rice
- 南京农业大学学报, 2016, 39(6): 889-897
- Journal of Nanjing Agricultural University, 2016, 39(6): 889-897.
- http://dx.doi.org/10.7685/jnau.201604004
-
文章历史
- 收稿日期: 2016-04-01
水稻是单子叶植物分子生物学研究的模式作物[1]。叶片是水稻进行光合作用的主要器官, 水稻叶色突变会直接影响植株的光合作用, 从而影响有机物质的合成和积累, 进而影响水稻的产量。因此, 通过鉴定水稻叶色调控的基因及分子调控机制, 并应用于育种实践, 是实现水稻产量再次飞跃的有效途径之一[2]。
叶色突变体是一种自然界常见的突变类型, 性状明显, 易于区分辨认。已有研究表明, 叶色突变大多受1对隐性核基因控制, 受显性核基因或细胞质基因控制的叶色突变极少被报道。根据表型可将叶色突变分为白化、黄化、浅绿、白翠、绿白、绿黄、黄绿和条纹等类型[3]。叶绿素是植物叶绿体内参与光合作用的重要色素, 叶绿素的生物合成是一个相当复杂的过程。叶色基因的突变可能直接或间接影响叶绿素的合成和降解, 进而改变叶绿素含量, 导致植物叶色发生变化。在水稻中已鉴定和克隆了多个参与叶绿素合成与降解的基因, 包括参与编码叶绿素合成的OsCAO 1/OsCAO2(编码叶绿素a加氧酶基因; OsCAO 1催化叶绿素a, OsCAO 2合成叶绿素b), YGL 1、OsCHLH、OsDVR、CBL、CHLD、CHLI(编码镁离子螯合酶D、I亚基), HEMA 1(编码谷酰基tRNA还原酶), PORA(编码NADPH依赖的原叶绿素酸酯氧化还原酶)和WGL等[4-12]; 叶绿素降解基因包括NYC 1、NYC3、NOL、SGR等[13-16]。有些参与类胡萝卜素合成的基因, 如OsZDS、OsPDS、OsCRTISO、β-OsLCY等编码的酶对类胡萝卜素前体ABA的合成起着关键的作用[17-18]。这些水稻叶色突变体的鉴定, 不仅为研究高等植物光合作用[19-20]、叶绿素合成、叶绿体分化与发育[21]提供了重要材料, 而且可以作为性状标记用于良种繁育及杂交育种[22]。
在本研究中, 通过60Co-γ射线辐射[23]诱变籼型水稻品种‘9311’, 获得1个黄叶突变体yl, 该突变体表现出苗期叶片黄化。我们对yl突变体的生理特征、叶绿体超微结构以及主要的农艺性状进行了考察, 并利用分子标记对突变位点进行遗传分析、基因定位及候选基因分析, 为进一步揭示该基因功能, 明确水稻叶色变异机制提供了依据。
1 材料与方法 1.1 供试材料从籼稻品种‘9311’经60Co-γ射线辐射诱变突变体库中, 筛选分离了1个黄叶突变体, 经多代自交稳定, 命名为yl。将yl突变体与叶片颜色正常的粳稻品种‘宁粳4号’进行杂交, 构建用于定位的F2分离群体。2015年夏季, 将野生型‘9311’、yl突变体和F2群体种植在南京农业大学水稻研究所土桥试验基地。
1.2 表型与农艺性状考察浸种催芽后, 放入温箱培养(12 h光照/12 h黑暗), 约14 d后, 在2叶1心期与3叶期之间, 分别取‘9311’和yl突变体第2片完整叶用于光合色素含量的测定和叶绿体超微结构的观察, 方法参照Li等[24]。于2015年5月15日前后, 在南京土桥试验基地进行播种育秧, 25 d后进行移栽。野生型和突变体各种植10行, 每行10株, 株距均为16.5 cm, 宽行行距为23.5 cm, 窄行行距为16.5 cm。采用常规田间栽培管理。于抽穗期, 随机挑选野生型和突变体各15株, 测量株高, 收获后考察穗长、有效穗数、每穗粒数、结实率、千粒质量、粒长和粒宽等农艺性状。采用Microsoft Excel 2007软件对野生型和突变体植株的光合色素含量及主要农艺性状进行方差分析, 采用万深SC-G自动拷种分析及千粒质量检测系统测量粒长、粒宽、千粒质量。
1.3 群体构建2014年夏季在南京土桥试验基地, 以yl突变体为父本与粳稻‘宁粳4号’杂交获得F1, 2014年冬季将F1种植于海南陵水, 观察F1表型, 并自交获得F2分离群体。2015年夏季将F2分离群体种植在南京土桥, 群体各种植200行, 每行10株, 株距均为16.5 cm, 宽行行距为23.5 cm, 窄行行距为16.5 cm。采用常规田间栽培管理。随机选择F2分离群体的一个区域, 考查黄叶性状的分离比, 并用χ2进行检验。进一步挑选F2分离群体中的48个正常叶色单株和752个黄叶单株用于基因定位。
1.4 DNA提取与标记检测采用CTAB法提取‘9311’‘宁粳4号’和yl以及由‘宁粳4号’与yl构建的48个正常叶色单株和752个黄叶单株水稻叶片的总DNA。
1.5 基因定位与候选基因分析首先从223个SSR标记和118个Indel标记筛选出有多态性的DNA标记。再利用选取的10个黄化表型的F2单株确定连锁标记与突变体基因间的重组值和遗传图距, 进行突变体基因的初步定位。根据Gramene网站(http://www.gramene.org/)的‘日本晴’和‘9311’基因组序列, 利用Primer Premier 5.0软件在初步定位的区间内设计SSR标记, 进一步缩小定位区域。然后根据水稻基因组注释数据库Gramene网站, 在目标区域内筛选候选基因。根据候选基因全长基因组序列设计测序引物, 采用高保真DNA聚合酶KOD-Plus-ver.2(TOYOBO日本公司)分别扩增野生型和突变体的基因组序列, 通过测序来确定基因的突变位点。
1.6 三级结构预测采用同源建模法对野生型和突变体的YL蛋白进行三级结构预测。在SWISS-MODEL (http://swissmodel.expasy.org)服务器中, 使用同一模板对野生型和突变体蛋白分别建模, 进行蛋白结构的比对。
1.7 RT-PCR分析提取生长14 d的水稻幼苗叶片RNA, 总RNA提取使用RNA Prep Pure Plant Kit (Tiangen)提取试剂盒。RNA反转录使用SuperScript ⅡKit (TaKaRa)反转录试剂盒。定量RT-PCR使用SYBR® Premix Ex TaqTMKit (TaKaRa)试剂盒, 仪器为ABI prism 7500定量RT-PCR系统。反应体系为:10 μL SYBR Premix Ex TaqⅡ, 0.8 μL 10 μmol · L-1前、后引物, 0.4 μL ROX Reference DyeⅡ(50×), 模板DNA为6 μL (一般为100 ng以下), ddH2O为2 μL, 总体积为20 μL, 重复3次。反应程序为:95 ℃预变性5 min; 95 ℃ 15 s 60 ℃ 30 s, 循环40次, 添加熔解曲线(95 ℃ 15 s, 60 ℃ 1 min, 95 ℃ 15 s)。水稻Actin基因(Os03g0718150)用作内参; 试验中所得到的CT值(样品达到域值水平的循环数)的范围为15~28较为合理, 试验数据结果采用2-ΔΔCT方法分析处理, 每个样品重复3次。
1.8 亚细胞定位载体的构建利用PrimeSTAR® HS DNA聚合酶(TaKaRa)分别从野生型、突变体的cDNA中扩增出YL和yl基因的全长编码序列(去除终止密码子), 采用双切双连的方法连接到瞬时表达载体pAN580上, 由CaMV 35S强启动子驱动, 序列融合到GFP蛋白的N端。
1.9 水稻原生质体的分离及转化根据Chen等[25]公布的水稻原生质体制备及转化的方法, 将生长10~14 d的幼苗茎秆切成0.5 mm的碎片, 放入事先配置好的10 mL酶液(包含1.5%的纤维素酶和0.3%的离析酶), 28 ℃、40 r · min-1进行黑暗酶解4 h; 滤除酶液, 固体沉淀加入10 mL的W5溶液, 28 ℃、80 r · min-1黑暗培养1 h; 过滤, 去沉淀, 滤液用10 mL圆底管分装, 室温250 g离心4 min; 去除上清液, 沉淀用适量的PSM (protoplast suspension medium)溶液轻轻悬浮; 在2.0 mL聚丙烯管中加入10 μg的质粒, 补水至20 μL; 将之前的原生质体悬浮液分装到这些2.0 mL聚丙烯管中, 轻轻混匀; 加入220 μL的40% PEG溶液, 轻轻颠倒混匀; 静置20 min, 加入1 mL的K3溶液, 颠倒混匀; 28 ℃黑暗培养16 h; GFP荧光用激光共聚焦显微镜(Leica TCS SP5)观察。
2 结果与分析 2.1 突变体的形态特征和主要农艺性状田间条件下, yl突变体苗期新生叶片表现出明显的黄化表型(图 1-A, B); 随着叶片生长, 叶片逐渐转绿最终恢复正常表型。抽穗之后, 所有的叶片均表现为正常的绿色。在光照培养箱生长7 d后, yl突变体较野生型(‘9311’)也表现出黄化表型(图 1-C)。此外, 对野生型和突变体的农艺性状进行调查发现, 突变体的株高、抽穗期、穗长、有效穗数、粒长和粒宽与野生型相比没有明显的差异, 而每穗粒数、结实率和千粒质量差异显著(表 1)。突变体相对于野生型在每穗粒数、结实率和千粒质量上分别下降了13.3%、12.9%和14.0%。这些结果表明, 叶色变化对突变体的籽粒灌浆和充实效率产生了影响。这可能是由于叶色变化改变了突变体的光合效率, 从而影响了植株的正常生长和发育。

|
图 1 野生型和yl突变体的表型 Figure 1 Phenotype of the wild-type (WT) and the yl mutant plants A, B:田间条件下分蘖初期; C:室内温室7 d幼苗; D:种子大小的比较。比例尺:A, B为15 cm, C为5 cm, D为5 mm。 A, B:Plants at early tillering stage in the paddy field; C:7-day-old plants in greenhouse; D:Comparisons of seed size. Bar (A, B)=15 cm, Bar (C)=5 cm, Bar (D)=5 mm. |
| 性状Trait | 9311 | yl | 比对照增减/% Compared with control |
| 株高/cm Plant height | 119.12±3.18 | 118.35±2.71 | -0.65 |
| 抽穗期/d Heading date | 103.00±0.00 | 102.00±0.00 | -0.97 |
| 穗长/cm Panicle length | 23.17±2.23 | 22.95±2.72 | -0.95 |
| 有效穗数Effective panicle number | 6.21±1.12 | 6.15±1.71 | -0.98 |
| 每穗粒数Grain number per panicle | 239.00±27.2 | 208.25±9.70 | -13.30** |
| 结实率/% Seed setting rate | 89.22±5.47 | 77.68±6.39** | -12.93** |
| 千粒质量/g 1 000-grain weight | 32.40±1.37 | 27.86±1.12** | -14.01** |
| 粒长/mm Grain length | 9.49±0.74 | 9.72±0.59 | 2.42 |
| 粒宽/mm Grain width | 2.78±0.75 | 2.49±0.34 | -10.43 |
| 注:* *表示野生型与突变体在0.01水平差异显著。* * means significant difference between the wild-type and the yl mutant at 0.01 level. | |||
光合色素含量会影响植株叶片的颜色, 分别对发芽后14 d的野生型‘9311’和yl突变体进行叶绿素含量的测定。结果显示:在30 ℃的生长环境下, 突变体的色素含量与野生型‘9311’相比均显著下降(图 2), 其中叶绿素a含量下降了77.3%, 叶绿素b含量下降了69.1%, 类胡萝卜素含量下降了68.4%。由此可以推断, 控制yl叶色突变的基因直接或间接影响了叶绿素的合成。
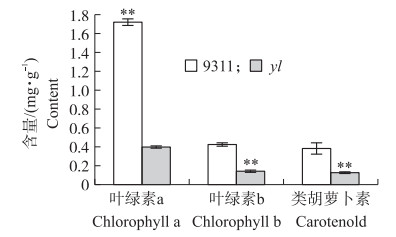
|
图 2 野生型9311和yl突变体叶片的光合色素含量比较(30 ℃) Figure 2 Comparisons of photosynthetic pigment contents between the wild-type 9311 and the yl mutant leaves * *P < 0.01 |
对野生型和突变体的叶片进行透射电镜观察, 发现yl突变体的叶绿体数目大小与野生型相差无几。野生型叶绿体基质浓厚, 类囊体丰富, 基粒垛叠整齐且排列紧密; 而yl突变体中类囊体数量明显减少, 其片层结构排列松散(图 3)。该结果表明YL基因的突变影响了叶绿体的正常发育。
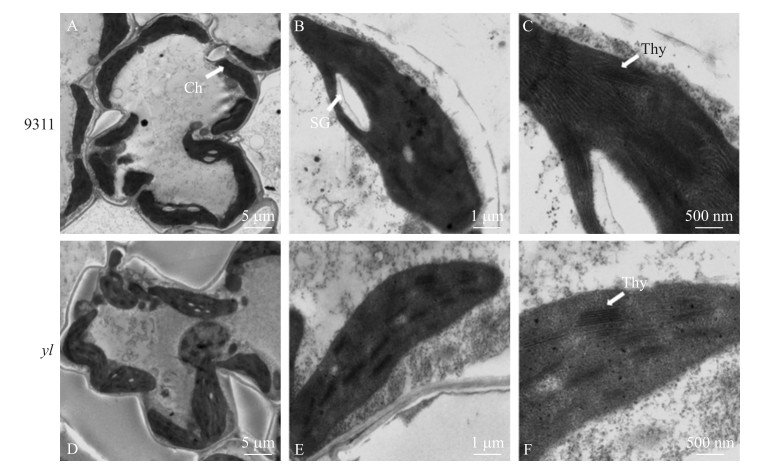
|
图 3 野生型9311和yl突变体的叶绿体超微结构比较 Figure 3 Comparisons of chloroplasts ultrastructures between the wild-type 9311 and the yl mutant plants Ch:叶绿体Chloroplast; SG:淀粉颗粒Starch granule; Thy:类囊体片层Thylakoid lamellar |
以正常叶色的‘宁粳4号’为母本, yl突变体为父本, 进行杂交配组, 对F1植株和自交得到的F2群体进行叶色的遗传分析。其中F1植株呈正常绿色, 而F2群体中出现明显的分离, 包含正常叶色与黄叶两种表型。随机调查了400个F2单株, 发现绿叶植株307个, 黄叶植株93个。卡方测验表明:绿叶与黄叶个体的分离比符合3 :1(χ2=0.53 < χ0.052=3.57, P=0.452 7), 说明该yl突变体的黄叶性状是由1对隐性的核基因控制。
利用McCouch[26]和Temnykh[27]公布的SSR标记, 针对定位群体的2个亲本‘宁粳4号’和yl突变体筛选有多态的标记。同时选取F2群体中10个黄叶极端个体用于连锁分析, 初步将定位区域锁定在第9染色体的长臂上, 位于标记RM24085和标记Indel 9-6之间。为了缩小区域, 选取了350个隐性极端个体用于基因定位, 将目标基因定位到RM321和RM524两个标记之间。在标记RM321和标记RM524之间设计了6个多态性的Indel标记, 通过对F2分离群体中300个黄叶交换单株进行分析, 最终将黄叶基因界定在标记Z19和标记RM6051间, 约14.5 kb的区间内。经Gramene网站预测, 该区间内有3个开放阅读框(ORF)(图 4):ORF1为假定的AMP结合酶, ORF2是一个假定蛋白, ORF3是已克隆的水稻黄化基因YLC 1 [28]。因此, 初步将YLC 1作为候选基因。
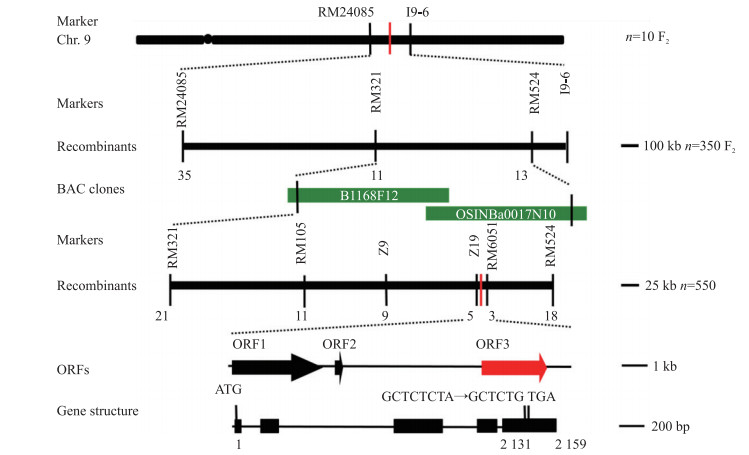
|
图 4 突变体基因的定位与图位克隆 Figure 4 Fine mapping and positional cloning of mutant gene |
2.5yl突变基因的确定
通过设计特异性引物, 从野生型和突变体分别扩增出YLC 1基因全长的CDS片段。测序比较发现, yl突变体在YLC 1基因的第5个外显子区域内, 从697处开始的3个碱基CTA突变为G。相应的, 其编码的第233位的亮氨酸发生改变, 而且移码导致蛋白翻译提前终止, 最终形成了一个包含原有232个氨基酸和16个新形成氨基酸残基的蛋白。这个结果表明YL是一个YLC 1功能丧失的新等位基因。基因组和cDNA序列比对发现, YLC 1包含5个外显子, 编码1个含有269个氨基酸残基的蛋白。前人研究表明YLC1蛋白包含1个不完整的J domain (76~135氨基酸)和4个跨膜结构域(167~268氨基酸)(图 5红色区域分别代表第1到第4个跨膜结构域)。突变后的yl蛋白在第3个跨膜结构域上发生残缺, 而且缺少了第4个跨膜结构域。同源比对发现:在水稻中, 还存在2个与YLC 1高度同源的基因LOC_Os08g32130和LOC_Os03G15033, 而且YLC1基因与拟南芥中的AtCdf1基因序列的相似度高达79%。
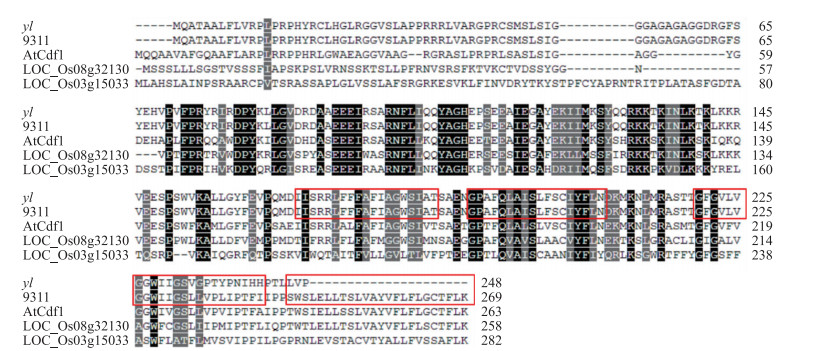
|
图 5 YLC1同源蛋白的氨基酸序列比对 Figure 5 Comparison of amino acid sequences of YLC1-related proteins |
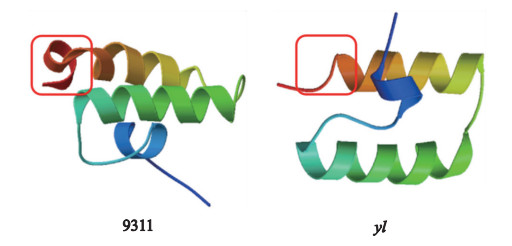
将野生型和突变体YLC1蛋白的氨基酸序列分别提交到SWISSMODEL服务器, 使用同一模板进行三维结构的构建。第5个外显子区域内的突变导致突变体较野生型YLC1蛋白的三维结构发生很大改变(图 6红色区域)。
|
图 6 野生型和yl突变体YLC1蛋白三维预测结构的比较 Figure 6 Comparison of 3D protein structure model of YLC1 between the wild-type and the yl mutant |
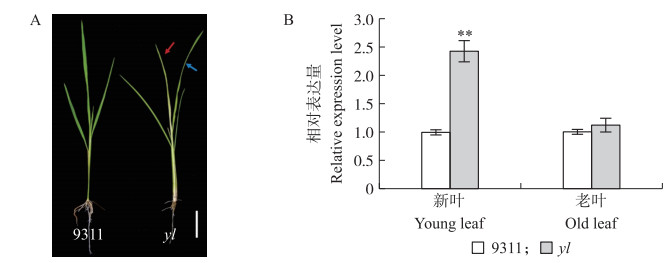
将野生型和yl突变体放在持续30 ℃条件下的光照培养箱生长(12 h光照/12 h黑暗)。在幼苗早期, 突变体的新叶表现出明显的黄化现象, 随着植株的发育叶片颜色会恢复到野生型水平(图 7-A); 用定量RT-PCR的方法分别检测在新叶(红色箭头)和较老叶片(蓝色箭头)中YLC 1基因的表达水平。结果发现, 在yl突变体的新叶中, YLC 1的表达水平与野生型相比显著上调, 而在较老叶片中YLC1的表达水平较野生型相比没有差异(图 7-B)。结果表明:突变体中YLC 1基因的碱基变化主要影响了突变体新叶中YLC1的转录水平, 而不影响老叶的转录水平。
|
图 7 YLC 1在野生型9311和yl突变体新叶和老叶中的表型与表达分析 Figure 7 Phenotype and expression analysis of YLC 1 in young leaf and old leaf of the wild-type 9311 and the yl mutant Bar=2 cm, * *P < 0.01 |
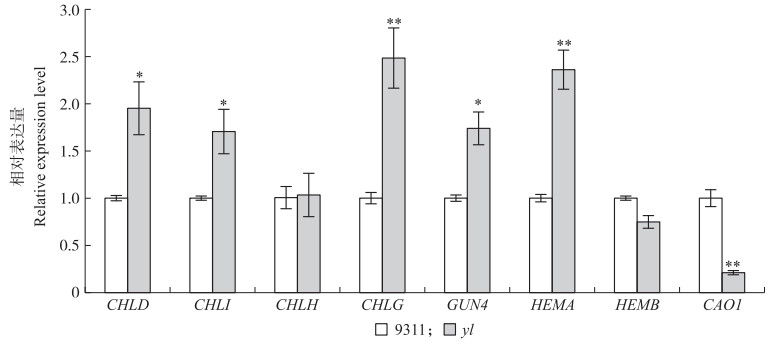
同时用RT-PCR的方法检测黄化叶片中与叶绿素合成相关基因的表达水平。结果(图 8)发现:与野生型相比, 叶绿素合成相关基因在黄化的突变体幼苗中的表达明显上调, 如CHLH、CHLD、CHLI(编码镁离子螯合酶的H、D、I亚基)、CHLG(编码叶绿素合成酶)、GUN 4(编码镁离子螯合酶H亚基结合蛋白)和HEMA(编码谷酰基tRNA还原酶)的表达量上调, 而HEMB(编码胆色素原合酶, 5-氨基酮戊酸脱水酶)、CAO 1(编码叶绿素a加氧酶基因)的表达量下调。因此, YLC 1的突变影响了叶绿素合成有关基因的表达。
|
图 8 叶绿素生物合成有关基因在野生型9311和yl突变体中的表达分析 Figure 8 Expression analysis of genes associated with chlorophyll biosynthesis in wild-type 9311 and yl mutant *P < 0.05, * *P < 0.01 |
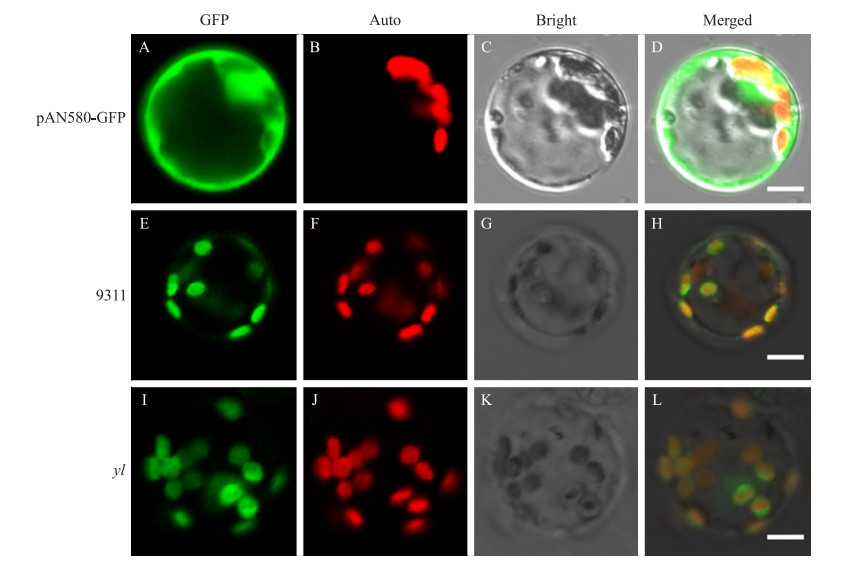
利用水稻原生质体瞬时转化的方法对YLC1蛋白进行亚细胞定位检测。转化GFP空载体到水稻原生质体中作为阴性对照, 用激光共聚焦显微镜观察, 发现GFP信号广泛存在于细胞质和细胞核中(图 9-A~D); 将全长YLC 1基因融合GFP转化到水稻原生质体中, 发现GFP的荧光呈现圆盘模式, 直径为1.5~2.5 μm, 而且与叶绿素的自发荧光完全重合, 从而证实YLC1蛋白是定位到叶绿体中的(图 9-E~H)。同时, 为了确定YLC 1的突变是否影响其蛋白在细胞内的定位, 转化yl-GFP的载体到水稻原生质体中, 发现虽然大多数的GFP荧光在叶绿体中, 但是其在叶绿体内的定位模式发生了变化, 不是呈现完整的叶绿体形态, 而是呈现点状分布(图 9-I~L)。这种定位差异可能是由于突变蛋白中2个跨膜结构域的改变导致的。
|
图 9 YLC1和突变蛋白yl在水稻原生质体中的亚细胞定位 Figure 9 Subcellular localization of YLC1 and yl in rice protoplasts (Bar=5 μm) |
叶绿体是高等植物进行光合作用的重要细胞器, 是1个半自主细胞器, 与细胞核有着微妙的信号传导。叶绿素的合成降解途径、叶绿体的分化发育以及高等植物细胞的质-核信号传导一直以来都是植物科学研究的重点[28]。虽然叶绿体拥有一套自身的遗传物质, 但是大量研究表明, 叶绿体中大部分重要蛋白质都是由核基因编码调控的。当控制叶绿体性状的核基因发生突变时, 造成的叶色突变便能够稳定地遗传。
水稻黄化突变属于叶绿素合成缺陷突变中的一种, 大部分的黄化突变在苗期就开始显现, 有些严重的黄化突变体是致死的, 也有些黄化突变体随着植株的生长能够逐渐转绿。目前在水稻中已发现的黄化突变体有chl 1、chl2、chl3、chl4、chI5、chl6、chl7等, 并均受1对隐性核基因控制。
在本研究中, 从‘9311’突变体库中筛选到了1个水稻黄叶的突变体yl, 该突变体在苗期表现黄化, 叶绿素和类胡萝卜素的含量均显著低于野生型。透射电镜观察显示:突变体叶片中叶绿体的类囊体片层结构排列松散。随着植株的生长, yl突变体的表型逐渐减弱; 从分蘖期开始, 突变表型只出现在新叶中; 抽穗之后, 突变体的叶片都恢复正常。遗传分析显示:该性状受单隐性核基因控制; 通过构建籼粳杂交的F2群体, 将该基因定位到第9染色体长臂14.5 kb的区间内。通过测序, 发现该区间候选基因LOC_Os 09g21250在第5个外显子处存在碱基的改变, 从而导致蛋白翻译提前终止。经查阅文献, 该基因与前人报道的YLC 1等位[28]。YLC 1突变体是在第3个外显子发生10个碱基的缺失突变, 引起基因的表达量下调。除在叶色表型上有差异外, 突变体的其他农艺性状, 如株高、分蘖数、抽穗期、千粒质量和每穗粒数与野生型相比没有明显的差异。进一步观察叶绿体的超微结构, 发现叶绿体的类囊体片层结构与野生型相比排列明显松散, 这与本研究的yl突变体是相似的。因此, yl突变体是1个YLC 1基因的新等位突变体。
表型观察发现:yl突变体会转绿, 即新生叶片表现出黄化表型, 而较老叶片表现出正常叶色表型, 对YL基因在新生叶片和较老叶片的RT-PCR分析结果显示, 该基因的突变只影响新生叶片的叶绿素合成, 而不影响老叶片的叶绿素合成。用RT-PCR方法分别检测野生型叶片和yl突变体黄化叶片中与叶绿素合成相关基因的表达, 多数基因的表达量较野生型有所上调, 说明YL的突变影响了叶绿素的合成, 该基因可能是参与叶绿素合成途径的一个早期调控因子, 发生突变后影响了叶绿素的合成, 从而引发其他与叶绿素合成有关的基因表达量上调。
YL基因编码一个未知功能的蛋白, 属于DUF3353超家族。蛋白结构预测发现, YL含有1个不完整的J结构域和4个跨膜结构域。3D蛋白结构预测表明, yl突变体基因由于第5个外显子区域内的突变导致其蛋白的第3个跨膜结构域残缺, 并且第4个跨膜结构域缺失, 最终影响了其蛋白功能。利用水稻原生质体转化的方法将YL蛋白定位到了叶绿体上。突变蛋白yl虽然定位到了叶绿体中, 但其定位模式与YL不同, 只是呈现点状结构分布在叶绿体内。这说明YL蛋白C端的115个氨基酸对其在叶绿体中的定位起到了重要的作用, yl失去正常的功能可能是由于其缺失了第4个预测的跨膜结构域。
本研究以一个新的水稻黄化突变体yl为材料, 定位了导致其黄化的基因。利用叶色突变体来定位和克隆与叶绿体发育相关的新基因, 对阐明水稻叶色形成的分子机制、光合作用机制、叶绿体发育与叶绿素生物合成具有参考价值。同时对利用基因工程技术提高水稻光合产能、增加水稻产量具有重要的理论意义和应用价值。
| [1] | 郭龙彪, 程式华, 钱前. 水稻基因组测序和分析的研究进展[J]. 中国水稻科学, 2004, 18(6): 557–562. Guo L B, Cheng S H, Qian Q. High lights in sequencing and analysis of rice genome[J]. Chinese J Rice Sci, 2004,18(6): 557–562. (in Chinese) |
| [2] | 王绍华, 刘胜环, 王强盛, 等. 水稻产量形成与叶片含氮量及叶色的关系[J]. 南京农业大学学报, 2002, 25(4): 1–5. Wang S H, Liu S H, Wang S Q, et al. Relationship between yield formation and leaf nitrogen content and color in rice plant[J]. Journal of Nanjing Agricultural University, 2002,25(4): 1–5. DOI: 10.7685/j.issn.1000-2030.2002.04.001 (in Chinese) |
| [3] | 刘艳霞, 林冬枝, 董彦君. 水稻温敏感叶色突变体研究进展[J]. 中国水稻科学, 2015, 29(4): 439–446. Liu Y X, Lin D Z, Dong Y J. Research advances in thermo sensitive leaf coloration mutants in rice[J]. Chinese Journal of Rice Science, 2015,29(4): 439–446. (in Chinese) |
| [4] | Lee S, Kim J H, Yoo E S, et al. Differential regulation of chlorophyll a oxygenase genes in rice[J]. Plant Molecular Biology, 2005,57(6): 805–818. DOI: 10.1007/s11103-005-2066-9 |
| [5] | Wu Z M, Zhang X, He B, et al. A chlorophyll-deficient rice mutant with impaired chlorophyllide esterification in chlorophyll biosynthesis[J]. Plant Physiology, 2007,145(1): 29–40. DOI: 10.1104/pp.107.100321 |
| [6] | Goh C H, Satoh K, Kikuchi S, et al. Mitochondrial activity in illuminated leaves of chlorophyll-deficient mutant rice (OsCHLH) seedlings[J]. Plant Biotechnology Reports, 2010,4(4): 281–291. DOI: 10.1007/s11816-010-0146-z |
| [7] | Wang P R, Wan C M, Xu Z J, et al. One divinyl reductase reduces the 8-vinyl groups in various intermediates of chlorophyll biosynthesis in a given higher plant species, but the isozyme differs between species[J]. Plant Physiology, 2013,161(1): 521–534. DOI: 10.1104/pp.112.208421 |
| [8] | Li J, LongY, Qi G N, et al. The Os-AKT1 channel is critical for K+ uptake in rice roots and is modulated by the rice CBL1-CIPK23 complex[J]. Plant Cell, 2014,26(8): 3387–3402. DOI: 10.1105/tpc.114.123455 |
| [9] | Deng X J, Zhang H Q, Wang Y, et al. Mapped clone and functional analysis of leaf-color gene Ygl7 in a rice hybrid (Oryza sativa L.ssp.indica)[J]. PLoS ONE, 2014,9(6): e99564. DOI: 10.1371/journal.pone.0099564 |
| [10] | Zhang H T, Li J J, Yoo J H, et al. Rice Chlorina-1 and Chlorina-9 encode ChlD and ChlI subunits of Mg-chelatase, a key enzyme for chlorophyll synthesis and chloroplast development[J]. Plant Molecular Biology, 2006,62(3): 325–337. DOI: 10.1007/s11103-006-9024-z |
| [11] | Liu W, Fu Y, Hu G, et al. Identification and fine mapping of a thermo-sensitive chlorophyll deficient mutant in rice (Oryza sativa L.)[J]. Planta, 2007,226(3): 785–795. DOI: 10.1007/s00425-007-0525-z |
| [12] | 刘喜, 周春雷, 任雅琨, 等. 水稻叶色白化转绿突变体WGL的遗传分析与基因定位[J]. 南京农业大学学报, 2015, 38(5): 712–719. Liu X, Zhou C L, Ren Y K, et al. Genetic analysis and gene mapping of virescent albino leaf mutant WGL in rice[J]. Journal of Nanjing Agricultural University, 2015,38(5): 712–719. DOI: 10.7685/j.issn.1000-2030.2015.05.003 (in Chinese) |
| [13] | Sakuraba Y, Rahman M L, Cho S H, et al. The rice faded green leaf locus encodes protochlorophyllide oxidoreductase B and is essential for chlorophyll synthesis under high light conditions[J]. Plant Journal, 2013,74(1): 122–133. DOI: 10.1111/tpj.2013.74.issue-1 |
| [14] | Sato Y, Morita R, Katsuma S, et al. Two short-chain dehydrogenase/reductases, NON-YELLOW COLORING 1 and NYC1-LIKE, are required for chlorophyll b and light-harvesting complex Ⅱ degradation during senescence in rice[J]. Plant Journal, 2009,57(1): 120–131. DOI: 10.1111/tpj.2008.57.issue-1 |
| [15] | Morita R, Sato Y, Masuda Y, et al. Defect in non-yellow coloring 3, an α/β hydrolase-fold family protein, causes a stay-green phenotype during leaf senescence in rice[J]. Plant Journal, 2009,59(6): 940–952. DOI: 10.1111/tpj.2009.59.issue-6 |
| [16] | Jiang H W, Li M R, Liang N T, et al. Molecular cloning and function analysis of the stay green gene in rice[J]. Plant Journal, 2007,52(2): 197–209. DOI: 10.1111/tpj.2007.52.issue-2 |
| [17] | Fang J, Chai C L, Qian Q, et al. Mutations of genes in synthesis of the carotenoid precursors of ABA lead to pre-harvest sprouting and photo-oxidation in rice[J]. Plant Journal, 2008,54(2): 177–189. DOI: 10.1111/j.1365-313X.2008.03411.x |
| [18] | Yin C C, Ma B, Collinge D P, et al. Ethylene responses in rice roots and coleoptiles are differentially regulated by a carotenoid isomerase-mediated abscisic acid pathway[J]. Plant Cell, 2015,27(4): 1061–1081. DOI: 10.1105/tpc.15.00080 |
| [19] | Wang P R, Gao J X, Wan C M, et al. Divinyl chlorophyll (ide) a can be converted to monovinyl chlorophyll (ide) a by a divinylreductase in rice[J]. Plant Physiology, 2010,153(3): 994–1003. DOI: 10.1104/pp.110.158477 |
| [20] | Yamatani H, Sato Y, Masuda Y, et al. NYC4, the rice ortholog of Arabidopsis THF1, is involved in the degradation of chlorophyll-protein complexes during leaf senescence[J]. Plant Journal, 2013,74: 652–662. DOI: 10.1111/tpj.2013.74.issue-4 |
| [21] | Kusumi K, Sakata C, Nakamura T, et al. A plastid protein NUS1 is essential for build-up of the genetic system for early chloroplast development under cold stress conditions[J]. Plant Journal, 2011,68(6): 1039–1050. DOI: 10.1111/tpj.2011.68.issue-6 |
| [22] | Su N, Hu M L, Wu D X, et al. Disruption of a rice pentatricopeptide repeat protein causes a seedling-specific albino phenotype and its utilization to enhance seed purity in hybrid rice production[J]. Plant Physiology, 2012,159(1): 227–238. DOI: 10.1104/pp.112.195081 |
| [23] | 杨春艳, 江玲, 沈贝贝, 等. 水稻品种'南粳35'辐射诱变突变体的鉴定[J]. 南京农业大学学报, 2012, 35(3): 1–6. Yang C Y, Jinag L, Shen B B, et al. Identification of mutants from radiated'Nanjing 35' in rice[J]. Journal of Nanjing Agricultural University, 2012,35(3): 1–6. DOI: 10.7685/j.issn.1000-2030.2012.03.001 (in Chinese) |
| [24] | Li Z, Zhang Y X, Liu L, et al. Fine mapping of the lesion mimic and early senescence 1(lmes1) in rice (Oryza sativa)[J]. Plant Physiology and Biochemistry, 2014,80: 300–307. DOI: 10.1016/j.plaphy.2014.03.031 |
| [25] | Chen S, Tao L, Zeng L, et al. A highly efficient transient protoplast system for analyzing defence gene expression and protein-protein interactions in rice[J]. Mol Plant Pathol, 2006,7: 417–427. DOI: 10.1111/mpp.2006.7.issue-5 |
| [26] | McCouch S R, Teytelman L, Xu Y, et al. Development and mapping of 2240 new SSR markers for rice (Oryza sativa L.)[J]. DNA Res, 2002,9: 199–207. DOI: 10.1093/dnares/9.6.199 |
| [27] | Temnykh S, Park W D, Ayres N, et al. Mapping and genome organization of microsatellite sequences in rice (Oryza sativa L.)[J]. Theor App Genet, 2000,100: 697–712. DOI: 10.1007/s001220051342 |
| [28] | Zhou K N, Ren Y L, Lü J, et al. Young leaf chlorosis 1, a chloroplast-localized gene required for chlorophyll and lutein accumulation during early leaf development in rice[J]. Planta, 2013,237(1): 279–292. DOI: 10.1007/s00425-012-1756-1 |




