文章信息
- 马百全, 魏天雨, 吴艳, 郭苹, 王钧顺, 张建生, 邢军, 刘红林, 李齐发
- MA Baiquan, WEI Tianyu, WU Yan, GUO Ping, WANG Junshun, ZHANG Jiansheng, XING Jun, LIU Honglin, LI Qifa
- 苏淮猪BMP4基因3'-UTR区克隆和多态性分析
- Cloning and polymorphism of BMP4 gene 3'-UTR in Suhuai pig
- 南京农业大学学报, 2016, 39(5): 819-824
- Journal of Nanjing Agricultural University, 2016, 39(5): 819-824.
- http://dx.doi.org/10.7685/jnau.201602002
-
文章历史
- 收稿日期: 2016-02-02
2. 淮阴种猪场, 江苏 淮安 223322 ;
3. 江苏农林职业技术学院, 江苏 句容 212400
2. Huaiyin Pig Breeding Farm, Huai'an 223322, China ;
3. Jiangsu Polytechnic College of Agriculture and Forestry, Jurong 212400, China
骨形态发生蛋白(bonemorphogeneticprotein, BMP)是转化生长因子β(TGF-β)超家族中最大的一个亚家族[1]。BMP4是BMP亚家族中的重要成员之一, 在哺乳动物体内发挥广泛的调控作用。研究发现BMP4除了促进软骨和骨组织形成外[2], 在干细胞调节、细胞功能、胚胎发育、器官形成、神经系统发育和分化, 甚至癌症发生等各方面均发挥重要作用[3-5]。在生殖系统调节中, 睾丸和卵巢是BMP4作用的重要靶器官[6-7]。在卵巢组织中, BMP4主要在各个发育阶段卵泡的卵泡膜细胞中表达, 对各级卵泡发育均具有一定的调节作用[7-8]。Nilsson等[9]研究发现BMP4是一个卵泡存活因子, 在体外培养的大鼠卵巢组织中添加BMP4, 可通过激活BMP/SMAD信号通路促进原始卵泡的发育和原始卵泡向初级卵泡的转换, 而抑制了BMP4表达后卵巢体积会显著缩小、变形, 卵母细胞和原始卵泡逐渐丢失, 细胞凋亡增加, 与Bertoldo等[10]在绵羊体外培养的卵巢中研究结果一致。BMP4可明显抑制小鼠原始卵泡卵母细胞的凋亡[11], 显著下调人卵泡颗粒细胞中卵丘扩张标志蛋白PTX3的表达[12], 说明BMP4在卵母细胞成熟和排卵中发挥重要作用。进一步研究证实BMP4主要通过调节卵巢颗粒细胞中类固醇激素生成通路中关键酶如StAR等来抑制颗粒细胞中孕酮和雄激素的产生[7, 10], 从而来调控颗粒细胞状态(增殖或凋亡)和卵泡发育进程(成熟或闭锁)。但目前关于猪BMP4基因的研究较少, 特别是猪BMP4基因多态性的研究还未见报道。本研究以BMP4为候选基因, 采用克隆测序技术获得苏淮猪BMP4基因3′非编码区(3′-untranslatedregion, 3′-UTR)序列, 利用DNA池筛选BMP4基因3′-UTR多态位点, 通过等位基因特异性PCR(allele-specificPCR, AS-PCR)方法对苏淮猪和高繁殖力猪种梅山猪BMP4基因3′-UTR进行单核苷酸多态性检测, 旨在筛选苏淮猪繁殖性状相关的遗传标记, 为苏淮猪的标记辅助选择提供科学依据。
1 材料与方法 1.1 试验材料 1.1.1 试验动物119头苏淮猪母猪来自淮安市淮阴种猪场, 63头小梅山猪母猪来自国家小梅山猪育种中心。用耳号钳采集耳组织样(约0.15g), -20℃冻存。
1.1.2 主要试剂TaqDNA聚合酶购自于上海皓嘉科技发展有限公司, DNAmarker、琼脂糖、DNAgreen核酸染料等购自南京鼎国生物技术有限公司。
1.2 试验方法 1.2.1 DNA提取采用常规的酚-氯仿抽提法提取耳组织基因组DNA, -20℃保存。
1.2.2 PCR扩增根据猪基因组序列(GenBank登录号:NC_010443.4), 利用PrimerPrimer5.0软件设计引物P1(表 1)扩增苏淮猪BMP4基因3′-UTR序列。PCR反应条件:95℃5min; 95℃30s, 54℃30s, 72℃30s,35个循环; 最后72℃7min; 4℃保存产物。PCR产物用15g·L-1琼脂糖凝胶电泳检测, Tanon-3500凝胶成像系统拍照。
| 引物 Primer |
引物对序列(5′→3′) Primerpairssequences |
退火温度/℃ Annealingtemperature |
长度/ bpLength |
用途 Purpose |
| P1 | CCCCTTTCCACTGGCTGA/GGCCAAAACATTTGCACAT | 54 | 396 | 3′-UTRclone |
| P2 | AGGCCTTCCGTGGGTAC/GGCCAAAACATTTGCACAT | 54 | 188 | AS-PCR |
| P3 | AGGCCTTCCGTGGGTAG/GGCCAAAACATTTGCACAT | 54 | 188 | AS-PCR |
用琼脂糖胶回收试剂盒(Axygen公司)回收纯化PCR扩增产物, 然后与pMD19-T载体(TaKaRa公司)连接, 并转化到DH5α感受态细胞中。挑取阳性克隆, 采用试剂盒(Axygen公司)提取质粒, 送往金唯智生物公司进行双向测序。
1.4 序列分析采用DNAman软件进行序列比对分析。哺乳动物BMP4基因3′-UTR区进化分析方法见文献[13]。
1.5 SNP位点筛选将20头苏淮猪基因组DNA样等量混合成DNA池。以DNA池为模板, 利用引物P1进行PCR扩增, 扩增条件见1.2.2。PCR产物直接送往苏州金唯智生物公司测序。运用Chromas231软件分析序列峰图, 筛选SNPs位点。
1.6 SNP分型采用AS-PCR技术对SNP位点进行分型。首先针对苏淮猪BMP4基因3′-UTR突变位点, 利用PrimerPremier5.0软件设计2条等位基因特异性引物(P2和P3), 对苏淮猪和梅山猪个体进行分型。PCR反应条件:98℃30s;98℃10s, 54℃30s, 72℃30s, 34个循环; 72℃7min; 4℃保存产物。扩增产物用1.5g·L-1琼脂糖凝胶电泳检测。
1.7 统计分析采用Excel2010软件计算基因型频率、等位基因频率、杂合度和多态信息含量, 并进行Hardy-Weinberg平衡检验。
2 结果与分析 2.1 苏淮猪BMP4基因3′-UTR扩增和测序以苏淮猪基因组DNA为模板, 利用引物P1进行扩增, 所得PCR扩增产物用1.5%琼脂糖凝胶电泳检测, 结果发现扩增片段与目的片段大小基本一致(图 1)。测序发现扩增片段长度为369bp, 与预期片段大小一致。经DNAman软件比对发现扩增片段与引物源序列的同源性为98.58%, 说明PCR扩增产物为苏淮猪BMP4基因3′-UTR区序列。
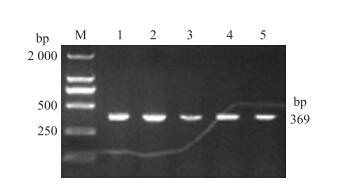
|
图 1 苏淮猪BMP4基因3′-UTR扩增结果 Figure 1 AgarosegelphotographofBMP43′-UTRinSuhuaipig M:DNAmarker(DL2000);1~5:PCR扩增产物PCRamplificationproduct |
苏淮猪BMP4基因3′-UTR区序列全长(终止密码子至PolyA尾之间)为267bp(图 2)。苏淮猪BMP4基因3′-UTR区序列中A、T、G、C碱基含量分别为39.33%、11.61%、27.72%和21.35%, 其中A+T含量67.04%, G+C含量32.96%, 可见A+T含量明显大于G+C含量。与哺乳动物其他物种BMP4基因3′-UTR区序列进行同源性比对, 发现苏淮猪与牛、绵羊、山羊、人的一致性分别为86.36%、86.27%、88.61%和84.01%, 而与小鼠、大鼠的一致性仅有66.17%和67.58%, 但小鼠和大鼠之间的一致性达89.88%。在苏淮猪BMP4基因3′-UTR区发现一个AC重复序列, 序列为AGAGACAGACAG(AC)9。苏淮猪BMP4基因3′-UTR含有2个PolyA结构, 一个由14个碱基A组成, 另外一个是PolyA尾。

|
图 2 苏淮猪BMP4基因3′-UTR与哺乳动物其他物种同源性比对 Figure 2 IdenticalalignmentsofBMP43′-UTRsequenceinSuhuaipigwithothermammals 箭头表示在苏淮猪中发现的突变位点。 ThearrowindicatedvariationsitewhichdetectedinSuhuaipig. |
在哺乳动物10个物种(人、苏门答腊猩猩、恒河猴、小鼠、大鼠、马、牛、绵羊、山羊和苏淮猪)BMP4基因3′-UTR区序列中共发现257个保守位点和82个多态位点, 多态位点为23.70%。在多态位点中, 简约信息多态位点38个, 占46.34%。哺乳动物BMP4基因3′-UTR区序列核苷酸多样度(π)为0.0783, 平均核苷酸差异数目(k)为19.578;碱基转换/颠换比值(Ts/Tv)为1.63, 小于临界值(2.0), 说明哺乳动物BMP4基因3′-UTR区的突变已达饱和状态。利用BMP4基因3′-UTR区序列构建了哺乳动物系统发育树(图 3)。从图 3可以看出外类群(鸡, 鸟类)单独聚为一类, 哺乳动物聚为一大类; 哺乳动物10个物种又聚为4个分支, 其中偶蹄目中的4个物种(牛、绵羊、山羊和苏淮猪)聚为分支A, 灵长目3个物种(人、苏门答腊猩猩和恒河猴)聚为分支B, 啮齿目2个物种(小鼠和大鼠)聚为分支C, 而奇蹄目的马单独聚为分支D。聚类结果与经典分类法一致。
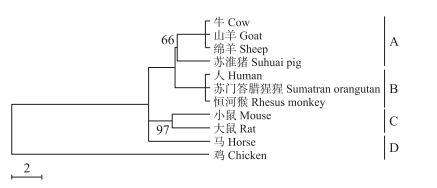
|
图 3 基于BMP4基因3′-UTR区序列构建的哺乳动物系统发育树 Figure 3 PhylogentictreeofmammalianconstructedbasedonsequenceoftheBMP43′-UTR |
以苏淮猪池DNA为模板, 利用P1引物进行PCR扩增和测序。序列比对分析发现, 在苏淮猪BMP4基因终止密码子(TGA)后20nt处发现一个SNP, 碱基G突变为碱基C, 并将此SNP命名为20G > C(图 2)。为了检测BMP4基因3′-UTR区20G > C位点的多态性, 我们设计了AS-PCR引物对单个个体进行分型。结果发现设计的AS-PCR引物在苏淮猪群体中可检测出3种不同的基因型, 分别为GG、GC和CC(图 4-A)。挑选3种基因型个体进行测序验证, 结果发现AS-PCR分型结果正确(图 4-B)。

|
图 4 苏淮猪BMP4基因3′-UTR区20G > C位点AS-PCR电泳图(A)和测序峰图(B) Figure 4 TheAS-PCRelectrophoresispatterns(A)andthesequencingdiagram(B)of20G > Clocusin3′-UTRofSuhuaipigBMP4 |
利用建立的AS-PCR对119头苏淮猪和63头梅山猪BMP4基因3′-UTR区20G > C位点进行了分型(表 2)。从表 2可以看出:在苏淮猪BMP4基因3′-UTR区20G>C位点3种基因型中GG型为优势基因型, 基因型频率为0.815;等位基因G为优势等位基因, 基因频率为0.887。而在梅山猪BMP4基因3′-UTR区20G9 C位点3种基因型中CC型为优势基因型, 基因型频率为0.667;等位基因C为优势等位基因, 基因频率为0.770。
| 品种Breed | 基因型频率Genotypefrequency | 等位基因频率Allelefrequency | ||||
| GG | GC | CC | G | C | ||
| 苏淮猪Suhuaipig | 0.815(97) | 0.143(17) | 0.042(5) | 0.887 | 0.113 | |
| 梅山猪Meishanpig | 0.127(8) | 0.206(13) | 0.667(42) | 0.230 | 0.770 | |
苏淮猪和梅山猪群体中BMP4基因3′-UTR区20G > C位点的有效等位基因数、多态信息含量和期望杂合度等遗传参数统计结果见表 3。由表 3可知, 苏淮猪群体中BMP4基因3′-UTR区20G > C位点的有效等位基因数为1.17;多态信息含量为0.09, 属于低度多态性(PIC < 0.25);期望杂合度为0.61。梅山猪中所检测的20G > C位点的有效等位基因数为1.26;多态信息含量为0.35, 属于高度多态性(PIC > 0.25);期望杂合度为0.29。χ2平衡性检验显示苏淮猪和梅山猪群体中BMP4基因3′-UTR区20G > C位点基因型分布达到Hardy-Weinberg平衡(P > 0.05)。
| 品种Breed | n | 有效等位基因数Ne | 多态信息含量PIC | 杂合度He | 平衡性检验χ2 |
| 苏淮猪Suhuaipig | 119 | 1.17 | 0.09 | 0.61 | 0.51 |
| 梅山猪Meishanpig | 63 | 1.26 | 0.35 | 0.29 | 0.34 |
| Note:Ne:Effectiveallelenumbers; PIC:Polymorphisminformationcontent; He:Heterozygosity | |||||
基因的调控区一般包括5′调控区和3′调控区, 在基因表达中发挥至关重要的调控作用, 目前关于基因表达调控的研究主要集中在5′调控区[14]。近年来, 随着miRNA研究的兴起, miRNA主要与靶基因3′-UTR区结合抑制靶基因的表达, 人们开始逐渐关注3′-UTR在基因表达中的调控作用[15]。同样地, 目前发现的调控哺乳动物BMP4基因表达的因子也主要在5′调控区[16-17], 关于其3′-UTR区特征的研究尚未见报道。我们克隆了苏淮猪BMP4基因3′-UTR区序列, 发现其与哺乳动物其他物种间相对保守。在猪BMP4基因3′-UTR区中发现一个AC重复序列, 通过与数据库中序列比对发现重复序列两端的碱基在哺乳动物中比较保守(分别为TGGGG和CCCAT), 且不同物种间重复次数具有物种特异性, 如猪为15个, 牛为20个, 绵羊为19个, 小鼠为26个, 而鸟类的鸡中则未发现AC重复序列, 因此BMP4基因3′-UTR区中AC重复次数可以作为一个物种的分子特征。另外,研究发现调控区中的重复序列与基因表达和基因控制的性状间密切相关, 经典案例是AR(androgenreceptor)基因CAG重复, Borgbo等[18]发现在人卵巢颗粒细胞中AR基因的表达水平随着CAG重复次数的增加逐渐上升, 且影响颗粒细胞相关基因如CYP19A1的表达水平和睾酮浓度。钟昕[19]在黄牛中发现BMP4基因3′-UTR区中AC重复次数与体尺性状显著关联, 但关于AC重复次数影响BMP4基因表达方面的研究还未见报道。
BMP4是一个多功能生长因子, 在动物机体内的生物学作用广泛, 因此国内外学者对BMP4基因多态性和性状间的关联进行了大量研究, 例如BMP4基因多态性与人类疾病[20]、家畜的生产性能[21]等。张弛[21]在山羊BMP4基因内含子3中检测到两处突变, 且不同基因型之间体质量、体高性状存在显著差异。BMP4与哺乳动物生殖机能密切相关, 通过自分泌/旁分泌形式, 对卵泡颗粒细胞、卵母细胞发挥调节作用, 对卵泡的形成和发育, 卵母细胞的生长和成熟具有积极的生物学作用。杨华等[22]在中国美利奴羊(军垦型)BMP4基因5′-UTR和外显子上未发现多态性, 而3′-UTR区6个碱基插入/缺失分析与产羔数无显著关联。储明星等[23]发现小尾寒羊BMP4基因外显子3第305位核苷酸发生C/A碱基突变, 导致编码氨基酸由丙氨酸变为天冬氨酸, CC型小尾寒羊的平均产羔数分别比GG型和CG型多0.61和1.01只。Sharma等[24]在印度高繁山羊品种BMP4基因编码区中发现一个低频率突变G1534A, 其中GA频率仅为0.02, 而AA型则未发现。本研究通过DNA池测序在苏淮猪BMP4基因3′-UTR区发现了一个新的突变位点20G > C, 多态性分析发现高繁殖力猪种梅山猪中等位基因C的频率为0.770, 而苏淮猪中仅为0.113, 说明BMP4基因3′-UTR区20G > C位点多态性可能与猪繁殖性能有关。苏淮猪BMP4基因3′-UTR区20G > C位点的发现, 对了解苏淮猪特色性状的遗传基础、开发苏淮猪繁殖性状的遗传标记以及利用分子标记快速实现苏淮猪的选育均具有一定的意义。
| [1] | Bier E, de Robertis E M. BMP gradients:a paradigm for morphogen-mediated developmental patterning[J]. Science, 2015,348(6242): aaa5838. DOI: 10.1126/science.aaa5838 |
| [2] | Craft A M, Rockel J S, Nartiss Y, et al. Generation of articular chondrocytes from human pluripotent stem cells[J]. Nature Biotechnology, 2015,33(6): 638–645. DOI: 10.1038/nbt.3210 |
| [3] | Yang Y, Adachi K, Sheridan M A, et al. Heightened potency of human pluripotent stem cell lines created by transient BMP4 exposure[J]. Proceedings of the National Academy of Sciences of the United States of America, 2015,112(18): E2337–2346. DOI: 10.1073/pnas.1504778112 |
| [4] | Lee J H, Bhang D H, Beede A, et al. Lung stem cell differentiation in mice directed by endothelial cells via a BMP4-NFATc1-thrombospondin-1 axis[J]. Cell, 2014,156(3): 440–455. DOI: 10.1016/j.cell.2013.12.039 |
| [5] | Cao Y, Slaney C Y, Bidwell B N, et al. BMP4 inhibits breast cancer metastasis by blocking myeloid-derived suppressor cell activity[J]. Cancer Research, 2014,74(18): 5091–5102. DOI: 10.1158/0008-5472.CAN-13-3171 |
| [6] | Hai Y, Sun M, Niu M, et al. BMP4 promotes human Sertoli cell proliferation via Smad1/5 and ID2/3 pathway and its abnormality is associated with azoospermia[J]. Discovery Medicine, 2015,19(105): 311–325. |
| [7] | Shimasaki S, Zachow R J, Li D, et al. A functional bone morphogenetic protein system in the ovary[J]. Proceedings of the National Academy of Sciences of the United States of America, 1999,96(13): 7282–7287. DOI: 10.1073/pnas.96.13.7282 |
| [8] | Al-Samerria S, Al-Ali I, McFarlane J R, et al. The impact of passive immunisation against BMPRIB and BMP4 on follicle development and ovulation in mice[J]. Reproduction, 2015,149(5): 403–411. DOI: 10.1530/REP-14-0451 |
| [9] | Nilsson E E, Skinner M K. Bone morphogenetic protein-4 acts as an ovarian follicle survival factor and promotes primordial follicle development[J]. Biology of Reproduction, 2003,69(4): 1265–1272. DOI: 10.1095/biolreprod.103.018671 |
| [10] | Bertoldo M J, Duffard N, Bernard J, et al. Effects of bone morphogenetic protein 4(BMP4)supplementation during culture of the sheep ovarian cortex[J]. Animal Reproduction Science, 2014,149(3-4): 124–134. DOI: 10.1016/j.anireprosci.2014.07.010 |
| [11] | 张海玉, 张晓丽, 纪淑芳, 等. 骨形态发生蛋白4/Smad信号通路在小鼠原始卵泡卵母细胞凋亡中的调控作用[J]. 解剖学报, 2014, 45(3): 375–382. Zhang H Y, Zhang X L, Ji S F, et al. Regulation of bone morphologenetic protein 4/Smad signaling pathway on the apoptosis of mouse primordial follicle oocytes[J]. Acta Anatomica Sinica, 2014,45(3): 375–382. (in Chinese) |
| [12] | Chang H M, Cheng J C, Fang L, et al. Recombinant BMP4 and BMP7 downregulate pentraxin 3 in human granulosa cells[J]. The Journal of Clinical Endocrinology & Metabolism, 2015,100(3): E365–374. |
| [13] | 姚勇, 潘增祥, 张久峰, 等. 二花脸猪NR5A2基因克隆与卵巢组织转录水平分析[J]. 南京农业大学学报, 2013, 36(3): 133–138. Yao Y, Pan Z X, Zhang J F, et al. Cloning and transcriptional level of NR5A2 gene in ovaries of Erhualian pig[J]. Journal of Nanjing Agricultural University, 2013,36(3): 133–138. DOI: 10.7685/j.issn.1000-2030.2013.03.023 (in Chinese) |
| [14] | Tu Dgğul M, Paixão T, Barton N H, et al. Dynamics of transcription factor binding site evolution[J]. PLoS Genetics, 2015,11(11): e1005639. DOI: 10.1371/journal.pgen.1005639 |
| [15] | Zhou J, Liu J, Pan Z, et al. The let-7g microRNA promotes follicular granulosa cell apoptosis by targeting transforming growth factor-β type 1 receptor[J]. Molecular and Cellular Endocrinology, 2015,409: 103–112. DOI: 10.1016/j.mce.2015.03.012 |
| [16] | Zhang Y, Yeh L K, Zhang S, et al. Wnt/β-catenin signaling modulates corneal epithelium stratification via inhibition of Bmp4 during mouse development[J]. Development, 2015,142(19): 3383–3393. DOI: 10.1242/dev.125393 |
| [17] | Zhuang W, Ge X, Yang S, et al. Upregulation of lncRNA MEG3 promotes osteogenic differentiation of mesenchymal stem cells from multiple myeloma patients by targeting BMP4 transcription[J]. Stem Cells, 2015,33(6): 1985–1997. DOI: 10.1002/stem.1989 |
| [18] | Borgbo T, Macek M, Chrudimska J, et al. Size matters:associations between the androgen receptor CAG repeat length and the intrafollicular hormone milieu[J]. Molecular and Cellular Endocrinology, 2016,419: 12–17. DOI: 10.1016/j.mce.2015.09.015 |
| [19] | 钟昕.黄牛BMP2、BMP4及BMPR-IB基因的多态性及其与体尺性状的关联分析[D].杨凌:西北农林科技大学, 2010. Zhong X. The polymorphism of BMP2, BMP4, BMPR-IB genes and their association with body measurement traits in yellow cattle[D]. Yangling:Northwest A & F University, 2010(in Chinese with English abstract). |
| [20] | Liu L, Su Q, Li L, et al. The common variant rs4444235 near BMP4 confers genetic susceptibility of colorectal cancer:an updated meta-analysis based on a comprehensive statistical strategy[J]. PLoS ONE, 2014,9(6): e100133. DOI: 10.1371/journal.pone.0100133 |
| [21] | 张弛.山羊BMP4基因多态性及其与生产性状关联性的研究[D].郑州:河南农业大学, 2010. Zhang C. Study on polymorphism of BMP4 gene and relevance with growth traits of goats[D]. Zhengzhou:Henan Agricultural University, 2010(in Chinese with English abstract). |
| [22] | 杨华, 杨永林, 冯静, 等. BMP4基因作为中国美利奴羊(军垦型)多胎性能候选基因的研究[J]. 家畜生态学报, 2010, 31(4): 10–13. Yang H, Yang Y L, Feng J, et al. Study of BMP4 as candidate genes for prolificacy in Chinese Merino(Junken type)[J]. Acta Ecologiae Animalis Domasici, 2010,31(4): 10–13. (in Chinese) |
| [23] | 储明星, 周文然, 孙少华, 等. 小尾寒羊BMP4基因多态性及其与高繁殖力关系[J]. 农业生物技术学报, 2008, 16(2): 237–241. Chu M X, Zhou W Y, Sun S H, et al. Polymorphism of BMP4 gene and its relationship with prolificacy of Small Tail Han sheep[J]. Journal of Agricultural Biotechnology, 2008,16(2): 237–241. (in Chinese) |
| [24] | Sharma R, Ahlawat S, Maitra A, et al. Polymorphism of BMP4 gene in Indian goat breeds differing in prolificacy[J]. Gene, 2013,532(1): 140–145. DOI: 10.1016/j.gene.2013.08.086 |




