文章信息
- 孔飞, 蔡跃, 汪鹏, 尤小满, 张杰, 江玲, 张文伟, 万建民
- KONG Fei, CAI Yue, WANG Peng, YOU Xiaoman, ZHANG Jie, JIANG Ling, ZHANG Wenwei, WAN Jianmin
- 水稻温度敏感型黄叶突变体yl2(t)的表型分析和基因定位
- Characterization and gene mapping of a thermo-sensitive yellow leaf mutant yl2(t)in rice
- 南京农业大学学报, 2016, 39(5): 703-710
- Journal of Nanjing Agricultural University, 2016, 39(5): 703-710.
- http://dx.doi.org/10.7685/jnau.201602033
-
文章历史
- 收稿日期: 2016-02-28
水稻是重要的粮食作物, 同时也是分子生物学中用于植物基因遗传分析和功能研究的重要单子叶模式作物[1]。水稻叶色变异表型明显、易于观察, 苗期叶色变异可以分为黄化、浅绿、白化、黄绿、绿黄、绿白、翠白和条纹等多种类型[2]。水稻叶片颜色的变化与叶片中叶绿素代谢和叶绿体发育等有关, 因此, 研究水稻叶色突变体对理解植物叶绿素生物合成和叶绿体的发育有重要意义。此外, 叶色变异出现在苗期, 但后期不影响植株生长发育和产量的叶色突变体, 可应用于作物杂交育种中快速、有效去除假杂种, 例如将ysa突变体白化表型作为标记用于两系杂交育种提高了真杂交种的纯度至100%[3]。
利用水稻叶色突变体, 目前已克隆到许多与叶绿素代谢和叶绿体发育相关的基因。例如, 利用图位克隆的方法从水稻高温黄叶突变体cde 1 (t)中克隆了一个编码谷酰基tRNA合成酶(HEMA)基因OsGluRs, 该基因在氨基酮戊酸(ALA)合成中起重要作用[4]。从水稻白化突变体oschlH、黄叶突变体chl 1和chl9中分别克隆到OsChlH、OsChlD和OsChlI等3个基因, 它们分别编码镁螯合酶(Mg chelatase)的H、D和I亚基, 催化Mg2+与原卟啉Ⅸ结合形成Mg-原卟啉Ⅸ[5-6]。利用T-DNA插入黄叶突变体, 研究了水稻叶绿素b合成的关键基因, 叶绿素酸酯a氧化酶(CAO)基因OsCAO的不同表达模式和功能[7]。对控制突变体fgl淡黄叶表型的基因定位发现, 该位点编码NADPH原叶绿素酸酯氧化还原酶(POR)基因OsPORB, 能够催化原叶绿素酸酯还原形成叶绿素酸酯, 并在叶片发育过程中对维持叶绿素的水平起重要作用[8]。利用叶色突变体克隆到调控叶绿体发育相关的基因, 如OsV 4、OsWLP1 、OsWSL等, 对它们的功能进行分析, 有利于诠释叶绿体发育的调控机制[9-11]。然而, 虽然控制叶绿素合成的许多关键基因已被克隆, 全面了解叶色变异的机制仍需要继续研究。
笔者从粳稻品种‘越光’(Koshihikari)经N-甲基亚硝基脲(MNU)诱变的M2群体中筛选到一个温度敏感型黄叶突变体, 暂命名为yl2(t)[yellow leaf 2(t)]。对该突变体幼苗叶片中光合色素含量测定和叶绿体超微结构观察发现, 20 ℃时其光合色素含量显著降低, 但叶绿体发育正常。本研究对控制yl2(t)的温敏黄叶性状的基因进行了遗传分析和定位, 为进一步图位克隆该基因提供了依据。
1 材料与方法 1.1 材料水稻黄叶突变体yl2(t), 由粳稻品种‘越光’(Koshihikari)经N-甲基亚硝基脲(MNU)诱变产生的M2群体后代中获得, 该突变体在持续20 ℃萌发生长至2叶期时(15 d左右)表现黄叶, 若延长处理时间至20 d时则生长开始受到抑制并出现死亡, 20 ℃处理15 d后转移至30 ℃或在30 ℃萌发生长时叶色能够恢复正常, 经多代自交繁殖及选择, 该突变体的性状已稳定。
1.2 yl2(t)的农艺性状调查2015年正季将突变体yl2(t)和野生型‘越光’播种于南京农业大学土桥实验基地, 自然条件下萌发和生长, 成熟期对突变体yl2(t)和野生型的株高、剑叶长宽、主穗长、主穗粒数和结实率、千粒质量农艺性状进行测定。除千粒质量测定重复3次, 株高等性状均随机选取10个单株进行测定。
1.3 光合色素含量的测定突变体和野生型种子室温下浸种后, 播种于GXZ智能培养箱内(生长温度分别为持续的20 ℃和30 ℃, 光照强度均为180 μmol · m-2 · s-1, 光照时间每天12 h)(以下处理相同), 生长至第2片叶完全展开, 取第2片完全叶0.05 g, 剪成约1 cm长的小块, 浸泡于盛有5 mL 95%乙醇溶液的棕色离心管中, 4 ℃黑暗条件下浸泡48 h, 期间多次轻柔摇晃。避光条件下吸取200 μL上清液, 利用多功能酶标仪M3(SpectraMax M3 microplate reader), 测定上清液在665、649和470 nm 3个波长下的光密度。根据Lichtenthaler[12]提出的公式计算单位质量叶绿素a(Ca)、叶绿素b(Cb)和类胡萝卜素的浓度(Cx):Ca=13.95A665-6.88A649, Cb=24.96A649-7.32A665, Cx=(1 000A470-2.05×Ca-114×Cb)/245。利用酶标仪测出的色素浓度, 依据公式计算出叶片中色素的含量:细胞色素的含量(mg · g-1)=(叶绿素的浓度×提取液体积×稀释倍数)/样品鲜质量。
1.4 叶绿体超微结构的观察分别选取GXZ智能培养箱内(光照强度均为180 μmol · m-2 · s-1, 光照时间每天12 h)持续20 ℃萌发生长至2叶期时的突变体和野生型幼苗叶片, 沿主叶脉切成5 mm×2 mm的条状小块, 2%戊二醛溶液(25%戊二醛8 mL, 0.2 mol · L-1 Na2HPO4-NaH2PO4 50 mL(pH7.2), ddH2O定容至100 mL, 4 ℃避光保存)室温固定24 h。在4 ℃条件下, 将样品置于1% OsO4溶液中漂洗并孵育过夜, 随后利用不同梯度的乙醇溶液逐级脱水、包埋、制片, 最后用醋酸铀染色, 在Hitachi H-7650(日立)透射电镜下观察并拍照。
1.5 yl 2 (t)基因的遗传分析和定位2014年夏季将突变体yl2(t)与籼稻‘南京11’进行杂交, 2015年经海南繁殖后获得F2种子。F2种子浸种2 d后, 播于盛有营养土/蛭石(体积比为1 : 3)的中转箱, 放于GXZ智能培养箱内萌发生长, 温度为20 ℃, 光照强度均为180 μmol · m-2 · s-1, 光照时间每天12 h, 10 d后观察幼苗表型, 标记出具有突变表型的个体, 统计F2群体中黄叶和正常的分离株数。亲本及F2群体中极端个体基因组DNA的提取均采用CTAB法[13], 略作调整。
利用本实验室已有的SSR和Indel标记, 针对定位群体的2个亲本yl2(t)和‘南京11’, 筛选有多态的标记; 选取F2群体中10个表型明显的隐性极端个体用于突变基因的初步连锁分析。确定连锁区间后扩大F2定位群体, 挑选更多极端个体, 进一步定位。10 μL的PCR扩增体系为:10×TaqBuffer(含20 mmol · L-1 Mg2+)1.2 μL, 1 mmol · L-1 dNTP混合液0.3 μL, 前后引物各1 μL, Taq酶0.2 μL, DNA模板2 μL(100~200 ng), 最后ddH2O补至10 μL。PCR反应程序为:95 ℃ 5 min; 94 ℃ 30 s, 55 ℃ 30 s(退火温度视引物而定), 72 ℃ 40 s, 34个循环; 72 ℃再延伸5 min。定位使用的分子标记列于表 1。
| 标记 Markers |
正向引物序列(5′→3′) Forward primer sequence |
反向引物序列(5′→3′) Reverse primer sequence |
物理位置/bp Physical location |
| N8-29 | ACCGATGAGCTCTCCACATC | TGACCTCACTTCACTTCCCC | 22 248 291 |
| Indel8-10 | TGCTGCTTATGAGGCTGCTA | GCATCACTGTCCTCAGCATC | 22 926 937 |
| N8-34 | GGCAGCCCATCAACTAGATC | TTGCAAACCCTAGTCCAAGC | 24 646 694 |
| P5 | AGAGGGCAAAGATAACGAAG | AGCCACTTAGTCACGCGAT | 25 904 352 |
| P14 | CCAATGGAAAGACTTGCTACTAA | TCTGACAATGCTTTCATCTGC | 26 399 305 |
| N8-36 | CCCTTGTGCTGTCTCCTCTC | ACGGGCTTCTTCTCCTTCTC | 26 549 725 |
| P8 | CAAGCAGCCCAGTTATGTTC | TTGCCCACAATCTACAGCC | 27 093 018 |
| P16 | GCATTTCGCTTCCATTGTT | TGCTGTGGTTAGTTCCTTTTG | 27 196 427 |
| P19 | TAGAAACAGCGTGTACGATGA | TTCCTATGCCTAAGCCGAC | 27 631 258 |
| N8-41 | GTTGCGTCCTACTGCTACTTC | GATCCGTGTCGATGATTAGC | 27 936 332 |
| N8-42 | TCTCGCGGTATAGTTTGTGC | ACCACTACCAGCAGCCTCTG | 28 077 804 |
选取在持续的20 ℃和30 ℃培养箱内生长至2叶期的突变体和野生型幼苗, 使用RNA Prep Pure Plant Kit试剂盒(天根生化有限公司)提取水稻总RNA。凝胶电泳检测RNA质量和测定其浓度(NanoDrop2000分光光度计, Thermo公司)后, 取2 μg作为模板经SuperScriptⅡ Kit试剂盒(TaKaRa公司)反转录为单链cDNA, 用引物EF-1α检测反转录效果。
利用实时荧光定量PCR(qRT-PCR)对20 ℃和30 ℃两种温度条件下突变体yl2(t)和野生型2叶期幼苗中叶绿素合成相关基因的表达水平进行分析。反应在7500 Real Time PCR System荧光定量PCR仪(ABI公司)上进行, 反应体系:SYBR Green Real-time PCR Master Mix 10 μL, cDNA模板30 ng, Forward Primer 0.6 μL, Reverse Primer 0.6 μL, ddH2O补至20 μL。反应程序为:95 ℃ 30 s; 95 ℃ 15 s, 60 ℃ 1 min, 40个循环; 95 ℃ 15 s, 60 ℃ 1 min, 95 ℃ 15 s, 60 ℃ 15 s; 3次重复。
本试验主要对叶绿素合成途径中的基因:谷氨酰-tRNA还原酶(HEMA)、谷氨酰-1-半醛转氨酶(HEML)、胆色素原合酶(HEMB)、羟甲基后胆色素原合酶(HEMC)、尿卟啉原脱羧酶(HEME)、粪卟啉原氧化脱羧酶(HEMF)、尿卟啉原脱羧酶(URO-D)、镁螯合酶D亚基(CHLD)、镁螯合酶H亚基(CHLH)、镁螯合酶Ⅰ亚基(CHLI)、镁原卟啉Ⅸ甲基转移酶(CHLM)、镁原卟啉Ⅸ单甲酯环化酶(CRD)、二乙烯还原酶(DVR)、NADPH原叶绿素酸脂氧化还原酶(POR)、叶绿素合成酶(CHLG)和叶绿素酸酯氧化酶1(CAO 1), 以水稻看家基因OsActin1作为内参基因, 目的基因的表达量为与内参的相对值, 使用的引物见表 2。
| 引物名称 Primers |
正向引物序列(5′→3′) Forward primer sequence |
反向引物序列(5′→3′) Reverse primer sequence |
| OsActin1 | TCCATCTTGGCATCTCTCAG | GTACCCGCATCAGGCATCTG |
| Q-HEMA | GATGCAATCACTGCTGGAAAGCGT | CCATCTTGCCAGCACCAATCAACA |
| Q-HEML | AGAACAAAGGGCAGATTGCTGCTG | TGTTTCGTCAAGTCACGGAGAGCA |
| Q-HEMB | TGGCATTGTCAGGGAAGATGGAGT | CCAAAGCAGCACGTATTGCTCCAA |
| Q-HEMC | TCATTCCGAGGGCTATTGGCTTCA | ACACTCTAGTTGGCCAATGGTGGA |
| Q-HEME | AATGGAGGCTTGCTTGAGCGAATG | TTGTTACCAAGGCGTCTCCTTCCA |
| Q-URO-D | AGGCTTCCACTGACAGGTGTTGAT | AAAGAACGCCAGGGTCAACATTCC |
| Q-HEMF | ACTGACTGCACGATGGCAGTATGA | AGAGATCGAGCCATTCCTTTGGGT |
| Q-CHLD | TAGCACAGCTGTCAGAGTGGGTTT | TTGCCAGCCACCTCAAGTATCTCA |
| Q-CHLH | GCACGGGAACTTGGCGTTTCATTA | ACATGTCCTGGAGCTGCTTCTCAT |
| Q-CHLI | AGGGATGCTGAACTCAGGGTGAAA | AAGTAGGACTCACGGAACGCCTTT |
| Q-CHLM | GCTTCATCTCCACGCAGTTCTACT | GCAATGACGAATCGAAGACGCACA |
| Q-CRD | TGGATCTAACATGACACGCACCCA | ACTGTAACGGCATTCTTCTCCGGT |
| Q-DVR | TTCTTCGAGAGGGTGATCAGGGAA | GAAACTGGCAATGGCAGCCAAGAA |
| Q-POR | TCGTCGGCCTCGTCTGAGTTTATT | AGGCCTCTCTCACTGAAAGCTGAA |
| Q-CHLG | CCAGCCACTGATGAAAGCAGCAAT | AGAGCGCTAATACACTCGCGAACA |
| Q-CAO1 | ACACCTTCATCTGGGCTTCAAGGA | AGATGCGTCGAACATTGCTTGGTG |
与野生型相比, yl2(t)在2叶期, 经20 ℃持续处理(15 d左右)时表现出叶片黄化, 生长减缓, 但未受到明显抑制(图 1-A和B), 但延长处理时间至20 d时则幼苗生长开始受到抑制并出现死亡, 处理15 d后移至30 ℃时叶色能够恢复正常。当突变体yl2(t)在30 ℃下萌发生长时, 叶色表现正常(图 1-C), 说明yl2(t)为温度敏感型突变体。

|
图 1 两种温度下突变体yl2(t)和野生型幼苗的表型 Figure 1 Phenotypes of yl2(t)mutant and wild type(WT) seedlings growing under two temperatures A.20 ℃条件下生长的幼苗Seedlings under 20 ℃; B.叶片特写Leaves under 20 ℃; C.30 ℃时的幼苗Seedlings under 30 ℃; 比例尺为1 cm Bar=1 cm |
调查了未经低温处理而是在田间条件下(南京正季)萌发生长的突变体yl2(t)的农艺性状(表 3), t测验显示, yl2(t)在株高、剑叶长和宽、主穗长、每穗粒数、结实率、千粒质量等农艺性状上与野生型相比均无显著差异, 说明yl2(t)在适宜温度条件下生长发育没有受到明显影响。
| 性状Traits | 野生型Wild type | yl2(t) | P-value |
| 株高/cm Plant height | 110.3±5.7 | 108.6±5.2 | 0.27 |
| 剑叶长/cm Length of flag leaf | 31.3±4.2 | 32.5±4.9 | 0.28 |
| 剑叶宽/cm Width of flag leaf | 1.4±0.1 | 1.5±0.1 | 0.17 |
| 主穗长/cm Length of panicle | 22.1±1.7 | 21.4±2.2 | 0.16 |
| 每穗粒数Grains per panicle | 122.6±13.0 | 118.5±17.9 | 0.27 |
| 结实率/% Seed-setting rate | 88.2±4.4 | 87.4±3.2 | 0.26 |
| 千粒质量/g 1 000-grain weight | 21.70±1.01 | 20.65±0.68 | 0.13 |
| 注:除千粒质量n=3, 其余各项n=10, 取平均值; 差异显著性分析采用t测验。 Note:Values are means±SD(n=10, except for 1 000-grain weight n=3). Different significance analysis was conducted by t-test. |
|||
分别对在20 ℃和30 ℃处理光照培养箱中生长的野生型和yl2(t)幼苗(2叶期)第2片叶光合色素含量进行测定, 发现20 ℃时yl2(t)幼苗叶片中叶绿素a、叶绿素b和类胡萝卜素含量均极显著低于野生型, 分别只有野生型的57.7%、52.1%和66.1%。而在30 ℃处理时, yl2(t)幼苗叶片中仅有叶绿素b的含量显著低于野生型, 叶绿素a和类胡萝卜素的含量没有显著差异(表 4)。
| 性状Traits | 20 ℃ | 30 ℃ | |||
| WT | yl2(t) | WT | yl2(t) | ||
| 叶绿素a含量/(mg·g-1)Chlorophyll a content | 1.05±0.02 | 0.60±0.03** | 1.04±0.02 | 1.03±0.02 | |
| 叶绿素b含量/(mg·g-1)Chlorophyll b content | 0.45±0.02 | 0.23±0.01** | 0.50±0.04 | 0.44±0.03* | |
| 类胡萝卜素含量/(mg·g-1)Carotenoid content | 0.19±0.01 | 0.13±0.01** | 0.18±0.02 | 0.18±0.01 | |
| Note:*P < 0.05, ** P < 0.01. The same as follows. | |||||
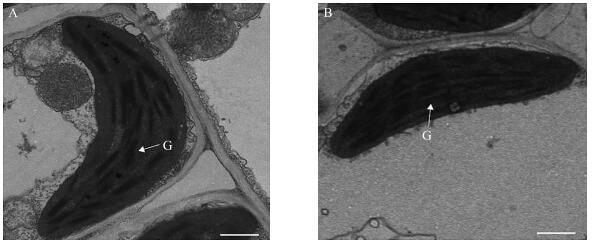
对20 ℃条件下yl2(t)和野生型幼苗叶片中叶绿体超微结构进行观察, 发现野生型中叶绿体发育正常, 形成完整的叶绿体结构(图 2-A)。与野生型相同, yl2(t)突变体幼苗叶片中叶绿体的发育未受到明显的影响(图 2-B)。这一结果说明低温时该位点的突变对叶绿体的发育没有明显影响, 可能仅仅影响了yl2(t)叶片中光合色素的合成。
|
图 2 20 ℃下野生型(A)和突变体yl2(t)(B)2叶期叶片中的叶绿体超微结构 Figure 2 Ultra-structure of chloroplasts in WT(A)and yl2(t)(B)leaves at 2-leaf stage under 20 ℃ A.野生型WT; B.yl2(t); G.基粒Grana; 比例尺为1 μm Bar=1 μm |
将突变体yl2(t)与籼稻品种‘南京11’杂交, 杂种F1幼苗在20 ℃时的叶片颜色正常, 说明该温敏黄化表型受到隐性核基因控制。统计20 ℃处理萌发生长的F2群体中正常叶色幼苗和黄叶幼苗数, 并进行χ2测验。结果表明, F2群体中正常幼苗与黄叶苗的分离比符合3 : 1, 说明该表型受到1对隐性基因控制(表 5)。
| 叶色Leaf color | 观察数Observation | 理论数Theory | χ2 | χ(0.05, 1)2 |
| 正常Normal | 984 | 961.5 | 0.503 | |
| 黄叶Yellow | 298 | 320.5 | 1.510 | |
| 总数Total | 1 282 | 1 282 | 2.013 | 3.841 |
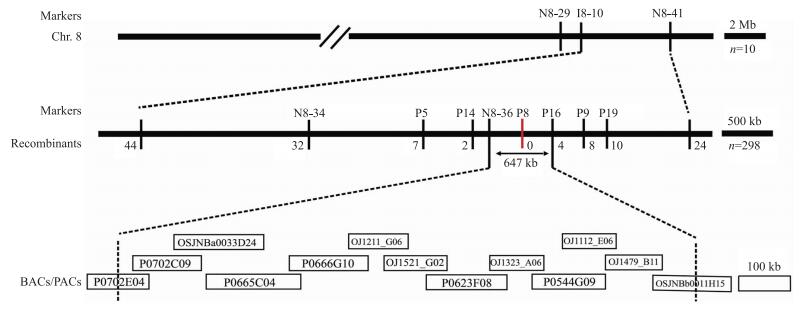
将yl2(t)/南京11杂交F2群体用于yl 2 (t)突变基因的定位。将定位F2群体在20 ℃处理, 从中挑选10株与yl2(t)突变体表型一致的极端个体, 并选取210个多态性良好且均匀分布于12条染色体的SSR和InDel标记用于初步连锁分析。结果表明, 在第8染色体长臂存在连锁, 初步定位于SSR标记N8-29和N8-41之间, 物理距离约为5.6 Mb(图 3)。通过扩大定位的极端个体至298个, 并开发新的分子标记, 最终将该突变位点缩小至标记N8-36与P16之间, 区间范围约647 kb, 而且与分子标记P8共分离(物理位置为27 093 kb)。该区间横跨13个BAC和PAC克隆(图 3)。
|
图 3 yl 2 (t)基因在水稻第8染色体长臂上的分子连锁图 Figure 3 Molecular linkage map of the yl 2 (t)gene on the long arm of rice chromosome 8 |
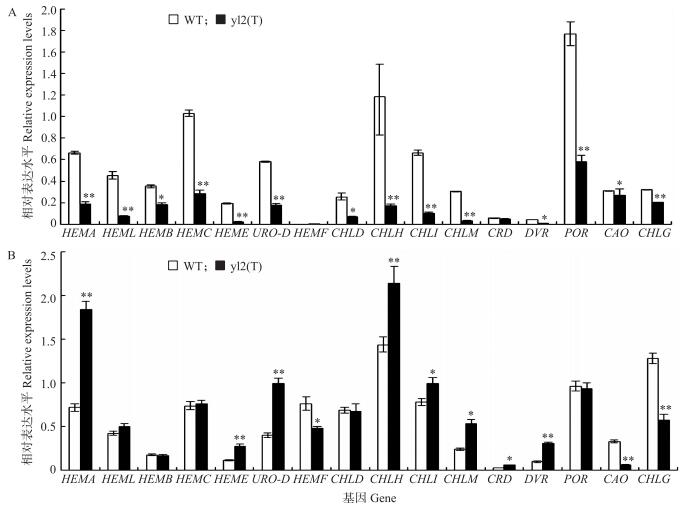
yl2(t)在20 ℃时表现为黄叶而30 ℃时叶色正常, 低温时叶绿素含量显著低于野生型而叶绿体发育正常, 因此, 对20 ℃和30 ℃条件下yl2(t)和野生型幼苗(2叶期)中叶绿素合成相关基因的表达水平进行了实时荧光定量PCR(qRT-PCR)分析。结果表明, 在20 ℃持续处理时, 与野生型相比, 除镁原卟啉Ⅸ单甲酯环化酶基因(CRD)外, yl2(t)幼苗中各基因的表达水平都显著降低, 尤其是谷氨酰-tRNA还原酶(HEMA)、羟甲基后胆色素原合酶(HEMC)、镁螯合酶H亚基(CHLH)、镁螯合酶Ⅰ亚基(CHLI)和NADPH原叶绿素酸脂氧化还原酶(POR)等基因的表达量极显著下调, 仅达野生型水平的1/3至1/5(图 4-A)。30 ℃时, yl2(t)幼苗中谷氨酰-tRNA还原酶(HEMA)、尿卟啉原脱羧酶(URO-D)、镁螯合酶H亚基(CHLH)、镁螯合酶Ⅰ亚基(CHLI)、镁原卟啉Ⅸ甲基转移酶(CHLM)及二乙烯还原酶(DVR)基因的表达水平较野生型显著升高, 而粪卟啉原氧化脱羧酶(HEMF)、叶绿素酸酯氧化酶(CAO)和叶绿素合成酶(CHLG)的表达量仍显著低于野生型(图 4-B)。
|
图 4 两种温度下yl2(t)和野生型2叶期幼苗中叶绿素合成相关基因的相对表达水平 Figure 4 Relative expression levels of genes involved in chlorophyll biosynthesis in yl2(t)and WT seedlings at 2-leaf stage under two temperatures A.持续20 ℃处理下, 野生型和突变体幼苗中各基因的表达水平; B.30 ℃处理下, 野生型和突变体幼苗中各基因的表达水平。以OsActin 1 基因为内参, 3次重复, 取平均值。 A.Relative expression levels of genes in WT and mutant under continuous 20 ℃; B.Relative expression levels of genes in WT and mutant under 30 ℃. Data were normalized against expression of OsActin 1 . Values are mean±SD(n=3). |
叶色突变可能控制叶绿素生物合成和叶绿体发育的重要基因沉默或失活, 直接或间接影响叶绿素合成和降解, 改变叶绿素含量。叶色突变体是研究植物光合作用机制、叶绿素生物合成途径、叶绿体的结构功能和遗传发育调控机制、作物标记性状等的理想材料。
叶色突变是水稻中常见的变异类型, 水稻叶色受内外因素的共同调节, 如基因突变、体内生理状况及外界环境中的温度、光照等条件或其他条件的变化都可能导致叶色变异。白化转绿突变体WGL体内抗氧化酶POD和SOD的活性显著升高, 说明WGL基因的突变使叶片受到了一定程度的氧化胁迫, 共同导致白化表型的出现[14]。白淮稻7号突变体在苗期移栽前后叶色出现绿—白—绿的变化, 该表型与基因突变和移栽损伤等内外条件的改变相关[15]。温度是水稻叶色突变体叶色变化主要的影响因子之一, 根据对温度的不同反应将水稻叶色突变体划分为:高温敏感型、低温敏感型和特殊温敏感型; 水稻中关于温度敏感型叶色突变体的报道较多, 目前报道约有44个水稻温度敏感型叶色突变体, 控制这些叶色变异表型的基因被定位或者克隆[16]。例如, 突变体v3和std1在20 ℃和30 ℃变换时表现为不同的叶色表型, 这2个突变体基因分别编码核糖核苷酸还原酶大亚基(RNRL1)、小亚基(RNRS1)[17]。突变体osv 4 在4叶期以前在20 ℃和24 ℃均表现为白化, 该表型由一个编码PPR蛋白基因OsV 4 突变引起[9]。本研究发现的苗期黄叶突变体yl2(t), 表现为低温敏感, 2叶期前经持续低温处理(20 ℃)表现出叶片黄化, 若延长处理的时间则幼苗不能继续生长直至死亡。以往对水稻黄叶突变体的研究发现, 黄化表型的出现与叶绿体发育异常相关, 如cde 1(t)、chl1和chl9突变体叶片中的叶绿体发育受阻, 无法形成片层结构[5-6]。又如低温敏感叶色突变体v 13 (t)和tws在苗期低温时叶绿体发育极不正常或叶片中只存在囊泡状结构, 形成白化叶片或者白色条斑叶片[18-19]。然而, 观察发现, 低温下yl2(t)幼苗中叶绿体发育正常, 并未受到YL 2 (T)位点突变的影响。这类突变表型目前发现较少, 出现的机制还不清楚, 还需要在基因克隆的基础上进行深入的研究。叶绿素含量测定发现, 低温时yl2(t)叶片中叶绿素水平显著低于野生型, 因此, 该黄化表型的出现可能是低温降低了突变体中叶绿素的生物合成。yl2(t)突变表型受一对隐性核基因控制, 我们将该突变基因定位于第8染色体长臂标记N8-36和P16之间约647 kb范围内, 跨越了13个BAC和PAC克隆。目前, 水稻中定位在第8染色体的温度敏感型叶色突变体有v8和al12, v8突变体在20 ℃时表现为黄白色, 30 ℃时表现为绿色; al 12 在温度低于24 ℃时均表现出白化表型, 26 ℃时表现为绿色; 这2个基因均位于yl 2 (t)基因定位区间的上游[16, 20-21]。水稻失绿突变体chl 8和chl9、斑马叶突变体z4、淡绿色突变体pgl2以及叶缘白化突变体mal对温度不敏感, 也定位在水稻第8染色体[22-24], 而yl 2 (t)定位于第8染色体长臂末端, 与这些基因的距离较远。通过水稻生物信息学网站(http://rice.plantbiology.msu.edu/cgibin/gbrowse/rice/)预测, 该区间内共有59个开放阅读框, 其中未有关于影响水稻叶色变化相关基因的报道, 说明YL 2 (T)是一个新的调控叶绿素合成的基因, 而且推测其对调控叶绿素b的合成至关重要。关于温度敏感型叶色突变体, 尽管已有很多研究, 但对调控基因的克隆还很少, 分子机制仍不是很清楚。对突变体yl2(t)的表型分析和基因定位为克隆该基因奠定了基础, 将为更全面地理解温度敏感型叶色突变表型调控的分子机制提供帮助。进一步的工作是扩大F2定位群体, 开发新的分子标记, 精细定位和克隆该基因。
| [1] | Izawa T, Shimamoto K. Becoming a model plant:the importance of rice to plant science[J]. Trends in Plant Science, 1996,1(3): 95–99. DOI: 10.1016/S1360-1385(96)80041-0 |
| [2] | Awan M A, Konzak C F, Rutger J N, et al. Mutagenic effects of sodium azidein rice1[J]. Crop Science, 1980,20(5): 663–668. DOI: 10.2135/cropsci1980.0011183X002000050030x |
| [3] | Su N, Hu M L, Wu D X, et al. Disruption of a rice pentatricopeptide repeat protein causes a seedling-specific albino phenotype and its utilization to enhance seed purity in hybrid rice production[J]. Plant Physiology, 2012,159(1): 227–238. DOI: 10.1104/pp.112.195081 |
| [4] | Liu W, Fu Y, Hu G, et al. Identification and fine mapping of a thermo-sensitive cholorophyll deficient mutant in rice(Oryza sativa L[J]. Planta, 2007,226(3): 785–795. DOI: 10.1007/s00425-007-0525-z |
| [5] | Zhang H, Li J, Yoo J H, et al. Rice Chlorina-1 and Chlorina-9 encode ChlD and ChlI subunits of Mg-chelatase, a key enzyme for chlorophyll synthesis and chloroplast development[J]. Plant Molecular Biology, 2006,62(3): 325–337. DOI: 10.1007/s11103-006-9024-z |
| [6] | Jung K H, Hur J, Ryu C H, et al. Characterization of a rice chlorophyll-deficient mutant using the T-DNA gene-trap system[J]. Plant and Cell Physiology, 2003,44(5): 463–472. DOI: 10.1093/pcp/pcg064 |
| [7] | Lee S, Kim J H, Yoo E S, et al. Differential regulation of chlorophyll a oxygenase genes in rice[J]. Plant Molecular Biology, 2005,57(6): 805–818. DOI: 10.1007/s11103-005-2066-9 |
| [8] | Sakuraba Y, Rahman M L, Cho S, et al. The rice faded green leaf locus encodes protochlorophyllide oxidoreductase B and is essential for chlorophyll synthesis under high light conditions[J]. The Plant Journal, 2013,74(1): 122–133. DOI: 10.1111/tpj.2013.74.issue-1 |
| [9] | Gong X, Su Q, Lin D, et al. The rice OsV4 encoding a novel pentatricopeptide repeat protein is required for chloroplast development during the early leaf stage under cold stress[J]. Journal of Integrative Plant Biology, 2014,56(4): 400–410. DOI: 10.1111/jipb.v56.4 |
| [10] | Song J, Wei X, Shao G, et al. The rice nuclear gene WLP1 encoding a chloroplast ribosome L13 protein is needed for chloroplast development in rice grown under low temperature conditions[J]. Plant Molecular Biology, 2014,84(3): 301–314. DOI: 10.1007/s11103-013-0134-0 |
| [11] | Tan J, Tan Z, Wu F, et al. A novel chloroplast-localized pentatricopeptide repeat protein involved in splicing affects chloroplast development and abiotic stress response in rice[J]. Molecular Plant, 2014,7(8): 1329–1349. DOI: 10.1093/mp/ssu054 |
| [12] | Lichtenthaler H. Chlorophylls and carotenoids:pigments of photosynthetic biomembranes[J]. Methods in Enzymology, 1987,148(34): 350–382. |
| [13] | Murray M G, Thompson W F. Rapid isolation of high molecular weight plant DNA[J]. Nucleic Acids Research, 1980,8(19): 4321–4326. DOI: 10.1093/nar/8.19.4321 |
| [14] | 刘喜, 周春雷, 任雅琨, 等. 水稻叶色白化转绿突变体WGL的遗传分析与基因定位[J]. 南京农业大学学报, 2015, 38(5): 712–719. Liu X, Zhou C L, Ren Y K, et al. Genetic analysis and gene mapping of virescent albino leaf mutant WGL in rice[J]. Journal of Nanjing Agricultural University, 2015,38(5): 712–719. DOI: 10.7685/j.issn.1000-2030.2015.05.003 (in Chinese) |
| [15] | 李育红, 王宝和, 戴正元, 等. 一个水稻新型叶色突变体的形态结构与遗传定位[J]. 中国水稻科学, 2011, 25(6): 587–593. Li Y H, Wang B H, Dai Z Y, et al. Morphological structure and genetic mapping of a new leaf color mutant in rice[J]. Chinese Journal of Rice Science, 2011,25(6): 587–593. (in Chinese) |
| [16] | 刘艳霞, 林冬枝, 董彦君. 水稻温敏感叶色突变体研究进展[J]. 中国水稻科学, 2015, 29(4): 439–446. Liu Y X, Lin D Z, Dong Y J, et al. Research advances in thermo-sensitive leaf coloration mutants in rice[J]. Chinese Journal of Rice Science, 2015,29(4): 439–446. (in Chinese) |
| [17] | Yoo S C, Cho S H, Sugimoto H, et al. Rice virescent3 and stripe1 encoding the large and small subunits of ribonucleotide reductase are required for chloroplast biogenesis during early leaf development[J]. Plant Physiology, 2009,150(1): 388–401. DOI: 10.1104/pp.109.136648 |
| [18] | 王军, 杨杰, 陈志德, 等. 水稻白化转绿突变体v13(t)的生理特性和基因定位[J]. 中国农业科学, 2011, 44(10): 1973–1979. Wang J, Yang J, Chen Z D, et al. Physiological character and gene fine mapping of a virescent mutant v13(t)in rice(Oryza sativa L[J]. Scientia Agricultura Sinica, 2011,44(10): 1973–1979. (in Chinese) |
| [19] | 李超, 林冬枝, 董彦君, 等. 一个水稻苗期温敏感白色条斑叶突变体的遗传分析及基因定位[J]. 中国水稻科学, 2010, 24(3): 223–227. Li C, Lin D Z, Dong Y J, et al. Genetic analysis and mapping of a thermo-sensitive white stripe leaf mutant at the seedling stage in rice(Oryza sativa L[J]. Chinese Journal of Rice Science, 2010,24(3): 223–227. (in Chinese) |
| [20] | Khush G S, Singh R J, Sur S C, et al. Primary trisomics of rice:origin, morphology, cytology and use in linkage mapping[J]. Genetics, 1984,107(1): 141–163. |
| [21] | Xia J, Wang Y, Ma B, et al. Ultrastructure and gene mapping of the albino mutant al12 in rice(Oryza sativa L[J]. Acta Genetica Sinica, 2006,33(12): 1112–1119. DOI: 10.1016/S0379-4172(06)60149-2 |
| [22] | 李育红, 王宝和, 戴正元, 等. 水稻叶色突变体及其基因定位、克隆的研究进展[J]. 江苏农业科学, 2011, 39(2): 34–39. Li Y H, Wang B H, Dai Z Y, et al. Research progresses in rice leaf color mutants and mapping and cloning of genes related[J]. Jiangsu Agricultural Science, 2011,39(2): 34–39. (in Chinese) |
| [23] | 朱丽, 刘文真, 吴超, 等. 水稻着丝粒附近一个淡绿叶突变相关基因的定位分析[J]. 中国水稻科学, 2007, 21(3): 228–234. Zhu L, Liu W Z, Wu C, et al. Identification and fine mapping of a gene related to pale green leaf near centromere region in rice(Oryza sativa L[J]. Chinese Journal of Rice Science, 2007,21(3): 228–234. (in Chinese) |
| [24] | 马娇, 任德勇, 吴国超, 等. 水稻叶缘白化突变体mal的遗传分析与基因定位[J]. 作物学报, 2014, 40(4): 591–599. Ma J, Ren D Y, Wu G C, et al. Genetic analysis and gene mapping of a marginal albino leaf mutant mal in rice[J]. Acta Agronomica Sinica, 2014,40(4): 591–599. DOI: 10.3724/SP.J.1006.2014.00591 (in Chinese) |




