文章信息
- 张美祥, 安玉艳, 刘廷利, 茹艳艳, 李文号, 窦道龙. 2015.
- ZHANG Meixiang, AN Yuyan, LIU Tingli, RU Yanyan, LI Wenhao, DOU Daolong. 2015.
- 在本氏烟中瞬时表达效应因子PsCRN127基因提高其对寄生疫霉的抗性
- Transient expression of the PsCRN127 effector gene enhances Nicotiana benthamiana resistance to Phytophthora parasitica
- 南京农业大学学报, 38(6): 930-935
- Journal of Nanjing Agricultural University, 38(6): 930-935.
- http://dx.doi.org/10.7685/j.issn.1000-2030.2015.06.009
-
文章历史
- 收稿日期: 2015-06-17
2. 南京农业大学园艺学院, 江苏 南京 210095
2. College of Horticulture, Nanjing Agricultural University, Nanjing 210095, China
病原菌在侵染寄主的过程中会分泌大量的效应因子(effectors),影响植物细胞的功能和生理生化代谢[1]。当寄主植物中含有与之对应的抗病蛋白(resistance protein,R)时,效应因子会触发植物的防卫反应(effector-triggered immunity,ETI),此时的效应因子又被称为无毒蛋白(avirulence protein,AVR)。而当寄主植物中不含与之对应的抗病蛋白时,效应因子往往会表现出毒性功能,抑制植物的免疫反应,从而促进病原菌的侵染[2]。
疫霉菌(Phytophthora)隶属于卵菌(Oomycetes),目前鉴定到的100多个疫霉种均是重要的植物病原菌,在全世界范围内给农林业生产造成巨大的经济损失。疫霉菌属于半活体(hemibiotrophic)营养生物,在侵染植物的早期以活体营养(biotrophic)的形式活动,抑制寄主的细胞死亡,而在侵染的后期,杀死寄主植物细胞,过渡到死体营养(necrotrophic)阶段[3]。效应因子在调控病原菌营养类型的转换过程中可能发挥了重要的作用[4]。
基因组序列分析表明,疫霉菌编码数目庞大的效应因子。根据效应因子在植物中靶标位置的不同,可将其分为两类:质外体效应分子(apoplastic effectors)和胞内效应分子(cytoplasmic effectors)[1]。胞内效应因子主要包括RxLR(R:精氨酸;x:任意氨基酸;L:亮氨酸)和CRN(crinkling and necrosis inducing protein)两类。Torto等[5]首次报道在致病疫霉菌中CRN效应因子具有诱导植物叶片皱缩和细胞死亡的活性。CRN效应因子在其蛋白N端为信号肽,紧接着有一个高度保守的FLAK(F:苯丙氨酸;L:亮氨酸;A:丙氨酸;K:赖氨酸)保守基序,其C端为多变区域。N端的信号肽-FLAK序列模式是CRN效应因子的分类特征[5, 6]。早期很多研究均认为CRN效应因子的主要活性是诱导植物细胞死亡[5, 6]。然而,近期的研究结果表明,只有极少数的CRN效应因子可以诱导植物细胞死亡[7, 8]。我们发现很多CRN效应因子能够抑制由激发子触发的细胞死亡[8, 9]。例如,大豆疫霉PsCRN115可以通过与植物的过氧化氢酶(catalase)互作来抑制由PsCRN63触发的细胞死亡[10];PsCRN70可以抑制由Bax、Avh241和PsojNIP等多种激发子触发的细胞死亡[11]。目前仅分析了数个CRN效应因子在致病过程中的功能。例如具有蛋白激酶生化活性的致病疫霉PiCRN8可以通过形成同源二聚体的形式发挥其毒性功能[12];在本氏烟中表达大豆疫霉PsCRN70可以降低植物对疫霉菌的抗性,表明PsCRN70是一个毒性因子[11];在本氏烟中表达PsCRN 115 则显著提高了植物对生物胁迫和非生物胁迫的耐受性[13]。这些结果表明,我们可以利用疫霉菌的效应因子提高植物的抗病性。
本研究初步解析了大豆疫霉菌效应因子PsCRN127在植物抗病中的作用,为进一步揭示疫霉菌的致病机制和利用病原菌效应因子提高植物抗病性提供了科学依据和参考。
1 材料与方法
1.1 试验材料
本氏烟(Nicotiana benthamiana)在25 ℃、16 h/8 h光暗交替培养6~8周后待用。寄生疫霉(Phytophthora parasitica)菌株Pp025为西北农林科技大学单卫星教授馈赠。寄生疫霉在10% V8固体培养基上,25 ℃、黑暗条件下培养。PVX∷PsCRN 127、PVX∷GFP、PVX∷Avh241、PVX∷Bax、PVX∷PsCRN63、PVX∷ INF1 和PVX∷PsojNIP质粒均为本实验室构建和保存。
1.2 农杆菌介导的瞬时表达
将重组质粒通过电击转化法转入GV3101农杆菌细胞。挑取阳性转化子接种在含有50 μg · mL-1卡那霉素的LB培养基中,220 r · min-1、30 ℃培养36 h;4 000 r · min-1离心3 min,收集细胞;用10 mmol · L-1 MgCl2洗涤3次后,用缓冲液(10 mmol · L-1 MgCl2,10 mmol · L-1 MES,200 μmol · L-1 acetosyringone,pH 5.7)重悬细胞并定容至A600=0.6。取由上至下第3至第6片完全展开的本氏烟真叶渗透接种农杆菌。
细胞死亡抑制分析:先将大豆疫霉菌效应因子PsCRN127渗透注射入本氏烟叶片,12 h后再注射含有Avh241、Bax、PsCRN63和INF1等各细胞死亡诱导因子的农杆菌,在注射后的2~7 d内观察表型并记录试验结果。
1.3 寄生疫霉游动孢子的制备和接种测试
切取约4 mm2大小寄生疫霉菌丝块20块,加入10%的V8液体培养基,25 ℃黑暗培养3~5 d后,用灭菌的自来水洗涤菌丝5~6次,再加入灭菌水浸没菌丝;将培养物放回25 ℃培养箱黑暗培养2~3 d后,将培养物移至4 ℃冷处理0.5 h再移回25 ℃培养箱放置1.0~1.5 h,待大量的游动孢子释放后,调节游动孢子浓度至50 μL-1。
剪取本氏烟叶片,叶柄部位用湿润的脱脂棉包裹,叶片平放在塑料盘子的滤纸上,叶片背面朝上;用移 液器吸取10 μL游动孢子悬液,滴加在本氏烟叶片上;接种结束后,用保鲜膜将塑料盘封好保湿,置于25 ℃ 黑暗培养;接种48 h内,观察和统计发病情况,接种的本氏烟叶片用70%(体积分数)乙醇脱色后拍照。 1.4 RNA提取和实时定量RT-PCR
本氏烟叶片的总RNA提取采用RNAsimple Total RNA Kit(TIANGEN)提取,具体的试验方法按照试剂盒的说明书进行。cDNA的合成采用RT reagent Kit With gDNA Eraser,TaKaRa逆转录试剂盒(TaKaRa)进行。实时定量PCR按照SYBR Premix Ex Taq试剂盒(TaKaRa,Dalian)说明书进行。PCR反应在Applied Biosystems 7500仪器上进行。反应体系如下:将50 ng cDNA和0.2 μmol引物、0.4 μL ROX Reference Dye及10 μL SYBR Premix Ex Taq混合于20 μL的PCR反应体系中。PCR反应程序为:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 34 s,40个循环。引物的特异性通过熔解曲线来判断。本研究所用引物名称和序列信息见表 1。
| 引物Primer | 引物序列(5′→3′)Primer sequence |
| EF1α-F | TATGATTACTGGTACCTCCC |
| EF1α-R | ACCTAGCCTTGGAATACTTG |
| PR2b-F | AGGTGTTTGCTATGGAATGC |
| PR2b-R | TCTGTACCCACCATCTTGC |
| EFR1-F | GCTCTTAACGTCGGATGGTC |
| ERF1-R | AGCCAAACCCTAGCTCCATT |
| LOX-F | AAAACCTATGCCTCAAGAAC |
| LOX-R | ACTGCTGCATAGGCTTTGG |
将DAB粉末溶解于pH 3.8的超纯水中,终质量浓度为1 mg · mL-1。将疫霉菌侵染后的本氏烟叶片浸没于DAB染液中,25 ℃黑暗中放置约8 h后,用70%乙醇脱色后观察,拍照。
1.6 PsCRN127的亚细胞定位分析
我们首先采用cNLS Mapper软件对PsCRN127序列中是否含有核定位信号(nuclear localization signla,NLS)进行预测,以5.0作为阈值(cut-off score)。接着采用试验的方法对PsCRN127的定位进行分析:将PsCRN 127 基因用BamHⅠ和XbaⅠ双酶切克隆到GFP融合载体pBinGFP2,获得重组载体pBinGFP2∷PsCRN 127 。将重组载体转化到农杆菌GV3101后,利用农杆菌介导的瞬时表达技术在本氏烟叶片中表达GFP∷PsCRN 127 融合蛋白,在注射农杆菌后36 h,在荧光显微镜下观察本氏烟叶片中融合蛋白荧光的分布情况。
1.7 数据统计与分析
使用SPSS 17.0软件对数据进行统计处理,采用Student′s t test进行差异显著性分析。
2 结果与分析
2.1 大豆疫霉效应因子PsCRN127对植物细胞死亡的调控作用
前期的研究表明,CRN效应因子具有抑制植物细胞死亡的活性[8, 9]。本研究发现:PsCRN127可以抑制由致病疫霉激发子INF1、大豆疫霉PsojNIP、大豆疫霉CRN效应因子PsCRN63、大豆疫霉RxLR效应因子Avh241等数个细胞死亡诱导因子引发的细胞死亡。我们利用农杆菌介导的植物瞬时表达技术首先在本氏烟叶片中先表达GFP或PsCRN127,12 h后注射各细胞死亡诱导因子,注射后1周内观察叶片注射点是否发生细胞死亡。以含有PVX∷GFP的农杆菌作为阴性对照,我们可以看到表达GFP不能够抑制由各激发子诱导的细胞死亡(图 1),而表达PsCRN 127 后,5个测试的细胞死亡诱导因子触发的细胞死亡均被抑制(图 1)。上述结果表明,大豆疫霉效应因子PsCRN127具有广泛的细胞死亡抑制活性。然而,PsCRN127在疫霉菌致病中的作用尚不明确。
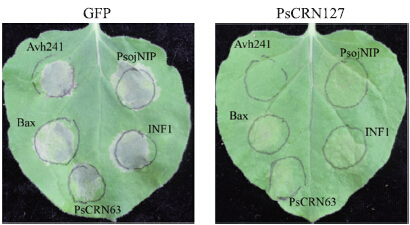 | 图 1 PsCRN127对5种激发子诱导植物细胞死亡的抑制作用Fig. 1 PsCRN127 suppression of Nicotiana benthamiana cell death triggered by five elicitors |
为了初步明确PsCRN127在大豆疫霉致病中的作用,我们在本氏烟叶片一侧表达GFP,另一侧表达效应因子PsCRN 127 ,并在注射农杆菌的36 h后接种寄生疫霉的游动孢子,评估该效应因子的表达对植物抗性的影响。结果表明:在接种疫霉菌后48 h,表达PsCRN 127 一侧植物叶片的病斑极显著小于表达GFP对照一侧(图 2),表明PsCRN 127 的表达可以激发植物的防卫反应,提高植物对疫霉菌的抗性。
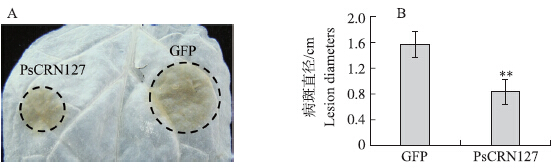 | 图 2 PsCRN127对本氏烟抗病性的作用Fig. 2 Enhancement of N.benthamiana disease resistance by PsCRN127* * P<0.01. The same as follows. |
利用实时定量RT-PCR技术分析了水杨酸(SA)信号途径中的PR 2 b基因、乙烯(ET)信号途径中的ERF 1 基因和茉莉酸(JA)信号途径中的LOX基因的表达情况。结果显示:与表达GFP的对照相比较,表达PsCRN 127 后SA和ET信号途径中的标记基因PR 2b、ERF1 均显著上调表达,而JA途径的标记基因LOX则下调表达(图 3-A)。表明:在本氏烟中表达PsCRN 127 基因可以显著改变激素抗性信号途径相关基因的表达,效应因子PsCRN127可能通过调控激素抗性信号途径来影响本氏烟的抗性。
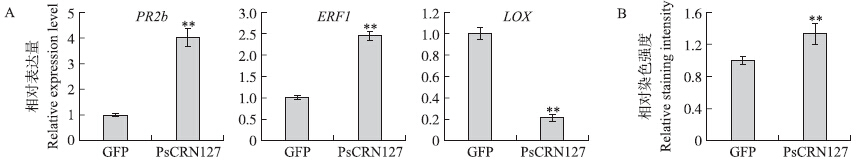 | 图 3 PsCRN127对本氏烟激素信号途径标记基因表达(A)和H2O2积累(B)的影响Fig. 3 The effect of PsCRN127 on expression of marker genes in hormone signaling pathways(A) and H2O2 accumulation(B)in N.benthamiana |
在本氏烟叶片中分别表达GFP对照和PsCRN 127 12 h后,接种寄生疫霉菌游动孢子,在接种16 h后收集叶片,利用DAB染料检测接种叶片中过氧化氢的积累。利用ImageJ软件对染色深度进行定量转换,并进行统计分析。结果表明:表达PsCRN 127 可以显著提高本氏烟接种后过氧化氢的含量(图 3-B)。表明,PsCRN127可能通过提高植物中的过氧化氢含量来增强本氏烟对寄生疫霉的抗性。
2.5 PsCRN127的亚细胞定位
已有研究表明大部分CRN定位于植物的细胞核[14]。为了明确PsCRN127效应因子发挥作用的亚细胞定位,我们采用cNLS Mapper软件对PsCRN127序列中是否含有核定位信号进行了预测。结果未鉴定到PsCRN127中含有NLS。紧接着我们采用农杆菌介导的植物瞬时表达技术,在本氏烟叶片中表达GFP ∶ PsCRN127融合蛋白,采用荧光显微镜观察融合蛋白的分布,进而确定PsCRN127的亚细胞定位。在注射后的36 h取样,剪取一小块本氏烟叶片,置于配置有GFP滤光片的荧光显微镜下观察,结果显示:与GFP的定位情况类似,发现GFP ∶ PsCRN127融合蛋白定位于植物的细胞质和细胞核(图 4),表明PsCRN127不是一个细胞核特异定位的CRN效应因子。
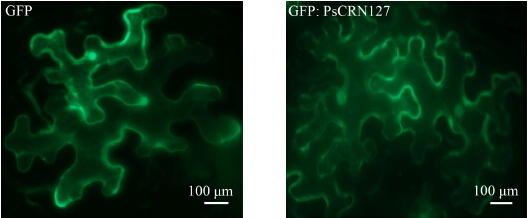 | 图 4 PsCRN127的亚细胞定位观察Fig. 4 Subcellular localization of PsCRN127 in N.benthamiana |
疫霉是半活体营养菌,在病原菌营养类型的转换过程中,效应因子可能在该过程中发挥重要的作用[4]。已有研究表明,疫霉菌的CRN和RxLR效应因子均具有调控植物细胞死亡的活性[14, 15, 16]。人们最初认为CRN效应因子的主要活性是诱导植物细胞死亡,而最近的研究显示仅有少数的CRN效应因子可以诱发植物细胞死亡[7, 8],提示CRN效应因子可能具有其他的功能。有趣的是我们发现有些CRN效应因子不但不能诱导细胞死亡,而且具有抑制细胞死亡的活性[8]。本研究我们从大豆疫霉菌中鉴定到一个能够抑制由多种激发子触发细胞死亡的CRN效应因子PsCRN127,并初步分析了其对植物抗性的影响和可能的作用机制,为认识疫霉菌CRN效应因子的功能和作用机制提供了线索,并为最终认识疫霉菌的致病机制和制定疫霉病害的防控策略提供了参考。
病原菌往往通过分泌效应因子进入植物细胞,抑制植物的防卫反应,促进病原菌的侵染[1]。为了明确PsCRN127在疫霉菌致病过程中的作用,我们分析了PsCRN 127的表达对植物防卫反应的影响。发现在本氏烟中表达PsCRN127 不仅不能够促进寄生疫霉菌的侵染,反而显著提高了本氏烟对其侵染的抗性。这与我们之前报道的另一个大豆疫霉效应因子PsCRN 115 表达显著提高本氏烟对病原菌抗性的研究结果类似[13]。PsCRN115可能通过诱导植物中的一系列抗病相关蛋白的表达来提高本氏烟的抗性。然而,PsCRN127与PsCRN115在调控植物细胞死亡的活性上存在差别,PsCRN115不能够抑制由INF1、Avh241和Bax诱导的植物细胞死亡。一个可能的解释是,这2个CRN效应因子调控植物细胞死亡和植物防卫的活性是独立的;另一个可能的解释是,虽然调控植物细胞死亡和调控植物免疫反应之间存在关联,但是PsCRN127与PsCRN115利用不同的分子机制调节植物的防卫反应。
在本氏烟中表达PsCRN127导致SA和ET信号途径下游基因的显著上调表达,表明PsCRN127可以触发SA和ET抗性信号途径,从而提高植物的抗病性。相反地,表达PsCRN 127 显著降低了JA信号途径的下游基因表达。已有研究表明SA和ET信号途径正调控植物对活体和半活体病原菌的抗性,负调控对死体营养菌的抗性;而JA正调控植物对死体营养菌的抗性,负调控对活体和半活体营养菌的抗性[17]。综合以上的研究结果,表明PsCRN127可能通过正调控SA和ET抗病信号途径,负调控JA途径来提高植物对半活体病原菌寄生疫霉的抗性。
过氧化氢在植物抗病过程中发挥重要作用[18, 19]。以往的研究表明,植物过氧化氢含量的提高对其抵御活体营养和半活体营养病原菌具有正调控作用[19]。与这些结果类似,我们发现表达PsCRN 127 可以通过提高本氏烟在病原菌胁迫下的过氧化氢积累来提高其对寄生疫霉菌的抗性。CRN效应因子在卵菌中高度保守,因此有研究者认为CRN具有病原相关分子模式(pathogen-associated molecular patterns,PAMP)的特点[20]。PAMP是病原菌保守的一类分子,可以触发植物的PTI(PAMP-triggered immunity),在此过程中伴随着植物中活性氧和胼胝质的积累等防卫反应的发生[21]。PsCRN127是否同时具有效应因子和PAMP的活性来调节植物的防卫反应,值得进一步开展研究。
绝大多数的CRN效应因子定位于植物的细胞核[14, 22]。我们利用融合GFP的方法观察了PsCRN127在本氏烟细胞中的分布情况。观察结果显示,与绝大多数CRN效应因子的定位不同,PsCRN127定位在本氏烟中的细胞质和细胞核中。PsCRN127的细胞死亡调控活性和植物免疫调节功能是在植物的细胞核还是细胞质内发挥作用,二者是否是相关联的,值得进一步开展研究。
| [1] | Kamoun S. A catalogue of the effector secretome of plant pathogenic oomycetes[J]. Annual Review of Phytopathology,2006,44:41-60 |
| [2] | Jones J D G,Dangl J L. The plant immune system[J]. Nature,2006,444(7117):323-329 |
| [3] | Fawke S,Doumane M,Schornack S. Oomycete interactions with plants:infection strategies and resistance principles[J]. Microbiology and Molecular Biology Reviews,2015,79(3):263-280 |
| [4] | Kleemann J,Rincon-Rivera L J,Takahara H,et al. Sequential delivery of host-induced virulence effectors by appressoria and intracellular hyphae of the phytopathogen Colletotrichum higginsianum[J]. PLoS Pathogens,2012,8(4):e1002643 |
| [5] | Torto T A,Li S,Styer A,et al. EST mining and functional expression assays identify extracellular effector proteins from the plant pathogen Phytophthora[J]. Genome Research,2003,13(7):1675-1685 |
| [6] | Haas B J,Kamoun S,Zody M C,et al. Genome sequence and analysis of the Irish potato famine pathogen Phytophthora infestans[J]. Nature,2009,461(7262):393-398 |
| [7] | Stam R,Jupe J,Howden A J M,et al. Identification and characterisation CRN effectors in Phytophthora capsici shows modularity and functional diversity[J]. PLoS ONE,2013,8(3):e59517 |
| [8] | Shen D Y,Liu T L,Ye W W,et al. Gene duplication and fragment recombination drive functional diversification of a superfamily of cytoplasmic effectors in Phytophthora sojae[J]. PLoS ONE,2013,8(7):e70036 |
| [9] | Liu T L,Ye W W,Ru Y Y,et al. Two host cytoplasmic effectors are required for pathogenesis of Phytophthora sojae by suppression of host defenses[J]. Plant Physiology,2011,155(1):490-501 |
| [10] | Zhang M X,Li Q,Liu T L,et al. Two cytoplasmic effectors of Phytophthora sojae regulate plant cell death via interactions with plant catalases[J]. Plant Physiology,2015,167(1):164-175 |
| [11] | Rajput N A,Zhang M X,Ru Y Y,et al. Phytophthora sojae effector PsCRN70 suppresses plant defenses in Nicotiana benthamiana[J]. PLoS ONE,2014,9(5):e98114 |
| [12] | van Damme M,Bozkurt T O,Cakir C,et al. The Irish potato famine pathogen Phytophthora infestans translocates the CRN8 kinase into host plant cells[J]. PLoS Pathogens,2012,8(8):e1002875 |
| [13] | Zhang M X,Rajput N A,Shen D Y,et al. A Phytophthora sojae cytoplasmic effector mediates disease resistance and abiotic stress tolerance in Nicotiana benthamiana[J]. Scientific Reports,2015,5:10837 |
| [14] | Schornack S,van Damme M,Bozkurt T O,et al. Ancient class of translocated oomycete effectors targets the host nucleus[J]. Proceedings of the National Academy of Sciences of the United States of America,2010,107(40):17421-17426 |
| [15] | Dou D L,Kale S D,Wang X L,et al. Conserved C-terminal motifs required for avirulence and suppression of cell death by Phytophthora sojae effector Avr1b[J]. Plant Cell,2008,20(4):1118-1133 |
| [16] | Wang Q Q,Han C Z,Ferreira A O,et al. Transcriptional programming and functional interactions within the Phytophthora sojae RXLR effector repertoire[J]. Plant Cell,2011,23(6):2064-2086 |
| [17] | Spoel S H,Johson J S,Dong X N. Regulation of tradeoffs between plant defenses against pathogens with different lifestyles[J]. Proceedings of the National Academy of Sciences of the United States of America,2007,104(47):18842-18847 |
| [18] | Kuzniak E,Urbanek H. The involvement of hydrogen peroxide in plant responses to stresses[J]. Acta Physiologiae Plantarum,2000,22(2):195-203 |
| [19] | van Camp W,van Montagu M,Inze D. H2O2 and NO:redox signals in disease resistance[J]. Trends in Plant Science,1998,3(9):330-334 |
| [20] | Thomma B P H J,Nürnberger T,Joosten M H A J. Of PAMPs and effectors:the blurred PTI-ETI dichotomy[J]. Plant Cell,2011,23(1):4-15 |
| [21] | Dou D L,Zhou J M. Phytopathogen effectors subverting host immunity:different foes,similar battleground[J]. Cell Host and Microbe,2012,12:484-495 |
| [22] | Stam R,Howden A J M,Delgado-Cerezo M,et al. Characterization of cell death inducing Phytophthora capsici CRN effectors suggests diverse activities in the host nucleus[J]. Frontiers in Plant Science,2013,4:387 |
 2015, Vol. 38
2015, Vol. 38


