文章信息
- 朱庆丰, 任雪平. 2015.
- ZHU Qingfeng, REN Xueping. 2015.
- D-半乳糖对小鼠初级感觉皮层M1受体表达的影响
- Effects of D-galactose on M1 receptor expressions in the primary sensory cortex of mice
- 南京农业大学学报, 38(3): 478-482
- Journal of Nanjing Agricultural University, 38(3): 478-482.
- http://dx.doi.org/10.7685/j.issn.1000-2030.2015.03.019
-
文章历史
- 收稿日期:2015-01-28
乙酰胆碱(acetylcholine,ACh)是脑内较早发现并具有重要作用的一类神经递质,由胆碱和乙酰辅酶A在胆碱乙酰转移酶的作用下合成,与突触后膜胆碱能受体结合而发挥作用[1]。胆碱能受体有两种类型:烟碱样受体(N型受体)和毒蕈碱样受体(M型受体)。脑内主要是M型受体,属7次跨膜肽链组成的G蛋白受体家族。目前,已发现至少存在5种亚型,分别为M1、M2、M3、M4、M5受体[1],其中M1受体含量最为丰富,几乎分布于所有脑区,参与感觉特异投射和锥体外系运动控制的各级神经调节,与躯体感觉、运动、学习记忆以及精神活动等密切相关,对内脏活动亦具调节作用[1, 2, 3, 4]。有文献报道,在一些病理和不利的生理条件下,大脑皮层内胆碱能系统的功能会发生变化,进而引起神经调节功能改变和行为学异常[5, 6]。
衰老过程中神经系统结构和功能发生明显改变,如脑体积萎缩、重量减轻、形态改变、神经元结构退化,神经网络功能异常,引起老年人或动物运动调控、感觉认知、学习记忆及内脏活动调节能力下降[4, 7, 8],伴随衰老进程,脑内胆碱能系统功能也出现退变[4, 9, 10]。D-半乳糖(D-galctose,D-gal)是一种快速有效构建脑衰老模型的方法,在神经科学研究中广泛运用[11, 12],但是,D-gal对感觉皮层中胆碱能系统的功能影响及作用机制还没有系统研究。在本试验中,我们探讨了D-gal是否影响小鼠初级感觉皮层中M1受体蛋白的表达,以期为揭示D-gal导致衰老的神经机制积累基础资料。 1 材料与方法 1.1 试验动物处理
选择健康雄性昆明小鼠(20~22 g,6周龄)16只,随机分成2组(n=8)。对照组皮下注射生理盐水(0.9 g · L-1氯化钠溶液,1 mL),试验组皮下注射D-gal(Sigma,100 mg · mL-1 · kg-1,1 mL),每天1次,连续8周,以制备衰老小鼠模型[12]。小鼠饲养于恒温动物房内(22~24 ℃,光/暗时间为12 h/12 h),配备充足的啮齿类饲料和清洁饮用水。动物试验符合美国国家卫生协会1996年公布的《试验动物管理和使用指南》要求,并获得我校动物试验伦理委员会批准。
1.2 组织学观察
小鼠经戊巴比妥钠(40 mL · kg-1体质量)麻醉,开胸后经左心室插管,灌注生理盐水,至肝脏发白后灌注体积分数为4%的多聚甲醛(200 mL · kg-1)进行预固定,随后开颅,取出右侧大脑初级感觉皮层,移入4%的多聚甲醛中后固定20~24 h,经PBS(0.1 mol · L-1,pH 7.4)冲洗,常规脱水、透明、石蜡包埋,制作厚度为6 μm的连续冠状切片,裱片于3-氨丙基-3-乙氧基硅烷处理的载玻片上,每隔10张切片取1张切片用于组织学染色。 1.2.1 Nissl染色
采用1%(质量分数)甲苯胺蓝染色(室温,5 min),再经乙醇梯度脱水,二甲苯透明,封片。切片染色后在Leica DMI4000B型显微镜下观察并拍照。 1.2.2 M1受体免疫组织化学染色
切片脱蜡至水,加体积分数为3%的H2O2室温孵育5 min,以消除内源性过氧化物酶活性;蒸馏水冲洗,PBS浸泡5 min;滴加正常山羊血清,室温孵育10 min,封闭非特异性反应部位;倾去血清,滴加一抗(兔抗鼠CHRM1单克隆抗体,1 ∶ 100; Affinity Biosciences公司),37 ℃孵育1 h; PBS冲洗5 min,3次;滴加生物素标记二抗(羊抗兔IgG抗血清,武汉博士德生物工程有限公司),37 ℃孵育10 min;PBS冲洗3次;滴加辣根酶标记链酶卵白素过氧化物酶工作液,37 ℃孵育10 min,PBS冲洗3次;DAB(3,3′-二氨基联苯胺四盐酸盐,武汉博士德生物工程有限公司)显色,自来水冲洗,脱水,透明,封片。阴性对照试验采用正常山羊血清和PBS代替一抗,其余步骤同上。 1.3 数据分析和定量统计
统计Nissl染色切片各层中神经元密度,统计免疫组化染色的切片M1受体免疫阳性神经元密度:每只小鼠随机选取5张切片,每张切片选择3个部位,在光镜(400×)下从皮层表层至髓质垂直采样,计算Ⅰ~Ⅵ层中采集网格(125 μm×125 μm)内的细胞数目,换算成密度即单位面积(mm2)内细胞数目。
所得数据用x±SD表示,用t测验或单因素方差分析(ANOVA)判定组间是否存在差异,所有数据采用SPSS 16.0软件统计。 2 结果与分析
2.1 Nissl染色下神经元的统计分析
在Nissl染色的切片上,神经元胞体及树突呈蓝色,根据细胞形态特征和分布特点,将感觉皮层由外向 内分为6层:Ⅰ(分子层)、Ⅱ(外颗粒层)、Ⅲ(外锥体层)、Ⅳ(内颗粒层)、Ⅴ(内锥体层)、Ⅵ(多形层)(图 1-A、B) ,各层厚度不均。统计表明,各层中神经元密度与分层因素密切相关[对照组F(5,318)=228.758,试验组F(5,318)=86.317,P < 0.001],其中分子层细胞较少。组间统计分析发现,对照组和试验组各层中神经元密度无显著差异(P>0.05,图 2-A),表明D-gal处理并不影响皮层中神经元的数量。
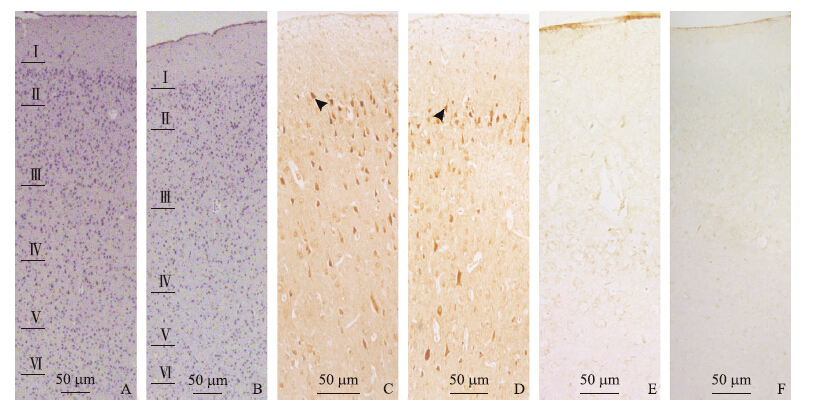 |
图 1 对照组(A、C、E)和试验组(B、D、F)小鼠感觉皮层的组织学观察
Fig. 1 Histological observation on the sensory cortex in control(A,C,E) and D-galactose-treated(B,D,F)mice
A、B.皮质分层及各层中的神经元:Ⅰ~Ⅵ分别为分子层、外颗粒层、外锥体层、内颗粒层、内锥体层和多形层;C、D.M1受体免疫阳性神经元(箭头所示);E、F.阴性对照 A,B.Laminar identification and the cortical neuron in the cortex:Ⅰ-Ⅵ represent molecular layer,outer granular layer,outer pyramidal layer,inner granular layer,inner pyramidal layer and multiform layer,respectively;C,D.M1-immunoreactive(M1-IR)neurons(arrows);E,F.Negative controls |
两组切片中,经DAB显色均可见棕黄色的免疫阳性细胞,在各层均有分布(图 1-C、D),阴性对照组未见阳性反应(图 1-E、F)。各层中阳性细胞密度不一,与分层因素密切相关[对照组F(5,318)=80.423,试验组F(5,318)=66.266,P < 0.001],其中分子层M1受体免疫阳性神经元密度最低。统计发现:试验组各层中M1受体免疫阳性细胞密度明显降低(图 2-B),与对照组相比,试验组小鼠皮层中M1受体免疫阳性神经元的密度从第Ⅰ层到第Ⅵ层分 别减少了16.28%、18.49%、47.62%、17.82%、37.14%和25.65%,表明D-gal处理显著降低皮层中M1受体蛋白表达。
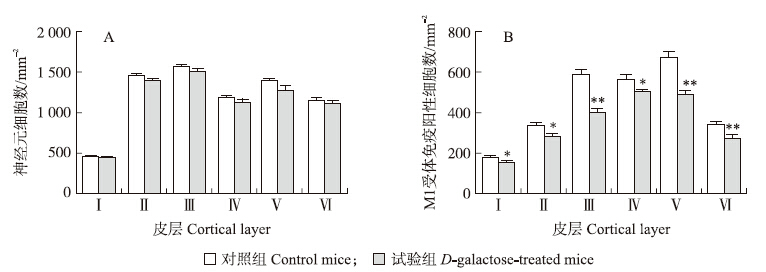 | 图 2 对照组和试验组小鼠皮层中神经元(A)和M1受体免疫阳性细胞(B)的统计 Fig. 2 Densities of the neuron and M1-immnuoreactive(M1-IR)neuron in each cortical layer of the control(A)and D-galactose-treated(B)mice 与对照组相比,*P < 0.05,**P < 0.01。Compared with control group,*P < 0.05,**P < 0.01. |
为进一步探讨D-gal对感觉皮层中M1蛋白表达的影响,研究各层中M1受体免疫阳性神经元与总神经元比率的变化,结果发现:该比率在试验组皮层中均有减少,在第Ⅲ层(29.54%)和第Ⅴ(20.41%)层下降尤为显著(表 1)。表明D-gal对M1受体蛋白表达的影响主要在传出神经元中,这可能是引起D-gal致衰老动物的感觉功能下降的重要原因之一。
| % | |||
| 皮层
Cortical layer |
M1受体免疫阳性神经元占总神经元的比率Ratio of M1-IR neuron to the total neuron | 下降率
Decreased rate |
|
| 对照组Control mice | 试验组 D-galactose-treated mice | ||
| 第Ⅰ层LayerⅠ | 38.07 | 33.77 | 11.30 |
| 第Ⅱ层Layer Ⅱ | 22.89 | 20.20 | 11.73 |
| 第Ⅲ层Layer Ⅲ | 37.49 | 26.42 | 29.54 |
| 第Ⅳ层Layer Ⅳ | 47.55 | 40.77 | 14.27 |
| 第Ⅴ层Layer Ⅴ | 47.84 | 38.08 | 20.41 |
| 第Ⅵ层Layer Ⅵ | 29.64 | 24.58 | 17.07 |
大脑皮层是对衰老敏感的一个靶区。研究显示,衰老过程中皮层的结构与功能显著退化,其中神经递质系统功能异常可能是一项重要因素。老年动物大脑皮层内多个递质系统功能改变,如GABA能系统、谷氨酸能系统和去甲肾上腺素能系统等,这些递质系统功能异常影响老年个体的神经调节[13, 14]。分布于基底前层以及脑干的胆碱能神经元发出纤维广泛投射至几乎全部脑区,构成中枢胆碱能神经系统(central cholinergic nervous system),也已被认为是皮层中一类重要的递质系统[1],对皮层功能的维持具有重要调节作用,如促进神经元形态发育,调节神经元兴奋性,改变突触传递效能,诱导突触可塑性,协调不同递质释放,调节神经网络活动,进而影响动物的整体功能调节[4, 15]。有报道发现,胆碱能系统在衰老过程中也出现结构与功能的退变,如胆碱能神经元树突萎缩、轴突和突触结构改变、胆碱能纤维分布减少、ACh合成与代谢异常等[10, 16]。老年中枢胆碱能系统功能退化并非是由胆碱能神经元丢失所致[10],因此,探索胆碱能受体功能的老年性退变尤显重要。有报道发现,老年脑内某些胆碱能受体mRNA和蛋白表达确实存在异常,并导致神经元对ACh的放电频率与发放模式发生改变[17],但是胆碱能受体在同一脑区不同层次间如何变化还不太清楚。Tayebati等[18]对大鼠小脑内M1~M5 5种受体蛋白表达做年龄相关性分析,发现各受体蛋白在分子层、浦肯野细胞(Purkinje cell)层和颗粒层中的表达存在显著差异(出现表达增强、表达减弱和无变化3种现象)。本研究发现,老年小鼠感觉皮层中M1受体蛋白表达均为下降,其中第Ⅲ层(下降47.62%)和第Ⅴ层(下降37.14%)的下降幅度较其他层次更为显著,表明M1受体功能在老年大脑皮层中均为退化,但也存在组织间的差异性。
另外,本试验也为探索D-gal构建脑衰老模型的神经机制提供新的证据。人们早已发现长期皮下注射D-gal可用来构建啮齿类动物的脑衰老模型,但是其作用的神经机制至今仍然不清楚,多数学者认为长期施加D-gal可能导致脑内氧化应激增加,突触联系变性,髓鞘超微结构退化,以及生化代谢异常(如丙二醛和/或超氧化物歧化酶的积累),这些异常也与大脑在正常衰老过程中所表现出来的变化相似[11, 12, 19]。本研究表明D-gal引起M1受体蛋白表达下降,尤其在传出神经元中,这也可能是导致D-gal衰老动物大脑皮层内胆碱能系统功能下降的重要因素。
| [1] | Kandel E R. Principles of Neural Science[M]. 5th ed. New York:McGraw-Hill, 2013:759-1006 |
| [2] | Zhao R R, Xu F, Xu X C, et al. Effects of alpha-lipoic acid on spatial learning and memory, oxidative stress, and central cholinergic system in a rat model of vascular dementia[J]. Neuroscience Letters, 2015, 587:113-119 |
| [3] | Demeter E, Sarter M. Leveraging the cortical cholinergic system to enhance attention[J]. Neuropharmacology, 2013, 64:294-304 |
| [4] | Zhu Q, Zhou P, Wang S, et al. A preliminary study on cerebellar acetylcholine-mediated blood pressure regulation in young and old rats[J]. Experimental Gerontology, 2015, 63:76-80 |
| [5] | Anju T R, Ajayan M S, Paulose C S. Disruption of cerebellar cholinergic system in hypoxic neonatal rats and its regulation with glucose, oxygen and epinephrine resuscitations[J]. Neuroscience, 2013, 236:253-261 |
| [6] | Dwivedi N, Flora G, Kushwaha P, et al. Alpha-lipoic acid protects oxidative stress, changes in cholinergic system and tissue histopathology during co-exposure to arsenic-dichlorvos in rats[J]. Environmental Toxicology and Pharmacology, 2014, 37:7-23 |
| [7] | Anderson S, White-Schwoch T, Parbery-Clark A, et al. Reversal of age-related neural timing delays with training[J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110:4357-4362 |
| [8] | Mander B A, Rao V, Lu B, et al. Prefrontal atrophy, disrupted NREM slow waves and impaired hippocampal-dependent memory in aging[J]. Nature Neuroscience, 2013, 16:357-364 |
| [9] | Nyakas C, Granic I, Halmy L G, et al. The basal forebrain cholinergic system in aging and dementia. Rescuing cholinergic neurons from neurotoxic amyloid-beta42 with memantine[J]. Behavior Brain Research, 2011, 221:594-603 |
| [10] | Schliebs R, Arendt T. The cholinergic system in aging and neuronal degeneration[J]. Behavior Brain Research, 2011, 221:555-563 |
| [11] | Banji D, Banji O J F, Dasaroju S, et al. Curcumin and piperine abrogate lipid and protein oxidation induced by D-galactose in rat brain[J]. Brain Research, 2013, 1515:1-11 |
| [12] | Zhu Q, Ren X, Zhang C. Effects of D-galactose on the structure of nerve fibers in cerebellar white matter[J]. Pakistan Journal of Zoology, 2015, 47:187-192 |
| [13] | Pinto J G A, Hornby K R, Jones D G, et al. Developmental changes in GABAergic mechanisms in human visual cortex across the lifespan[J]. Frontiers in Cellular Neuroscience, 2010, 4:16 |
| [14] | Wenk G L, Pierce D J, Struble R G, et al. Age-related changes in multiple neurotransmitter systems in the monkey brain[J]. Neurobiology of Aging, 1989, 10:11-19 |
| [15] | Ramanathan D S, Conner J M, Anilkumar A A, et al. Cholinergic systems are essential for late-stage maturation and refinement of motor cortical circuits[J]. Journal of Neurophysiology, 2015, 113:1585-1597 |
| [16] | Uchida S. Cholinergic vasodilative system in the cerebral cortex:effects of acupuncture and aging[J]. Journal of Acupuncture and Meridian Studies, 2014, 7:173-179 |
| [17] | Akhmedov K, Rizzo V, Kadakkuzha B M, et al. Decreased response to acetylcholine during aging of aplysia neuron R15[J]. PLoS ONE, 2013, 8:e84793 |
| [18] | Tayebati S K, Vitali D, Scordella S, et al. Muscarinic cholinergic receptors subtypes in rat cerebellar cortex:light microscope autoradiography of age-related changes[J]. Brain Research, 2001, 889:256-259 |
| [19] | Cui X, Zuo P, Zhang Q, et al. Chronic systemic D-galactose exposure induces memory loss, neurodegeneration, and oxidative damage in mice:protective effects of R-alpha-lipoic acid[J]. Journal of Neuroscience Research, 2006, 84:647-654 |



