细胞(cell)作为生命体结构和功能的基本单位,是生命的重要组成部分构成了生命体从宏观到微观链条中极为重要的一环. 微观上,细胞是由亚细胞组元(细胞膜/壁、细胞核、细胞器等)和各种不同大小分子组成; 宏观上,细胞与其他胞外基质成分一道构成了生命体的各种组织和器官. 与终末分化细胞不同,干细胞是一类未充分分化、尚不成熟的特殊细胞群体,具有自我更新、高度增殖和多向分化潜能(multi-lineage differentiation),被喻为"万用细胞". 目前,干细胞在损伤组织自行修复中起着关键的作用. 若将由干细胞分化而成的目标细胞移植到体内,将有可能替代各种受损细胞,恢复其功能,这就为数以百万计的各类患者带来希望. 随着对干细胞认识的深化,干细胞所具有的独特分化潜能在治疗难以自愈的组织创伤和疾病、延缓机体衰老等方面显示出愈来愈重要的应用前景,因而其在生物医学、药物研发和体外毒理学的研究中均具有重要地位.
机体所有的组织器官均受到由细胞自身和细胞外环境所产生的力学刺激作用既可诱导细胞增殖,亦可促进细胞死亡.力学刺激的大小、方向及分布均可影响细胞的生物学响应(Lim et al.2006). 例如流体剪切可促使内皮细胞释放激素并激活胞内钙离子信号通路引发细胞骨架重构增强细胞强度( Jen et al. 2000, Sato et al. 1987);压力可引起软骨细胞蛋白多糖的变化( Bachrach et al. 1995, Buschmann et al. 1995); 基底拉伸可改变细胞的活性和取向( Liu 1998,Wang et al.1995); 甚至重力大小和方向的改变可导致细胞骨架的重排(Li et al.2010, Vorselen et al. 2014, Zhang et al. 2016).生理学水平的力学刺激是器官结构与功能发育和维持的必要条件之一提高或降低力学刺激则可导致细胞死亡,引发机体一系列病理学变化.特别地,生命体的生长、分化乃至其自身稳定、肿瘤发生、生命延续等均与干细胞有关. 在动物体内干细胞的发育、生长、增殖、分化等行为与它们所处的力学环境是分不开的.在正常的生理力学环境中,干细胞能正常发挥其功能;而当周围力学环境发生变化后,干细胞的各种功能也随之发生变化.这种力学微环境与生物化学微环境(如激素和生长因子)一道协同调控干细胞的生长、分化和命运.生物学家在探讨干细胞自我更新、生长和分化的分子信号机制时大多关注生物化学信号的作用往往忽视了其中重要的力学和物理因素的影响. 近年来人们发现细胞内外的力学微环境以及所产生的力学信号可调控干细胞形态、结构和功能重力、拉伸、压缩、静水压、流体剪切等能够影响细胞自我更新、分化、衰老和凋亡并在组织生长、功能整合等生理过程和某些病理过程(如心肌肥大、动脉粥样硬化、皮肤扩张、骨折愈合等)中发挥重要的作用.此外,由干细胞主动变形所产生的牵引力,即细胞牵引力(cell traction forces,CTFs)也影响着伤口愈合、血管生成和肿瘤转移等许多病理生理过程的发生与发展.更重要的是力学刺激或细胞周围基质材料的力学特性对干细胞的形态、发育和功能也起着重要的调节作用.然而,力是如何被干细胞感受并传递至干细胞内最终导致干细胞发生一系列生物学效应其精细的响应机制和作用模式仍处于探索阶段,有待进一步阐明.
2 (干)细胞力学性质与力学模型 2.1 (干)细胞力学性质细胞作为具有细胞膜、细胞骨架、多种细胞器和细胞核等复杂结构的物体大多表现出黏弹性材料的性质.其力学性质主要表现为黏附、变形、爬行、迁移等主动行为以及剪切、拉伸、压缩、扭转、微重力等外力诱导的被动力学行为研究难点在于如何刻画和建立其力学本构关系.多种细胞力学测试方法的对比研究,新技术的不断涌现与应用使得人类对不同细胞整体力学性质和局部力学行为有了愈来愈清楚的认识.除部分干细胞以克隆方式生长干细胞力学性质与通常的已分化成体细胞并无本质差别;而且即便是对于以克隆方式生长的特定干细胞其力学行为也需要以单个干细胞力学性质为基础( Liu et al. 2014). 故此在本节中统一以(干)细胞力学性质与力学模型进行描述.
2.2 (干)细胞力学模型迄今为止,单个细胞力学模型可分为连续介质模型(continuum mechanical models)和微观结构模型(microstructural models)两大类.前者主要包括黏弹性模型(viscoelastic models)和两相模型(biphasic model)两个亚类,且黏弹性模型还可进一步细分为固体模型(solid models)液滴模型(liquid drop models)和幂指数结构阻尼模型(power-law structural damping model). 后者主要包括张力整合模型(tensegrity model)绳索网络模型(cable network model),开孔泡沫模型(open-cell foams model)微观血影蛋白网络模型(microscopic spectrin-network model)整合迁移模型(integrated cell migration model)等. 值得注意的是上述模型大多针对细胞某一个或数个方面的力学性质而提出难以从功能和结构两个方面进行完整刻画,且模型参数多依赖性于所采用的实验技术.
2.2.1 连续介质模型连续介质模型是最为常见的描述细胞力学性质和行为的模型.连续介质模型将细胞看作由具有某种连续材料性质的物质组成其本构模型和相关参数可以直接从实验观察中评估得到.尽管连续介质模型能提供的亚细胞级或者分子级的响应信息较少但是它能够容易并且较直接的在细胞尺度上预测细胞的力学性质. 更重要的是一旦细胞的连续介质模型被建立起来,就能够给出细胞的应力和应变分布而应力和应变分布信息又可以用来确定传导至细胞骨架和亚细胞器上的应力及其分布并可用于构建考虑细胞骨架和细胞器的结构模型( Lim et al. 2006).连续介质细胞模型通常可以分为两类,即黏弹性模型和两相模型.
黏弹性模型主要包括固体模型,液滴模型和幂指数结构阻尼模型.(1)固体模型通常把整个细胞假定为均质且不含明显皮层的弹性或者黏弹性固体.由于不考虑皮层的作用,固体模型大大减少了模型中力学参数从而极大简化对实验数据的分析. 从所使用的材料模型来看细胞的固体模型可分为线弹性固体模型和黏弹性固体模型,分别如图1(a)和图1(b)所示.线弹性固体模型忽略了细胞的黏性、采用一个简单的弹簧来描述细胞的力学性质.该模型的一个典型应用是采用微管吸吮技术(micropipette aspiration technique,MAT)研究了负压作用下内皮细胞在微管内的变形问题( Theret et al. 1988). 当微管口径远小于细胞直径时细胞可以被近似为不可压缩的线弹性半空间. 然而由于黏弹性材料的弹性与加载速率和加载历史有关线性弹性模型一般不足以描述细胞的力学行为.而细胞黏弹性固体模型同时考虑细胞的黏性和弹性、采用不同弹簧和黏壶间特定的串并联模式来描述可用于研究负压作用下白细胞的小变形情况( Schmid-Schönbein et al.1981),在确定的外载作用下细胞通常可以达到平衡作态.即使吮吸负压远大于其临界值由固体模型模拟的内皮细胞和软骨细胞也无法被完全吸入微管( Jones et al. 1999).(2)液滴模型则将单个细胞看作一个液滴滴液模型可以用来模拟细胞的大变型.最先提出的牛顿液滴模型可用于模拟细胞被吸入微管的过程( Yeung & Evans 1989). 如图1(c)所示牛顿液滴模型将细胞模拟成一个弹性皮层包裹着一个均质牛顿黏性液滴皮层具有各向同性的张力、但不抗弯. 当细胞受负压作用缓慢进入微管时液滴模型能够很好地模拟细胞的大变形. 但是如果细胞被吸入的速度较快牛顿液滴模型就不适合了( Evans & Yeung 1989). 进一步为了考虑细胞核在细胞变型中所起的作用还提出了复合液滴模型( Hochmuth et al. 1993). 如图1(d)所示复合液滴模型将细胞核也作为一个封装的液滴、具有不同的核膜张力和胞核黏性.相比于牛顿液滴模型复合液滴模型能够有效地解释细胞微管吸吮实验中观察到的细胞初期快速响应及恢复时快速反冲现象( Tran-Son-Tay et al. 1998). 此外,复合液滴模型还被用来模拟细胞在剪切流( Agresar et al. 1998)和拉伸流动( Kan et al. 1999)中的运动细胞黏附和迁移( N'Dri et al. 2003)以及细胞的剪切变稀和细胞膜的弹性( Marella & Udaykumar 2004).(3)固体模型和液滴模型主要是从瞬时加载条件中导出然而真实的细胞在生理环境中通常受到动态的力学加载.在应用振荡型磁扭扭技术(magnetic tweezer cytometryMTC)和原子力显微技术(atomic force microscopyAFM)对细胞开展的动态测试中贴壁细胞的动态存储模量与振荡频率间存在弱幂级数关系而损耗模量在低频时也呈现出类似的幂级数依赖关系、高频时则显示出明显的牛顿黏滞效应( Mahaffy et al. 2000).这种弱幂级数的动态行为无法用弹簧-黏壶模型来描述( Pritz 1996).幂指数结构阻尼模型的提出正是为了描述细胞的这种流变行为( Fabry et al. 2001),并可用于描述多种贴壁细胞的动态力学响应(Alcaraz et al.2003, Fabry et al. 2003, Puig-De-Morales et al. 2001).

|
| 图 1 典型的4种连续介质细胞模型.(a)线弹性固体模型(b)黏弹性固体模型(c)牛顿液滴模型,(d)复合液滴模型 |
以上所述的固体模型液滴模型和幂指数结构阻尼模型均将细胞看作是单相材料. 然而细胞组成十分复杂除脂双层分子组成的细胞膜(植物细胞还有由纤维素组成的较硬细胞壁)构成细胞与环境的界面外细胞内还有细胞核、细胞器、细胞骨架等有形组元悬浮或锚定与细胞质液中,故细胞既包含固态物质,也包含液相流体.基于此两相模型是将细胞处理成由固相材料和液相材料复合而成的两相材料假定其中的固相材料为线弹性、液相材料无黏性且液相材料可透过固相材料进行扩散.这一模型已经被广泛用于研究肌肉骨骼细胞的力学性质特别是单个软骨细胞及其与胞外基质的相互作用( Guilak et al. 1999, Shieh & Athanasiou 2002, 2003).然而两相模型忽略了细胞膜的流体屏障作用因此有待进一步改进以考虑细胞膜的作用.
2.2.2 结构模型尽管细胞的连续介质模型能够在一定程度上较好地反映细胞的力学性质(例如细胞的黏度弹性,刚度等性质),但这类模型忽略了细胞膜下的微丝微管和中间丝骨架的力学支撑作用以及这些骨架所构成的复杂网络的功能. 基于此人们发展了各种能够反映细胞骨架结构的细胞力学模型主要将细胞骨架简化为规则或不规则的几何结构.这类模型认为细胞受力时的响应行为主要由细胞中的微丝微管和中间丝3种骨架及其网络结构决定.在保持细胞形态的作用中微丝和中间丝主要负责抗拉而微管则主要负责抗压; 3种骨架网络在空间上的耦合交联增大了骨架网络的强度.这类模型主要有开孔泡沫模型、索网模型和张力整合模型.
开孔泡沫模型基于细胞皮层丝状网络结构与泡沫的特点相似将细胞骨架简化为弹性杆件相互连接而成的网络(如图2(a)所示).如果相对泡沫密度φ(杆件部分与泡沫部分的体积比,0 < φ< 1)较小时,杆件拉伸或弯曲时结构的弹性模量分别正比于 φ或φ 2( Warren & Kraynik 1997).该模型可用于模拟贴壁培养内皮细胞的微丝骨架并假定微丝的弯曲和扭转是微丝网络产生应力的主要方式由此得到开孔泡沫模型的剪切模量为E∝ E f φ 2( Satcher Jr & Dewey Jr 1996, Satcher et al. 1997). 对于微丝骨架若取φ= O(10 -3)及E f = O(10 9)Pa则由此可得微丝骨架网络的剪切模量为 O(10 3)Pa这个值是贴壁黏附细胞剪切模量评测值 O(10 2~10 3)Pa 的上限( Stamenović & Ingber 2002). 此外开孔泡沫模型所预测的细胞在压缩过程中的应变硬化现象(Gibson & shby 1982)与贴壁黏附细胞局部受压时所观察到的应变硬化特征一致( Petersen et al. 1982, Radmacher 1997, Shroff et al. 1995). 尽管如此由于开孔泡沫模型将细胞骨架过于简化和理想化其公式的导出依赖于过多假设因此该模型描述的结构与真实的细胞骨架相差较大. 同时开孔泡沫模型还忽略了细胞骨架中的预应力和黏性因此也很难解释实验中观测到的细胞骨架预应力影响细胞刚度的现象.
|
| 图 2 典型的3种细胞结构模型.(a)开孔泡沫模型,(b)索网模型(c)六杆张力整合模型 |
索网模型将细胞皮层微丝骨架简化为由抗拉元件无摩擦地铰接而成的弹性索网(如图2(b)所示). 该模型将细胞骨架中的微丝简化为线弹性绳索微丝间的相互作用简化为无摩擦的铰,并假设绳索只能承受张力.绳索之间由铰接相连,所形成的预张力可保证绳索网络稳定的形态结构其张力可以外部作用(如胞外基质)、内部作用(如骨架中的抗压元件或抗压的细胞质)、或者内外部同时作用而加以平衡( Stamenović & Ingber 2002).该模型被用于考察不同实验技术下贴壁黏附细胞微丝骨架的变形能力可较好地模拟细胞穿刺(cell poking,CP)实验中的细胞响应但却不能很好地描述MTC等其他实验中的细胞响应(Coughlin & Stamenović 2003).索网模型中没有考虑细胞膜、微管、中间丝和细胞核等结构的贡献模型只能对某些特定的外载下的变形响应作出预测. 因此索网模型在描述贴壁黏附细胞的力学响应时并不完善.
张力整合作为建筑学上的概念最早是由美国著名建筑师Fuller提出、并由雕塑家Snelson首次形象化( Snelson 1996)定义为一系列连续的拉绳和连续或不连续的压杆组成的自应力、自平衡的空间杆系结构( Ingber 2003, Stamenović et al. 1996).Ingber等观察到细胞变形与张力整合结构非常类似据此认为细胞的骨架是预应力的张力整合结构并提出了细胞骨架的张力整合模型( Ingber 1993, Stamenović et al.1996),如图2(c)为典型的六杆张力整合模型.该模型将微丝和中间丝简化为只能承受拉力的拉绳并将微管简化为承受压力的压杆拉绳和压杆的共同作用决定了细胞的整体力学特征.随后的实验研究证明了张力整合模型能够较好地模拟活细胞的力学行为( Stamenović et al. 2002, Wang et al. 2001, Wang et al. 2002).张力整合模型中所包含的预应力可以解释实验中观察到的预应力引起细胞硬化及外载作用下的应变硬化并预测细胞在外力作用下的响应( Pourati et al. 1998,Wang et al.1993). 然而,在某些特定的外载作用下,张力整合模型也会表现出软化而这种软化现象在相应的实验中并没有观测到( Coughlin & Stamenović 1997, Coughlin & Stamenović 1998, Volokh et al.2000). 总体而言尽管张力整合模型在一定程度上为细胞骨架对外力的响应提供了良好可信的描述然而该模型将错综复杂的细胞骨架网络过于简化在描述细胞力学行为方面还有待进一步完善.
上述的结构模型虽然在一定程度上能够反映细胞骨架对细胞力学性质的贡献但对细胞骨架的处理过于简化和理想化. 为此人们还发展了描述更为精细微/纳米结构的细胞力学模型.一个典型的实例是针对红细胞悬浮问题建立和发展了微观血影网络模型(microscopic spectrin-network model)用于研究红细胞在大变形中细胞膜和血影蛋白网络的影响(Discher et al.1998, Li et al. 2005). 这种模型采用节点来表示蛋白络合物利用蠕虫(worm-like)链来表示相邻络合物间的血影蛋白的连接作用最终形成以三角形为基本单元的网络细胞骨架.该模型需要大量的节点来构造细胞骨架故计算细胞的变形时需要大量的计算;也可采用简化的粗粒化模型对红细胞在微通道中的变形进行模拟(Pivkin & Karniadakis 2008),但均局限于红细胞的研究.还有一种结构模型是整合迁移模型采用两层网络来分别模拟细胞膜和核膜结构每层由节点和连接节点的弹簧组成,内膜和外膜可以通过微丝连接;多个跨膜整合素簇集于外膜的每个节点上通过与基底上的配体结合而形成黏附斑,并连接至应力纤维(Kim et al.2012,2013). 该模型被成功地应用于考察二维(Kim et al.2013)和三维的细胞迁移( Kim et al. 2012)不仅涵盖细胞膜和核胞的重建还涉及黏附斑动力学、马达蛋白激活、伪足突起等.整合迁移模型可较好地研究细胞迁移但仅适用于细胞主动迁移行为的模拟不能考虑细胞对外界力学刺激和加载的响应.
2.3 亚细胞组元力学细胞之中有许多结构和功能上独立的单位---亚细胞组元. 除细胞骨架外细胞核、线粒体(叶绿体)、内质网、高尔基体、中心体等细胞器的力学性质不仅决定其本身的主动力学行为和被动力学响应而且也是细胞整体力学性质的重要组成部分. 细胞核作为细胞内最大的细胞器是细胞遗传物质的存储场所同时具有相对独立的结构(核膜、核仁等)和致密的物质(密度较高)既是细胞力学性质的主要贡献组元也是通过表观遗传学改变耦合力学刺激与生物学响应的关键成为目前细胞力学研究的热点. 在诸多的亚细胞组元中线粒体力学在近些年的研究中也受到特别的关注因为它具有独特的基因组信息和生物学结构在真核细胞进化、细胞生命活动中起到非常重要的作用而且其分裂与融合动力学过程也是确保(干)细胞完成复杂生物学功能的基础.
2.3.1 细胞核力学细胞核具有封闭膜状结构,含有绝大部分的遗传物质DNA是机体内生物化学反应(如复制、转录、剪接和核蛋白体生物合成等)的主要场所.细胞核既是细胞的主要遗传控制器,也是一个普遍的力学感受器及效应器在力学应答中处于核心位置. 随着细胞力学特性研究的快速展开越来越多的研究聚焦于细胞核力学特性的研究以深入探究力学因素调控细胞生命活动的奥秘.
2.3.1.1 细胞核的力学特性前述的细胞生物力学模型和实验研究大多将细胞作为一个整体难以考察诸如细胞核等亚细胞组元的贡献和影响( Bao & Suresh 2003, Huang et al. 2004, Ingber 2000, Kasza et al. 2007). 为此利用新的微观力学与生物学技术获取细胞核力学行为的数据就成为当前细胞核力学研究的热点和关键.针对细胞核的形态观测主要利用光学显微镜或者激光扫描共聚焦荧光显微镜(laser scanning confocal fluorescence microscope,LSCFM)进行可清晰拍摄到细胞核的形貌特征( Rodrigues & Sanches 2008).体外细胞核力学性能测试主要采用MAT、光镊(optical tweezersOT)、AFM等技术,用于测量力学刺激下细胞内的或分离的细胞核的响应.以AFM技术为例,不仅采用商业探针可获得贴壁细胞核力学特性( Di Bucchianico et al. 2011)而且还可以采用修饰的极细针尖探针实现了对细胞核的直接测试( Obataya et al. 2005)获得针尖穿透细胞膜以及核膜时的力-位移曲线、得到更加合理的细胞核静态杨氏模量(10 2~10 3 Pa量级)( Liu et al. 2014a). 然而对于细胞核的测试不能仅停留在静态力学特性层面需要更进一步了解其动态特性,分析其在动态刺激下的应激响应.
干细胞分化过程中细胞核内发生明显的的基因表达改变、结构重组包括染色质去凝聚和核蛋白固定等.干细胞的细胞核较已分化细胞的更易发生形变.全能干细胞的细胞核更加柔软且具有更好的可塑性;人类胚胎干细胞(embryonic stem cellESC)中细胞核在初期是高度可变形的,但分化数天后细胞核会逐渐变硬其分化的胚胎成纤维细胞的细胞核硬度高出约6倍而后呈指数形式衰减( Ozolek et al. 2007). 其生物学意义在于在胚胎中更多可变形的细胞核能够给未分化或分化程度低的干细胞提供使其发育分化的组织部位.这种细胞核硬度依赖性甚至可作为判别干细胞分化程度的依据之一. 例如骨髓来源的造血干细胞(hemopoietic stem cell,HSC)虽分化潜能不如ESC但可分化成为所有成熟的血细胞类型( Kondo et al. 2003)采用MAT技术研究发现HSC细胞核的硬度大于ESC、而其可变形性则大于成熟成纤维细胞提示HSC是一种部分分化的干细胞且这种成熟干细胞的细胞核具有中等硬度、形变不可逆的特性( Pajerowski et al. 2007). 正如细胞整体一样细胞核力学性质主要由细胞核骨架决定.由于任何一种干细胞中均不表达已分化细胞中的细胞核骨架成分lamin A使其细胞核具有更好的流动性、更大的变形能力(尤其是初始10s以内的形变)( Pajerowski et al. 2007). 引人注目的是多数干细胞的细胞核形变均可观测人脑组织中干细胞样的神经前体细胞在迁移中会发生较大的细胞核形变并可用MAT技术模拟该变形过程( Tsai et al. 2005).成体干细胞的多潜能形变也具有更高的收缩性并能产生明显的骨架应力( Engler et al. 2006)这不仅是细胞运动性的驱动力,还有助于细胞内核的重塑( Pajerowski et al. 2007).
然而,无论是已分化的成熟体细胞,还是具有分化潜能的干细胞其细胞核的力学性质确定、力学行为分析等尚很不清楚. 其一目前仍然难以实现对活细胞内细胞核力学性质的准确测量; 其二细胞核的力学建模及其与细胞整体力学模型的关联还知之甚少需要更多新的知识.
2.3.1.2 力学刺激对细胞核性质及干细胞分化的影响不对等的非对称式分裂是干细胞实现自我更新或分化、保持组织稳态的重要基础( Betschinger & Knoblich 2004),父代干细胞需产生一个子代干细胞来维持其分化能力而其他细胞则启动分化程序、分化成相应的成熟组织细胞.由于力学因素可使干细胞发生非对称分裂而细胞核在细胞分裂过程中起着关键作用故细胞核力学在干细胞分化过程中可能扮演重要的限速角色( Shin & Discher 2015). 例如血流剪切作用下红系造血祖细胞在分化过程中细胞核受到压缩( Zermati et al. 2001),以至于分化末期细胞核过度硬化而不能通过内皮屏障导致被巨噬细胞吞噬、形成血细胞-巨噬细胞岛( Chasis & Mohandas 2008),从而影响造血作用和细胞转运. 此外作为细胞骨架分子马达的肌球蛋白Myosin II能够调节红细胞去核( Tsai & Discher 2008),在模式上类同于细胞分裂过程中的非对称分裂( Simpson & Kling 1967).
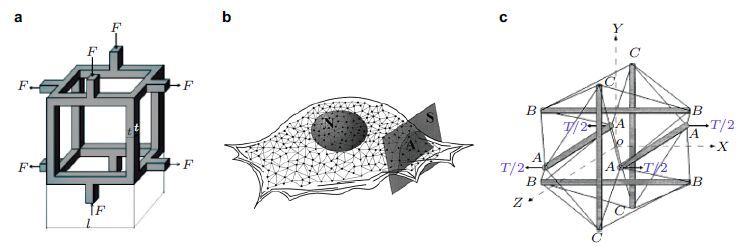
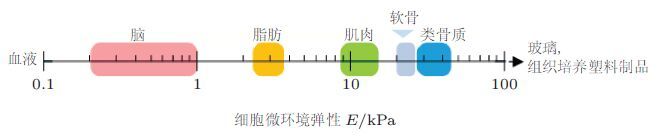
人体组织具有不同的生理硬度,如脑、骨髓、脂肪等组织较软只能承受较小的应力; 而较硬的肌肉、软骨、骨等组织则能承受较大应力.如前所述,细胞核的力学性质主要由核骨架蛋白lamin A决定而细胞微环境中的基质硬度和应力将通过调控lamin A的表达水平和网络结构,影响细胞核及细胞的生物学功能(Han et al.2015, Qi et al. 2016),乃至干细胞分化. 作为一种中间丝骨架蛋白Lamin可调节细胞核的变形能力在已分化的成熟细胞具有较高含量、导致更硬的细胞核(Pajerowski et al.2007); 其表达水平是由基质硬度提供的外部应力决定的,可能通过Myosin II产生的细胞张力与细胞核的组分相耦合并调节干细胞的分化( Peric-Hupkes et al. 2010, Swift et al. 2013).组织培养中的基质硬度会增加细胞的张力并稳定lamin A通过调节自身的转录和应力纤维基因而促进分化: 在软基底上干细胞会通过低表达lamin A使其向脂肪向分化;而在硬基底上则通过高表达lamin A使其向骨向分化( 图3).应力能够抑制lamin A的类绳索细丝状结构的发生改变以稳定细胞核内lamin A的表达与干细胞杨氏模量之间的关系:生理上高表达lamin A能够使细胞核增强对抗应力的能力从而稳定核纤层(nuclear lamina)和核染色质(chromatin)结构可稳定干细胞的表型及限制对DNA的损伤( Swift et al. 2013). 此外细胞核骨架蛋白lamin的不同亚型具有不同的力学特性,lamin A是黏性的、而lamin B是弹性其相互间成分比率在分化过程中也会发生变化从而决定造血细胞系的分化命运. 例如,lamin A与lamin B的比率在向骨髓和淋巴细胞分化过程中增大、导致细胞运动能力的提高( Shin et al. 2013),而lamin B1过表达会降低骨髓和淋巴细胞在循环中的数量( Wong et al. 2013)导致细胞核的压缩和红细胞在骨髓内的保留.
|
| 图 3 组织微观力学影响干细胞分化并与细胞核内富含的骨架蛋白lamins相关( Swift et al. 2013) |
总体而言,力学环境如何影响细胞核性质并调控干细胞分化仍远未有答案有许多基础问题还需要回答. 例如造血细胞系的流变学研究在干细胞自我更新和命运决定等核心问题上给出了重要线索需要回答诸如干细胞如何黏附基底弹性、外部剪切力如何与内部的细胞骨架及细胞核力学耦合等( Shin & Discher 2015). 另一个问题是细胞核力学如何通过细胞核骨架蛋白lamin的控制调节干细胞的分化和转运.
2.3.1.3 细胞核的力学传递在真核细胞中细胞核是最大、最硬的细胞器是生命体内复制、转录、剪接和核蛋白体合成等生物化学反应的场所其形状和结构组分在细胞发育、分化、成熟和衰老等生命过程均会发生变化从而改变细胞核内基因表达和功能,实现对力学刺激的应答反应.细胞外的力学刺激可以跨越细胞骨架传递到细胞核,直接作用于DNA元件导致DNA双螺旋结构或染色质高级结构的构象改变和转录活性变化表明力学刺激能够诱导基因转录必需的重建和分解过程发生(Amy et al.2008, Kris et al. 2008).除了承受通过细胞骨架所传递的来自于细胞外的力学刺激作用外细胞核内染色质结构的后天性修饰也会改变细胞核的力学性质.
典型的细胞核为球形或椭圆形,是一个能承受连续形状变化的动态细胞器.从结构与功能看细胞核包括核膜(两层磷脂双分子膜和核纤层)和核内结构(染色质纤维、核仁、核小体和核浆蛋白等).核纤层是一层致密的蛋白网状结构主要由核纤层蛋白(lamin)和核纤层结合蛋白(lamin binding proteins)组成.核纤层结合蛋白除了可将核纤层蛋白与染色质结构和基因调节元件连接在一起外还有助于将核纤层与内层核膜连接在一起,稳定核纤层网状结构并横跨核膜、将核膜结构与细胞骨架连接在一起形成细胞骨架和细胞核之间的物理连接. 在整个细胞周期中细胞核的形状经历了巨大的变化从分裂间期的稳定、清晰结构到有丝分裂期的结构完全分解、消失其变化程度取决于细胞核膜的组成成分.
细胞外的力学刺激主要通过细胞骨架与核骨架的耦联而传递至细胞核.细胞骨架由肌动蛋白微丝、微管和中间丝组成:肌动蛋白微丝为细胞骨架提供了拉伸和收缩力;承载压缩性荷载的微管形成一个极化的网络结构允许细胞器和蛋白在细胞内各处运动; 中间丝提供了额外的结构强化作用.如前述的细胞结构模型细胞骨架结构在细胞形状维持、力学完整性、细胞运动性和分裂中起着重要作用而细胞骨架和细胞核膜之间的物理连接为将细胞外力学刺激传递至细胞核提供了结构基础.
生命个体的力学行为变化最终将表现为细胞外基质(extracellular matrixECM)的力学特征改变,可经ECM与细胞间形成的黏着斑复合物(focal adhesion complex,FAC)传递到细胞内、与细胞骨架网络结构相连接并最终通过调控细胞核的基因表达而改变细胞的力学稳态以适应外界力学环境的变化. 将细胞锚定在ECM上的FAC由跨膜整合素、黏着激酶、踝蛋白和黏着斑蛋白等组成允许细胞与ECM的信息交流. 硬基底上的力学抑制会减慢细胞核的运动相应地,多种转录因子可进入到多种细胞的细胞核、并促进力学敏感基因的表达( Dupont et al. 2011, Miralles et al. 2003, Swift et al. 2013).一个实例是一种在心脏发生中起作用的关键转录因子NKX2.5被认为是骨髓间充质干细胞中平滑肌微丝蛋白的力学敏感抑制物( Dingal et al. 2015).
施加在干细胞表面的作用力可通过细胞核传递导致一系列生物学响应如力学牵张能够刺激牵张敏感离子通道开启或关闭,改变细胞内离子浓度活化导致基因转录变化的信号通道,激活细胞核的应答(Uzer et al.2016). 同样,力学刺激也可激活整合素和其他黏着斑蛋白调节和修饰细胞骨架交联蛋白和肌球蛋白的浓度与构象或者通过改变肌动蛋白、中间丝蛋白和微管蛋白的构象对细胞骨架进行重新排序( Janmey & McCulloch 2007, Johnson et al. 2007, Vogel & Sheetz 2006)从而直接或间接地影响细胞核的基因转录. 同时基因转录既受到细胞骨架活化的影响也受到与细胞核骨架结构相关的核蛋白的作用. 例如R-Smad蛋白通过配体结合的方式与转化生长因子- β(transforming growth factor- β,TGF- β)结合并活化然后与核组织蛋白MAN-1相互作用( Lammerding et al. 2004);核膜蛋白中的核纤层蛋白lamin A/C的丢失可导致由NF- κB调节的转录障碍( Vogel & Sheetz 2006).在细胞核基因转录过程中,除了依赖核纤层蛋白的变化外还有提出了许多其他的假设机制、可将细胞核的形状与细胞的力学转导途径联系在一起.
细胞核是最硬的细胞器,虽然其刚度为周围细胞骨架的2~3倍但细胞外力学刺激仍可导致明显、可检测的细胞核变形(Lozoya et al.2016). 细胞刚度主要是由细胞核刚度决定的而ESC具有非常大的细胞核(核/质比可占50%)可采用细胞刚度来间接反映细胞核刚度.ESC细胞核刚度大小主要取决于染色质的状态当染色质发生去凝集时细胞核会变软. 一个典型实例是针对经受1.1 Pa24 h恒定流体剪切作用后的人类ESC其细胞(核)刚度从原来的33 kPa显著减小到13 kPa下降幅度达60.61%. 然而细胞核自身如何传递、感知力学信号并对其发生应答反应细胞核形状、结构和力学性质与细胞核生物学响应间的关系乃至力学刺激与基因组相互作用的直接机制,仍需要进一步深入研究.已有研究提示,在力学应答过程中细胞可主动改变细胞核结构元件以适应力学环境的变化.细胞外的力学刺激可以跨越细胞骨架传递到细胞核并直接作用于DNA,导致DNA双螺旋结构或高阶染色质结构的构象改变; 有关纯化DNA、染色质和染色体的实验研究也显示力学刺激能够诱导基因转录必需的重建和分解过程发生( Amy et al. 2008, Kris et al. 2008).
综上所述,细胞核形状、结构、刚度与细胞功能和表型具有高度的相关性.一方面,细胞核被膜的结构和力学性质的改变可影响细胞核的力学信号传递和转导. 另一方面核被膜蛋白的突变也可调控转录调节子的连接,进而改变基因表达的模式.虽然已获得大量关于细胞内力承载元件连接性的有价值的信息并且通过核纤层蛋白病、转基因和RNA干扰等方法获得了更多的知识但关于细胞核力学传递和转导的直接作用仍然不十分清楚.生物系统的复杂性,上述力学敏感蛋白与DNA的直接连接关系、有关细胞核核被膜蛋白功能和组织结构等的知识局限性使得要解析上述力学传递和转导途径变得更为困难需要从分子、细胞和组织水平系统认识力学刺激导致的细胞表观遗传学改变.
2.3.2 线粒体力学及分裂与融合动力学线粒体具有独立的基因组,可以自我复制,但不具有完全的自主性被称为半自主性细胞器.在亚细胞层次上线粒体的动力学行为是非常重要的原因是线粒体的动力学行为是(干)细胞的生命活动的基本需要.线粒体的基本生物学意义在于它在真核细胞的能量代谢中起到了核心作用被称为细胞的"能量工厂". 线粒体是产生ATP的重要场所而ATP是一切生物进行生命活动的直接能量来源.线粒体还是(干)细胞信号转导的一个重要枢纽作为细胞中非常重要的第二信使,Ca 2+与线粒体的生理活动密切相关( Bhat et al. 1997, Cheng et al. 1993).
2.3.2.1 单个线粒体的力学性质及其与(干)细胞生物学功能的关联线粒体在(干)细胞内形成动态网络状结构的过程中单个线粒体自身也在不断的运动、变形,因此单个线粒体的力学性质是线粒体动力学行为的基础.将分离得到的线粒体采用MAT对其力学响应进行研究发现线粒体的直径尺寸呈钟形分布,其最可几直径约为1.0 μm;线粒体在MAT负压的作用下膜的变形行为呈现一种从过渡态向平衡态转变的过程膜张力与面积应变呈线性关系,其面积模量约为9 mN· m -1( Wang et al. 2012).线粒体膜的变形行为与线粒体缓冲液的物理化学环境及线粒体的生物学功能相关:降低渗透压可降低线粒体膜的变形能力; 相比于中性的pH值生理酸性和碱性的pH值能降低线粒体膜的变形能力;活跃的呼吸状态能使线粒体膜的变形能力增加并且这种变形能力的增加不能被呼吸链的解耦剂羰基氰化物间氯苯腙(carbonylcyanide-m-chlorophenylhydrazoneCCCP)( Chaudhari et al. 2007, Sims 1990)或抑制剂抗霉素A(antimycin A)所抑制( Park et al. 2007); 此外线粒体膜的变形能力可被线粒体通透性转换的诱导剂Ca 2+所调节并且这种变形能力的改变能被线粒体通透性转换的抑制剂环孢霉素A(cyclosporin A,CsA)所抑制( Staal et al. 2007).
2.3.2.2 胞内线粒体分裂与融合动力学线粒体是高度动态的细胞器其分裂和融合的动力学过程是维持胞内线粒体动态网络结构的基本过程.胞内线粒体之间具有高度的动态相关性单个线粒体力学性能和线粒体网络动力学行为是相互联系的二者之间存在耦合作用. 如果对线粒体的某一局部加以去极化刺激同样会导致网络远端线粒体膜电位的下降这说明胞内线粒体是高度连通的( de Giorgi et al. 2000).线粒体相互作用最直接的证据就是线粒体的分裂融合行为这种行为不仅在活细胞中被观察到在胞外实验中线粒体的融合也被成功诱导( Meeusen et al. 2004):分别把绿色和红色荧光蛋白导向两组细胞的线粒体基质并将分别分离的线粒体在一定条件下混合发现部分线粒体表现为黄色的荧光由此证明线粒体基质成分发生了充分的混合.线粒体胞外融合实验充分证明了融合是线粒体的基本生物学行为.线粒体融合可促进线粒体的协作有利于线粒体之间的物质交换、能量传递和信息沟通诱导膜电位的快速传递以及基因组的交换和互补. 伴随着生命的衰老线粒体脱氧核糖核酸(mitochondrial deoxyribonucleic acidMtDNA)会凝聚很多的突变,通过线粒体网络进行的基因组互补可以有效地修复这些突变,从而保证线粒体正常的生命活动.线粒体分裂可以使得细胞内不同区域的线粒体执行各自的功能表现出不同水平的生物学活性,并且可以方便地被输送到细胞的各个角落.分裂融合还可以使线粒体在细胞分裂过程中平均分配到子代细胞中.近几年的研究显示线粒体的融合分裂与细胞凋亡也是密切相关的( Karbowski & Youle 2003).
在细胞分裂期,线粒体的分裂和融合动力学行为会发生很大的变化这个过程与细胞骨架密切相关.线粒体在细胞内的运动并不是简单的随机热运动而是通过细胞骨架的分子马达介导,沿着细胞骨架进行定向的输运( Chada & Hollenbeck 2003, Salmeen et al. 1985,Wagner et al.2003).细胞骨架蛋白的变异及细胞骨架干扰剂的作用均会使线粒体的动力学行为受到影响( Knowles et al. 2002, Yaffe et al. 1996). 在有丝分裂期线粒体分裂和融合活性显著提高线粒体分配到两个子代细胞的过程是通过结合而形成的大线粒体团一分为二的方式实现的;而微管解聚剂Nocodazole可阻碍细胞的有丝分裂从而使线粒体结合和解离动力学行为趋向于与分裂间期相似;线粒体结合和解离动力学模型分别拟合发生了结合和解离的线粒体的存活概率--存活时间--体积的实验数据可获得表观线粒体结合和解离速率常数分别作为描述线粒体融合和分裂活性的指标( Wang et al. 2012).
由于高度网络化和动态化的线粒体比孤立静态的线粒体更具生物学的优势线粒体统称为形成网络化结构,并具有运动、分裂与融合活性.胞内线粒体网络化程度取决于线粒体分裂与融合的相对速度通常情况下融合与分裂速度相当,线粒体的数目与形态保持稳定.如果线粒体融合过程受到抑制,就会发生线粒体片断化;而如果线粒体分裂过程受到抑制,线粒体的网络化程度就会加强( Sesaki & Jensen 1999).线粒体分裂和融合的动力学性质对稳定线粒体网络的形态非常重要.线粒体的形态还随细胞周期而改变在细胞分裂间期线粒体的网络化程度较高在有丝分裂和减数分裂期线粒体呈现片断化的结构( Gorsich & Shaw 2004, Taguchi et al. 2007).
线粒体的动态网络结构及其运动、分裂和融合的复杂动力学行为可以精确调节细胞复杂的生命活动.不论是胞外还是胞内研究均可证明线粒体的力学性质和动力学行为受到细胞质中物理化学环境以及细胞自身生命活动的影响和调控( Wang et al. 2012).线粒体在细胞能量代谢及信号转导中起着重要的作用.为了完成其生物学功能线粒体在细胞中需要形成高度动态的复杂网络结构这种网络结构处于连续不断的运动、分裂和融合之中. 当前虽然在线粒体运动、分裂和融合的分子机理研究中获得了很大的进展但限于技术手段亚细胞水平上线粒体力学性质、动力学行为及其与生物学功能的定量关联仍然没有被充分的研究.由于线粒体在细胞能量代谢与信号转导中的核心地位,许多疾病如帕金森氏病、阿尔茨海默氏病、糖尿病、肌营养不良病、肝病、心肌病及癌症的发生与发展均与线粒体密切相关( Bandyopadhyay & Dutta 2005, Darin et al. 2006, Galluzzi et al. 2006)故需进一步深入研究这些重要生物学过程的精细调控机制.
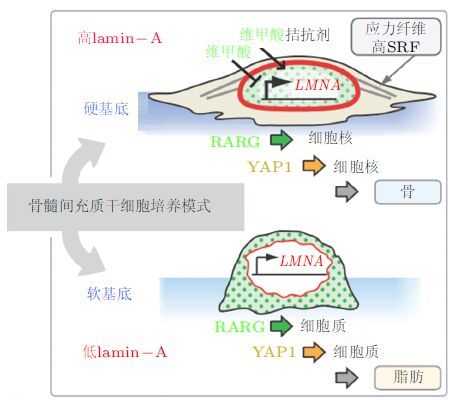
2.3.2.3 线粒体动力学影响干细胞特性及命运深入了解干细胞干性维持的调控机制是防止干细胞耗竭和衰老的关键所在.线粒体动力学能够通过调控核转录编程影响干细胞的自我更新以及命运决定为深入了解干细胞如何维持干性以及因干细胞异常导致的疾病的机制、并找到相应治疗方法提供了重要信息.为了找到线粒体结构变化导致干细胞损伤的原因,基因表达谱分析表明干细胞自我更新抑制分子Botch以及促进未成熟细胞发生分化的转录因子均存在异常表达.线粒体动力学发生改变能够影响干细胞命运决定而这一过程是通过驱动氧自由基介导的生理过程来实现的该过程会触发两种不同的转录编程,既可以抑制干细胞自我更新又会通过NRF-2介导的逆行信号途径促进干细胞分化( 图4)( Khacho et al. 2016). 同时线粒体动力学是影响干细胞自我更新和命运决定过程的上游调控因素并且这种调控是通过转录编程完成的.虽然线粒体形态学在组织发育和稳态维持的过程中发挥基础作用但是干细胞的线粒体如何对干细胞产生影响仍须深入了解.
|
| 图 4 线粒体动力学通过调控核转录程序影响干细胞命运( Khacho et al. 2016) |
干细胞感知力学刺激并对其产生应答是胚胎发育、干细胞生长与分化等生物学过程的重要调控因素并在力学信号转导(mechanotransduction)和组织内环境稳定的维持中具有重要作用.上述力学刺激既可以是细胞外环境作用于细胞上的外力(如压力、张力和流体切应力)也可以是细胞自身响应细胞外力学微环境变化所产生的细胞内主动力(如细胞牵引力).干细胞的力学信号转导常常涉及到细胞表型的改变其结构、功能以及命运与干细胞力学性质与力学行为密切相关.
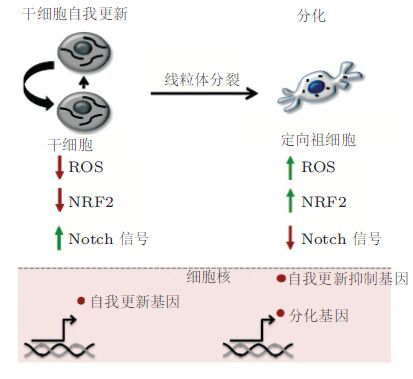
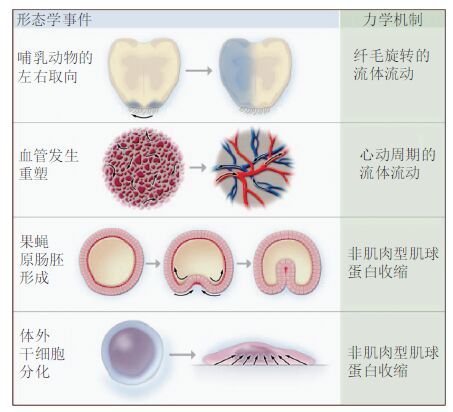
3.1.1 力学因素及力学信号在组织发育中的作用力学因素在胚胎发育、组织形成过程中发挥着重要作用( 图5)尤其影响组织形成特定形态的过程,即组织的形态建成.该过程涉及细胞数量、形态、大小的改变和由细胞迁移与重排引起的位置的改变包括诸如细胞夹层、邻细胞交换等细胞生物学过程并通过细胞间黏附而传递作用力、进而触发组织形态改变. 在上皮组织中每一上皮细胞的腔面受到细胞黏附和肌动蛋白-肌球蛋白网络的限制导致上皮细胞片层的弯曲;细胞位置的协同性改变可触发组织旋转而引起组织的变窄变长并实现多细胞组织内细胞增殖、定向分裂、凋亡/死亡的空间控制也能引起组织形态的整体改变. 斑马鱼是一种重要的模式动物在其原肠形成中,张力主导了胚层的组织结构;每个胚层的相邻祖细胞间的黏附力是不同的,外胚层的黏附力最小力学性质相似的祖细胞可以自组装成相应的胚层( Krieg et al. 2008).原肠期斑马鱼卵黄细胞中肌动蛋白-肌球蛋白系统会对包被层细胞产生拉力;这些肌动蛋白-肌球蛋白源自于还未被包被层覆盖的卵黄细胞表面并朝向包被层边缘通过紧密连接连接至卵黄细胞当与卵黄细胞摩擦而阻挡时产生对包被层边缘的拉力从而趋动了包被层向卵黄的扩展. 果蝇是另一种典型的模式生物在其原肠形成时,中胚层内陷是由中胚层细胞的协同顶部收缩驱动的;顶部的II型肌球蛋白结构动态性的反复增强并朝细胞顶部中间移动导致中胚层细胞顶部周期性收缩,最终导致II型肌球蛋白维持在高水平从而在细胞顶部稳定下来( Martin et al. 2009).组织扩展过程中伴随着肌动蛋白-肌球蛋白结构的形成在果蝇的背向闭合时侧面上皮向背部羊浆膜细胞运动以关闭胚胎上皮的背孔而背向闭合时上皮细胞前缘会特化为前缘细胞并形成大的超细胞肌动蛋白-肌球蛋白束( Harden 2002).这种超细胞丝与羊浆膜细胞顶部收缩产生的收缩力驱动了闭合过程的进行而侧向上皮产生的力则会抑制此过程( Hutson et al. 2003).
|
| 图 5 组织形态建成中的力学因素( Patwari & Lee 2008) |
除组织建成外,力学因素还可以调节干细胞分化和增殖.干细胞在较短的时间尺度上通过改变黏附和骨架来感知外力并影响组织的结构在较长的时间尺度上则通过影响干细胞的特化和分化来发挥力学调控作用.外力可来自于与胞外基质的相互作用和整体组织应力也可来自于组织内微流体的流动( Heisenberg & Bellaiche 2013)还可源自重力改变等极端条件. 举例说明:(1)组织压缩及其产生的应力在组织大小的调节和细胞命运特化中发挥着重要作用.果蝇成虫原基生长时,应力触发的信号保证了整个组织保持相同的增殖率从而控制组织大小; 其胚带延长引起的气孔原基(stomadeal primordium)压缩可以上调Twist基因的表达( Desprat et al. 2008).在小鼠中,肌肉收缩是维持关节祖细胞定向分化所必须的(Kahn et al.2009). 在脊椎动物中,牙齿形成时骨髓间充质干细胞(mesenchymal stem cells,MSC)聚集会产生力学压缩,进而影响细胞特化和分化( Mammoto et al. 2011).(2)组织间隙微流体运动所产生的作用力也可以影响细胞分化和胚胎和组织的模式.某些物种中左向流可使信号分子流向一侧并触发力学应答从而控制胚胎左右体轴的形成( Okada et al. 1999). 在胚胎血管生成时流体剪切作用是血管重建必需的. 在流动出现以前胚胎中胚层细胞首先形成"血岛"; 在心管开始发挥功能后流动开始出现并产生流体剪切力从而迅速将血管重塑为动脉和静脉分支( Pardanaud & Eichmann 2009, Patwari & Lee 2008).(3)重力在鸟类的早期胚胎发育中有重要作用,可决定径向对称(radial symmetry)的囊胚转换为双侧对称结构.当鸟卵通过生殖道时会在卵壳腺中以10~12 r/h的速率持续旋转20h,使得卵黄中较轻的成分转移至囊胚的一边被占据的囊胚端就变成了胚胎的后端,即原条形成起始的位置( Eyal-Giladi & Fabian 1980, Kochav & Eyal-Giladi 1971); 此时重力对囊胚的极性作用(方向指向地心)随着连续旋转而使其矢量方向积分趋向于零而减弱乃至消失表现模拟空间微重力环境的生物学效应(龙勉2014).
3.1.2 干细胞生长的力学微环境干细胞的发育受多种内在机制和微环境因素的影响近年来随着研究的深入,从干细胞的三维培养到干细胞的定向分化人们越来越意识到干细胞周围微环境---壁龛(stem cell niche)对干细胞的生长和分化的重要影响( Conway & Schaffer 2012). 干细胞作为一种具有高分化潜能和自我更新能力的特殊细胞在体内一直处于生物体组织的包围中周围组织/细胞的力学性质也会影响到干细胞的行为.干细胞为了维持分裂和分化和潜能,需要进行精细的调控壁龛的存在对此过程起着重要的作用( 图6). 在体内干细胞周围微环境是指在组织中干细胞在驻留位置上增殖、自我更新并分化为组织细胞时其周围的所有环境因素,包括可溶的生物大分子、固态的ECM与支撑细胞以及干细胞本身周围的力学环境和理化环境等.干细胞自我更新与定向分化之间的选择必须进行严格的调控分化过多则导致干细胞群很快消耗殆尽而过度自我更新则可能导致干细胞数量过度增加、易发二次突变并最终导致肿瘤发生.干细胞如何自主或被动的调控更新与分化的平衡除了需要考察细胞自身的内在调控机制同时还需关注其所处壁龛内力学微环境的调控作用.
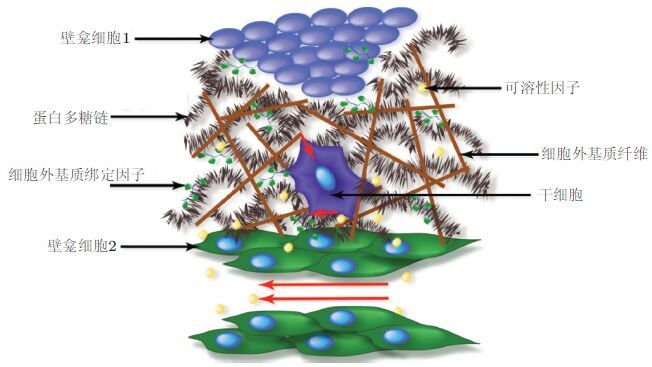
|
| 图 6 干细胞"壁龛"中的力学作用模式( Conway & Schaffer 2012) |
ESC是研究胚胎发育和原肠形成等过程的理想模型. 长期以来生物学家重点考察生物化学因子对干细胞分化的影响但力学和物理因素如何调控ESC的生长并与生物化学机制协同作用却知之甚少. 胚胎是从卵细胞受精开始经过细胞分裂和持续性的结构重建形成了特定的形状. 实际上作用力从一开始便调节着这一过程可影响卵细胞的激活、细胞的不对称分裂和胚胎极性的形成.发育过程中的第一个胞内信号就是由力学因素激活的,鲎( Limulus polyphemus)的精子可将弹力储存在叫做顶体的细胞骨架结构中然后通过蜷缩素-钙调蛋白复合体交联胞内微丝蛋白而引发构象改变最终产生驱动力释放精子并穿透卵子的物理屏障( Sanders et al. 1996, Shin et al. 2007).细胞可主动产生张力和收缩力并传递给相邻的细胞和胞外环境.在ECM沉积和组织稳定前,胚胎的行为与由表面张力支配的液体类似( Foty & Steinberg 2005);而在原肠形成时细胞肌球蛋白的重定位与收缩可在细胞外表面产生拉力( Patwari & Lee 2008). 实际上细胞形态的力学稳定性要求细胞骨架网络处于力学平衡状态通过平衡微丝、微管和胞外基质之间的作用力使得细胞内产生"预应力"、从而稳定了细胞形态并调控细胞命运( Harris et al. 1980, Ingber 2006). 生长是细胞主动产生压力的来源;细胞的增殖、细胞体积的增大、ECM的产生等因素对周围环境施加了径向的压力可见于肿瘤生长和卵细胞由卵巢向子宫运动等过程( Chen et al. 2001, Horner & Wolfner 2008). 此外,细胞除了主动产生应力以外还会被动地受到外部微环境施加的张力、压力或流体剪切力的作用如早期胚胎发育中子宫壁对胚胎施加的作用力、周围细胞施加对干细胞施加的张力和压力( Henderson & Cater 2002). 上述力学微环境的改变,可触发细胞的应答影响细胞内部结构和功能改变,进而影响细胞生长和分化( Rosowski et al. 2015, Wang et al. 2014). 除作用力本身的影响外干细胞壁龛的力学环境也可调控其命运如不同的ECM硬度可影响ESC的早期分化;不同尺寸的纤维丝所形成的不规则的表面模式结构可促使ESC向不同的方向分化( Liang et al. 2016);软ECM可使MSC分化为神经细胞、而硬ECM则促使MSC骨向分化提示力学微环境对干细胞的生物学行为有重要影响( Engler et al. 2006).尽管近年来有关力学微环境对干细胞分化的调控方面的研究发展迅速越来越多的证据表明力学因素也可通过黏附斑、离子通道等力学感受器激活胞内信号通路进而影响其分化、迁移等过程,然而目前对胚胎干细胞力学感受机制大多还是唯象的,依赖于具体的实验条件其力学调控方式及胞内信号转导机制还不清楚同时干细胞对力学刺激做出应答的整体规律还需深入研究.
3.2 力学因素诱导干细胞分化干细胞在组织修复、器官再造和再生医学等方面的应用前景非常广阔通过适宜的培养条件将干细胞分化为特定组织器官是临床应用的基础( Cherbuin et al. 2015). 近年来,随着力学微环境决定干细胞命运的证据逐渐增多对干细胞体外分化影响的研究已从化学和生物学方面拓展至力学刺激对干细胞分化的作用.干细胞的体外力学和物理微环境及干细胞相互作用的力学刺激可模拟干细胞体内生长的微环境改变干细胞的形状、大小、排列方向、分化状态及干细胞表面标记物表达并影响干细胞的谱系分化( Engler et al. 2006, Li et al. 2013,Lü et al. 2014, Poh et al. 2014)其中力学载荷(包括剪应力、牵张力、压应力)、ECM硬度、培养基底表面拓扑结构、形状控制等四类力学因素对干细胞分化的影响机制是目前研究的热点.在胚胎发育过程中,干细胞分化受到黏附力的影响而分化成不同器官表明ESC能感应外力,并表现出相应的分化差异.成体干细胞也可对外力作出反应,在牵张力作用下向平滑肌细胞分化.与其他细胞类似干细胞的力学感知、传递和转导整合了不同信号的级联反应但应力传导及最终导致力学信号转化为生物化学信号的特异通路却不完全清楚.目前,干细胞对力学微环境的响应通过力学传递链(ECM→力学感受器(整合素/ G蛋白偶联受体/离子通道)→细胞骨架→黏附斑)和力学转导链(磷酸化→胞内力学通路(小G蛋白/蛋白激酶))将力学信号转化为生物化学信号并最终影响干细胞的表观遗传效应(核内骨架)的理论已逐渐被接受干细胞对外力的感知主要围绕力学敏感通道、生长因子介导的应力感受、蛋白形变介导的应力感受进行而胞内力学信号的转化研究则主要围绕细胞黏附介导的信号通路、MAPK信号通路、细胞骨架进行.然而由于干细胞种类的多样性及分化方向和过程的复杂性以及不同种类力学因素刺激的独特性等因素决定了干细胞的应答及响应过程的多样性这就迫切要求发展专门的力学加载方法、装置或实验方法、在体外考察干细胞的定向分化及相关分子机制.此外,既往的力学加载装置多是二维体系而三维环境则更接近干细胞的在体环境通常分为模拟体内力学环境和体外力学加载两大类.前者主要包括ECM硬度和拓扑、流动剪切、静水压、周向应力、基底拉伸等而后者则包括三维细胞流动/旋转培养、离心力场法、气体加压、声波刺激、微光束辐射等.另外还包括微管吸吮、微悬臂梁、磁扭转和光镊操控等适应于研究单个干细胞力学应答的技术.本节重点论述细胞体内生长的力学微环境---壁龛---对干细胞生物学行为的影响.
3.2.1 干细胞生长的力学微环境对其分化的影响干细胞分化的命运不但取决于细胞与生物化学信号之间的相互作用而且还受到细胞所处力学微环境的影响. 例如胶原基质的硬度不仅可单独影响MSC的分化方向、而且其影响还可与基于分化诱导因子的生物化学作用正向协同( Engler et al. 2006); 又如具有不同表面拓扑结构的水凝胶可显著改变MSC的铺展过程从而有可能影响其分化潜能和方向. 因此通过改变干细胞生长的力学微环境(如基底硬度和拓扑)就有可能调控干细胞的分化方向.如果利用微制作技术(microfabricating)等手段在不同硬度的基底上实现准三维微拓扑结构从而对干细胞空间形态实现精确控制那么就可能在模拟生理环境下对体外培养干细胞的三维、动态生长与分化过程进行定量认识和分析.这一新思路不仅可以深化对干细胞分化基本规律的认识(如ECM硬度和基底拓扑结构的协同作用、细胞和基质的黏附和铺展动力学、三维力学加载对干细胞增殖与分化潜能的影响)还可积极推动干细胞治疗与再生医学、人工组织器官构建与康复工程等应用领域的发展成为目前干细胞力学-生物学耦合研究的重点.干细胞可分别感知基质硬度和基底拓扑结构的变化并通过从胞外至胞内的信号传递、转导、应答过程而达到新的生物学稳态.
3.2.1.1 基底硬度对干细胞生物学行为的影响目前,细胞响应基底硬度的研究之所以受到广泛关注主要原因如下:(1)在生理条件下体内细胞均锚定于硬度不同的组织基底上其生物学功能具有的硬度特异性;(2)在病理条件下某些疾病的发生、发展和转移与基底硬度密切相关正如不少肿瘤细胞喜好转移至较硬的基底上;(3)在离体条件下通过调控材料基底(如玻璃)和生物基质(如ECM)的硬度发现了大量新的生物学现象和过程对认识体内的病理生理过程具有指导意义和借鉴作用也可解释诸多与细胞力学响应相关的病理生理现象.基底硬度对细胞生物学行为的影响非常广泛从细胞迁移、取向定位、到生长增殖和分化表型. 目前用于构建基底硬度的高分子材料包括聚丙烯酰胺(polyacrylamidePA)、聚苯乙烯(polystyrenePS)、聚二甲基硅氧烷(polydimethylsiloxanePDMS)、胶原(collagen)、琼脂糖凝胶(agarose gel)和硅胶(silica gel)等,具有不同的硬度范围和硬度调节能力.其中PA胶因其本身的三维网络结构、亲水性,且不易受微生物腐蚀和酶解理化性质稳定,是模拟体内细胞生长的理想基质,应用最广.通过控制丙烯酰胺与双丙烯酰胺的比例可构建硬度范围从10 2 Pa到10 2 kPa的凝胶可真实反映体内细胞生存的硬度.针对其他亲水性差、细胞吸附力弱的基底材料则需要进行必要的表面改性和表面修饰(如裱衬ECM蛋白)以提高表面生物活性、强化细胞在材料上的黏附进而促进细胞的增殖和分化.
基底硬度在干细胞定向分化中具有独特作用.基底硬度通过影响细胞黏附调节细胞内力学平衡进而影响细胞形态、黏着斑装配、骨架状态、细胞间连接方式等多种行为对干细胞表型的维持至关重要,甚至决定着干细胞分化的命运( Chowdhury et al. 2010b).最早的研究发现将MSC置于类似于脑组织硬度的基质时可分化为神经细胞、置于类似于肌肉组织硬度的基质时可分化为肌细胞、而置于类似于骨胶原硬度的基质上则可分化为成骨细胞提示干细胞的在不同硬度的基底上越容易向更接近组织硬度的特异组织细胞分化并且力学因素导致的分化与生物化学因子诱导的分化呈正相关协同作用、并具有不同的效应时程( Engler et al. 2006). ESC在不同硬度的胶原、Matrigel和琼脂糖凝胶上分别表现出向不同世系分化的特征提示ECM的黏附特性是调控ESC分化的主要因素( Zhang W et al. 2016).据此,人们提出一个全新的观点: 软基底更易于维持ESC的干性可在体外长时间维持干细胞表型而无需生物化学因子的存在( Chowdhury et al. 2010a, Lü et al. 2014). 基底硬度除影响干细胞的分化方向外还能维持已分化细胞的生长功能. 例如,关节软骨细胞在硬度为4kPa的基底比在其他硬度基底上更圆、表达更多的II型胶原蛋白和典型的关节组织蛋白聚糖;在可调节硬度的PA水凝胶上培养小鼠ESC分化的类肝细胞在越软的基底上分泌更多的白蛋白、更低的尿素.最新构建的一种硬度可调的新型干细胞支架在无需改变其化学成分条件下干细胞对基底施加的主动力与其分化有关( Fu et al. 2010).在生物力学机理层面(干)细胞对基质硬度的不同响应模式被认为与细胞骨架收缩产生的应变能和基底与细胞作用的界面能相关表面体系总自由能取决于基底硬度与细胞硬度比值,二者相等时能量最小从而为细胞更青睐于与自身硬度相当的基底环境提供了一种合理的力学解释.同时,黏附于基底上细胞主动产生的牵引力作用会在基底上形成应力梯度其影响随基底硬度的增大而减弱而中等硬度基底上交替接触与分离的两个细胞始终活动在对方牵引力的影响范围之内提示力学因素是细胞与基底作用的重要调控因素.在骨架重构和分子调控方面细胞形态、胞内骨架和黏着斑组装均直接受到基底硬度的调节:在硬基底上细胞铺展面积大、应力纤维粗而呈张紧状、黏着斑紧密且组装完善;而在软基底上细胞行为截然相反铺展面积小并趋近于圆形、细胞骨架和黏着斑组装均不够完善( Discher et al. 2005).
3.2.1.2 基底拓扑结构对干细胞生物学行为的影响干细胞与其生存微环境之间的直接/间接作用影响干细胞的命运在维持干细胞的干性、调控干细胞分化等方面发挥重要作用.基底表面拓扑结构是除基底硬度外另一个重要的微环境因素因其在对干细胞壁龛特性的重要调控作用而在影响乃至决定着干细胞分化的命运.基底拓扑结构对细胞行为的影响是普遍的生物学过程可追溯至20个世纪有关蜘蛛网拓扑结构可影响细胞的运动取向并通过"接触诱导"(contact guidance)现象感知与响应基底拓扑结构、生物材料表面纳米形貌进而影响细胞行为的研究.这一现象不仅在构建具有高度取向的细胞群体中具有潜在应用(如在神经、肌键的修复和再生等)而且也可被用于控制材料表面与细胞及组织的相互作用以达到实现细胞特定生理响应的目的. 正常人体组织具有有序结构细胞在体内呈现规则性、有序化的排列细胞体内生长的微环境具有微(纳)尺度、表面拓扑等结构特征.近年来随着微制作技术的不断深入有关基底拓扑结构(包括有序排列的突起或凹陷特定的尺寸、分布密度和几何形状等)影响细胞行为的研究迅速增多通过微加工工艺可在不同基材上制作出结构、尺寸和形状各异的图案或表面并成功应用于多种细胞(干细胞、成纤维细胞、成骨细胞、上皮细胞、成肌细胞等)的生物学过程和生理与功能的研究并逐渐形成一个热点方向.
干细胞生物学行为强烈依赖于基底表面的拓扑结构. 在细胞响应层面MSC对微环境的拓扑形貌变化非常敏感不同拓扑结构对MSC的骨向及神经向分化具有重要影响( Dalby et al. 2007, Li et al. 2013),甚至可对小到5 nm 的形貌变化产生响应:沟槽结构引发的"接触诱导"现象显著促进干细胞神经向分化并可有效触发干细胞的极化,调节细胞膜及细胞骨架的排列方式导致细胞骨架的张力变化从而影响细胞的形态. 在拓扑结构层面无显著突凹结构的纳米点表面可抑制细胞的黏附而导致分化而突起或凹陷显著的结构能促进黏附细胞的形态变化、张力纤维的增多加速细胞的铺展;进一步增大结构可使整合素的聚集和黏着斑组装的数量明显增多进而影响细胞骨架的重组和细胞核的形状.干细胞不仅能识别表面结构的形状,甚至可感受表面结构的尺度变化.细胞形态和取向极性对于干细胞而言绝不仅仅意味着形状的改变而且还决定着其内部的力学平衡、尤其是对细胞骨架(应力纤维)的维持和动态调控与其增殖、分化和凋亡过程之间密切相关对干细胞的分化过程有着深刻的影响.培养于同一生物化学环境(培养液)的干细胞随培养模具形状的不同而导致分化方向受到明显影响也为基于不同形状和拓扑结构的干细胞分化、并构建各种可供病人移植的器官组织提供了新的思路和可能.因此,在认识干细胞定向分化规律时基底表面拓扑结构的作用和影响是一个不可忽略的因素可以有目的地构建特定的表面拓扑结构,以实现特定的分化方向.相对于大尺度的二维表面和三维支架结构微(纳)米尺度的拓扑结构与体内干细胞生长的微环境具有更为相近的尺度这不仅使细胞生物学家能从新的视角研究细胞与其微环境相互作用机理而且有望通过构建基底和表面性质可控的功能化生物材料实现对单个细胞、细胞网络、乃至体外构建组织/器官的生物学调控发展生物传感器设计和基于细胞筛选药物的新方法和新技术.尽管近年来基底拓扑结构对干细胞生物学行为的影响开始受到关注然而影响基底拓扑结构的因素很多、所导致的细胞生物学响应也较复杂还有待于进一步深入研究.
3.2.1.3 ECM对干细胞分化的影响ECM是由细胞合成并分泌到胞外、分布在细胞表面或细胞之间的大分子构成复杂的网架结构支持并连接组织结构、调节组织的发生和细胞的生理活动并调控细胞的黏附、铺展、迁移、增殖、分化和凋亡等多种行为和功能( Discher 2005, Engler et al. 2006).ECM以蛋白聚糖和结构蛋白(如胶原蛋白)为基本骨架在细胞表面形成纤维网状复合物通过纤维连接蛋白(如纤粘连蛋白或层粘连蛋白等)直接与细胞表面受体(如跨细胞膜的整合素蛋白)连接并与细胞内的骨架蛋白网络相连,从而将ECM与细胞内连成了一个整体.ECM的力学和物理性质(特别是硬度或拓扑)不仅可以调控干细胞的锚定还能影响干细胞的分化. 将活化域缺失的β1-整合素突变体转染干细胞可导致其与IV型胶原的黏附显著降低、MAPK酶活性显著减弱、克隆形成能力下降、增殖潜能丧失、很快进入终末分化;而上调野生型β1-整合素的表达或者激活MAPK则可恢复黏附特性及增殖潜能,说明ECM -整合素-MAPK信号通路可以调节干细胞的分化. 此外在体外分化体系的基底上包被ECM有利于从干细胞诱导分化的肝细胞保持其表型并且在特定细胞因子和生长因子的刺激下ECM还能刺激成体干细胞和ESC向肝细胞分化( Tuleuova et al. 2010). 将多种ECM成分单独或耦合包被在培养基底发现只有特定种类的成分才能对人类ESC向内胚层方向定向分化有作用而其余则对分化不起作用甚至抑制分化( Brafman et al. 2013).从某种意义上讲,细胞锚着的ECM就是细胞骨架的延伸提供了ECM与细胞骨架之间的物理连接和调控关联使两者处于不断重构或重组中并调控细胞自身刚度以匹配其锚着基底的力学和物理性质动态变化.在某些疾病中,ECM理化性质的改变既是病程发展的结果也可能是疾病发生、发展的诱因(如肝纤维化、肝硬化所伴随的肝组织ECM硬度近10倍的改变).为了模拟生理条件下细胞的生存微环境细胞外基质在组织工程材料的构建中已逐渐广泛使用.可在体外构建基于人体组织硬度差异( 图7)的ECM机制利用其不同的理化性质影响细胞(尤其是干细胞)的多种生物学行为.胚胎干细胞是组织再生与细胞治疗的理想种子细胞若将ECM广泛应用于诱导胚胎干细胞向功能性肝脏、软骨、神经、肌肉和骨等组织方向分化可为新型生物医学材料的设计和应用提供科学根据.
|
| 图 7 硬度范围与相应的组织类型( Buxboim et al. 2010) |
基底硬度或拓扑结构不仅可分别调控干细胞的生物学功能而且在生理微环境中两者往往是耦合在一起、协同调控干细胞的定向分化和干性维持.以对硬度与拓扑影响MSC定向分化为例生长在不同硬度基底的MSC会向不同的方向分化:在低刚度基底上MSC铺展面积收缩,伪足增加,呈纤细的放射状从形态学和特异蛋白表达上都发现其接近类神经元细胞;而高刚度基底时铺展面积扩大,边缘变薄蛋白表达检测发现其接近成骨细胞; 而在中间刚度,形态为成纤维状接近肌肉细胞( Engler et al. 2006).上述结果表明MSC能感受周围组织的硬度,在铺展时会产生拉伸力骨架和基底之间类似于串联的弹簧基底主要通过影响了细胞骨架张力发挥作用进而使自身形态发生相应的改变,并产生相应分化.重点关注与细胞尺度相当的微拓扑结构(平面、沟槽、六边形凹槽)可使细胞能够"立体"铺展于更加接近生理状态的基底上并进一步考察特定硬度基底对MSC的铺展、生长、分化及骨架分布的影响:MSC在常规培养皿上呈三角或长梭形,铺展面积最大;在平面PDMS(polydimethylsiloxane聚二甲基硅氧烷)基底上则呈现较狭长的长梭形;在沟槽结构PDMS基底上呈现更为狭长的长梭形,铺展面积最小细胞沿沟槽方向生长;在六边形凹槽的PDMS基底上细胞铺展形状虽然与在常规培养皿上的对照组没有明显区别但细胞骨架的排布方向却受到了影响.微拓扑结构对细胞骨架蛋白actin、vimentin的表达和分布形式及vinculin的表达也产生了不同程度的影响.在沟槽或六边形凹槽基底上细胞伸出的突起或伪足倾向于贴附于槽的嵴部( 图8(a)). 进一步使用与细胞本身尺度相当的、具有不同表面拓扑结构特征的基底(平面、沟槽、六边形凹槽)对MSC的铺展、生长、骨架分布及分化进行研究发现:MSC在常规培养皿上呈三角或长梭形,铺展面积最大;在平面PDMS基底上呈现较狭长的长梭形;在沟槽结构PDMS基底上呈现更为狭长的长梭形,铺展面积最小细胞沿沟槽方向生长;在六边形凹槽的PDMS基底上细胞铺展形状虽然与在常规培养皿上的对照组没有明显区别但影响细胞骨架蛋白的排布---在沟槽或六边形凹槽基底上细胞伸出的突起或伪足倾向于贴附于槽的嵴部.平面PDMS基底较常规培养皿对MSC的增殖有抑制作用但拓扑结构的PDMS基底上MSC的增殖与常规培养皿中细胞相当.对成骨方向分化指标碱性磷酸酶(alkaline phosphatase,ALP)的分析表明向成骨诱导的MSC在PDMS基底上ALP表达均有所降低且在沟槽拓扑结构的PDMS基底上尤为显著与使用茜素红染色表征的成骨细胞矿化结果一致.以上研究表明基底拓扑结构可以调节MSC的增殖和分化过程其机制与拓扑结构引起的细胞铺展状态及细胞骨架变化相关.在基底硬度和拓扑结构耦合效应方面采用生物相容性好的聚丙烯酰胺水凝胶(polyacrylamide hydrophilic gelPA gel)制作弹性可调拓扑水凝胶基底考察细胞的增殖和分化等行为比较基底硬度、拓扑结构形状及特征尺寸三因素对MSC生物学行为的影响可确定影响干细胞生物学行为的重要影响因素( 图8(b)):(1)细胞增殖主要是基底硬度或拓扑结构的特征尺寸单一因素的影响占主导地位;(2)拓扑结构形状或基底硬度因素影响细胞形态;(3)基底硬度诱导骨髓间充质干细胞分化;(4)单一因素对骨架重组似乎无明显作用;(5)多因素耦合的作用主要体现在拓扑形状与特征尺寸对微丝和中间纤维的调控( Li et al. 2013).通过综合考察硬度、拓扑形状和特征尺寸3种基底力学因素对MSC生物学功能影响的权重确定何种力学因素影响MSC的哪一种功能可为深化体内干细胞壁龛及体外复制其结构和功能的认识、并应用于组织修复和再生医学提供科学基础.
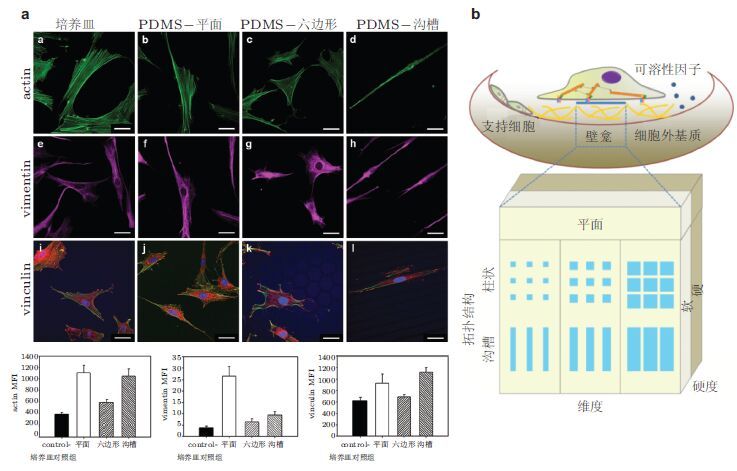
|
| 图 8 基底硬度耦合拓扑结构对MSC的影响.(a)MSC在不同基底上的形态、细胞骨架及黏附斑蛋白的表达,(b)结构模式示意图 |
除定向分化外,干性维持是干细胞另一种反向、但重要的功能与认识胚胎发育机理、拓展再生医学应用等具有重要意义.以硬度与拓扑耦合维持ESC干性为例小鼠ESC能在不同硬度耦合拓扑结构的PA胶表面正常生长并传代软胶(6.1 kPa)更利于其黏附和增殖,同时形成更为紧密的克隆;生长在软胶表面的小鼠ESC较硬胶(46.7 kPa)能更好地维持干性( 图9).在沟槽、六边形及四方柱状基底生长的小鼠ESC能沿着不同拓扑结构生长并能形成与基底结构相一致的特定三维结构其中以六边形结构的影响最为明显. 值得注意的是软胶耦合六边形结构的拓扑基底较单纯的软胶或六边形基底能更好地维持干性.不同硬度耦合拓扑结构基底对小鼠ESC干性维持的调节能力不同(Lü et al. 2014).
综上,基底硬度耦合拓扑结构能更好调控干细胞的命运为未来体内或体外基底微环境力学调控干细胞的干性维持和定向分化等生物学特性研究奠定基础并为工程化组织构建和临床医学应用提供依据.
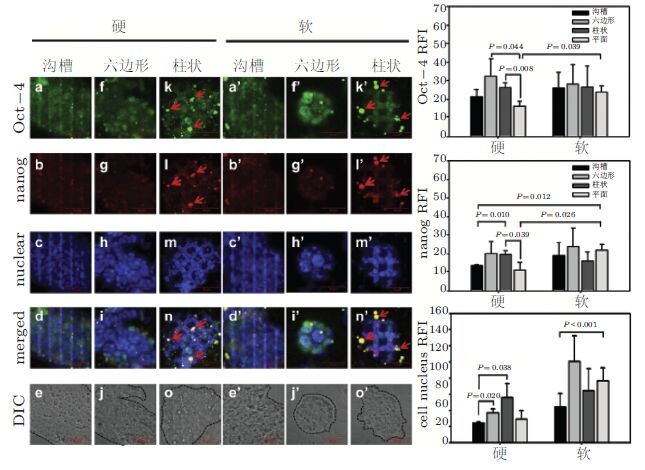
|
| 图 9 不同基底硬度耦合拓扑结构基底对胚胎干细胞干性的影响(Lü et al. 2014) |
(干)细胞自身无论是感受基底硬度还是拓扑环境的变化并完成相应的调控过程其动力学过程与力敏感信号通路密不可分. 例如整合素亚基的变构和黏着斑蛋白以及其他维持细胞结构力学稳定性的相关蛋白均可感受外界力学微环境的变化而基底硬度和拓扑结构的改变可引起细胞-基质牵拉等效应导致位于黏附位点的整合素被激活通过黏着斑复合物中多种蛋白完成力学信号"从外向内"转导的过程继而通过细胞骨架蛋白的胞内端与相关蛋白的相互作用将信号传递至细胞核内最终通过核内表观遗传学改变决定细胞的生长、分化或凋亡或者通过"从内向外"途径调控细胞的铺展和迁移等行为(Li et al.2011). 力学刺激也可调控组织发育和干细胞分化.压缩可以诱导转录因子Twist的表达进而影响果蝇的发育( Farge 2003)而牵拉可通过影响转录因子MAL的核移位来调控果蝇的发育.在胚胎肺间充质细胞中,牵拉则是通过染色质重建来发挥作用的( Jakkaraju et al. 2005),细胞从圆形变成梭形可促使向肌肉细胞分化(Yang et al.1999),同时牵拉还可通过调节EFG分泌和β1整合素表达影响表皮干细胞的迁移行为(Lü et al. 2013,2016);ESC存在过渡态、始发态等特殊状态、具有拉胀性当受到牵拉或者压缩时可以改变染色质状态从而对力学刺激做出应答( Chalut et al. 2012, Pagliara et al. 2014).牵拉、压缩和微拓扑会影响人类MSC细胞核的形状和组蛋白去乙酰化酶(HDAC)的活性( Li et al. 2011),而流体剪切刺激下内皮细胞中HDAC活性也受到影响( Lee et al. 2012).
尽管细胞形状、小G蛋白酶(RhoA)信号通路和细胞骨架张力能使干细胞对力学刺激做出应答但尚不清楚上述因子是否会收敛于单个力学敏感的细胞组分或分子.FAC是胞内一种可能的力学敏感蛋白复合物结构可将基底上的整合素锚定于微丝骨架并可能介导张力依赖性的力学信号转导.细胞产生的牵张力在黏附斑处被传导到胞外基质( Balaban et al. 2001, Tan et al. 2003)所产生应力进而调节黏附斑的装配和解聚(Chrzanowska-Wodnicka et al.1996). 此外,FAC还是信号分子集散中心参与关键的力学敏感激酶的招募和激活、并调节下游转录因子的核-细胞质输运( Miyamoto et al. 1995, Nix & Beckerle 1997).尽管黏附斑是细胞中已鉴定的力学感受器之一( Ingber 2006)其他可能的力学感受器还包括膜脂微结构域曲率的改变(Rizzo et al.1998)、G蛋白偶联受体( Chachisvilis et al. 2006)力学敏感的离子通道( Sukharev & Corey 2004)细胞骨架蛋白的构象改变( Yasuhiro et al. 2006)核纤层与核变形( Lammerding et al. 2005),以及原发性纤毛( Resnick & Hopfer 2007)等. 图10对细胞力学信号转导过程进行了总结.

|
| 图 10 细胞力学信号转导的媒介( Ingber 2006) |
干细胞的形态改变、增殖生长及命运决定均受生理力学微环境的影响.干细胞能够感知微小力学变化并将其转化成生物化学信号进而通过细胞骨架、胞内力学敏感蛋白信号通路产生一系列分子水平的应答反应最终导致基因差异表达、引起表观遗传学的变化.外力在胚胎发育过程中发挥着重要作用未分化细胞能感知周围环境的作用力并根据其刺激的不同而向不同的方向分化胚胎干细胞应答外力的基本过程对于认识胚胎早期发育和分化机制、研发克隆和再生药物等均有重要意义.
4.1.1 细胞刚度主导力学信号的感知与传递干细胞对力学刺激的应答机制与其自身的力学性质密切相关细胞刚度是其响应力学刺激的关键. 细胞刚度体现其内在特性控制着干细胞在生理环境和体外培养环境中对外力的响应. 细胞刚度可随干细胞形态和细胞骨架组分的改变而变化刚度越小则其硬度越低. 在多细胞生物发育过程中细胞刚度与细胞类型和分化程度密切相关其生理功能与细胞力学的敏感性具有一致性如早期胚胎细胞在分裂和分化过程中硬度变大以保护机体免受外力损伤这在进化上是有优势的; 未受精卵子的硬度约为10 PaESC的硬度约为500 Pa,大脑神经细胞的硬度约为100~500 Pa肌肉细胞的硬度约为1~5 kPa.
细胞在运动、分裂等正常生命活动中会产生拉伸力或收缩力细胞质的边缘是决定细胞力学特性的主要部位,其主要成分是F-肌动蛋白可通过肌动蛋白结合蛋白的交联而形成各向同性的网络结构或平行的束状结构呈双股螺旋状,直径为8 nm. 随着肌动蛋白聚合和交联的变化细胞骨架结构也发生变化,进而非线性地调节细胞刚度所以肌动蛋白对维持细胞形态、运动、增殖、分化、胞内物质输运等均具有重要作用. 肌动蛋白动态聚合控制细胞突出和铺展过程使其在应力诱导下的形状改变与骨架结构的改变具有一致性. 在相同硬度基底上,小鼠ESC的刚度比由其分化的组织细胞低7倍二者细胞刚度与它们的F-肌动蛋白密度呈负相关,说明F-肌动蛋白是决定细胞刚度的重要因素( Chowdhury et al. 2010a). 人类间充质干细胞与分化所得成骨细胞的细胞刚度和膜力学具有明显差异主要也是由于两种细胞的肌动蛋白结构不同在干细胞发育为成骨细胞的过程中不断发生肌动蛋白的解聚和重组从而导致细胞刚度的改变( Titushkin & Cho 2007).
4.1.2 ECMECM是由动物细胞合成并分泌到胞外、分布在细胞表面或细胞之间的大分子通过构成复杂的网架结构,支持并连接组织结构、调节组织的发生和细胞的生理活动. ECM弹性是细胞所处微环境的重要组成部分其力学性质是一种持续存在的生理力学刺激与细胞因子、生物化学诱导剂等为人熟知的影响因素相比,这种力学刺激持久、稳定对干细胞的功能及命运决定过程具有重要的调控作用. 因此细胞响应ECM弹性的特性为解决组织工程化构建与再生医学中种子细胞的诱导分化、表型维持等问题提供了新的线索. 细胞感受ECM弹性的过程就是细胞将感受到的力学刺激转化为生物化学信息的过程称为细胞力学信号转导.
目前已知的能够将胞外力学信号传递到胞内的蛋白质分子主要有位于细胞膜表面的整合素、黏着斑中的相关蛋白和力学敏感的离子通道.细胞通过黏着斑的整合素分子与ECM黏附在力学刺激作用下可触发黏着斑相关结构蛋白的形变、启动力学敏感信号分子在细胞内的运输等一系列分子事件.整合素作为一种跨膜蛋白,是一种由α和β两个亚基构成的异质二聚体蛋白起到将胞外力学信号转变为胞内化学信号的作用. 在细胞内部大部分整合素与肌动蛋白纤维相连,如整合素α 6 β 4与中间纤维相连接、整合素α 5 β 1则与肌球蛋白相连; 在细胞外整合素可与胶原蛋白、纤连蛋白、层粘连蛋白等细胞外基质蛋白相连.整合素在外界力学刺激下可发生构象改变,由低活化态激活为高活化态使其与配体的结合力和作用寿命均发生改变( Friedland et al. 2009)而位于黏着斑中的整合素是活化的整合素( Hoffman et al. 2011)与包括踝蛋白(talin)、黏着斑蛋白(vinculin)、桩蛋白(paxillin)、黏着斑激酶(focal adhesion kinaseFAK)、P130Cas、Src等其他结构蛋白一起构成连接ECM与细胞骨架的桥梁( 图11). 在组成黏着斑的蛋白中,整合素的胞外部分与ECM分子结合而其胞内部分则可募集多种结构蛋白、并与细胞骨架相连是细胞感知力学环境的关键分子,位于多种力学信号转导通路的上游.在力学刺激下上述黏着斑的组成蛋白能够发生诸如构象改变、亚细胞定位改变、磷酸化位点暴露等多种响应从而起到从细胞外向细胞内传递力学信号的作用. 比如当受到循环牵张刺激时黏着斑中的FAK、桩蛋白、p130的酪氨酸位点会发生磷酸化引发c-Src的活化,从而触发力学信号传导等. 在活细胞中黏着斑的恢复以及黏着斑之间力的传递对受力状态下黏着斑的稳定性是必要的( Grashoff et al. 2010). 同时,ECM弹性与黏着斑的大小成正比( Weis 2004)较软的ECM能够促进与I型胶原结合的整合素的内吞主要由小窝蛋白介导的,导致BMP-SMAD信号通路的改变; 在较硬的ECM上整合素可启动β-catenin/Wnt正反馈调节环进而对细胞的分化、迁移等功能产生影响( Du et al. 2011). 因此整合素活性及其信号转导的力学调控方式可能是决定干细胞命运的关键机制之一.

|
| 图 11 黏着斑复合物结构示意图( Mitra et al. 2005) |
细胞骨架是胞内力学信号传递的关键蛋白质分子由微丝、微管和中间纤维等构成,形成复杂而有序的网络结构在维持细胞形状的同时参与力学信号传递的过程.当细胞局部受到力学刺激时细胞骨架能够将力学信号从受刺激部位迅速传递到细胞的其他部位.与生化信号(主要依赖于扩散方式进行传播)相比力学信号在通过细胞骨架进行传递时具有高速和定向的特点,因此细胞骨架在响应外界力学刺激中具有不容忽视的特殊作用.流体剪切力可以刺激细胞顶部而中间纤维却在细胞与细胞、细胞与ECM的黏附区域变形最大( Matthews et al. 2006).F-肌动蛋白丝在外力诱导干细胞增殖、分化和变形过程中发挥功能采用磁珠对细胞施加定点的力学刺激同样能够通过F-肌动蛋白等细胞骨架成分在细胞的远端产生影响( Na et al. 2008,Wang & Stamenović,2000).将MSC分别培养在三维蚕丝蛋白--壳聚糖组织工程支架和二维玻片上前者对应的F-肌动蛋白的含量比后者高43%(Sansores-Garcia et al.2011). 因此,细胞骨架可以称为力学信号的传递器在细胞内传递力学刺激中起到重要作用( Altman et al. 2010).
肌球蛋白是另一类重要的力学信号传递分子,其中非肌肉型肌球蛋白II(Myosin II)具有调节细胞收缩的作用并对胚胎早期发育、外力调控干细胞命运至关重要. 将人类ESC消化制成单细胞悬液,在接种于培养皿前短暂抑制Myosin II可改善人类ESC的活性增强细胞在ECM底物中粘附和扩展的能力,说明Myosin II依赖的收缩力是降低人ESC成活的主要原因( Watanabe et al. 2007)因为Myosin II的活化对维持人类ESC的长期自我更新是必需的( Li D et al. 2010). 当对小鼠ESC细胞施加特定应力后,细胞边缘Myosin II磷酸化程度提高40\%、牵引力增大50\%,而抑制Myosin II功能后小鼠ESC完全没有发生应力诱导的铺展表明在小鼠ESC细胞中Myosin II的牵引力的产生会导致应力所致的铺展( Chowdhury et al. 2010a).此外,钙黏素(E-cadherin)是Myosin II作用于人类ESC的关键靶分子.体外沉默Myosin II基因可导致人类ESC细胞间连接紊乱、细胞与ECM间作用力降低;而通过外源性高表达E-cadherin则可恢复ESC的相应功能.在果蝇原肠胚形成过程中腹部顶层细胞会发生依次分别由转录因子snail和twist控制的两次收缩、从而导致中胚层入鞘在整个过程中需要肌球蛋白-II重新分布并转移到收缩细胞的顶部;而在Snail基因突变果蝇中肌球蛋白-II的重新分布和中胚层入鞘过程异常对中胚层施加外力刺激后,收缩反应恢复正常证明由肌球蛋白-II收缩或重排产生的外力在胚胎发育过程中发挥重要作用( Pouille et al. 2009). 因此,Myosin II引起的收缩在决定干细胞命运信号的产生和传递甚至胚胎发育过程中具有重要的作用.
4.2 干细胞对力学信号的转导与响应机制 4.2.1 力学信号转导的分子机制力学感知、传递、转导和响应是哺乳动物细胞的重要特征可将施加于细胞表面的力学刺激转变成细胞内生物化学变化. 一般来说细胞应答外力的过程是细胞与外部微环境相互作用的循环反馈过程细胞表面的力学受体蛋白感知外界力学环境的变化并通过受体蛋白胞内端的构象改变、磷酸化状态变化等将细胞外力学刺激转化为胞内的生物化学事件从而诱导下游系列的信号级联传导,以及胞核内基因表达与调控的改变从而引起细胞形态、结构、功能,以及生长、分化和死亡等变化( Tajik et al. 2016). 例如,粘附于血管内皮细胞表面的白细胞在血流剪切的作用下其力学受体蛋白--整合素--胞外结构域会发生构象改变可诱导粘着斑蛋白和其他相关蛋白变形同时整合素β亚基胞内端磷酸化位点发生改变进而改变由小G蛋白酶激活的信号通路( Guilluy et al. 2011).
力学刺激被细胞感知后将在细胞内触发一系列与力学信号转导相关的信号通路导致细胞增殖、迁移、分化等功能的改变.力学刺激可使黏着斑中的FAK激酶发生磷酸化进而引起ERK和p38通路的激活( Aikawa et al. 2002, Wang et al. 2001);也可使MAPK通路、ERK1/2、JNK通路激活,并调控Rac和p53通路( MacKenna et al. 1998)以及Rho和NF- κB通路( Wernig et al. 2003, Zhu et al. 2015)等. 较硬的ECM硬度能够激活RhoA进而影响BMP/Smad信号通路、p-ERK从而活化Runx2、促进干细胞向成骨世系分化( Arnsdorf et al. 2009, Wang et al. 2012). 尽管目前外力刺激和细胞内应力如何影响Wnt/ β-catenin信号通路尚未完全明了但可以确认的是力学刺激能够通过影响这一信号通路调控细胞的分化和发育并与其他力学信号通路(如TGF- β通路)发生相互作用( Tschumperlin et al. 2013, Zhang et al. 2016).TGF- β是与整合素密切相关的力学信号传导途径,40pN的外力可使TGF- β从胞内结合肽上释放出来从而影响其下游信号通路( Buscemi et al. 2011);而这一外力的大小与整合素与ECM间的作用力大小相当(Moore et al.2010). 此外,ECM硬度的改变还可改变成纤维细胞中TGF- β的活化程度( Wipff et al. 2007).
对于干细胞而言,不同分化程度的干细胞中Rho 蛋白家族的不同成员作用不同:Cdc42和Rho在ESC应答外力过程中有重要作用( Chowdhury et al. 2010a, 2010b; Price et al. 1998)而Rac则主要介导分化细胞应答外力的过程( D'Souza-Schorey et al.1998). 基底硬度不仅在调节干细胞铺展和分化方面发挥重要作用而且影响细胞早期信号转导:接种于较硬基底上的人类MSC可在细胞质和内质网中表现出自发的Ca 2+振荡,而当基底硬度降低到1 kPa 时振荡幅度和频率均大幅降低同时RhoA 活性也相应降低,表明RhoA 及其下游分子ROCK在基底硬度调节Ca 2+信号转导中发挥重要作用并决定人类MSC的功能( Kim et al. 2009). 此外酪氨酸家族蛋白激酶Src对于人或小鼠的ESC细胞保持未分化状态至关重要( Anneren et al. 2004). 外力可以激活MAP激酶、酪氨酸激酶/磷酸酶等多种信号通路( Geiger & Bershadsky 2002),而Src可影响细胞将力学刺激转化为生物化学信号的过程( Wang et al. 2005). 综上,力学信号转导作为活细胞独特的信号传导机制为耦联细胞外生理力学刺激与细胞内生物化学响应提供了有力的途径.
4.2.2 力学信号响应的分子机制力学刺激通过跨膜整合素/粘连蛋白结合于细胞表面的粘着斑并通过细胞质中的细胞骨架网络连接于细胞核、核内骨架以及染色质最终通过力学信号传递和力学信号转导等方式来调控细胞核的表观遗传学性质从而对外界力学刺激产生响应和应答、形成新的力学稳态. 因此细胞核是响应力学刺激的终极结构可通过调控力学敏感基因的表型实现对外界环境的应答.作用于细胞核的外力可导致核内特异分子形态、折叠以及动力学变化也可改变染色质的结构,进而影响核蛋白组装、基因转录、DNA复制以及RNA 加工等( Tajik et al. 2016, Wang et al. 2009)对调控细胞的行为、组织的发生以及干细胞的命运也是至关重要的.对干细胞施加外力会诱导细胞中的关键信号通路进而产生一系列重要的生物学效应从而协助调控干细胞的命运.包围在坚硬组织(如下颌)中的干细胞往往具有强韧的张力可促进诸如骨骼等坚硬组织的产生而生长在较低硬度或者张力组织中的干细胞则有利于分化为诸如脂肪一样的柔软组( Kim et al. 2015).
细胞核作为重要的力学敏感元件可通过力学表观遗传学效应响应外界力学刺激的改变( Swift et al. 2013).人类ESC细胞核可作为基底拉伸和流体剪切的共同力学感受器其力学作用可调控组蛋白乙酰化、RNA结合、以及核糖体合成;流体剪切作用可上调H2B乙酰化和染色质去凝集增强细胞核铺展、降低细胞核刚度且上述改变与细胞骨架的重组密切相关.
不仅是细胞核及其核内骨架可响应外界力学刺激其他细胞核相关蛋白或因子也可通过调控其表观遗传学行为应答外力作用.在血管内皮细胞(vascular endothelial cellsECs)表面施加流体切剪切应力会抑制两种核包膜蛋白Nesprin2和LaminA的表达影响下游重要转录因子的表达而增加ECs的增殖和凋亡( Han et al. 2015);使用周期性张应力模拟体内高血压高张应变诱导血管平滑肌细胞(vascular smooth muscle cell,VSMCs)增殖中的作用及其机制时发现,细胞核骨架蛋白emerin和laminA/C表达降低参与了高血压高张应变诱导的VSMCs 异常增殖,揭示emerin和laminA/C 可分别与包含特异性转录因子motif序列的DNA片段结合进而调控多种与VSMCs增殖相关的转录因子活性( Qi et al. 2016).拉伸刺激能够通过细胞骨架相关蛋白zyxin影响Hippo通路的活化(Rauskolb et al.2011). Hippo通路及其下游的YAP、TAZ因子均与力学信号传导相关(Elbediwy et al.2016). 作为暴露于核膜的两个力学信号传感分子,YAP/TAZ的活性受到ECM硬度变化、细胞形状及几何形变的调控,主要依赖于Rho GTP酶的活化和Myosin II蛋白的拉伸,但不依赖于Hippo/LATS(large tumor suppresso)级联效应,可通过感知基底弹性来调控细胞铺展( Dupont et al. 2011).此外在由ECM硬度诱导的MSC分化以及通过细胞几何形态改变调控内皮细胞的存活方面YAP/TAZ 发挥至关重要的作用. 因此细胞核相关的YAP/TAZ因子可能是细胞微环境中调控力学信号的传感器和介质之一.类似地,力学刺激也能够通过细胞骨架F-actin和应力纤维激活YAP、TAZ从而进一步调控细胞周期和细胞分化( Sansores-Garcia et al. 2011,Wada et al.2011),并与其他力学相关的信号通路(如Smad通路)之间存在复杂的互作关系( Tschumperlin et al. 2013).
4.3 力学组学的进展与未来趋势力学刺激对器官、组织、细胞乃至分子水平上的生物学过程均起着重要的作用.细胞生长的微环境中存在多种力学刺激(拉伸、压缩、扭转、剪切等)每种力学刺激包括不同作用模态(稳态、振荡、周期性往复等)而每一模态涵盖多个加载参数(幅值、频率、时间等)( Long et al. 2011).在生理条件下上述因素常常同时发生,其效应之间可能存在着撷抗或者协同作用使得各个因素所产生的独特效应可同时得到保留,也可能会相互抵消或者增强. 因此全域性、系统地评估细胞对生理复合力学刺激的应答之间的关系显得至关重要.在当今生物学技术中蛋白质组学和转录组学等组学方法是在系统水平上开展生物学研究的强有力工具并在力学生物学的研究中也逐渐得到了应用. 尽管如此人们对参与生物学过程的生理复合力学刺激的效应大多还停留在单一类型、模态或参数组合的水平在系统层面上全域认识仍不清楚. 近年来,有关"力学组"(mechanome)"力学组学"(mechanomics)等概念被相继提出( Wang et al. 2014)有助于深化对(干)细胞力学感知和力学转导的认识.
4.3.1 力学组学概念力学组的定义源于在细胞与分子尺度上全面诠释生理力学作用的功能( Lang 2007, Song et al. 2012)而后扩展至组织、器官甚至个体水平上对相关事件的描述以期从微纳尺度到宏观尺度上揭示应力的作用( Song et al. 2012).这就催生了一个新的领域---力学组学即整合生理复合力学作用并阐述不同力学刺激与其生物学功能之间的关联.该术语最早出现在将核磁共振技术与生物信息学方法相结合、用于从大规模单蛋白质家族中筛查特定的受体-配体相互作用( Sem et al. 2001),与本文所指的内涵不同. 在(干)细胞生物力学研究中力学组学被赋予了更广泛的定义用于描述生理复合力学刺激所导致的细胞-分子事件以阐明外力是如何通过传递和转导而诱导生物学应答. 图12给出了力学组学定义的概念流程图旨在认识对生物学过程起普适作用的基本力学过程、考察外力对生物学响应的调控( Wang et al. 2014). 需要指出的是还有一个类似的术语即物理组学(physicomics)用于考察与组织、器官和生理水平相关的物理因素(如压力、温度、电磁场等)对生物学过程的调控作用( van Loon 2009).

|
| 图 12 力学组学概念示意图 |
由于力学组学术语最早是从药物设计这一角度提出的故相当一段时间以来,这一提法远离力学生物学领域而被湮没仅仅是有少量研究沿着本文讨论的力学组学概念思路而得以开展.早前人们已经意识到对外力与蛋白质机器功能关联作用的认识可能将为分子医学打开一扇门( Huang et al. 2013, Qi et al. 2011, Wang et al. 2008)结合荧光微珠和计算流体力学模拟筛查活的干细胞的力学组、以及通过原位测量流体-细胞界面局部应变场可为外力在干细胞谱系建立中的作用提供机理性诠释( Song et al. 2012, Wang et al. 2008). 力学组学的概念提出之后人们开始应用力学组学的思想或概念、用于阐明不同力学刺激下的细胞和分子事件分别开展了皮肤创伤愈合( Rolin et al. 2014)、生物热力学( Lucia 2015)、拉伸作用下血管内皮细胞应答(Jufri et al.2015)、微重力下细胞应答( Blaber et al. 2015, Long et al. 2015, Wuest et al. 2015,Zhang C et al.2016)、超重力下细胞应答(Tavakolinejad et al.2015)、成骨细胞基因表达( Han & He 2015)、关节软骨表型变化(Novochadov et al.2014)及其干细胞自我更新数学建模( Shiroky et al. 2014)等工作在认识生理复合力学刺激下调控细胞生物学过程的力学敏感基因、转录因子、蛋白质等方面获得了新线索和新认识.
4.3.3 未来可能的发展趋势力学组学是一个崭新但发展很快的分支领域其相关领域近年来的正面证据令人鼓舞. 未来工作中至少有以下潜在的重要问题需要回答:
生物学或生理重要性在力学组学研究中至关重要.人们对外力如何影响发育、分化、生理和疾病仍然知之甚少.由于目前尚难以构建细胞响应全域生理力学刺激的响应网络,因此细胞如何通过力学受体等分子机制感知和响应力学信号仍是面临的主要挑战.正如生物学家通常做的一样需要采用更多的生物学模型、通过生物多样性拓展视野. 例如在肿瘤生长的力学生物学中病理力学条件下的表达谱筛选是另一个热点( Carey et al. 2012).
生理力学刺激类型、模态或参数的重现是力学组学研究的关键.活的生命体中在体的力学环境异常复杂、且常与其他物理或化学因素耦合在一起其生理力学参数较为缺乏. 因此复现环绕细胞的生物力学微环境难度较大确定其生理力学模态和参数也很不易. 同时现有细胞暴露于力学刺激的离体数据通常是与静态培养的结果比较也需要精细设计对照实验、以期更加合理地从测量信号中扣除背景噪声.其他诸如振动、声波、触摸等力学刺激的作用也值得关注.
发展力学组学研究专用的新的离体方法也是重要的课题.相关领域的高新技术发展为推动力学组学发展提供了机遇.采用微制作技术结合力学拉伸而发展的在线芯片传感器可平行测试小样本和力学加载、减少操作劳动、提高测试效率( Mac Queen et al. 2012).利用微制作方法获得的复合生物材料筛选阵列可确定基底拉伸、可溶性分子、基质蛋白对少量细胞的组合效应最终可获得单细胞的基因谱( Moraes et al. 2013). 同时生物学的最新技术可实现对细胞的原位或在体分析或在实验完成后对样品实现即时分析以保证其原生性质因而有可能设计适当的离体实验、以考察生理力学刺激的最主要特征.同时第二代测序或单细胞测序技术可能是筛选不同生物学样品力学组的有效候选技术( Lawrie et al. 2008).
大数据挖掘和生物信息学分析在力学组学中不可或缺. 为实现数据整合需建立国际化的开源、可下载的力学组数据库,基于大合作的思路建立诸如美国NCBI数据库一样的网络资源,以便查对力学组学的定量分析.这一数据库的关键特征是能够全域筛查细胞的力学环境并从不同来源提供转录本和蛋白质的定量信息.另一关键特征是大规模的精细分析,有良好的用户界面方便采用不同的搜索引擎查找已有数据和上传新的实验数据.
总之,整合力学生物学与转录组学/基因组学是一个新兴的分支领域可全域认识响应不同力学刺激的基因和蛋白质. 显然当前力学组学仍在襁褓之中.随着高通量转录组学/基因组学分析方法和先进的生物力学技术的发展可以预期未来人们可自定义所需力学参量、并从分子和细胞力学组视角获得力学信号转导的整体图谱( Wang et al. 2014).
5 结论(干)细胞与分子层面的力学-生物学、力学-化学耦合是认识生命活动和生物学过程的基本问题.在基础研究层面众多细胞力学模型(连续性模型、离散性模型)的提出和发展体现了细胞生物力学研究在理论层面的飞速发展微管吸吮、原子力显微镜、细胞牵引力显微镜、平板流动腔等技术已广泛应用于细胞生物力学研究并逐步整合.随着近年来有关应力对干细胞结构和功能调控研究的不断深入干细胞对外力产生适应性应变的响应和力学转导机制已逐渐为人们所认识外力及干细胞生长力学微环境作为影响干细胞形态、结构、功能和分化的主要因素之一逐渐受到人们的广泛关注. 然而这一领域中仍有许多未知问题等待人们去探索如不同外力类型、模态、参数对干细胞表型的影响及其增殖、分化、凋亡的动力学变化在组织修复过程中应力对干细胞的生物学行为的影响以及胞内相关力学信号转导和细胞应答的分子机制等.只有深入研究外力和力学转导通路与细胞的关系进一步研究力学影响细胞生命活动的力学-生物学耦合规律才能有效控制干细胞分化过程,满足临床和产业化细胞治疗的需求同时助于了解外力在特定疾病的发病机制和创伤修复过程中的作用在治疗疾病和改善人类健康发挥更加重要的作用.
| 龙勉. 2014. 如何在地球表面模拟空间微重力环境或效应: 从空间细胞生长对微重力响应谈起. 科学通报, 59: 2004-2015 (Long M. 2014. How to stimulate a space microgravity environment or effect on Earth: From the viewpoint of responses of space cell growth to microgravity. Chinese Science Bulletin, 59: 2004-2015) . http://www.cnki.com.cn/Article/CJFDTOTAL-KXTB201420013.htm |
| Agresar G, Linderman J J, Tryggvason G, Powell K G. 1998. An adaptive, cartesian, front-tracking method for the motion, deformation and adhesion of circulating cells. Journal of Computational Physics , 143 :346–380. doi:10.1006/jcph.1998.5967 |
| Aikawa R, Nagai T, Kudoh S, Zou Y, Tanaka M, Tamura M, Akazawa H, Takano H, Nagai R, Komuro I. 2002. Integrins play a critical role in mechanical stress-induced p38 MAPK activation. Hypertension , 39 :233–238. doi:10.1161/hy0202.102699 |
| Alcaraz J, Buscemi L, Grabulosa M, Trepat X, Fabry B, Farré R, Navajas D. 2003. Microrheology of human lung epithelial cells measured by atomic force microscopy. Biophysical Journal , 84 :2071–2079. doi:10.1016/S0006-3495(03)75014-0 |
| Altman A M, Gupta V, Rios C N, Alt E U, Mathur A B. 2010. Adhesion, migration and mechanics of human adipose-tissue-derived stem cells on silk fibroin-chitosan matrix. Acta Biomaterialia , 6 :1388–1397. doi:10.1016/j.actbio.2009.10.034 |
| Amy C R, Jan L, Harald H, Aebi U. 2008. Towards an integrated understanding of the structure and mechanics of the cell nucleus. Bioessays , 30 :226–236. doi:10.1002/(ISSN)1521-1878 |
| Anneren C, Cowan C A, Melton D A. 2004. The Src family of tyrosine kinases is important for embryonic stem cell self-renewal. The Journal of Biological Chemistry , 279 :31590–31598. doi:10.1074/jbc.M403547200 |
| Arnsdorf E J, Tummala P, Kwon R Y, Jacobs C R. 2009. Mechanically induced osteogenic differentiation--the role of RhoA, ROCKII and cytoskeletal dynamics. Journal of Cell Science , 122 :546–553. doi:10.1242/jcs.036293 |
| Bachrach N M, Valhmu W B, Stazzone E, Ratcliffe A, Lai W M, Mow V C. 1995. Changes in proteoglycan synthesis of chondrocytes in articular cartilage are associated with the time-dependent changes in their mechanical environment. Journal of Biomechanics , 28 :1561–1569. doi:10.1016/0021-9290(95)00103-4 |
| Balaban N Q, Schwarz U S, Riveline D, Goichberg P, Tzur G, Sabanay I, Mahalu D, Safran S, Bershadsky A, Addadi L and Geiger B. 2001. Force and focal adhesion assembly: a close relationship studied using elastic micropatterned substrates. Nature Cell Biology , 3 :466–472. doi:10.1038/35074532 |
| Bandyopadhyay S K, Dutta A. 2005. Mitochondrial hepatopathies. The Journal of the Association of Physicians of India , 53 :973–978. |
| Bao G, Suresh S. Cell and molecular mechanics of biological materials. 2003. Nature materials, 2: 715-725. |
| Betschinger J, Knoblich J A. 2004. Dare to be different: asymmetric cell division in Drosophila, C. elegans and vertebrates. Current Biology , 14 :R674–R685. |
| Bhat M B, Zhao J, Zang W, Balke W, Takeshima H, Wier W G, Ma J. 1997. Caffeine-induced release of intracellular Ca 2+ from chinese hamster ovary cells expressing skeletal muscle ryanodine receptor effects on full-length and carboxyl-terminal portion of Ca1 release channels . The Journal of General Physiology , 110 :749–762. doi:10.1085/jgp.110.6.749 |
| Blaber E A, Dvorochkin N, Torres M L, Yousuf R, Burns B P, Globus R K, Almeida E A. 2014. Mechanical unloading of bone in microgravity reduces mesenchymal and hematopoietic stem cell-mediated tissue regeneration. Stem Cell Research , 13 :181–201. doi:10.1016/j.scr.2014.05.005 |
| Brafman D A, Phung C, Kumar N, Willert K. 2013. Regulation of endodermal differentiation of human embryonic stem cells through integrin-ECM interactions. Cell Death and Differentiation , 20 :369–381. doi:10.1038/cdd.2012.138 |
| Buscemi L, Ramonet D, Klingberg F, Formey A, Smith-Clerc J, Meister J J, Hinz B. 2011. The single-molecule mechanics of the latent TGF-beta1 complex. Current Biology , 21 :2046–2054. doi:10.1016/j.cub.2011.11.037 |
| Buschmann M D, Gluzband Y A, Grodzinsky A J, Hunziker E B. 1995. Mechanical compression modulates matrix biosynthesis in chondrocyte/agarose culture. Journal of Cell Science , 108 :1497–1508. |
| Buxboim A, Ivanovska I L, Discher D E. 2010. Matrix elasticity, cytoskeletal forces and physics of the nucleus: how deeply do cells 'feel' outside and in? Journal of Cell Science, 123: 297-308. |
| Carey S P, D'Alfonso T M, Shin S J, Reinhart-King C A. 2012. Mechanobiology of tumor invasion: Engineering meets oncology. Critical Reviews in Oncology Hematology , 83 :170–183. doi:10.1016/j.critrevonc.2011.11.005 |
| Chachisvilis M, Zhang Y L, Frangos J A. 2006. G protein-coupled receptors sense fluid shear stress in endothelial cells. Proceedings of the National Academy of Sciences of the United States of America , 103 :15463–15468. doi:10.1073/pnas.0607224103 |
| Chada S R, Hollenbeck P J. 2003. Mitochondrial movement and positioning in axons: The role of growth factor signaling. The Journal of Cell Biology , 206 :1985–1992. |
| Chalut K J, Hopfler M, Lautenschlager F, Boyde L, Chan C J, Ekpenyong A, Martinez-Arias A, Guck J. 2012. Chromatin decondensation and nuclear softening accompany Nanog downregulation in embryonic stem cells. Biophysical Journal , 103 :2060–2070. doi:10.1016/j.bpj.2012.10.015 |
| Chasis J A, Mohandas N. 2008. Erythroblastic islands: niches for erythropoiesis. Blood , 112 :470–478. doi:10.1182/blood-2008-03-077883 |
| Chaudhari A A, Seol J W, Kim S, Lee Y, Kang H, Kim I, Kim N, Park S Y. 2007. Reactive oxygen species regulate Bax translocation and mitochondrial transmembrane potential, a possible mechanism for enhanced TRAIL-induced apoptosis by CCCP. Oncology Report , 18 :71–76. |
| Chen C Y, Byrne H M, King J R. 2001. The influence of growth-induced stress from the surrounding medium on the development of multicell spheroids. Journal of Mathematical Biology , 43 :191–220. doi:10.1007/s002850100091 |
| Cheng H, Lederer W J, Cannell M B. 1993. Calcium sparks: Elementary events underlying excitation contraction coupling in heart muscle. Science , 262 :740–744. doi:10.1126/science.8235594 |
| Cherbuin T, Movahednia M M, Toh W S, Cao T. 2015. Investigation of human embryonic stem cell-derived keratinocytes as an in vitroresearch model for mechanical stress dynamic response . Stem Cell Reviews and Reports , 11 :460–473. |
| Chowdhury F, Li Y, Poh Y C, Yokohama-Tamaki T, Wang N, Tanaka T S. 2010a. Soft Substrates Promote Homogeneous Self-Renewal of Embryonic Stem Cells via Downregulating Cell-Matrix Tractions. PLoS One , 5 :e15655. doi:10.1371/journal.pone.0015655 |
| Chowdhury F, Na S, Li D, Poh Y C, Tanaka T S, Wang F, Wang N. 2010b. Material properties of the cell dictate stress-induced spreading and differentiation in embryonic stem cells. Nature Materials , 9 :82–88. doi:10.1038/nmat2563 |
| Chrzanowska-Wodnicka M, Burridge K. 1996. Rho-stimulated contractility drives the formation of stress fibers and focal adhesions. Journal of Cell Biology , 133 :1403–1415. doi:10.1083/jcb.133.6.1403 |
| Conway A, Schaffer D V. 2012. Biophysical regulation of stem cell behavior within the niche. Stem Cell Research & Therapy , 3 :1–7. |
| Coughlin M F, Stamenović D. 1997. A tensegrity structure with buckling compression elements: application to cell mechanics. Journal of Applied Mechanic , 64 :480–486. doi:10.1115/1.2788918 |
| Coughlin M F, Stamenović D. 1998. A tensegrity model of the cytoskeleton in spread and round cells. Journal of Biomechanical Engineering , 120 :770–777. doi:10.1115/1.2834892 |
| Coughlin M F, StamenovićD. 2003. A prestressed cable network model of the adherent cell cytoskeleton. Biophysical journal , 84 :1328–1336. doi:10.1016/S0006-3495(03)74948-0 |
| Dalby M J, Gadegaard N, Tare R, Andar A, Riehle M O, Herzyk P, Wilkinson C D, Oreffo R O. 2007. The control of human mesenchymal cell differentiation using nanoscale symmetry and disorder. Nature Materials , 6 :997–1003. doi:10.1038/nmat2013 |
| D'Souza-Schorey C, Boettner B, Aelst L V. 1998. Rac regulates integrin-mediated spreading and increased adhesion of T lymphocytes. Molecular and Cellular Biology , 18 :3936–3946. doi:10.1128/MCB.18.7.3936 |
| Darin N, Kollberg G, Moslemi A, Tulinius M, Holme E, Gr?nlund M A, Andersson S, Oldfors A. 2006. Mitochondrial myopathy with exercise intolerance and retinal dystrophy in a sporadic patient with a G583A mutation in the mt tRNA phe gene . Neuromuscular Disorders , 16 :504–506. doi:10.1016/j.nmd.2006.05.010 |
| de Giorgi F, Lartigue L, Ichas F. 2000. Electrical coupling and plasticity of the mitochondrial network. Cell Calcium , 28 :365–370. doi:10.1054/ceca.2000.0177 |
| Desprat N, Supatto W, Pouille P A, Beaurepaire E, Farge E. 2008. Tissue deformation modulates twist expression to determine anterior midgut differentiation in Drosophila embryos. Developmental Cell , 15 :470–477. doi:10.1016/j.devcel.2008.07.009 |
| Di Bucchianico S, Poma A M, Giardi M F, Di Leandro L, Valle F, Biscarini F, Botti D. 2011. Atomic force microscope nanolithography on chromosomes to generate single-cell genetic probes. Journal of Nanobiotechnology , 9 :511. |
| Dingal P C, Bradshaw A M, Cho S, Raab M, Buxboim A, Swift J, Discher D E. 2015. Fractal heterogeneity in minimal matrix models of scars modulates stiff-niche stem-cell responses via nuclear exit of a mechanorepressor. Nature Materials , 14 :951–960. doi:10.1038/nmat4350 |
| Discher D E, Boal D H, Boey S K. 1998. Simulations of the erythrocyte cytoskeleton at large deformation. ii. micropipette aspiration. Biophysical Journal , 75 :1584–1597. |
| Discher D E, Janmey P, Wang Y L. 2005. Tissue cells feel and respond to the stiffness of their substrate. Science , 310 :1139–1143. doi:10.1126/science.1116995 |
| Du J, Chen X, Liang X, Zhang G, Xu J, He L, Zhan Q, Feng X Q, Chien S, Yang C. 2011. Integrin activation and internalization on soft ECM as a mechanism of induction of stem cell differentiation by ECM elasticity. Proceedings of the National Academy of Sciences of the United States of America , 108 :9466–9471. doi:10.1073/pnas.1106467108 |
| Dupont S, Morsut L, Aragona M, Enzo E, Giulitti S, Cordenonsi M, Zanconato F, Le Digabel J, Forcato M, Bicciato S, Elvassore N, Piccolo S. 2011. Role of YAP/TAZ in mechanotransduction. Nature , 474 :179–183. doi:10.1038/nature10137 |
| Elbediwy A, Vincent-Mistiaen Z I, Thompson B J. 2016. YAP and TAZ in epithelial stem cells: A sensor for cell polarity, mechanical forces and tissue damage. Bioessays , 38 :644–653. doi:10.1002/bies.v38.7 |
| Engler A J, Sen S, Sweeney H L, Discher D E. 2006. Matrix elasticity directs stem cell lineage specification. Cell , 126 :677–689. doi:10.1016/j.cell.2006.06.044 |
| Evans E, Yeung A. 1989. Apparent viscosity and cortical tension of blood granulocytes determined by micropipet aspiration. Biophysical Journal , 56 :151. doi:10.1016/S0006-3495(89)82660-8 |
| Eyal-Giladi H, Fabian B. 1980. Axis determination in uterine chick blastocysts under changing spatial positions during the sensitive period of polarity. Developmental Biology , 77 :228–232. doi:10.1016/0012-1606(80)90470-4 |
| Fabry B, Maksym G N, Butler J P, Glogauer M, Navajas D, Fredberg J J. 2001. Scaling the microrheology of living cells. Physical Review Letters , 87 :148102. doi:10.1103/PhysRevLett.87.148102 |
| Fabry B, Maksym G N, Butler J P, Glogauer M, Navajas D, Taback N A, Millet E J, Fredberg J J. 2003. Time scale and other invariants of integrative mechanical behavior in living cells. Physical Review E , 68 :041914. doi:10.1103/PhysRevE.68.041914 |
| Farge E. 2003. Mechanical induction of twist in the Drosophila foregut/stomodeal primordium. Current Biology , 13 :1365–1377. doi:10.1016/S0960-9822(03)00576-1 |
| Friedland J C, Lee M H, Boettiger D. 2009. Mechanically activated integrin switch controls alpha5beta1 function. Science , 323 :642–644. doi:10.1126/science.1168441 |
| Foty R A, Steinberg M S. 2005. The differential adhesion hypothesis: a direct evaluation. Developmental Biology , 278 :255–263. doi:10.1016/j.ydbio.2004.11.012 |
| Fu J, Wang Y K, Yang M T, Desai R A, Yu X, Liu Z, Chen C S. 2010. Mechanical regulation of cell function with geometrically modulated elastomeric substrates. Nature Methods , 7 :733–736. doi:10.1038/nmeth.1487 |
| Galluzzi L, Larochette N, Zamzami N, Kroemer G. 2006. Mitochondria as therapeutic targets for cancer chemotherapy. Oncogene , 25 :4812–4830. doi:10.1038/sj.onc.1209598 |
| Geiger B, Bershadsky A. 2002. Exploring the neighborhood: adhesion-coupled cell mechanosensors. Cell , 110 :139–142. doi:10.1016/S0092-8674(02)00831-0 |
| Gibson L J, Ashby M F. 1982. The mechanics of three-dimensional cellular materials//Proceedings of the Royal Society of London A: Mathematical, Physical and Engineering Sciences, 382: 43-59. |
| Grashoff C, Hoffman B D, Brenner M D, Zhou R, Parsons M, Yang M T, McLean M A, Sligar S G, Chen C S, Ha T, Schwartz M A. 2010. Measuring mechanical tension across vinculin reveals regulation of focal adhesion dynamics. Nature , 466 :263–266. doi:10.1038/nature09198 |
| Gorsich S W, Shaw J M. 2004. Importance of mitochondrial dynamics during meiosis and sporulation. Molecular Biology of the Cell , 15 :4369–4381. doi:10.1091/mbc.E03-12-0875 |
| Guilak F, Jones W R, Ting-Beall H P, Lee G M. 1999. The deformation behavior and mechanical properties of chondrocytes in articular cartilage. Osteoarthritis and Cartilage , 7 :59–70. doi:10.1053/joca.1998.0162 |
| Guilluy C, Swaminathan V, Garcia-Mata R, O'Brien E T, Superfine R, Burridge K. 2011. The Rho GEFs LARG and GEF-H1 regulate the mechanical response to force on integrins. Nature Cell Biology , 13 :722–727. |
| Han J, He H. 2015. Expression and function of osteogenic genes runt-related transcription factor 2 and osterix in orthodontic tooth movement in rats. International Journal of Clinical and Experimental Pathology , 8 :11895–11900. |
| Han Y, Wang L, Yao Q P, Zhang P, Liu B, Wang G L, Shen B R, Cheng B, Wang Y, Jiang Z L, Qi Y X. 2015. Nuclear envelope proteins Nesprin2 and LaminA regulate proliferation and apoptosis of vascular endothelial cells in response to shear stress. Biochimica et Biophysica Acta , 1853 :1165–1173. doi:10.1016/j.bbamcr.2015.02.013 |
| Harden N. 2002. Signaling pathways directing the movement and fusion of epithelial sheets: lessons from dorsal closure in Drosophila. Differentiation , 70 :181–203. doi:10.1046/j.1432-0436.2002.700408.x |
| Harris A K, Wild P, Stopak D. 1980. Silicone rubber substrata: a new wrinkel in the study of cell locomotion. Science , 208 :177–179. doi:10.1126/science.6987736 |
| Heisenberg C P, Bellaiche Y. 2013. Forces in tissue morphogenesis and patterning. Cell , 153 :948–962. doi:10.1016/j.cell.2013.05.008 |
| Henderson J H, Cater D R. 2002. Mechanical induction in limb morphogenesis: the role of growth-generated strain and pressures. Bone , 31 :645–653. doi:10.1016/S8756-3282(02)00911-0 |
| Hochmuth R M, Ting-Beall H P, Beaty B B, Needham D, Tran-Son-Tay R. 1993. Viscosity of passive human neutrophils undergoing small deformations. Biophysical Journal , 64 :1596. doi:10.1016/S0006-3495(93)81530-3 |
| Hoffman B D, Grashoff C, Schwartz M A. 2011. Dynamic molecular processes mediate cellular mechanotransduction. Nature , 475 :316–323. doi:10.1038/nature10316 |
| Horner V L, Wolfner M F. 2008. Mechanical stimulation by osmotic and hydrostatic pressure activates Drosophila oocytes in vitro in a calcium-dependent manner. Developmental Biology , 316 :100–109. doi:10.1016/j.ydbio.2008.01.014 |
| Huang H, Kamm R D, Lee R T. 2004. Cellmechanicsandmechanotransduction: pathways, probes, and physiology. American Journal of Physiology-Cell Physiology , 287 :C1–C11. doi:10.1152/ajpcell.00559.2003 |
| Huang C, Holfeld J, Schaden W, Orgill D, Ogawa R. 2013. Mechanotherapy: revisiting physical therapy and recruiting mechanobiology for a new era in medicine. Trends in Molecular Medicine , 19 :555–564. doi:10.1016/j.molmed.2013.05.005 |
| Hutson M S, Tokutake Y, Chang M S, Bloor J W, Venakides S, Kiehart D P, Edwards G S. 2003. Forces for morphogenesis investigated with laser microsurgery and quantitative modeling. Science , 300 :145–149. doi:10.1126/science.1079552 |
| Ingber D E. 1993. Cellular tensegrity: defining new rules of biological design that govern the cytoskeleton. Journal of Cell Science , 104 :613–627. |
| Ingber D E. 2003. Tensegrity i. cell structure and hierarchical systems biology. Journal of cell science , 116 :1157–1173. |
| Ingber D E. 2000. Opposing views on tensegrity as a structural framework for understanding cell mechanics. Journal of Applied Physiology , 89 :1663–1678. |
| Ingber D E. 2006. Cellular mechanotransduction: putting all the pieces together again. Faseb Journal , 20 :811–827. doi:10.1096/fj.05-5424rev |
| Jakkaraju S, Zhe X, Pan D, Choudhury R, Schuger L. 2005. TIPs are tension-responsive proteins involved in myogenic versus adipogenic differentiation. Developmental Biology , 9 :39–49. |
| Janmey P A, McCulloch C A. 2007. Cell mechanics: integrating cell responses to mechanical stimuli. Annual Review of Biomedical Engineering , 9 :1–34. doi:10.1146/annurev.bioeng.9.060906.151927 |
| Jen C J, Jhiang S J, Chen H I. 2000. Invited review: effects of flow on vascular endothelial intracellular calcium signaling of rat aortas ex vivo. Journal of Applied Physiology , 89 :1657–1662. |
| Johnson C P, Tang H Y, Carag C, Speicher D W, Discher D E. 2007. Forced unfolding of protein swith in cells. Science , 317 :663–666. doi:10.1126/science.1139857 |
| Jones W R, Ting-Beall H P, Lee G M, Kelley S S, Hochmuth R M, Guilak F. 1999. Alterations in the young's modulus and volumetric properties of chondrocytes isolated from normal and osteoarthritic human cartilage. Journal of biomechanics , 32 :119–127. doi:10.1016/S0021-9290(98)00166-3 |
| Jufri N F, Mohamedali A, Avolio A, Baker M S. 2015. Mechanical stretch: physiological and pathological implications for human vascular endothelial cells. Vascular Cell , 7 :8. doi:10.1186/s13221-015-0033-z |
| Kahn J, Shwartz Y, Blitz E, Krief S, Sharir A, Breitel D A, Rattenbach R, Relaix F, Maire P, Rountree R B, Kingsley D M, Zelzer E. 2009. Muscle contraction is necessary to maintain joint progenitor cell fate. Developmental Cell , 16 :734–743. doi:10.1016/j.devcel.2009.04.013 |
| Kan H C, Shyy W, Udaykumar H S, Vigneron P, Tran-Son-Tay R. 1999. Effects of nucleus on leukocyte recovery. Annals of Biomedical Engineering , 27 :648–655. doi:10.1114/1.214 |
| Karbowski M, Youle RJ. 2003. Dynamics of mitochondrial morphology in healthy cells and during apoptosis. Cell Death and Differentiation , 10 :870–880. doi:10.1038/sj.cdd.4401260 |
| Kasza K E, Rowat A C, Liu J, Angelini T E, Brangwynne C P, Koenderink G H, Weitz D A. 2007. The cell as a material. Current Opinion in Cell Biology , 19 :101–107. doi:10.1016/j.ceb.2006.12.002 |
| Khacho M, Clark A, Svoboda D S, Azzi J, MacLaurin J G, Meghaizel C, Sesaki H, Lagace D C, Germain M, Harper M E, Park D S, Slack R S. 2016. Mitochondrial dynamics impacts stem cell identity and fate decisions by regulating a nuclear transcriptional program. Cell Stem Cell , 19 :232–247. doi:10.1016/j.stem.2016.04.015 |
| Kim M C, Kim C, Wood L, Neal D, Kamm R D, Asada H H. 2012. Integrating focal adhesion dynamics, cytoskeleton remodeling, and actin motor activity for predicting cell migration on 3d curved surfaces of the extracellular matrix. Integrative Biology , 4 :1386–1397. doi:10.1039/c2ib20159c |
| Kim M C, Neal D M, Kamm R D, Asada H H. 2013. Dynamic modeling of cell migration and spreading behaviors on fibronectin coated planar substrates and micropatterned geometries. PLoS Computational Biology , 9 :e1002926. doi:10.1371/journal.pcbi.1002926 |
| Kim T J, Joo C, Seong J, Vafabakhsh R, Botvinick E L, Berns M W, Palmer A E, Wang N, Ha T, Jakobsson E, Sun J, Wang Y. 2015. Distinct mechanisms regulating mechanical force-induced Ca 2+ signals at the plasma membrane and the ER in human MSCs . Elife , 4 :e04876. |
| Kim T J, Seong J, Ouyang M, Sun J, Lu S, Hong J P, Wang N, Wang Y. 2009. Substrate rigidity regulates Ca 2+ oscillation via rhoa pathway in stem cells . Journal of Cellular Physiology , 218 :285–293. doi:10.1002/jcp.v218:2 |
| Knowles M K, Guenza M G, Capaldi R A, Marcus A H. 2002. Cytoskeletal-assisted dynamics of the mitochondrial reticulum in living cells. Proceedings of the National Academy of Sciences of the United States of America , 99 :14772–14777. doi:10.1073/pnas.232346999 |
| Krieg M, Arboleda-Estudillo Y, Puech P H, Kafer J, Graner F, Muller D J, Heisenberg C P. 2008. Tensile forces govern germ-layer organization in zebrafish. Nature Cell Biology , 10 :429–436. doi:10.1038/ncb1705 |
| Kris N D, Alexandre J S, Jan L. 2008. Nuclear Shape, Mechanics, and Mechanotransduction. Circulation Research , 102 :1307–1318. doi:10.1161/CIRCRESAHA.108.173989 |
| Kochav S M, Eyal-Giladi H. 1971. Bilateral symmetry in the chick embryo determination by gravity. Science , 171 :1027–1029. doi:10.1126/science.171.3975.1027 |
| Kondo M, Wagers A J, Manz M G, Prohaska S S, Scherer D C, Beilhack G F, Shizuru J A, Weissman I L. 2003. Annual Review of Immunology, 21: 759-806. |
| Lammerding J, Hsiao J, Schulze P C, Kozlov S, Stewart C L, Lee R T. 2005. Abnormal nuclear shape and impaired mechanotransduction in emerin-deficient cells. Journal of Cell Biology , 170 :781–791. doi:10.1083/jcb.200502148 |
| Lang M. 2007. Lighting up the mechanome. Bridge , 37 :11–16. |
| Lawrie C H, Gal S, Dunlop H M, Pushkaran B, Liggins A P, Pulford K, Banham A H, Pezzella F, Boultwood J, Wainscoat J S, Hatton C S, Harris A L. 2008. Detection of elevated levels of tumour-associated microRNAs in serum of patients with diffuse large B-cell lymphoma. British Journal of Haematology, 2008, 141: 672-675. |
| Lee D Y, Lee C I, Lin T E, Lim S H, Zhou J, Tseng Y C, Chien S, Chiu J J. 2012. Role of histone deacetylases in transcription factor regulation and cell cycle modulation in endothelial cells in response to disturbed flow. Proceedings of the National Academy of Sciences of the United States of America , 109 :1967–1972. doi:10.1073/pnas.1121214109 |
| Li D, Zhou J, Wang L, Shin M E, Su P, Lei X, Kuang H, Guo W, Yang H, Cheng L, Tanaka T S, Leckband D E, Reynolds A B, Duan E, Wang F. 2010. Integrated biochemical and mechanical signals regulate multifaceted human embryonic stem cell functions. The Journal of Cell Biology , 191 :631–644. doi:10.1083/jcb.201006094 |
| Li H, Chen J, Zhang Y, Sun S J, Tao Z L, Long M. 2010. Effects of oriented substrates on cell morphology, the cell cycle, and the cytoskeleton in ros 17/2. 8 cells. Science China Life Sciences , 53 :1085–1091. doi:10.1007/s11427-010-4057-6 |
| Li J, Dao M, Lim C T, Suresh S. 2005. Spectrin-level modeling of the cytoskeleton and optical tweezers stretching of the erythrocyte. Biophysical Journal , 88 :3707–3719. doi:10.1529/biophysj.104.047332 |
| Li Y, Chu J S, Kurpinski K, Li X, Bautista D M, Yang L, Sung K L, Li S. 2011. Biophysical regulation of histone acetylation in mesenchymal stem cells. Biophysical Journal , 100 :1902–1909. doi:10.1016/j.bpj.2011.03.008 |
| Li Z, Gong Y W, Sun S J, Du Y, Lü D Y, Liu X F, Long M. 2013. Differential regulation of stiffness, topography, and dimension of substrates in rat mesenchymal stem cells. Biomaterials , 34 :7616–7625. doi:10.1016/j.biomaterials.2013.06.059 |
| Liang Z, Liu C, Li L, Xu P, Luo G, Ding M, Liang Q. 2016. Double-network hydrogel with tunable mechanical performance and biocompatibility for the fabrication of stem cells-encapsulated fibers and 3D assemble. Scientific Reports , 6 :33462. doi:10.1038/srep33462 |
| Lim C T, Zhou E H, Quek S T. 2006. Mechanical models for living cells--a review. Journal of Biomechanics , 39 :195–216. doi:10.1016/j.jbiomech.2004.12.008 |
| Liu H, Wen J, Xiao Y, Liu J, Hopyan S, Radisic M, Simmons C A, Sun Y. 2014a. In situ mechanical characterization of the cell nucleus by atomic force microscopy. ACS Nano , 8 :3821–3828. doi:10.1021/nn500553z |
| Liu S Q. 1998. Influence of tensile strain on smooth muscle cell orientation in rat blood vessels. Journal of Biomechanical Engineering , 120 :313–320. doi:10.1115/1.2797996 |
| Liu X F, Vargas D A, Lü D Y, Zhang Y, Zaman M H, and Long M. 2014. Computational modeling of stem cell migration: A mini review. Cellular and Molecular Bioengineering , 7 :196–204. doi:10.1007/s12195-014-0330-2 |
| Long M, Wang Y R, Zheng H Q, Shang P, Duan E K, Lü D Y. 2015. Mechano-biological coupling of cellular responses to microgravity. Microgravity Science and Technology , 27 :505–514. doi:10.1007/s12217-015-9464-7 |
| Long M, Sato M, Lim C T, Wu J H, Adachi A, and Inoue Y. 2011. Advances in experiments and modeling in micro-and nano-biomechanics---A mini review. Cellular and Molecular Bioengineering , 4 :327–339. doi:10.1007/s12195-011-0183-x |
| Lozoya O A, Gilchrist C L, Guilak F. 2016. Universally conserved relationships between nuclear shape and cytoplasmic mechanical properties in human stem cells. Scientific Reports , 6 :23047. doi:10.1038/srep23047 |
| Lucia U. 2015. Bioengineering thermodynamics: An engineering science for thermodynamics of biosystems. International Journal of Thermophysics , 18 :254–265. |
| Lü D Y, Li Z, Gao Y X, Huo H, Kang Y Y, Chen J, Sun S J, Luo X D, Long M. 2013. Asymmetric migration of human keratinocytes under mechanical stretch and cocultured fibroblasts in a wound repairing model. PLoS One , 8 :e74563. doi:10.1371/journal.pone.0074563 |
| Lü D Y, Luo C H, Zhang C, Li Z, Long M. 2014. Differential regulation of morphology and stemness of mouse embryonic stem cells by substrate stiffness and topography. Biomaterials , 35 :3945–3955. doi:10.1016/j.biomaterials.2014.01.066 |
| Lü D Y, Li Z, Gao Y X, Luo C H, Zhang F, Zheng L, Wang J W, Sun S J, Long M. 2016. β1 integrin signaling in asymmetric migration of keratinocytes under mechanical stretch in a co-cultured wound repair model. Biomedical Engneering Online. 15: 605-620. |
| MacKenna D A, Dolfi F, Vuori K, Ruoslahti E. 1998. Extracellular signal-regulated kinase and c-Jun NH2-terminal kinase activation by mechanical stretch is integrin-dependent and matrix-specific in rat cardiac fibroblasts. Journal Clinical Investigation , 101 :301–310. doi:10.1172/JCI1026 |
| MacQueen L, Chebotarev O, Simmons C A, Sun Y. 2012. Miniaturized platform with on-chip strain sensors for compression testing of arrayed materials. Lab on a Chip , 12 :4178–4184. doi:10.1039/c2lc40670e |
| Mahaffy R E, Shih C K, MacKintosh F C, K?s J. 2000. Scanning probe-based frequency-dependent microrheology of polymer gels and biological cells. Physical Review Letters , 85 :880. doi:10.1103/PhysRevLett.85.880 |
| Mammoto T, Mammoto A, Torisawa Y S, Tat T, Gibbs A, Derda R, Mannix R, de Bruijn M, Yung C W, Huh D, Ingber D E. 2011. Mechanochemical control of mesenchymal condensation and embryonic tooth organ formation. DevelopmentalCell , 21 :758–769. |
| Marella S, Udaykumar H S. 2004. Computational analysis of the deformability of leukocytes modeled with viscous and elastic structural components. Physics of Fluids , 16 :244–264. doi:10.1063/1.1629691 |
| Martin A C, Kaschube M, Wieschaus E F. 2009. Pulsed contractions of an actin-myosin network drive apical constriction. Nature , 457 :495–499. doi:10.1038/nature07522 |
| Matthews B D, Overby D R, Mannix R, Ingber D E. 2006. Cellular adaptation to mechanical stress: role of integrins, Rho, cytoskeletal tension and mechanosensitive ion channels. Journal of Cell Science , 119 :508–518. doi:10.1242/jcs.02760 |
| Meeusen S, McCaffery M, Nunnari J. 2004. Mitochondrial fusion intermediates revealed in vitro . Science , 305 :1747–1752. doi:10.1126/science.1100612 |
| Miralles F, Posern G, Zaromytidou A I, Treisman R. 2003. Actin dynamics control SRF activity by regulation of its coactivator MAL. Cell , 113 :329–342. doi:10.1016/S0092-8674(03)00278-2 |
| Mitra S K, Hanson D A, Schlaepfer D D. 2005. Focal adhesion kinase: in command and control of cell motility. Nature Reviews Molecular Cell Biology , 6 :56–68. doi:10.1038/nrm1549 |
| Miyamoto S, Teramoto H, Coso O A, Gutkind J S, Burbelo P D, Akiyama S K, Yamada K M. 1995. Integrin function: molecular hierarchies of cytoskeletal and signaling molecules. Journal of Cell Biology , 131 :791–805. doi:10.1083/jcb.131.3.791 |
| Moore S W, Roca-Cusachs P, Sheetz M P. 2010. Stretchy proteins on stretchy substrates: the important elements of integrin-mediated rigidity sensing. Developmental Cell , 19 :194–206. doi:10.1016/j.devcel.2010.07.018 |
| Moraes C, Likhitpanichkul M, Lam C J, Beca B M, Sun Y, Simmons C A. 2013. Microdevice array-based identification of distinct mechanobiological response profiles in layer-specific valve interstitial cells. Integrative Biology , 5 :673–680. doi:10.1039/c3ib20254b |
| N'Dri N A, Shyy W, Tran-Son-Tay R. 2003. Computational modeling of cell adhesion and movement using a continuum-kinetics approach. Biophysical Journal , 85 :2273–2286. doi:10.1016/S0006-3495(03)74652-9 |
| Na S, Collin O, Chowdhury F, Tay B, Ouyang M, Wang Y, Wang N. 2008. Rapid signal transduction in living cells is a unique feature of mechanotransduction. Proceedings of the National Academy of Sciences of the United States of America , 105 :6626–6631. doi:10.1073/pnas.0711704105 |
| Nix D A, Beckerle M C. 1997. Nuclear-cytoplasmic shuttling of the focal contact protein, zyxin: A potential mechanism for communication between sites of cell adhesion and the nucleus. Journal of Cell Biology , 138 :1139–1147. doi:10.1083/jcb.138.5.1139 |
| Novochadov V V, Bovol'skaya K A, Lipnitzkaya S A, Perevalova E V, Shuvalova E Y, Zagrebina Z N, Zaytzev V G. 2014. Different phenotype of chondrocytes in articular c'artilage: Mapping, possible mechanisms, and impact to implant healing. European Journal of Molecular Biotechology , 6 :210–222. |
| Obataya I, Nakamura C, Han S, Nakamura N, Miyake J. 2005. Nanoscale operation of a living cell using an atomic force microscope with a nanoneedle. Nano letters , 5 :27–30. doi:10.1021/nl0485399 |
| Okada Y, Nonaka S, Tanaka Y, Saijoh Y, Hamada H, Hirokawa N. 1999. Abnormal nodal flow precedes situs inversus in ivand invmice . Molecular Cell , 4 :459–468. doi:10.1016/S1097-2765(00)80197-5 |
| Ozolek J A, Jane E P, Krowsoski L A, Sammak P J. 2007. Human embryonic stem cells (HSF-6) show greater proliferation and apoptoses when grown on glioblastoma cells than mouse embryonic fibroblasts at day 19 in culture: comparison of proliferation, survival, and neural differentiation on two different feeder cell types. Stem Cells Development , 16 :403–412. doi:10.1089/scd.2006.0109 |
| Pagliara S, Franze K, McClain C R, Wylde G W, Fisher C L, Franklin R J, Kabla A J, Keyser U F, Chalut K J. 2014. Auxetic nuclei in embryonic stem cells exiting pluripotency. Nature Materials , 13 :638–644. doi:10.1038/nmat3943 |
| Pardanaud L, Eichmann A. 2009. Stem cells: The stress of forming blood cells. Nature , 459 :1068–1069. doi:10.1038/4591068a |
| Pajerowski J D, Dahl K N, Zhong F L, Sammak P J, Discher D E. 2007. Physical plasticity of the nucleus in stem cell differentiation. Proceedings of the National Academy of Sciences of the United States of America , 104 :15619–15624. doi:10.1073/pnas.0702576104 |
| Park W, Han Y, Kim S, Kim S, Cho K, Kim S. 2007. Antimycin A induces apoptosis in As4. 1 juxtaglomerular cells. Cancer Letters , 251 :68–77. |
| Patwari P, Lee R T. 2008. Mechanical control of tissue morphogenesis. Circulation Research , 103 :234–243. doi:10.1161/CIRCRESAHA.108.175331 |
| Peric-Hupkes D, Meuleman W, Pagie L, Bruggeman S W, Solovei I, Brugman W, Gr?f S, Flicek P, Kerkhoven R M, van Lohuizen M, Reinders M, Wessels L, van Steensel B. 2010. Molecular maps of the reorganization of genome-nuclear lamina interactions during differentiation. Molecular Cell , 38 :603–613. doi:10.1016/j.molcel.2010.03.016 |
| Petersen N O, McConnaughey W B, Elson E L. 1982. Dependence of locally measured cellular deformability on position on the cell, temperature, and cytochalasin b. Proceedings of the National Academy of Sciences , 79 :5327–5331. doi:10.1073/pnas.79.17.5327 |
| Poh Y C, Chen J, Hong Y, Yi H, Zhang S, Chen J, Wu D C, Wang L, Jia Q, Singh R, Yao W, Tan Y, Tajik A, Tanaka T S, Wang N. 2014. Generation of organized germ layers from a single mouse embryonic stem cell. Nature Communications , 5 :4000. |
| Pouille P A, Ahmadi P, Brunet A C, Farge E. 2009. Mechanical signals trigger Myosin-II redistribution and mesoderm invagination in Drosophila embryos. Science Signalling , 2 :ra16. |
| Pourati J, Maniotis A, Spiegel D, Schaffer J L, Butler J P, Fredberg J J, Ingber D E, 1998. Stamenović D, Wang N. Is cytoskeletal tension a major determinant of cell deformability in adherent endothelial cells? American Journal of Physiology-Cell Physiology. 274: C1283-1289. |
| Price L S, Leng J, Schwartz M A, Bokoch G M. 1998. Activation of rac and cdc42 by integrins mediates cell spreading. Molecular Biology of the Cell , 9 :1863–1871. doi:10.1091/mbc.9.7.1863 |
| Pritz T. 1996. Analysis of four-parameter fractional derivative model of real solid materials. Journal of Sound and Vibration , 195 :103–115. doi:10.1006/jsvi.1996.0406 |
| Puig-De-Morales M, Grabulosa M, Alcaraz J, Mullol J, Maksym G N, Fredberg J J, Navajas V. 2001. Measurement of cell microrheology by magnetic twisting cytometry with frequency domain demodulation. Journal of Applied Physiology , 91 :1152–1159. |
| Qi Y X, Jiang J, Jiang X H, Wang X D, Ji S Y, Han Y, Long D K, Shen B R, Yan Z Q, Chien S, Jiang Z L. 2011. PDGF-BB and TGF- β1 on cross-talk between endothelial and smooth muscle cells in vascular remodeling induced by low shear stress . Proceedings of the National Academy of Sciences of the United States of America , 108 :1908–1913. doi:10.1073/pnas.1019219108 |
| Qi Y X, Yao Q P, Huang K, Shi Q, Zhang P, Wang G L, Han Y, Bao H, Wang L, Li H P, Shen B R, Wang Y, Chien S, Jiang Z L. 2016. Nuclear envelope proteins modulate proliferation of vascular smooth muscle cells during cyclic stretch application. Proceedings of the National Academy of Sciences of the United States of America , 113 :5293–5298. doi:10.1073/pnas.1604569113 |
| Radmacher M. 1997. Measuring the elastic properties of biological samples with the afm. IEEE Engineering in Medicine and Biology Magazine , 16 :47–57. |
| Rauskolb C, Pan G, Reddy B V, Oh H, Irvine K D. 2011. Zyxin links fat signaling to the hippo pathway. PLoS Biology , 9 :e1000624. doi:10.1371/journal.pbio.1000624 |
| Resnick A, Hopfer U. 2007. Force-response considerations in ciliary mechanosensation. Biophysical Journal , 93 :1380–1390. doi:10.1529/biophysj.107.105007 |
| Rizzo V, Sung A, Schnitzer J E. 1998. Rapid mechanotransduction in situ at the luminal cell surface of vascular endothelium and its caveolae. The Journal of Biological Chemistry , 273 :26323–26329. doi:10.1074/jbc.273.41.26323 |
| Rodrigues I, Sanches J. 2008. Temporal 2D reconstruction of cell nucleus from fluorescence confocal Microscopy images with anisotropic filtering. Conference Proceedings IEEE Engineering in Medicine and Biology Society , 2008 :2197–2200. |
| Rolin G L, Binda D, Tissot M, Viennet C, Saas P, Muret P, Humbert P. 2014. In vitro study of the impact of mechanical tension on the dermal fibroblast phenotype in the context of skin wound headling. Journal of Biomechanics , 47 :3555–3561. doi:10.1016/j.jbiomech.2014.07.015 |
| Rosowski K A, Mertz A F, Norcross S, Dufresne E R, Horsley V. 2015. Edges of human embryonic stem cell colonies display distinct mechanical properties and differentiation potential. Scientific Reports , 5 :14218. doi:10.1038/srep14218 |
| Salmeen I, Zacmanidis P, Jesion G, Feldkamp LA. 1985. Motion of mitochondria in cultured cells quantified by analysis of digitized images. Biophysical Journal , 48 :681–686. doi:10.1016/S0006-3495(85)83825-X |
| Sanders M C, Way M, Sakai J, Matsudaira P. 1996. Characterization of the actin cross-linking properties of the scruin-calmodulin complex from the acrosomal process of Limulu sperm. The Journal of Biological Chemistry , 271 :2651–2657. doi:10.1074/jbc.271.5.2651 |
| Sansores-Garcia L, Bossuyt W, Wada K, Yonemura S, Tao C, Sasaki H, Halder G. 2011. Modulating F-actin organization induces organ growth by affecting the Hippo pathway. The EMBO Journal , 30 :2325–2335. doi:10.1038/emboj.2011.157 |
| Satcher R L Jr, Dewey C F Jr. 1996. Theoretical estimates of mechanical properties of the endothelial cell cytoskeleton. Biophysical Journal , 71 :109. doi:10.1016/S0006-3495(96)79206-8 |
| Satcher R, Dewey C F, Hartwig J H. 1997. Mechanical remodeling of the endothelial surface and actin cytoskeleton induced by fluid flow. Microcirculation , 4 :439–453. doi:10.3109/10739689709146808 |
| Sato M, Levesque M J, Nerem R M. 1987. Micropipette aspiration of cultured bovine aortic endothelial cells exposed to shear stress. Arteriosclerosis, Thrombosis, and Vascular Biology , 7 :276–286. doi:10.1161/01.ATV.7.3.276 |
| Schmid-Sch?nbein G W, Sung K L, T?zeren H, Skalak R, Chien S. 1981. Passive mechanical properties of human leukocytes. Biophysical Journal , 36 :243. doi:10.1016/S0006-3495(81)84726-1 |
| Sem D S, Yu L, Coutts S M, Jack R. 2001. Object-oriented approach to drug design enabled by NMR SOLVE: First real-time structural tool for characterizing protein-ligand interactions. Journal of Cellular Biochemistry , 84 :99–105. doi:10.1002/(ISSN)1097-4644 |
| Sesaki H, Jensen RE. 1999. Division versus fusion: Dnm1p and Fzo1p antagonistically regulate mitochondrial shape. The Journal of Cell Biology , 147 :699–706. doi:10.1083/jcb.147.4.699 |
| Shieh A C, Athanasiou K A. 2002. Biomechanics of single chondrocytes and osteoarthritis. Critical Reviews in Biomedical Engineering , 30 :307–343. doi:10.1615/CritRevBiomedEng.v30.i456 |
| Shieh A C, Athanasiou K A. 2003. Principles of cell mechanics for cartilage tissue engineering. Annals of Biomedical Engineering , 31 :1–11. doi:10.1114/1.1535415 |
| Shin J H, Tam B K, Brau R R, Lang M J, Mahadevan L, Matsudaira P. 2007. Force of an actin spring. Biophysical Journal , 92 :3729–3733. doi:10.1529/biophysj.106.099994 |
| Shin J W, Discher D E. 2015. Blood and immune cell engineering: cytoskeletal contractility and nuclear rheology impact cell lineage and localization: biophysical regulation of hematopoietic differentiation and trafficking. Bioessays , 37 :633–642. doi:10.1002/bies.v37.6 |
| Shin J W, Spinler K R, Swift J, Chasis J A, Mohandas N, Discher D E. 2013. Lamins regulate cell trafficking and lineage maturation of adult human hematopoietic cells. Proceedings of the National Academy of Sciences of the United States of America , 110 :18892–18897. doi:10.1073/pnas.1304996110 |
| Shiroky A A, Volkov A V, Novochadov V V. 2014. Crucial processes' interaction during the renewal of articular cartilage: the mathematical modeling. European of Journal Molecular Biotechology , 4 :86–94. doi:10.13187/issn.2310-6255 |
| Shroff S G, Saner D R, Lal R. 1995. Dynamic micromechanical properties of cultured rat atrial myocytes measured by atomic force microscopy. American Journal of Physiology-Cell Physiology , 269 :C286–C292. |
| Simpson C F, Kling J M. 1967. The mechanism of denucleation in circulating erythroblasts. Journal of Cell Biology , 35 :237–45. doi:10.1083/jcb.35.1.237 |
| Sims N R. 1990. Rapid isolation of metabolically active mitochondria from rat brain and subregions using percoll density gradient centrifugation. Journal of Neurochemistry , 55 :698–707. doi:10.1111/jnc.1990.55.issue-2 |
| Snelson K. 1996. Snelson on the tensegrity invention. International Journal of Space Structures , 11 :43–48. doi:10.1177/026635119601-207 |
| Song M J, Brady-Kalnay S M, McBride S H, Phillips-Mason P, Dean D, Tate ML. 2012. Mapping the mechanome of live stem cells using a novel method to measure local strain fields in situ at the fluid-cell interface. PLoS One , 7 :43601. doi:10.1371/journal.pone.0043601 |
| Staal J A, Dickson T C, Chung R S, Vickers J C. 2007. Cyclosporin-A treatment attenuates delayed cytoskeletal alterations and secondary axotomy following mild axonal stretch injury. Developmental Neurobiology , 67 :1831–1842. doi:10.1002/(ISSN)1932-846X |
| Stamenović D, Ingber D E. 2002. Models of cytoskeletal mechanics of adherent cells. Biomechanics and Modeling in Mechanobiology , 1 :95–108. doi:10.1007/s10237-002-0009-9 |
| Stamenović D, Mijailovich S M, Tolic-N$ Ø$rrelykke I M, Chen J, Wang N. 2002. Cell prestress. II. Contribution of microtubules. American Journal of Physiology-Cell Physiology , 282 :C617–624. doi:10.1152/ajpcell.00271.2001 |
| Sukharev S, Corey D P. 2004. Mechanosensitive channels: multiplicity of families and gating paradigms. Science's STKE: Signal Transduction Knowledge Environment , 2004 :re4. |
| Swift J, Ivanovska I L, Buxboim A, Harada T, Dingal P C, Pinter J, Pajerowski J D, Spinler K R, Shin J W, Tewari M, Rehfeldt F, Speicher D W, Discher D E. 2013. Nuclear lamin-A scales with tissue stiffness and enhances matrix-directed differentiation. Science , 341 :1240104. doi:10.1126/science.1240104 |
| Taguchi N, Ishihara M, Jofuku A, Oka T, Mihara K. 2007. Mitotic phosphorylation of dynamin-related GTPase Drp1 participates in mitochondrial fission. The Journal of Biological Chemistry , 282 :11521–11529. doi:10.1074/jbc.M607279200 |
| Tajik A, Zhang Y, Wei F, Sun J, Jia Q, Zhou W, Singh R, Khanna N, Belmont A S, Wang N. 2016. Transcription upregulation via force-induced direct stretching of chromatin. Nature Materials , 15 :1287–1296. doi:10.1038/nmat4729 |
| Tan J L, Tien J, Pirone D M, Gray D S, Bhadriraju K, Chen C S. 2003. Cells lying on a bed of microneedles: an approach to isolate mechanical force. Proceedings of the National Academy of Sciences of the United States of America , 100 :1484–1489. doi:10.1073/pnas.0235407100 |
| Tavakolinejad A, Rabbani M, Janmaleki M. 2015. Effects of hypergravity on adipose-derived stem cell morphology, mechanical property and proliferation. Biochemical and Biophysical Research Communications , 464 :473–479. doi:10.1016/j.bbrc.2015.06.160 |
| Theret D P, Levesque M J, Sato M, Nerem R M, Wheeler L T. 1988. The application of a homogeneous half-space model in the analysis of endothelial cell micropipette measurements. Journal of Biomechanical Engineering , 110 :190–199. doi:10.1115/1.3108430 |
| Titushkin I, Cho M. 2007. Modulation of cellular mechanics during osteogenic differentiation of human mesenchymal stem cells. Biophysical Journal , 93 :3693–3702. doi:10.1529/biophysj.107.107797 |
| Tran-Son-Tay R, Kan H C, Udaykumar H S, Damay E, Shyy W. 1998. Rheological modelling of leukocytes. Medical and Biological Engineering and Computing , 36 :246–250. doi:10.1007/BF02510753 |
| Tsai J W, Chen Y, Kriegstein A R, Vallee R B. 2005. LIS1 RNA interference blocks neural stem cell division, morphogenesis, and motility at multiple stages. Journal of Cell Biology , 170 :935–945. doi:10.1083/jcb.200505166 |
| Tschumperlin D J, Liu F, Tager A M. 2013. Biomechanical regulation of mesenchymal cell function. Current Opinion in Rheumatology , 25 :92–100. doi:10.1097/BOR.0b013e32835b13cd |
| Tuleuova N, Lee J Y, Lee J, Ramanculov E, Zern M A, Revzin A. 2010. Using growth factor arrays and micropatterned co-cultures to induce hepatic differentiation of embryonic stem cells. Biomaterials , 31 :9221–9231. doi:10.1016/j.biomaterials.2010.08.050 |
| Uzer G, Fuchs R K, Rubin J, Thompson W R. 2016. Concise Review: Plasma and Nuclear Membranes Convey Mechanical Information to Regulate Mesenchymal Stem Cell Lineage. Stem Cells , 34 :1455–1463. doi:10.1002/stem.v34.6 |
| van Loon JJ. 2009. Mechanomics and physicomics in gravisensing. Microgravity Science Technology , 21 :159–167. |
| Vogel V, Sheetz M. 2006. Local force and geometry sensing regulate cell functions. Nature Reviews Molecular Cell Biology , 7 :265–275. doi:10.1038/nrm1890 |
| Volokh K Y, Vilnay O, Belsky M. 2000. Tensegrity architecture explains linear stiffening and predicts softening of living cells. Journal of Biomechanics , 3 :1543–1549. |
| Vorselen D, Roos W H, MacKintosh F C, Wuite G J, van Loon J J. 2014. The role of the cytoskeleton in sensing changes in gravity by nonspecialized cells. The FASEB Journal , 28 :536–547. doi:10.1096/fj.13-236356 |
| Wada K, Itoga K, Okano T, Yonemura S, Sasaki H. 2011. Hippo pathway regulation by cell morphology and stress fibers. Development , 138 :3907–3914. doi:10.1242/dev.070987 |
| Wagner O I, Lifshitz J, Janmey P A, Linden M, McIntosh T K, Leterrier J. 2003. Mechanisms of mitochondria-neurofilament interactions. The Journal of Neuroscience , 23 :9046–9058. |
| Wang H, Ip W, Boissy R, Grood E S. 1995. Cell orientation response to cyclically deformed substrates: experimental validation of a cell model. Journal of Biomechanics , 28 :1543–1552. doi:10.1016/0021-9290(95)00101-8 |
| Wang J W, Lü D Y, Mao D B, Long M. 2014. Mechanomics: an emerging field between biology and biomechanics. Protein & Cells , 5 :518–531. |
| Wang J G, Miyazu M, Matsushita E, Sokabe M, Naruse K. 2001. Uniaxial cyclic stretch induces focal adhesion kinase (FAK) tyrosine phosphorylation followed by mitogen-activated protein kinase (MAPK) activation. Biochemical and Biophysical Research Communications , 288 :356–361. doi:10.1006/bbrc.2001.5775 |
| Wang N, Naruse K, Stamenović D, Fredberg J J, Mijailovich S M, Tolic-N Ørrelykke I M, Polte T, Mannix R, Ingber D E. 2001. Mechanical behavior in living cells consistent with the tensegrity model. Proceedings of the National Academy of Sciences , 98 :7765–7770. doi:10.1073/pnas.141199598 |
| Wang N, Butler J P, Ingber D E. 1993. Mechanotransduction across the cell surface and through the cytoskeleton. Science , 260 :1124–1127. doi:10.1126/science.7684161 |
| Wang N, Stamenović D. 2000. Contribution of intermediate filaments to cell stiffness, stiffening, and growth. American Journal of Physiology-cell Physiology , 279 :188–194. |
| Wang N, Tolic-N Ørrelykke I M, Chen J, Mijailovich S M, Butler J P, Fredberg J J, StamenovićD. 2002. Cell prestress. I. Stiffness and prestress are closely associated in adherent contractile cells. American Journal of Physiology-Cell Physiology , 282 :C606–616. |
| Wang N, Tytell J D, Ingber D E. 2009. Mechanotransduction at a distance: mechanically coupling the extracellular matrix with the nucleus. Nature Reviews Molecular Cell Biology , 10 :75–82. doi:10.1038/nrm2594 |
| Wang S Q, Xiao W M, Shan S C, Jiang C S, Chen M, Zhang Y, Lü S Q, Chen J, Zhang C M, Chen Q, Long M. 2012. Multi-patterned dynamics of mitochondrial fission and fusion in a living cell. PLoS One , 7 :e19879. doi:10.1371/journal.pone.0019879 |
| Wang Y, Botvinick E L, Zhao Y, Berns M W, Usami S, Tsien R Y, Chien S. 2005. Visualizing the mechanical activation of Src. Nature , 434 :1040–1045. doi:10.1038/nature03469 |
| Wang Y K, Yu X, Cohen D M, Wozniak M A, Yang M T, Gao L, Eyckmans J, Chen C S. 2012. Bone morphogenetic protein-2-induced signaling and osteogenesis is regulated by cell shape, RhoA/ROCK, and cytoskeletal tension. Stem Cells and Development , 21 :1176–1186. doi:10.1089/scd.2011.0293 |
| Wang Y X, Shyy J Y, Chien S. 2008. Fluorescence proteins, live-cell imaging, and mechanobiology: Seeing is believing. Annual Review of Biomedical Engineering , 10 :1–38. doi:10.1146/annurev.bioeng.010308.161731 |
| Warren W E, Kraynik A M. 1997. Linear elastic behavior of a low-density kelvin foam with open cells. Journal of Applied Mechanics , 64 :787–794. doi:10.1115/1.2788983 |
| Weis W I. 2004. How to build a cell junction. Nature , 430 :513–514. doi:10.1038/430513a |
| Watanabe K, Ueno M, Kamiya D, Nishiyama A, Matsumura M, Wataya T, Takahashi J B, Nishikawa S, Nishikawa S, Muguruma K, Sasai Y. 2007. A ROCK inhibitor permits survival of dissociated human embryonic stem cells. Nature Biotechnology , 25 :681–686. doi:10.1038/nbt1310 |
| Wernig F, Mayr M, Xu Q. 2003. Mechanical stretch-induced apoptosis in smooth muscle cells is mediated by beta1-integrin signaling pathways. Hypertension , 41 :903–911. doi:10.1161/01.HYP.0000062882.42265.88 |
| Wipff P J, Rifkin D B, Meister J J, Hinz B. 2007. Myofibroblast contraction activates latent TGF-beta1 from the extracellular matrix. Journal of Cell Biology , 179 :1311–1323. doi:10.1083/jcb.200704042 |
| Wong J J, Ritchie W, Ebner O A, Selbach M, Wong J W, Huang Y, Gao D, Pinello N, Gonzalez M, Baidya K, Thoeng A, Khoo T L, Bailey C G, Holst J, Rasko J E. 2013. Orchestrated intron retention regulates normal granulocyte differentiation. Cell , 154 :583–595. doi:10.1016/j.cell.2013.06.052 |
| Wuest S L, Richard S, Kopp S, Grimm D, Egli M. 2015. Simulated microgravity: critical review on the use of random positioning machines for mammalian cell culture. Biomed Research International , 2015 :971474. |
| Yaffe, M.P., Harata, D., Verde, F., Eddison, M., Toda, T., Nurse, P. 1996. Microtubules mediate mitochondrial distribution in fission yeast. Proceedings of the National Academy of Sciences of the United States of America, 93: 11664-11668. |
| Yang Y, Relan N K, Przywara D A, Schuger L. 1999. Embryonic mesenchymal cells share the potential for smooth muscle differentiation: myogenesis is controlled by the cell's shape. Development , 126 :3027–3033. |
| Yasuhiro S, Masako T, Dubin-Thaler B J, Cherniavskaya O, Sakai R, Tanaka S, Sheetz M P. 2006. Force sensing by mechanical extension of the Src family kinase substrate p130Cas. Cell , 127 :1015–1026. doi:10.1016/j.cell.2006.09.044 |
| Yeung A, Evans E. 1989. Cortical shell-liquid core model for passive flow of liquid-like spherical cells into micropipets. Biophysical Journal , 56 :139–149. doi:10.1016/S0006-3495(89)82659-1 |
| Zermati Y, Garrido C, Amsellem S, Fishelson S, Bouscary D, Valensi F, Varet B, Solary E, Hermine O. 2001. Caspase activation is required for terminal erythroid differentiation. The Journal of Experimental Medicine , 193 :247–254. doi:10.1084/jem.193.2.247 |
| Zhang C, Zhou L W, Zhang F, Lü D Y, Li N, Zheng L, Xu Y H, Li Z, Sun S J, Long M. 2016. Mechanical remodeling of normally-sized mammalian cells under a gravity vector. FASEB Journal, 2016 Nov 8. pii: fj.201600897RR. |
| Zhang L, Liu W, Zhao J, Ma X, Shen L, Zhang Y, Jin F, Jin Y. 2016. Mechanical stress regulates osteogenic differentiation and RANKL/OPG ratio in periodontal ligament stem cells by the Wnt/ β-catenin pathway . Biochimica et Biophysica Acta , 1860 :2211–2219. doi:10.1016/j.bbagen.2016.05.003 |
| Zhang W, Kong C W, Tong M H, Chooi W H, Huang N, Li R A, Chan B P. 2016. Maturation of human embryonic stem cell-derived cardiomyocytes (hESC-CMs) in 3D collagen matrix: Effects of niche cell supplementation and mechanical stimulation. Acta Biomaterialia, 24, pii: S1742-7061(16) 30654-7. |
| Zhu Z, Gan X, Fan H, Yu H. 2015. Mechanical stretch endows mesenchymal stem cells stronger angiogenic and anti-apoptotic capacities via NF κB activation . Biochemical and Biophysical Research Communications , 468 :601–605. doi:10.1016/j.bbrc.2015.10.157 |


