文章信息
- 李志能, 江英杰, 陈竟, 李婷, 眭顺照, 李名扬.
- Li Zhineng, Jiang Yingjie, Chen Jing, Li Ting, Sui Shunzhao, Li Mingyang.
- 蜡梅CpWOX13基因的表达及功能
- Expression and Function of CpWOX13 Gene in Chimonanthus praecox
- 林业科学, 2019, 55(7): 77-85.
- Scientia Silvae Sinicae, 2019, 55(7): 77-85.
- DOI: 10.11707/j.1001-7488.20190708
-
文章历史
- 收稿日期:2018-07-16
- 修回日期:2018-09-13
-
作者相关文章
2. 新疆建设职业技术学院 乌鲁木齐 830054
2. Xinjiang Vocational and Technical College of Construction Urumqi 830054
同源异型盒(homeobox, HB)转录因子超家族, 是一类主要存在于真核生物体内的转录因子, 得名于含有同源异型结构域(homeodomain, HD), 植物中特有的WUSCHEL(WUS)相关同源异型盒(WUSCHEL related homeobox, WOX)转录因子家族也属于HB转录因子超家族, WOX转录因子同样含有同源异型结构域(HD), 与其他的HB转录因子最大的不同在于WOX蛋白具有其特有的WUS盒(WUS-box)结构, 其基本的组成是T-L-X-L-F-P-X-X(X为任意氨基酸)(Haecker et al., 2004)。近年来报道的WOX基因无一例外的在植物中被发现, 所以普遍认为WOX是植物特有的转录因子, 并且把植物中具有WUS盒的转录因子都归为WOX转录因子家族。如在拟南芥(Arabidopsis thaliana)中的15个成员(WUS、WOX1-WOX14)分别参与了胚的发育、花器官的形成、花发育、侧生器官的发育以及茎尖和根尖顶端分生区干细胞的维持等重要生命活动。系统进化分析表明拟南芥中的WOX蛋白存在3个进化支, 分别为:WUS进化支(WUS clade), 即现代进化支, 包括WUS、WOX1、WOX2、WOX3、WOX4、WOX5、WOX6、WOX7以及它们在种子植物中的直系同源蛋白; 中间进化支(Intermediate clade), 是WUS进化支的姐妹进化支, 包括WOX8、WOX9、WOX11、WOX12以及它们在维管植物中的直系同源蛋白; 古老进化支(Ancient clade), 包括WOX10、WOX13和WOX14及它们在维管和非维管植物中的直系同源蛋白(Mayer et al., 1998; Ueda et al., 2011; van der Graaff et al., 2009; Lin et al., 2013a; 2013b; Zhang et al., 2011a)。
1996年Laux最早发现并确定了WUS基因功能(Laux et al., 1996), 该研究发现突变体中真叶的缺失与顶端优势的消失呈正相关, WUS基因的缺失导致种子萌发速度变慢, 发育迟缓甚至停滞, 分枝数量和密度呈上升趋势, 主茎态势不明显, 且分枝重复主茎莲座叶的发育模式。随后WOX1、WOX2、WOX4、WOX5、WOX6、WOX8、WOX9、WOX11、WOX12被成功克隆出具有WUS同源异型盒的基因序列, 它们编码182~378个氨基酸, 分析其结构发现是WUS同源异型结构域蛋白中的WOX蛋白家族成员(Haecker et al., 2004)。此后关于WOX家族基因的研究逐步深入, 系统地形成了三大分支的基本分类体系, WOX13基因是WOX基因家族的成员, 属于古老进化支, 在拟南芥中参与成花转化和根的发育过程, 也与莲座叶的发育有关, 此外还参与花器官发育过程的调控。这一类转录因子, 参与植物干细胞的调控。
蜡梅(Chimonanthus praecox)是木兰亚纲(Magnoliids)樟目(Laurales)蜡梅科(Calycanthaceae)蜡梅属(Chimonanthus)植物, 作为少有的冬季开花植物, 其花香浓郁, 具有较高经济和观赏价值, 因此对其花发育研究十分有意义。蜡梅花发育相关基因研究表明:CpAP3在花被片中表达量最高、心皮中次之、雄蕊和茎中表达量最低, 过表达拟南芥没有表型变异, 却会影响矮牵牛(Petunia hybrida)花冠、花瓣和雄蕊的发育(Zhang et al., 2011b); 异位表达CpAGL6导致拟南芥早花、雌雄蕊发育异常和不同程度的不育(Wang et al., 2011), 该基因启动子能够驱动GUS基因在转基因烟草(Nicotiana tabacum)的叶、茎、花中表达, 且在不同花期表达强度存在差异, 根中几乎不表达(敬帆等, 2015); 同时, 露瓣、盛开和衰败期蜡梅花蕾进行Illumina转录组测序也为蜡梅花发育研究奠定了基础(Liu et al., 2014)。拟南芥中WOX13参与成花转化和根的发育过程, 也与莲座叶的发育有关, 此外还参与花器官发育过程的调控, 所以, 对蜡梅中CpWOX13基因功能研究可以为进一步研究进化地位较低的物种——蜡梅开花的调控机制提供更多的线索。
1 材料与方法 1.1 材料试验材料罄口蜡梅(C. praecox ‘grandiflorus’)种植于西南大学校园第四运动场旁边, 常规养护管理。拟南芥哥伦比亚野生型(Col-0)及转化株系均种植在22 ℃、长日照条件(16 h光照/8 h黑暗)人工气候室。根据课题组前期石蜡切片研究结果, 采集蜡梅花芽样品:4月份花芽(4FB, flower bud in April), 花被片原基分化阶段(stage of tepal primordia differentiation); 5月份花芽(5FB, flower bud in May), 雌、雄蕊原基分化阶段(stage of stamen and pistil primordia differentiation); 7月份花芽(7FB, flower bud in July), 原基分化停止阶段、夏季休眠(stage of primordia differentiation cease, summer dormancy); 9月份花芽(9FB, flower bud in September), 花器官分化完成阶段(stage of flower organ differentiation completed)(江英杰等, 2016)。拟南芥T2代转化苗现蕾前的全株, 于干冰上采样后-80 ℃低温保存, 用于RNA提取。总RNA提取试剂Trizol、RNAprep Pure植物总RNA提取试剂盒、质粒提取(小量)试剂盒、DNA胶回收试剂盒和DNA分子量标准DL2000均购自天根生化科技(北京)有限公司; Prime Script® RT-PCR Kit反转录试剂盒等均购自TaKaRa公司(大连); Goldview核酸染料购自赛佰特生物科技有限公司(北京); Eva Green荧光定量染料购自百乐(Bio-Rad, 美国)公司; 试验中所用引物合成及测序由上海英潍捷基生物技术有限公司和成都擎科生物有限公司完成; 其他化学试剂均采购自上海生物工程有限公司。
大肠杆菌(Escherichia coli)菌株DH5α由本实验室保存, 克隆菌株感受态细胞DH5α由本实验室自制, 根癌农杆菌(Agrobacterium tumefaciens)植物表达菌株GV3101由本实验室自制。pMD19-T克隆载体购自于日本TaKaRa公司(大连)。pCAMBIA2301G植物表达载体由本实验室保存。
1.2 蜡梅CpWOX13基因克隆及系统进化分析RNA提取采用RNAprep Pure植物总RNA提取试剂盒(天根, 北京), cDNA的合成使用宝生物的PrimerScript RTMaster Mix试剂盒(TaKaRa, 大连)。RNA浓度和质量检测用NanoDrop 2000分光光度计和琼脂糖凝胶电泳。PCR扩增程序为:94 ℃变性5 min; 94 ℃变性30 s, 58 ℃退火30 s, 72 ℃延伸1 min, 26个循环; 72 ℃延伸10 min。基因克隆和过表达载体构建所用PCR引物分别为CpWOX13-F+CpWOX13-R和CpWOX13-v-F+ CpWOX13-v-R(表 1)。加酶切位点的PCR反应混合液经纯化回收后进行BamHⅠ和EcoRⅠ双酶切, PCR产物及双酶切产物经1%琼脂糖凝胶电泳检测, 将大小在800~1 000 bp之间扩增产物和酶切产物条带的胶切下来, 用DNA胶回收试剂盒进行回收(天根, 北京)。回收产物经1%琼脂糖凝胶电泳检测后连接pMD19-T载体, 经蓝白筛选后, 用M13-F+M13-R引物(表 1)组合检测(PCR程序同上), 菌液PCR扩增片段与胶回收条带大小一致的克隆子为阳性克隆子, 送公司测序。
|
|
序列分析和多序列比对使用Vector NTI 11.5和ClustalX1.83软件, 基因序列作图使用genedoc软件, 系统进化分析使用MEGA4软件(Tamura et al., 2007), 采用Neighbor Joining (NJ)分析法Poisson correction模型和Complete deletion数据处理, 使用1 000个重复进行Bootstrap检验。将蜡梅WOX家族同源基因命名为CpWOX13。蜡梅CpWOX13蛋白序列系统进化分析所用蛋白质序列信息如下:拟南芥(Arabidopsis thaliana)WOX1A (NP_188428), WOX1B (AAP37133), WOX2A (OAO90278), WOX2B (AAP37131), WOX3(NP_180429), WOX4A (NP_001320246), WOX4B (NP_175145), WOX5 (NP_187735), WOX6 (OAP08493), WOX7A (NP_196196), WOX7B (AIR72305), WOX7C (OAO92889), WOX8 (NP_199410), WOX9(NP_180944), WOX10(NP_173494), WOX11A (NP_187016), WOX11B (AAP37140), WOX12A (NP_197283), WOX12B (NP_001330983), WOX13(NP_195280), WOX14A (NP_001322715), WOX14B (NP_173493), WUS (CAA09986)。短花稻(Oryza brachyantha)WOX3-like (XP_015692532);水稻(Oryza sativa Japonica Group)WOX2 (XP_015639083), WOX4 (XP_015635367);荷花(Nelumbo nucifera)WUS (AAP37131), WOX1-like (XP_010274717), WOX2 (XP_010260182), WOX3-like (XP_010259966), WOX4-like (XP_010270556), WOX5-like (XP_010262794), WOX7-like (XP_010256620), WOX9-like (XP_010279211), WOX11 (XP_019054443);葡萄(Vitis vinifera)WOX13 (XP_002279942);毛白杨(Populus tomentosa)WUS1(FJ23 2063), WUS2(FJ23 2064), WOX11/12a(KF982710)和WOX4a(KF982703)。
1.3 拟南芥转化及表型分析将蜡梅CpWOX13基因的过表达载体通过浸花法转化拟南芥哥伦比亚野生型(Col-0)(Clough et al., 1998)。转化后的T1代种子在含有50 μg·mL-1卡那霉素的MS琼脂培养基中进行筛选, 取显蕾之前的转基因拟南芥及野生型拟南芥全株并提取基因组DNA, 用CpWOX13基因特异引物CpWOX13-F+CpWOX13-R进行PCR检测, 并观察PCR阳性植株的表型。通过卡方检测, 选择符合3:1分离比的转基因株系, 选择qRT-PCR检测CpWOX13相对表达量有差异的株系如1.1所述条件下种植, 并统计T2代25~30株转化个体的开花时间和开花形态特征, 取平均值采用SPSS18.0软件通过t检验进行方差分析。
1.4 实时定量RT-PCR取蜡梅各发育阶段的茎分生组织、花分生组织和拟南芥T2代转化苗现蕾前的全株, 用Trizol试剂盒提取总RNA, 经DNase处理去除gDNA并纯化后, 用PrimeScript RT reagent Kit (Takara, 大连)进行cDNA第1链的反转录。将cDNA第1链稀释10倍后作为模板进行PCR反应。然后利用SYBR Premix Ex Taq (Bio-Rad, USA)反应试剂盒, 在Bio-Rad CFX96荧光定量PCR仪(Bio-Rad, 美国)上完成反应, 并分析基因相对表达量。PCR反应体系为10 μL, 共设置3个重复, 反应条件为40个循环, 95 ℃ 60 s, 95 ℃ 5 s, 60 ℃ 34 s, 引物见表 1。拟南芥Actin和蜡梅Tublin为内参基因(Liu et al., 2017)(表 1), 检测CpWOX13、WOX13、LFY、AP1、AG、PI、GA20的相对表达量。
2 结果与分析 2.1 CpWOX13基因序列分析及同源性比对RT-PCR扩增得到927 bp包含全长编码序列的cDNA, 通过软件Vector NTI Advance 11.5对该基因的核酸序列进行分析, 结果表明, 其cDNA序列包含588 bp的ORF框和40 bp/299 bp的5′/3′-UTR区, 共编码195个氨基酸。该基因编码的蛋白质序列与WOX13同源性最高, 系统进化树显示CpWOX13与拟南芥和葡萄WOX13聚为一支, 将该基因命名为CpWOX13(GenBank Accession:MH753006)。
在NCBI中用Blastp对CpWOX13的氨基酸序列进行同源性比对, 结果显示其与拟南芥WOX13同源性最高达54%, 其次是古老进化支中的WOX10和WOX14, 同源性分别为46%和44%;与中间进化支中的WOX8、WOX11和WOX12的同源性分别为25%、28%和27%;与WUS进化支中的WUS、WOX1、WOX2、WOX4、WOX5和WOX7的同源性分别为24%、22%、26%、17%、24%和25%(图 1A), 与毛白杨PtoWOX11/12a、PtoWOX4a、PtoWUS1和PtoWUS2的同源性分别为47%、47%、47%和48%。
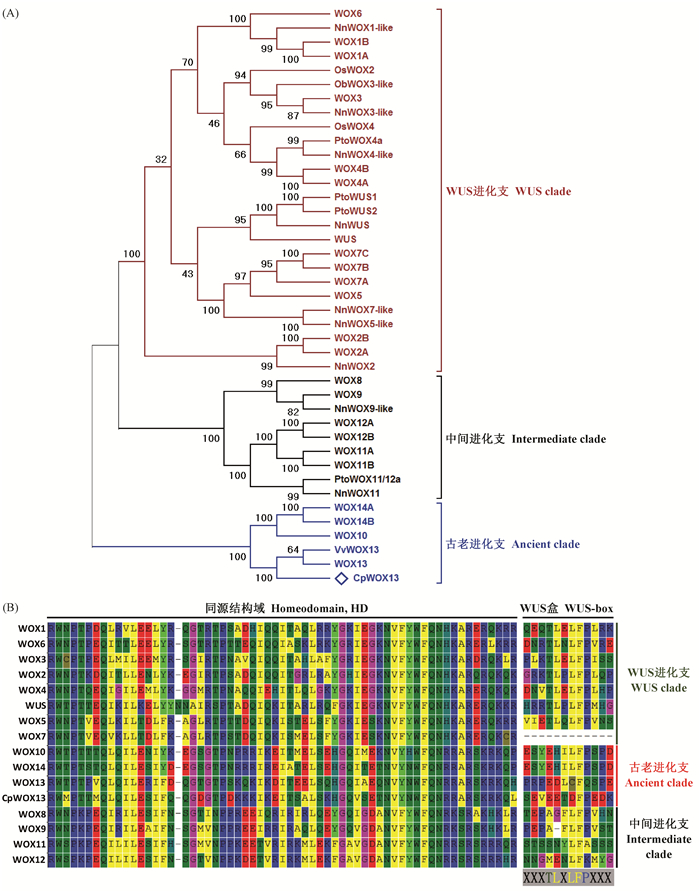
|
图 1 CpWOX13系统进化树(A)和结构域分析(B) Fig. 1 CpWOX13 protein phylogenetic (A) and domain (B) analysis Cp:蜡梅Chimonanthus praecox ‘grandiflorus’; Ob:短花稻Oryza brachyantha; Os:水稻Oryza sativa Japonica Group; Nn:荷花Nelumbo nucifera; Vv:葡萄Vitis vinifera; Pto:毛白杨Populus tomentosa.其他蛋白来自拟南芥。Other proteins are from Arabidopsis thaliana. |
CpWOX13编码的蛋白质序列与拟南芥WUS同源蛋白序列进行系统进化分析, 采用NJ法, 检验参数设置为1 000 bootstrap重复, 通过MEGA4构建进化树。如图 1 A所示, 所有的蛋白序列被分为明显的3个组, 分别对应WOX家族3个进化支, 即WUS进化支(WUS clade)、古老进化支(Ancient clade)和中间进化支(Intermediate clade, WUS进化支的姐妹进化支), 蜡梅CpWOX13与葡萄WOX13及拟南芥WOX13、WOX10、WOX14A和WOX14B聚为一支, 都属于古老进化支(图 1A), 该结果与前人研究报道(van der Graaff et al., 2009)一致。各成员除含有HD结构域外, 还含有其他功能元件, 如WUS支的成员在HD的羧基端一侧含有1个WUS-box结构域(一般形式是T-L-X-L-F-P-X-X, X代表任意氨基酸), 其他2支也存在相似结构域(Ikeda et al., 2009), WUS支成员WUS-box起始氨基酸为T-L, 古老支和中间支起始氨基酸并不固定(Lin et al., 2013a), 它们并不具有WUS(图 1B), WUS盒是WUS调控茎尖分生组织干细胞平衡和参与花分生组织形态建成必不可少的元件(Ikeda et al., 2009)。以上结果表明, 蜡梅CpWOX13聚类到WOX基因家族的古老支, 不具有WUS-box特征结构域。
2.2 蜡梅CpWOX13基因表达分析对蜡梅CpWOX13基因在不同月份的花芽中表达分析, 发现该基因在4FB(4月份花被片原基分化阶段的花芽)、5FB(5月份雌、雄蕊原基分化阶段的花芽)、7FB(7月份原基分化停止阶段、夏季休眠的花芽)和9FB(9月份花器官分化完成阶段的花芽)中均有表达, 但表达水平有较大差异(图 2)。该基因在5FB时期表达量最高, 是4FB中表达量的6.5倍, 分别是7FB和9FB的3.8倍和3.3倍, 而7FB和9FB表达量差别不大(图 2), 表明CpWOX13可能参与蜡梅雌、雄蕊原基的分化。
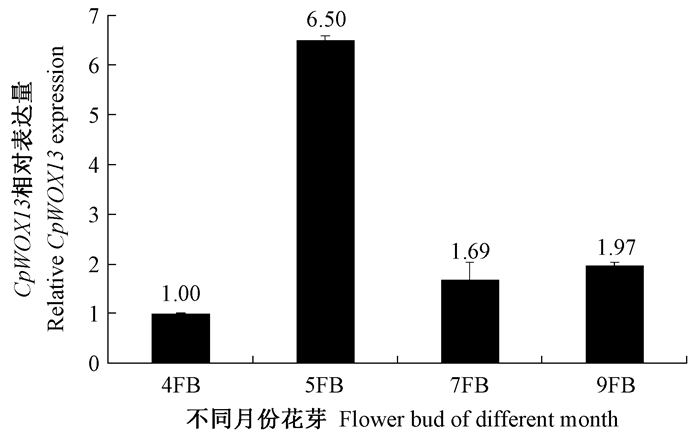
|
图 2 CpWOX13在蜡梅不同发育阶段花芽中表达分析 Fig. 2 Relative CpWOX13 gene expression analysis in flower bud of different month in Chimonanthus praecox by qRT-PCR 4FB, 5FB, 7FB, 9FB:分别为4月、5月、7月和9月份的花芽 Flower bud in April, May, July and September, respectively. |
对蜡梅35S∷CpWOX13过表达拟南芥株系单株中CpWOX13基因的表达量进行qRT-PCR检测, 35S∷CpWOX13/Col-0的T2代转基因的拟南芥中, CpWOX13基因在不同过表达拟南芥株系间相对表达量存在一定的差异, 表达量从高到低依次为OE8#>OE2#>OE7#>OE3#>OE6#>OE4#>OE1#, OE8#株系CpWOX13基因的相对表达量是OE1#株系的11.3倍。其中CpWOX13在OE8#和OE3#株系中的相对表达量分别是OE6#株系中的2.1倍和1.5倍(图 3), 挑选CpWOX13基因表达量高的OE8#、表达量中等的OE3#和表达量低的OE6#株系, 观察、分析其表型, 并检测拟南芥内源基因的相对表达量。
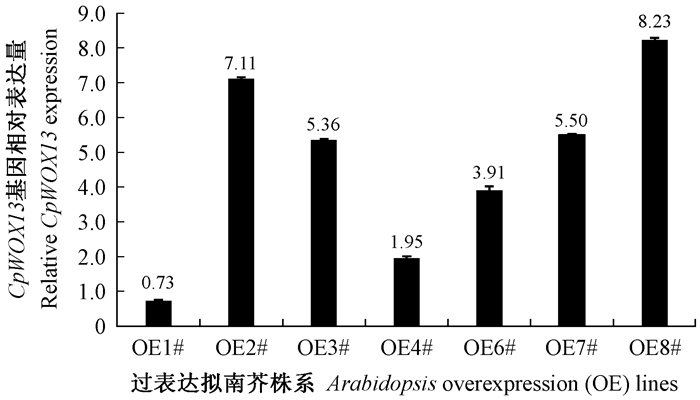
|
图 3 CpWOX13基因在35S∷CpWOX13/Col-0株系中表达分析 Fig. 3 Relative CpWOX13 gene expression analysis in 35S∷CpWOX13/Col-0 lines by qRT-PCR |
与野生型相比较, 35S∷CpWOX13/Col-0过表达株系OE6#、OE3#和OE8#中, 6个拟南芥内源基因(WOX13、LFY、AP1、AG、PI、GA20)的表达量均显著增加, 最低的都增加了2倍, 说明CpWOX13基因过量表达拟南芥会上调其开花相关基因的表达(图 4)。其中, 拟南芥LFY、AG基因的相对表达量表现出较为一致的变化趋势, 依次为OE8#> OE3#>OE6#; WOX13在OE8#和OE3#中的表达量相近、略高于在OE6#中的表达量; AP1与GA20基因的表达趋势类似, 依次为OE8#>OE6#>OE3#; PI表达量依次为OE3#>OE8#>OE6#(图 4)。
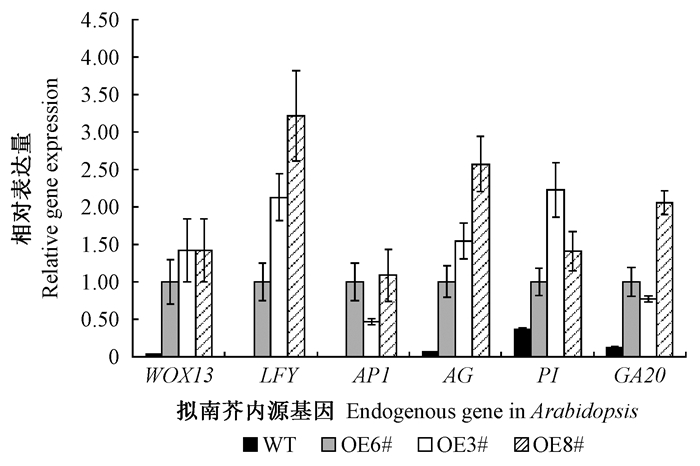
|
图 4 拟南芥内源基因在35S∷CpWOX13/Col-0过表达株系OE6#、3#、8#和WT中相对表达量分析 Fig. 4 Relative gene expression analysis of Arabidopsis endogenous genes in 35S∷CpWOX13/Col-0 overexpression lines OE6#, OE3#, OE8# and WT by qRT-PCR |
观察、统计并分析转基因拟南芥T2代株系和WT的表型, 结果显示:转基因拟南芥的3个株系与野生型拟南芥相比, 莲座叶的数量均比野生型的减少, 差异显著; 此外, 转基因拟南芥茎生叶普遍增多, OE8#与WT差异显著(图 5A, B, 表 2); 抽薹的时间(抽薹标志定为抽薹至1 cm左右)、第1朵花开的时间, OE3#、OE6#和OE8#与WT相比差异显著, 皆早于WT, 而3个转基因株系之间无明显差异; 在结第1个果荚的时间上3个株系均与WT存在显著差异, OE8#株系分别与OE6#和OE3#株系无显著差异, 但后二者之间存在显著差异。另外, 竖直培养皿发芽试验结果显示, 35S∷CpWOX13的T2代与WT植株根的萌发时间相差不大, 但生长速度有所不同, 野生型拟南芥明显偏慢; 转基因拟南芥根长比WT拟南芥长, 并且转基因拟南芥主根上的侧根分支明显多于WT(图 5C); 35S∷CpWOX13/Col-0的T2代株系与WT拟南芥相比株高增高, OE3#、OE8#与WT相比株高均增加约12 cm, OE6#与WT相比株高增加10 cm, 且具有显著差异(图 5D, 表 2)。以上结果表明, 过表达CpWOX13基因不仅引起拟南芥早花, 同时也影响了植株根的发育以及株高。

|
图 5 35S∷CpWOX13/Col-0过表达株系(OE6#、3#和8#)T2代拟南芥与野生型对照表型分析 Fig. 5 Phenotype analysis of different 35S∷CpWOX13/Col-0 overexpression T2 lines (OE6#, OE3# and OE8#) and WT in Arabidopsis A, B. 28天过表达拟南芥T2代(OE6#, OE3#和OE8#)第1朵花现蕾时过表达株系与WT(Col-0)表型差异; C.拟南芥种子播种于无抗性的MS培养基上的根系表型对比, 红色方框所示为WT, 其他均为不同35S∷CpWOX13/Col-0株系T2代种子, 转基因拟南芥根长明显长于WT, 且侧根数目增多; D. 60天过表达拟南芥T2代与野生型结最后的果荚时植株高度对比。 A, B. Phenotype difference between 35S∷CpWOX13/Col-0 overexpression (OE6#, OE3# and OE8#) and WT when the 1st flower appeared; C. Root phenotype difference on MS medium without antibiotic, plants in red rectangle are WT, others are different T2 lines of OE6#, OE3# and OE8#, and the length of axial root and the number of lateral roots of transgenic lines increased significantly; D. Plant height difference between OE6#, OE3#, OE8# and WT when the last pot appeared on the 60th day after sowing. |
|
|
本研究克隆了蜡梅CpWOX13基因cDNA序列, 系统进化分析发现蜡梅CpWOX13与拟南芥和葡萄WOX13聚在一起, 同属于古老进化支, 含有WUS家族共有的HD结构域, 但不具有典型的WUS-box特征序列TLXLFPXX(Haecker et al., 2004), 而是EETDFPED。这一差异可能与蜡梅的进化地位有关, 蜡梅隶属于进化地位很低的木兰亚纲樟目, 与蔷薇类核心真双子叶模式植物拟南芥进化地位相差较远。
不同物种中WOX13同源基因的表达模式差异较大, 拟南芥WOX13主要在胎座等分生组织中表达, 该基因有助于拟南芥果实中胎座的形成, WOX13也在初生根和侧根的发生和发育、雌蕊群和胚胎的发育过程中表达, 在花芽和花序中也有较高表达, 参与侧根的发育和花器官的形成(Romera-Branchat et al., 2013)。在苔藓类植物中, 小立碗藓(Physcomitrella patens) PpWOX13L基因是开花植物中的干细胞调节子同源基因, 在干细胞形成过程中瞬时上调表达且与细胞生长的起始有关, 参与叶片和原生质体细胞向干细胞的转变过程(Sakakibara et al., 2014)。毛白杨PtoWOX4a在茎中表达量最高, 且主要集中在木质部和韧皮部, 在根中表达水平次之, 而在叶片等其他组织中的表达量较低(李建波等, 2018), PtoWOX11/12a基因在杨树(Populus)不定根形成和生长过程中发挥作用(李真等, 2017)。本研究发现蜡梅CpWOX13在5月份雌、雄蕊原基分化阶段的花芽中的表达量远高于其他发育阶段, 推测其可能参与蜡梅雌、雄蕊的形成。
在过表达蜡梅CpWOX13转基因拟南芥的表型观察中发现, 35S∷CpWOX13/拟南芥开花提前; qRT-PCR结果显示转基因拟南芥中CpWOX13基因的过量表达引起了其内源开花关键基因LFY和AP1的表达上调, 进而促进拟南芥过表达株系早花, 该结果与已报道的拟南芥中的研究结果(Jack, 2004; Krizek et al., 2005; Parcy, 2005)一致; 同时, 在35S∷CpWOX13/拟南芥与野生型株系内源基因的相对表达量分析中发现, 被激活的LFY会上调B类基因PI的表达, LFY和WUS共同激活C类基因AG的表达, 以上内源基因qRT-PCR结果与早期在拟南芥中的研究结果(Lenhard et al., 2001; Lohmann et al., 2001)一致。另外, CpWOX13过表达拟南芥株系的主根明显长于WT、主根上的侧根分支明显增多, 株高远超过WT, 其中株高的增长(即地上部生物量的增加)可能与过表达拟南芥地下部分主根变长、侧根分支增多有关; 前人对拟南芥WOX13基因的研究表明, 拟南芥wox13功能缺失突变体胎座变小, 侧根数量减少, 角果发育异常(Romera-Branchat et al., 2013)。本文研究结果与拟南芥WUS参与花发育和WOX13影响根系发育的基因功能研究结果(Deveaux et al., 2008)相似, 推测CpWOX13可能参与调控蜡梅花和根系的发育, 其分子机理有待进一步研究。
4 结论CpWOX13基因为WOX家族同源基因, 在蜡梅花发育过程中参与蜡梅雌、雄蕊原基的分化, 35S∷CpWOX13过表达拟南芥的研究结果表明蜡梅CpWOX13基因可能参与调控花发育、促进植物开花, 并参与植物根的发育, 进而影响植物生长发育。本研究揭示了CpWOX13在蜡梅花发育和根组织发育中的作用, 为深入探索WOX基因参与植物不同器官生长发育的调控机制提供了参考。
江英杰, 李婷, 张弈, 等. 2016. 蜡梅花芽分化的初步研究. 中国观赏园艺研究进展: 288-291. (Jiang Y J, Li T, Zhang Y, et al. 2016. Preliminary studies on the flower bud differentiation of wintersweet. Advances in Ornamental Horticulture of China: 288-291. [in Chinese]) |
敬帆, 罗登攀, 马婧, 等. 2015. 蜡梅CpAGL6基因启动子的克隆及功能初步分析. 园艺学报, 42(6): 1139-1149. (Jing F, Luo D P, Ma J, et al. 2015. Cloning and preliminary functional analysis of CpAGL6 promoter from Chimonanthus praecox. Acta Horticulturae Sinica, 42(6): 1139-1149. [in Chinese]) |
李建波, 贾会霞, 张进, 等. 2018. 毛白杨PtoWOX4a基因过表达对次生生长的影响. 林业科学, 54(2): 52-59. (Li J B, Jia H X, Zhang J, et al. 2018. Effect of overexpression of Populus tomentosa WUSCHEL-related homeobox 4 (PtoWOX4a) on the secondary growth of poplar. Scientia Silvae Sinicae, 54(2): 52-59. [in Chinese]) |
李真, 王留强, 卢孟柱. 2017. 毛白杨PtoWOX11/12a对杨树扦插苗生长发育的影响. 林业科学, 53(11): 69-76. (Li Z, Wang L Q, Lu M Z. 2017. Effects of PtoWOX11/12a gene from Populus tomentosa on the growth and development of cutting seedlings in poplar. Scientia Silvae Sinicae, 53(11): 69-76. DOI:10.11707/j.1001-7488.20171108 [in Chinese]) |
Clough S J, Bent A F. 1998. Floral dip:a simplified method for Agrobacterium-mediated transformation of Arabidopsis thaliana. Plant Journal, 16(6): 735-743. DOI:10.1046/j.1365-313x.1998.00343.x |
Deveaux Y, Toffano-Nioche C, Claisse G, et al. 2008. Genes of the most conserved WOX clade in plants affect root and flower development in Arabidopsis. BMC Evolutionary Biology, 8(1): 291. |
Haecker A, Gross-Hardt R, Geiges B, et al. 2004. Expression dynamics of WOX genes mark cell fate decisions during early embryonic patterning in Arabidopsis thaliana. Development, 131(3): 657-668. |
Ikeda M, Mitsuda N, Ohme-Takagi M. 2009. Arabidopsis WUSCHEL is a bifunctional transcription factor that acts as a repressor in stem cell regulation and as an activator in floral patterning. Plant Cell, 21(11): 3493-3505. DOI:10.1105/tpc.109.069997 |
Jack T. 2004. Molecular and genetic mechanisms of floral control. Plant Cell, 16(Suppl): S1-S17. |
Krizek B, Fletcher J. 2005. Molecular mechanisms of flower development:An armchair guide. Nature Reviews Genetics, 6(9): 688-698. DOI:10.1038/nrg1675 |
Laux T, Mayer K F, Berger J, et al. 1996. The WUSCHEL gene is required for shoot and floral meristem integrity in Arabidopsis. Development, 122(1): 87-96. |
Lenhard M, Bohnert A, Jurgens G, et al. 2001. Termination of stem cell maintenance in Arabidopsis floral meristems by interactions between WUSCHEL and AGAMOUS. Cell, 105(6): 805-814. DOI:10.1016/S0092-8674(01)00390-7 |
Lin H, Niu L, McHale N A, et al. 2013a. Evolutionarily conserved repressive activity of WOX proteins mediates leaf blade outgrowth and floral organ development in plants. Proceedings of the National Academy of Sciences of the United States of America, 110(1): 366-371. DOI:10.1073/pnas.1215376110 |
Lin H, Niu L, Tadege M. 2013b. STENOFOLIA acts as a repressor in regulating leaf blade outgrowth. Plant Signal Behav, 8(6): e24464. DOI:10.4161/psb.24464 |
Liu D F, Sui S Z, Ma J, et al. 2014. Transcriptomic analysis of flower development of wintersweet (Chimonanthus praecox). PLoS ONE, 9(1): e86976. DOI:10.1371/journal.pone.0086976 |
Liu H M, Huang R W, Ma J, et al. 2017. Two C3H type zinc finger protein genes, CpCZF1 and CpCZF2, from Chimonanthus praecox affect stamen development in Arabidopsis. Genes, 8(8): E199. DOI:10.3390/genes8080199 |
Lohmann J, Hong R, Hobe M, et al. 2001. A molecular link between stem cell regulation and floral patterning in Arabidopsis. Cell, 105(6): 793-803. DOI:10.1016/S0092-8674(01)00384-1 |
Mayer K F, Schoof H, Haecker A, et al. 1998. Role of WUSCHEL in regulating stem cell fate in the Arabidopsis shoot meristem. Cell, 95(6): 805-815. DOI:10.1016/S0092-8674(00)81703-1 |
Parcy F. 2005. Flowering:A time for integration. The International Journal of Developmental Biology, 49(5/6): 585-593. |
Romera-Branchat M, Ripoll J J, Yanofsky M F, et al. 2013. The WOX13 homeobox gene promotes replum formation in the Arabidopsis thaliana fruit. Plant Journal, 73(1): 37-49. |
Sakakibara K, Reisewitz P, Aoyama T, et al. 2014. WOX13-like genes are required for reprogramming of leaf and protoplast cells into stem cells in the moss Physcomitrella patens. Development, 141(8): 1660-1670. DOI:10.1242/dev.097444 |
Tamura K, Dudley J, Nei M, et al. 2007. MEGA4:molecular evolutionary genetics analysis (MEGA) software version 4.0. Molecular Biology and Evolution, 24(8): 1596-1599. DOI:10.1093/molbev/msm092 |
Ueda M, Zhang Z, Laux T. 2011. Transcriptional activation of Arabidopsis axis patterning genes WOX8/9 links zygote polarity to embryo development. Developmental Cell, 20(2): 264-270. DOI:10.1016/j.devcel.2011.01.009 |
van der Graaff E, Laux T, Rensing S A. 2009. The WUS homeobox-containing (WOX) protein family. Genome Biology, 10(12): 248. DOI:10.1186/gb-2009-10-12-248 |
Wang B G, Zhang Q, Wang L G, et al. 2011. The AGL6-like gene CpAGL6, a potential regulator of floral time and organ identity in Wintersweet (Chimonanthus praecox). Journal of Plant Growth Regulation, 30(3): 343-352. DOI:10.1007/s00344-011-9196-x |
Zhang Y, Wu R, Qin G, et al. 2011a. Over-expression of WOX1, leads to defects in meristem development and polyamine homeostasis in Arabidopsis. Journal of Integrative Plant Biology, 53(6): 493-506. DOI:10.1111/j.1744-7909.2011.01054.x |
Zhang Q, Wang B G, Duan K, et al. 2011b. The paleoAP3-type gene CpAP3, an ancestral B-class gene from the basal angiosperm Chimonanthus praecox, can affect stamen and petal development in higher eudicots. Development Genes and Evolution, 221(2): 83-93. DOI:10.1007/s00427-011-0361-9 |
 2019, Vol. 55
2019, Vol. 55

