文章信息
- 陈丽, 代松, 马青江, 邓先静, 朱铭玮, 李淑娴.
- Chen Li, Dai Song, Ma Qingjiang, Deng Xianjing, Zhu Mingwei, Li Shuxian.
- 合欢种皮结构及其与吸水的关系
- Structure of Seed Coat of Albizia julibrissin and Its Relationship with Water Uptake
- 林业科学, 2019, 55(5): 46-54.
- Scientia Silvae Sinicae, 2019, 55(5): 46-54.
- DOI: 10.11707/j.1001-7488.20190506
-
文章历史
- 收稿日期:2018-04-06
- 修回日期:2018-06-29
-
作者相关文章
2. 贵州省铜仁科学院 铜仁 554300;
3. 青海省林业厅种苗站 西宁 810008
2. Tongren Academy of Sciences Tongren 554300;
3. Forestry Seedling Station of Qinghai Xining 810008
种子吸水特性是研究种子休眠与萌发的关键问题。在种子吸水和萌发的研究中,以豆科(Leguminosae)植物种子为最多(Krishnan et al., 2004;李然等,2009;Kestring et al., 2009;Geisler et al., 2017)。多数豆科植物种子种皮坚厚致密,严重阻碍种子的吸水作用,也是研究吸水机制的理想材料。Rodrigues-Junior等(2014)通过密封小叶黄槐(Senna multijuga)种皮不同部位,测定其吸水量的差异,发现水分通过种脊进入种子内部。染色法则是通过观察吸水后种子的着色位置来判定种子的吸水位点,其中,最常用的指示剂为氯化三苯基四氮唑(TTC)溶液或苯胺蓝溶液。TTC是无色指标剂,被种子吸收后,可被活细胞还原型脱氢辅酶的氢还原,生成红色、稳定的不扩散物质,借以显示种子吸水后活力,由此分析种子内部组织的吸水情况(ISTA,2013)。Perissé等(2004)利用TTC染色法发现种脐处的微孔是白羽扇豆(Lupinus albus)和狭叶羽扇豆(L. angustifolius)种子的初始吸水位点。Zhou等(2015)对TTC染色不同时间的乌桕(Sapium sebiferum)种子观察发现,水分最先透过种皮的中间部位进入种子。苯胺蓝作为一种大分子染料,可通过没有生命的种皮,却能被原生质层阻挡在种胚以外,因此苯胺蓝也可用于探究种子的初始吸水位点以及水分在种皮中的迁移规律。Jayasuriya等(2008)对菟丝子(Cuscuta australis)种子进行苯胺蓝染色发现,水分最先通过种脐进入种子内部。Paula等(2012)利用苯胺蓝染色法研究Cassia leptophylla和Senna macranthera种子的吸水机制,发现种孔是其初始吸水位点。
合欢(Albizia julibrissin)是含羞草亚科(Mimosaceae)合欢属(Albizia)落叶乔木,在我国东北至华南以及西南部各省区均有分布,其生长迅速,能耐砂质土及干燥气候,树冠开展,开花如绒簇,可用作庭荫树和行道树,也是重要的荒山绿化造林的先锋树种(臧德奎,2012)。合欢心材黄灰褐色,边材黄白色,可用于制作家具;嫩叶可食用,老叶可洗衣物;树皮、花可入药,是一种集观赏和经济价值于一体的优质树种(中国科学院中国植物志编著委员会,1988)。合欢常采用种子进行繁殖,但种子具有硬实性,种皮吸水能力差,出苗不整齐,这给其育苗生产带来了一定困难。种皮结构及其吸水机制研究是解除其硬实性、促进种子吸水萌发的关键。目前,对合欢种子的研究仅在解除硬实性方法的探索方面,种皮形态结构虽有研究(郭学民等,2006;连洁琼,2013),但至今还未有关于合欢吸水机制以及种皮结构对其吸水影响的相关研究报道。为研究合欢种子种皮结构对其吸水的影响,本研究采用染色法和密封法,探究其初始吸水位点和吸水后水分在种子内的迁移规律,同时通过种皮结构的显微观察,分析种皮结构对其吸水的影响,以期为解除合欢种子的硬实性及其在育苗生产中的合理开发利用提供理论依据。
1 材料与方法 1.1 试验材料及处理2015年11月于江苏宿迁采集合欢种子,以水选法去除空粒、虫粒、种皮受损粒,将种子在室内自然阴干,在4 ℃冰箱中保存待用。
1.2 种皮结构观察取饱满的合欢种子,采用OLYMPUS SZX16体视显微镜和扫描电镜(scanning electron microscopy, SEM)对整粒种子、种皮结构(包括局部表皮、横、纵切面以及热水处理前后)进行观察。其中种子SEM横、纵切面样品的制备参照肖媛等(2013)的常用干燥法。
1.3 解除种子硬实性方法的探究取合欢种子若干,分别用初始温度为70、80、90 ℃的热水处理5 min,于室温下自然冷却24 h,对照用清水处理相同时间。随机抽取4×100粒种子(未充分吸胀的种子用单面刀片切除子叶末端一小部分使其能够吸水),取出种胚,根据林木种子检验规程(GB 2772—1999)(1999)的规定采用TTC染色法测定各处理种子的生活力。
1.4 种皮不同部位吸水量的差异将合欢种子分为3部分,对各部分吸水情况定量测定,分别是:①区,胚根端区域(包括种脐、种孔和种脊);②区,中间区域(椭圆形棱区域);③区,子叶末端区域(图 1)。

|
图 1 合欢种子分区示意 Fig. 1 Schematic diagram of a A. julibrissin seed HI:种脐Hilum;MI:种孔Micropyle;LE:种脊Lens;OE:椭圆形棱Oval-shaped edge. |
取合欢种子若干,采用1.3中的最佳温度处理种子,5 min后将种子从热水中取出,参照Rodrigues-Junior等(2014)的方法,根据图 1所示划定种子各区域,采用凡士林密封法分别测定各处理(标记为Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ)的吸水情况(表 1)。每个处理设4个重复,每个重复取30粒种子用千分之一天平称质量并记录各处理的初始质量。将各处理的种子分别置于装有清水的烧杯中,每隔4 h取出,擦除凡士林后,用吸水纸擦干种子表面的水分并称质量。再用凡士林涂抹种子的相应部位,重复上述操作,直至处理Ⅴ的种子吸水饱和为止。参照周健(2016)的方法分别计算各处理种子的吸水率并绘制吸水曲线。
|
|
取合欢种子若干,采用1.3中的最佳温度处理种子,5 min后将种子从热水中取出浸没于饱和苯胺蓝溶液中,置于35 ℃恒温箱染色。染色后每隔2 h取出部分种子,纵剖种子,在OLYMPUS SZX16体式显微镜下观察种子的着色情况。
1.5.2 TTC染色法取合欢种子若干,经1.5.1中相同方法解除休眠后,浸没于0.5%TTC溶液,置于35 ℃恒温箱中染色。染色后每隔2 h取出部分种子,剥除种皮,取出种胚,观察种胚的着色情况。
1.6 数据分析数据采集后用Excel 2010软件进行整理,采用SPASS 20.0对测定指标进行差异显著性分析。
2 结果与分析 2.1 合欢种子种皮结构观察对完整的合欢种子、局部表皮及热水处理前后种子的显微观察结果见图 2。合欢种子呈不规则扁椭圆形,种皮坚硬,黄褐色,种皮背腹面各有一条向外突出且长轴与种子纵轴平行的椭圆形棱(oval-shaped edge),该棱与种子外侧相距约1 mm(图 2A)。由扫描电镜结果可知,椭圆形棱处种皮开裂,故椭圆形棱是种皮表面的一道裂痕,其宽度为20~30 μm(图 2D)。种子尖端的种脐(hilum)和种孔(micropyle)清晰可见(图 2B)。由图 2G可知,种脐部位的表皮细胞呈网眼状排列,与其他部位相比较为疏松,但被厚厚的蜡质所覆盖;种孔是一个直径为15~20 μm的较为明显的封闭式小孔;种脊是位于种子顶端偏一侧的明显突起。通过种子纵切面的电镜观察发现,在种皮的一侧有一条从种脐开始平行于种皮表面的通道(图 2C)。通过对种子侧缘和背腹面表皮(图 2E、F)观察可知,种子侧缘表皮上有许多宽度为5~10 μm的细小裂缝,种子背腹面表皮细胞排列紧密,由许多交错的条状纹饰组成。对热水处理前后种子表面的微形态发生了明显变化(图 2G、H),原来封闭的种孔开启,种脊部位的表皮层破裂并出现一道较大的裂缝,种脐部位的蜡质也有所减少。

|
图 2 合欢种子表皮体视显微镜(A-C)和扫描电镜(D-H) Fig. 2 Microstructure of the A. julibrissin seed coat revealed by stereomicroscopy (A-C) and scanning electron microscopy (SEM) (D-H) A.完整种子;B.种脐区域;C.种脐部位纵切面图;D.椭圆形棱;E.种子侧缘表皮;F.种子背腹面表皮;G.种脐部位表皮;H.种脐部位表皮(热水处理后)。HI:种脐;LE:种脊;MI:种孔;OE:椭圆形棱;VB:维管束(C中黑色小箭头所指)。 A.Whole seed; B.Hilum region; C.Longitudinal section of hilum region; D.Oval-shaped edge; E.The later margin of the seed coat; F.Dorsal and ventral side of the seed coat; G.The hilum region of the seed coat; H.The hilum region of the seed coat after heating treatment. HI:Hilum; LE:Lens; MI:Micropyle; OE:Oval-shaped edge; VB:Vascular bundle (small black arrowhead in C). |
由图 3A可知,种子各部分种皮的厚度存在较大差异,其中背腹两侧较薄,厚度为198.30(±31.56)μm,侧缘部位较厚,为337.97(±24.69)μm。由图 3B可知,种皮由外向里主要由表皮层、栅栏层、石细胞层、厚壁细胞层和薄壁细胞层组成。种皮最外侧的表皮层由一层厚约30 μm的角质化细胞组成。与表皮层紧挨着的是一层厚度约为65 μm的栅栏层,栅栏层由长柱状石细胞纵向紧密排列而成,该层与表皮层交界处部分细胞硬化形成一条平行于种皮表面的连续线,即明线(light line),这种特殊结构使种子透性变差,是种子具有硬实性的重要原因(郭学民等,2006)。骨状石细胞层仅由一层细胞组成,呈“工”字形横向排列,细胞间有较大的间隙,排列疏松。厚壁细胞层由多层细胞组成,其细胞壁在种子成熟过程中木质化加厚,排列紧密,无细胞间隙。种皮的最内层为薄壁细胞层,形状不规则,组织疏松。
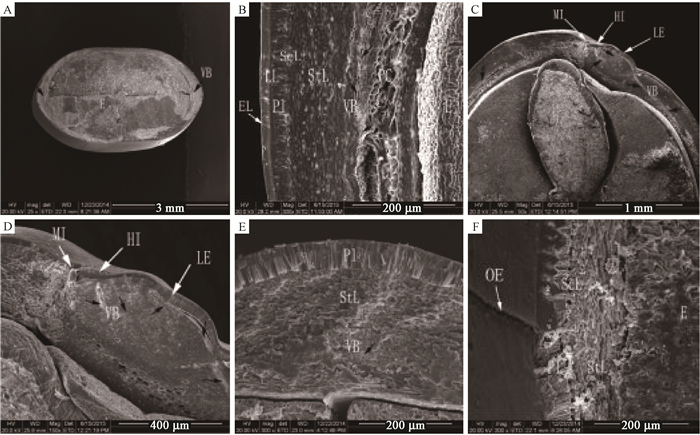
|
图 3 合欢种子横(A, E, F)、纵(B-D)切面结构 Fig. 3 Cross-sections (A, E, F) and longitudinal sections (B-D) of A. julibrissin seeds A.种子横切面;B.种皮结构;C.种脐部位切面结构;D.种脐部位切面结构;E.侧缘部位种皮结构;F.背腹部位种皮结构。HI:种脐;LE:种脊;MI:种孔;OE:椭圆形棱;LL:明线;VB:维管束(黑色箭头所示);EL:表皮层;Pl:栅栏层;StL:厚壁细胞层;PC:薄壁细胞;ScL:骨状石细胞层;E:胚。 A.Cross section of seed; B. Longitudinal section showing the structure of seed coat; C. Longitudinal section of hilum region; D. Longitudinal section of hilum region; E. The later margin showing the structure of seed coat; F. Dorsal and ventral side of the seed coat at. HI: Hilum; LE: lens; MI: Micropyle; OE: Oval-shaped edge; LL: Light line; VB: Vascular bundle(small black arrowhead in); EL: Epidermal layer; Pl: palisade layer; StL: Stereid layer; PC: Parenchymal cell; ScL: Osteosclereid layer; E: Embryo. |
在高倍镜下对种子纵切面(图 3B、D)和横切面(图 3E)观察发现,种子的侧缘面薄壁细胞层和厚壁细胞层之间存在螺纹状管胞(黑色箭头所示)。对种脐部位的切面观察发现,维管束贯穿于合欢种子的侧缘部位,且由种脐延伸至种脊的栅栏层,之后在厚壁细胞层和薄壁细胞层之间穿行。维管束在种子的发育过程中具有运输养分的作用,也可能是种子萌发时的吸水通道。对种子表面的椭圆形棱观察发现,该棱为种子表面一个大的较深的裂缝,此处的表皮层、栅栏层、石细胞层均已开裂(图 3F)。
2.2 解除合欢种子硬实性方法采用不同温度的热水处理后合欢种子的吸胀率和生活力结果见表 2。对照组吸水24 h后吸胀率仅为9.3%,因此合欢种子具有硬实性。随着热水处理温度的升高,种子的吸胀率显著提高,但70 ℃和80 ℃热水处理组之间差异不显著,吸胀率均在80%以上。生活力指标中,除80 ℃热水处理组较对照有显著下降外,其他处理组与对照相比均无显著差异。综合考虑,始温为70 ℃的热水处理5 min是解除合欢种子硬实性的最佳方法。
|
|
解除硬实后的合欢种子,采用凡士林对不同区域进行密封处理,其吸水曲线如图 4所示。完全密封的种子浸种72 h后,其吸水率仅为5.7%,显著低于其他处理,因此凡士林密封法测定合欢种皮不同部位吸水量的方法是可行的。完全不密封的处理Ⅰ,浸种后种子迅速吸水,在吸水24 h前的各测定阶段,吸水率均显著高于其他4个处理组。将种子局部密封的3个处理中,浸种4 h时,处理Ⅱ的吸水率为13.9%,显著高于处理Ⅲ(6.6%)和Ⅳ(5.1%),因此种脐区域可能是种子的最初吸水部位;吸水至12 h时,3个处理的吸水速率明显加快,仍是处理Ⅱ的吸水率最高(39.6%),但与处理Ⅲ(20.2%)相比差异不显著,处理Ⅲ与处理Ⅳ(13.3%)之间虽然仍差异不显著,但二者的吸水率相差已经由之前的1.5%增加到6.9%;浸种至24 h时,处理Ⅱ(67.0%)和处理Ⅲ(51.8%)的吸水率差异仍不显著,但这2个处理的吸水率显著高于处理Ⅳ(23.0%);当吸水时间延长至72 h时,处理Ⅱ与处理Ⅲ的吸水率仅相差1.3%,二者显著高于Ⅳ(56.1%)。综上所述,种子在吸水初期,种脐区域(处理Ⅱ)吸水速率明显高于中间区域(处理Ⅲ)和子叶末端区域(处理Ⅳ);在吸水4~12 h阶段,种子中间区域吸水加快,直至与种脐区域无显著差异,且该趋势一直持续至种子吸水饱和。结合上图 3F中对种子背腹面种皮结构的超微形态观察,笔者推测,4 h后吸水速率的提高可能与椭圆形棱处的裂痕和吸水表面积较大有关。合欢种子的种脐区域是种子的初始吸水部位,随后种皮中间部位吸水加快;在测定的各阶段,子叶末端区域的吸水率始终最小。

|
图 4 密封合欢种子不同部位的吸水曲线 Fig. 4 Water absorption curves for seeds of A. julibrissin following five different blocking treatments |
染色2 h时,种脊最先被染成蓝色(图 5A),随后种孔和种脐也呈现蓝色(图 5B);随着染色时间的延长,种脊内的维管束和种皮的表皮层细胞也被染成蓝色(图 5C),之后种孔、种脐和种脊以及其内的维管束区域蓝色明显加深(图 5D)。吸水不同阶段的苯胺蓝染色结果表明:合欢种皮的吸水主要有3条途径,水分最先通过种脊进入种皮并沿其内的维管束继续移动;随后是水分也由种孔和种脐进入种皮;此外,水分还能透过种子的表皮层但不能透过其栅栏层进入种子。

|
图 5 合欢种子吸水不同阶段的苯胺蓝染色 Fig. 5 Photographs of non-dormant seed in different water absorption stages deyed by aniline blue A.染色2 h;B.染色3 h;C.染色4 h;D.染色5 h。箭头表示染色具体位置。 Deyed in aniline blue for 2 h(A), 3 h(B), 4 h(C) and 5 h(D).The arrow indicates the tocation of staining.。 |
合欢种子经TTC染色2 h时,胚根尖端最先被染成红色(图 6A)。随着染色时间的延长,染色区域逐渐向子叶末端延伸(图 6B-E);同一水平位置,子叶外侧先被染成红色,后向中间部分扩散(图 6B、D),染色至10 h时,整个种胚都被染成红色。结合种子TTC染色的原理,笔者推断:种子吸收的水分由胚根端进入到营养组织后,逐渐向子叶末端迁移,在同一水平位置,水分则由子叶外侧向中间迁移。

|
图 6 合欢种子的TTC染色 Fig. 6 Photographs of non-dormant seed stained by 2, 3, 5-triphenyl tetrazolium chloride solution A.染色2 h;B.染色4 h;C.染色6 h;D.染色8 h;E.染色10 h。 Deyed in 2, 3, 5-triphenyl tetrazolium chloride for 2 h(A), 4 h(B), 6 h(C), 8 h(D) and 10 h(E). |
合欢种子具有硬实性,种皮的不透性严重阻碍了种子吸胀萌发作用。种皮的不透性通常与微观结构有关,种皮内细胞的排列方式和组成成分直接影响了种子的透性。周健(2016)对紫荆(Cercis chinensis)种皮结构的观察时发现,该种子表面有一层蜡状物覆盖的角质层,此结构导致了种皮的不透水性。也有学者认为栅栏层是水分或其他物质进入种子的主要障碍(Moïse et al., 2005;文婷婷等,2013),是造成种皮透性差的主要原因。有的种子还具有明线(light line)这一特殊结构,Desouza等(2001)认为明线是种质最不能渗透的区域。本研究对合欢种皮结构观察时也发现了致密的表皮层、栅栏层以及明线等特殊结构,它们可能对阻隔水气起到了主要作用。但合欢种子表面还存在许多大小不一的裂缝,一直延伸到石细胞层。笔者推测,尽管表皮层和栅栏层对水气有一定阻碍作用,但依然有少量水气可以通过表皮层和栅栏层的裂缝进入到种子内部,因此排列紧密、无细胞间隙的厚壁细胞可能也是阻碍水分进入种子的重要结构。
另一方面,种脐区域结构的特殊性也是影响种皮透性的关键因素。Kikuchi等(2006)认为成熟的豆科植物种子,种脐部位是控制种子与外部环境水分交换的主要部位,该结构对种子硬实性的形成与破除起着重要作用。尽管种脐位置没有栅栏细胞,但该部位常被种子分泌的一些色素或其他物质所填充,导致该部位具有不透性(Lush et al., 1980)。本研究发现,合欢种子的种脐部位被白色蜡质所覆盖,甚至在连接种脐的维管束起始段也被这种蜡质填充,种孔封闭,这些结构也可能是引起种皮不透的重要原因。
3.2 热水处理解除种子硬实性的有效性酸蚀处理、热水处理、机械处理都是解除种子硬实性的有效方法(Burns,1959;周元,2003;Zhang et al., 2012;方芳等,2013)。酸蚀处理和机械处理对破除种子硬实性有一定效果,但操作较为复杂,对环境也有较大破坏。因此,热水处理是生产中常用的既简单又有效的方法。热水处理不仅可使种皮龟裂、软化,还能去除种皮表层的蜡质和油脂,改善种皮的透性,从而解除种子的硬实性,提高种子的发芽率(杨期和等,2006)。本研究发现,热水处理后合欢种皮的微形态发生很大变化,尤以种脐区域变化最为显著,热水处理后原来封闭的种孔开启,种脐部位的蜡质减少或消失,种脊部位出现一个较大的裂缝,这些变化在很大程度上提升了种皮的透性,这与许多豆科植物种子在热水处理后的变化规律相吻合(Ma et al., 2004;胡小文,2008;Rodrigues-Junior et al., 2014)。
3.3 种子吸水机制染色法是通过种子着色位置来判定其吸水位点的。本研究合欢种子的苯胺蓝染色结果表明,种脊是该种子的初始吸水部位,其内的维管束在种子吸水过程中起到运输水分的作用;种孔和种脐也是重要的吸水部位,大多数水分由种脐和种孔进入到种子内部到达种胚。Kikuchi等(2016)也认为菜豆(Phaseolus vulgaris)和赤豆(Vigna angularis)种子通过种孔和种脐吸水。本研究还发现,合欢种子解除硬实性后,水分可以进入种皮的表皮层,但栅栏层对水分的继续流入有较大的阻碍作用,这可能是种皮吸水较胚吸水早的主要原因。苯胺蓝为大分子的物质,不能进入营养组织,因此该方法只适用于早期种皮吸水过程的研究,无法确定水分在营养组织内的移动规律。本研究中TTC染色结果表明,由种孔和种脐处吸收的水分进一步向营养组织移动,先使胚根尖端染成红色,再逐渐使整个子叶染成红色,且在同一水平位置,染色区域从子叶外侧向其内侧扩散。由于四唑溶液只能与活种子中的脱氢酶发生反应生成红色物质,且每次观察都是破坏性试验,因此不能对同一粒种子的水分变化持续观测。
密封法也常被用来确定种子的初始吸水位点。本次凡士林的密封试验表明,热水处理后合欢种子各区域均能吸水,但吸水能力不尽相同。在最初的4 h,主要是种脐区域吸收水分;之后种脐区域和种子中间部位吸水迅速增加,说明种子表面椭圆形裂痕在浸种12 h后也具有较强的吸水能力。这与Rodrigues-Junior等(2014)研究小叶黄槐种子得到的结论相似。密封法绘制吸水曲线能对种子各部位的吸水情况进行定量分析,从而更好地确定种子的吸水位点。
种子吸水途径与种皮结构密切相关(Ma et al., 2004),而种皮的表皮层、栅栏层、石细胞层等结构以及种脐部位的特殊结构被普遍认为是种子吸水的主要障碍,这些结构也被认为是解除种子硬实性后主要的吸水位点(Gama-Arachchige et al., 2010)。而Perissé等(2004)则认为种子吸水最先是从种皮最薄处开始的,种脊被普遍认为是豆科植物种子种皮最薄的位点(Baskin et al., 2003)。本研究发现,合欢种子种皮最薄处为背腹面中心位置,但凡士林密封试验表明种子硬实解除后初始的吸水部位为种脐区域而非种皮背腹面位置,该结果与Gama-Arachchige等(2010)的观点相同。
4 结论本研究通过对合欢种子种皮结构的扫描电镜和体视显微镜观察发现,其种皮结构由外向内依次为:表皮层、栅栏层、石细胞层、厚壁细胞层、薄壁细胞层。未解除硬实的种子表面有许多裂缝,种孔和种脊紧闭,种脐被蜡质覆盖。始温70 ℃的热水浸种5 min可以有效打破合欢种子的硬实性,扫描电镜观察到热水处理前后种皮有明显变化。凡士林封堵试验表明,种脐区域吸水是合欢种子解除、休眠后的初始吸水部位,结合染色试验发现,种脊是合欢种子的初始吸水位点,水分从种脊进入种子后沿维管束运输,也可由种孔和种脐进入种胚,后由胚根尖端向子叶末端迁移。
方芳, 彭祚登, 郭志民, 等. 2006. 刺槐种子硬实特性及萌发促进的研究. 中南林业科技大学学报, 33(7): 72-76. (Fang F, Peng Z D, Guo Z M, et al. 2006. Study on seed hardness characteristic and germination promoting of Robinia pseudoacacia seeds. Journal of Central South University of Forestry & Technology, 33(7): 72-76. [in Chinese]) |
郭学民, 徐兴友, 孟宪东, 等. 2006. 合欢种子硬实与萌发特征及种皮微观形态与结构特征的研究. 内蒙古农业大学学报:自然科学版, 27(3): 13-18. (Guo X M, Xu X Y, Meng X D, et al. 2006. Bourgeon characteristics of hard seed of Albizia julibrissn Durazz. and its testa micro-morphology and structure.Journal of Inner Mongolia Agricultural University:Natural Science Edition, 27(3): 13-18. [in Chinese]) |
国家质量技术监督局. 1999. GB2772—1999林木种子检验规程. 北京: 中国标准出版社, 13-20. (State Bureau of Quality and Technical Supervision. 1999. GB 2772—1999 Rules for forest tree seed testing. Beijing: Standards Press of China, 13-20. [in Chinese]) |
胡小文, 武艳培, 王彦荣, 等. 2009. 苦豆子种子休眠的形成及其解剖结构变化. 西北植物学报, 29(1): 16-21. (Hu X W, Wu Y P, Wang Y R, et al. 2009. Sophora alopecuroides seed dormancy formation and the change of seed anatomical structure. Acta Botanica Boreali-Occidentalia Sinica, 29(1): 16-21. DOI:10.3321/j.issn:1000-4025.2009.01.003 [in Chinese]) |
连洁琼. 2013.三种豆科树种硬实形成机制及破除方法的初步研究.泰安: 山东农业大学硕士学位论文. (Lian J Q. 2013. The preliminary studies on hard seed formation mechanism and breaking methods of three legume species. Taian: MS thesis of Shandong Agricultural University. [in Chinese]) |
李然, 李振川, 陈珊珊, 等. 2009. 应用低场核磁共振研究绿豆浸泡过程. 食品科学, 30(15): 137-141. (Li R, Li Z C, Chen S S, et al. 2009. Study of water absorption of mung beans based on low-field nuclear magnetic resonance technology. Food Science, 30(15): 137-141. DOI:10.3321/j.issn:1002-6630.2009.15.031 [in Chinese]) |
文婷婷, 田艺心, 朱岩芳, 等. 2013. 蚕豆种皮结构、细胞壁成分及其与透水性的关系. 科技通报, 29(5): 63-67. (Wen T T, Tian Y X, Zhu Y F, et al. 2013. Structure and cell wall components of broad bean (Vicia faba L. ) seed coat and their relationship with water permeability. Bulletin of Science and Technology, 29(5): 63-67. DOI:10.3969/j.issn.1001-7119.2013.05.014 [in Chinese]) |
肖媛, 刘伟, 汪艳, 等. 2013. 生物样品的扫描电镜制样干燥方法. 实验室研究与探索, 32(5): 45-53. (Xiao Y, Liu W, Wang Y, et al. 2013. Drying methods of biological sample preparation for scanning electron microscope. Research and Exploration in Laboratory, 32(5): 45-53. DOI:10.3969/j.issn.1006-7167.2013.05.013 [in Chinese]) |
杨期和, 尹小娟, 叶万辉. 2006. 硬实种子休眠的机制和解除方法. 植物学报, 23(1): 108-118. (Yang Q H, Yin X J, Ye W H. 2006. Dormancy mechanism and breaking methods for hard seeds. Chinese Bulletin of Botany, 23(1): 108-118. DOI:10.3969/j.issn.1674-3466.2006.01.014 [in Chinese]) |
臧德奎. 2012. 园林树木学. 2版. 北京: 中国建筑工业出版社, 276-277. (Zang D K. 2012. Landscape dendrology. 2nd ed. Beijing: China Construction Industry Press, 276-277. [in Chinese]) |
中国科学院中国植物志编著委员会. 1988. 中国植物志第三十九卷. 2版. 北京: 科学出版社, 59. (The Chinese Academy of Sciences Compilation Committee of Chinese Flora. 1988. Chinese flora thirty-ninth volume. 2nd ed. Beijing: Science Press. [in Chinese]) |
周健. 2016.紫荆种子休眠特性及其吸水机制研究.南京: 南京林业大学硕士学位论文 (Zhou J. 2016. The mechanism of water absorbing and dormancy in Cercis chinensis seeds. Nanjing: MS thesis of Nanjing Forestry University. [in Chinese]) |
周元. 2003. 滇青冈种子的萌发. 植物生理学报, 39(4): 325-326. (Zhou Y. 2003. Seed germination of Cyclobalanopsis glaucoides. Journal of Plant Physiology, 39(4): 325-326. [in Chinese]) |
Baskin C C. 2003. Breaking Physical dormancy in seeds focusing on the lens. New Phytologist, 158: 227-238. DOI:10.1046/j.1469-8137.2003.00753.x |
Bewley J D. 1997. Seed germination and dormancy. The Plant Cell, 9(7): 1055-1066. DOI:10.1105/tpc.9.7.1055 |
Burns R E. 1959. Effect of acid scarification on lupine seed impermeability. Plant Physiology, 34(2): 107-108. |
Desouza F H D, Marcos F J. 2001. The seed coat as a modulator of seed-environment relationships in Fabaceae. Revista Brasileira de Botanica, 24(4): 365-375. |
Gama-Arachchige N S, Baskin J M, Geneve R L, et al. 2010. Identification and characterization of the water gap in physically dormant seeds of Geraniaceae, with special reference to Geranium carolinianum. Annals of Botany, 105(6): 977-990. DOI:10.1093/aob/mcq078 |
Geisler G E, Pinto T T, Santos M, et al. 2017. Seed structures in water uptake, dormancy release, and germination of two tropical forest Fabaceae species with physically dormant seeds. Brazilian Journal of Botany, 40(1): 67-77. DOI:10.1007/s40415-016-0334-3 |
International Seed Testing Association. 2013. International rules for seed testing. Seed Science and Technology, 27(Supplement): 33-35. |
Jayasuriya K M G G, Baskin J M, Geneve R L, et al. 2008. Physical dormancy in seeds of the holoparasitic angiosperm Cuscuta australis (Convolvulaceae, Cuscuteae): dormancy-breaking requirements, anatomy of the water gap and sensitivity cycling. Annals of Botany, 102(1): 39-48. DOI:10.1093/aob/mcn064 |
Kestring D, Klein J, de Menezes L C C R, et al. 2009. Imbibition phases and germination response of Mimosa bimucronata (Fabaceae: Mimosoideae) to water submersion. Aquatic Botany, 91(2): 105-109. DOI:10.1016/j.aquabot.2009.03.004 |
Kikuchi K, Koizumi M, Ishida N, et al. 2006. Water uptake by dry beans observed by micro-magnetic resonance imaging. Annals of Botany, 98(3): 545-553. DOI:10.1093/aob/mcl145 |
Krishnan P, Joshi D K, Nagarajan S, et al. 2004. Characterization of germinating and non-viable soybean seeds by nuclear magnetic resonance (NMR) spectroscopy. Seed Science Research, 14(4): 355-362. DOI:10.1079/SSR2004189 |
Lush M W, Evans L T. 1980. The seed coats of cowpeas and other grain legumes structure in relation to function. Field Crops Research, 3(3): 267-286. |
Ma F S, Cholewa E, Mohamed T, et al. 2004. Cracks in the palisade cuticle of soybean seed coats correlate with their permeability to water. Annals of Botany, 94(2): 213-228. DOI:10.1093/aob/mch133 |
Moïse J A, Han S, Gudynaitęsavitch L, et al. 2005. Seed coats: Structure, development, composition, and biotechnology. In Vitro Cellular & Developmental Biology-Plant, 41(5): 620-644. |
Paula A S D, Delgado C M L, Paulilo M T S, et al. 2012. Breaking physical dormancy of Cassia leptophylla and Senna macranthera seeds water absorption and alternating temperatures. Seed Science Research, 22(4): 1-9. |
Perissé P, Planchuelo A M. 2004. Seed coat morphology of Lupinus albus L. and Lupinus angustifolius L. in relation to water uptake. Seed Science & Technology, 32(1): 69-77. |
Rodrigues-Junior A G, Faria J M R, Vaz T A A, et al. 2014. Physical dormancy in Senna multijuga (Fabaceae: Caesalpinioideae) seeds: The role of seed structures in water uptake. Seed Science Research, 24(2): 147-157. DOI:10.1017/S0960258514000087 |
Zhang L F, Wu X W, She Y H. 2012. Study on characters of hard seeds of Amphicarpaea edgeworthii Benth. (Leguminosae) and methods for breaking dormancy. Agricultural Science & Technology, 13(9): 1885-1890. |
Zhou J, Yin Y T, Qian C M, et al. 2015. Seed coat morphology in Sapium sebiferum in relation to its mechanism of water uptake. Journal of Horticultural Science & Biotechnology, 90(6): 613-618. |
 2019, Vol. 55
2019, Vol. 55

