文章信息
- 王超群, 焦如珍, 董玉红, 厚凌宇, 赵京京, 赵世荣.
- Wang Chaoqun, Jiao Ruzhen, Dong Yuhong, Hou Lingyu, Zhao Jingjing, Zhao Shirong.
- 不同林龄杉木人工林土壤微生物群落代谢功能差异
- Differences in Metabolic Functions of Soil Microbial Communities of Chinese Fir Plantations of Different Ages
- 林业科学, 2019, 55(5): 36-45.
- Scientia Silvae Sinicae, 2019, 55(5): 36-45.
- DOI: 10.11707/j.1001-7488.20190505
-
文章历史
- 收稿日期:2017-10-06
- 修回日期:2018-11-29
-
作者相关文章
森林土壤微生物是森林土壤生态系统中最活跃的组成部分,在维持土壤生态系统中能量流动和物质循环方面发挥着关键作用(Chen et al., 2013),具有分解有机物质、合成腐殖质、降解有机污染物、富集重金属、分泌抗生素、改善土壤性质等作用,对林木生长产生直接或间接的影响(Liu et al., 2006; Bell et al., 2005; Fierer et al., 2006; Ling et al., 2014)。
杉木(Cunninghamia lanceolata)是我国特有的亚热带速生丰产用材树种,实现杉木人工林健康可持续发展可以有效缓解我国木材供需方面日益严峻的矛盾。随着杉木林龄的增长,土壤微生物数量出现先下降再上升(焦如珍等,2005),或者“低高低”的变化趋势(徐秋芳等,1998),或土壤微生物群落结构多样性和丰富度出现随着林龄的增加而增加(刘丽等,2009)。此外,王丹等(2010)通过对杉木幼龄林到过熟林5种林龄土壤微生物数量的研究发现,0~20 cm表层土壤的细菌、放线菌和真菌数量均呈现过熟林最高、幼龄林次之、中龄林和近熟林阶段降低到最低水平的规律。魏志超等(2017)采用高通量测序技术分析不同发育阶段杉木人工林土壤细菌类群特征,发现幼龄林与中龄林和老龄林之间细菌类群相似度较低。上述研究表明,不同林龄杉木林土壤微生物的变化规律并不统一,因此有必要对不同林龄杉木人工林的微生物功能多样性进一步的研究。
近年来,Biolog-ECO技术因其具有灵敏度高、测定简便,可以最大限度保留微生物群落原有代谢特征的基础上进行批量分析的优点,被广泛用于确定不同类型土壤微生物群落的功能多样性(Oren et al., 2008)。该技术基于可培养的微生物群落在微孔板中使用碳底物与氧化还原染料发生显色反应以获得微生物群落的生理特征(Smalla et al., 1998; Garland et al., 1991)和功能多样性(Zak et al., 1994),对揭示土壤微生物群落组成和功能的变化、土壤健康调控以及维持土壤生态系统功能等具有重要意义。该技术已经成功应用于研究不同树种的酸性森林土壤中微生物群落的代谢活性和多样性(Laverman et al., 2005)、不同林龄落叶松人工林土壤微生物群落的代谢活性差异(范瑞英等,2013)、不同的杉木-火力楠(Michelia macclurei)凋落物配比对不同林龄杉木人工林土壤微生物代谢活性的影响(王珍等,2017)。目前,针对林龄驱动杉木人工林土壤微生物群落代谢功能变异的研究鲜见报道,因此,本文以不同林龄杉木人工林为研究对象,采用Biolog-ECO技术解析土壤微生物群落代谢功能差异,进一步揭示不同林龄杉木林土壤微生物群落特征,为实现杉木人工林可持续经营管理提供理论依据。
1 材料与方法 1.1 试验地概况试验地位于福建省邵武市卫闽林场,武夷山北段中山山脉东南侧山区(117°43′E,27°05′N)。属山地丘陵地貌,年平均气温19.4 ℃,无霜期290天,年平均日照时数1 714.4 h,年平均降雨量1 712 mm,立地条件适宜杉木生长。
1.2 土壤样品的采集2017年5月在卫闽林场分别选择地位指数为14的3、12和38年生的杉木林样地各3块,共9块样地,每块样地20 m×30 m。采样点土壤类型为红壤,母岩为花岗岩,坡向为东南。所选杉木人工林样地的前茬均为杉木人工纯林,样地信息见表 1。分别测定样地内每株树木的实际胸径和树高,计算平均胸径和平均树高。在每块样地内随机设置10个1 m×1m的小样方,记录每个样方内的植物种类和植被盖度。在每块样地内以S型采样法选取8个采样点,用土钻采集0~20 cm土层的土壤样品,混合后装入已灭菌的土壤袋中并放入装有冰块的保温箱,带回实验室后立即冷藏,并在7天内进行分析。同时每个样品常温下保存500 g左右,带回实验室,经过研磨过筛后,供土壤理化性质分析。
|
|
采用电位法(水:土=2.5:1)测定土壤pH值。土壤含水量、全氮、总有机碳、碱解氮、有效磷和速效钾含量的测定参照《土壤理化分析》(中国科学院南京土壤研究所,1978)。采用烘干法(105 ℃干燥24 h)测量土壤水分。通过KMnO4氧化法测量土壤有机碳含量(Tirol-Padre et al., 2004)。全氮含量采用凯氏定氮法测定(2300 Kjeltec,FOSS,Sweden)。
1.3.2 Biolog-ECO技术采用含有31种碳源的Biolog-ECO分析土壤微生物群落的代谢特征。采用Classen等(2003)的方法制备生态板接种液。首先称取相当于30 g烘干土质量的鲜土加入到盛有270 mL浓度为0.85%的NaCl溶液的三角瓶中180 r·min-1震荡30 min,取3 mL上清液加入到27 mL NaCl溶液,混匀后再取3 mL上清液加入到27 mL NaCl溶液,土壤溶液最终稀释至10-3。向ECO板的各孔中加入150 μL的稀释液。将接种好的微孔板放在28 ℃的恒温培养箱中。分别于24、48、72、96、120、144、168 h在室温条件下于MicroLogTM Version 4.20.05微孔板读数仪(Biolog Inc,USA)上进行测定,读取波长分别为590 nm(颜色+浊度)和750 nm(浊度)处的数值。
1.4 数据处理微生物群落代谢活性用590 nm处的值减去750 nm处的值表示。孔的平均颜色变化率(AWCD)计算方法(李世朋等,2008;Degens et al., 2000)如下:
| ${\rm{AWCD}} = \frac{{\sum {(C - R)} }}{n}。$ |
式中,C为每个碳源孔的两波段光密度差值;R为对照孔的光密度值;n为培养基碳源种类数(n=31)。
采用反应72 h的数据计算土壤微生物群落的功能多样性。
Shannon-Wiener多样性指数(H′):H′=-∑Pi lnPi;式中,Pi表示第i个非对照孔中的吸光值与所有非对照孔吸光值总和的比值。
Pielou均匀度指数(J):
| $J = \frac{{{H^\prime }}}{{\ln S}}; $ |
式中, S为被利用的碳源总数。
Simpson优势度指数(D):
| $D = 1 - \Sigma {\rm{P}}_{\rm{i}}^2。$ |
McIntosh多样性指数(U)(杨永华等,2000):
| $U = \sqrt {\left( {\sum {n_i^2} } \right)}。$ |
式中, ni是第i个碳源孔的(C-R)值。
McIntosh均匀度(E)(杨永华等,2000):
| $E = \frac{{N - U}}{{N - N/\sqrt S }}。$ |
式中, N是引种碳源的(C-R)值的总和。
使用R i386 3.3.1进行主成分分析(PCA),使用Origin9.0进行绘图。
2 结果与分析 2.1 不同林龄杉木人工林土壤理化性质各土壤样品理化性质测定结果如表 2所示。土壤pH随林龄的增加而增加,但是3种林龄之间无显著差异。全氮含量随林龄的增加而增加,38年生杉木林土壤全氮含量显著高于3年生(P < 0.05)。碱解氮含量随林龄的增加而增加,38年生和12年生杉木林土壤碱解氮含量显著高于3年生(P < 0.05)。速效钾含量随林龄的增加而增加,3种林龄之间差异显著(P < 0.05)。土壤碳氮比随林龄的增加而下降,含水量、有机碳和有效磷含量呈现出12年生> 38年生> 3年生的趋势,但是均未达到显著差异水平(P>0.05)。
|
|
土壤微生物群落的代谢活性用AWCD值表示,根据1.4中的公式,计算3种林龄土壤样品中微生物群落利用31种碳源的AWCD,其变化曲线如图 1所示。微生物群落代谢活性的总体变化趋势:在培养24 h以内,土壤微生物群落代谢缓慢,24~96 h变化速度较快,96 h以后变化速度有所减慢。在48~96 h培养阶段,3种林龄的AWCD变化曲线的斜率均达到最大,说明杉木人工林土壤微生物群落在48~96 h培养时间内代谢活性最强。48~96 h培养时间内,38年生杉木林的AWCD变化曲线的斜率明显大于12年生和3年生,且3年生杉木林的AWCD变化曲线的斜率最小,表明38年生杉木林土壤微生物群落的代谢活性最强,12年生次之,3年生最弱。12年生杉木林的AWCD曲线在96 h以后出现平缓现象,说明土壤微生物群落对碳源的利用能力减弱。培养0~48 h内,3种林龄土壤微生物群落的代谢活性无明显差异,培养96~168 h,38年生杉木林土壤微生物群落的代谢活性显著高于12年生和3年生杉木林,培养72~120 h,12年生杉木林土壤微生物群落的代谢活性显著高于3年生杉木林(P < 0.05,图 1),但培养144~168 h,12年生杉木林土壤微生物群落的代谢活性与3年生杉木林的差异不显著。AWCD的总体变化趋势为38年生>12年生>3年生,说明38年生杉木林土壤微生物群落具有最强的代谢能力。

|
图 1 不同林龄土壤微生物群落AWCD随时间变化s Fig. 1 AWCD changes during incubation of soil microbial community at different stand age |
结合碳源底物的基团性质、微生物的代谢途径以及生态功能3个方面,可将31种碳源分为6大类:碳水化合物、氨基酸、羧酸、多聚物、酚酸类和胺类(Choi et al., 1993)。由1.4中的公式计算3种林龄土壤样品中微生物群落利用6类碳源的AWCD,其变化曲线如图 2所示。土壤微生物群落对6类碳源的利用率均随着培养时间的延长而增加,3种林龄的土壤微生物群落对各类碳源的利用率:38年生>12年生>3年生(图 2)。

|
图 2 不同林龄土壤微生物群落利用碳源的AWCD变化 Fig. 2 AWCD changes of soil microbial communities at different stand ages |
3种林龄的土壤微生物群落在利用6类碳源的水平上差异较大。38年生杉木林对碳源的利用水平由高到低依次为酚酸类、胺类、氨基酸、多聚物、羧酸、碳水化合物;12年生杉木林对碳源的利用水平由高到低依次为酚酸类、多聚物、氨基酸、羧酸、碳水化合物、胺类;3年生杉木林对碳源的利用水平由高到低依次为多聚物、羧酸、碳水化合物、酚酸类、氨基酸、胺类(图 2)(表 3)。38年生杉木林土壤微生物群落代谢碳水化合物、氨基酸、羧酸和胺类的强度显著高于3年生(P < 0.05),而12年生和3年生杉木林土壤微生物群落对这4类碳源的利用率差异不显著(P>0.05)(表 3)。38年生土壤微生物群落对碳水化合物的利用强度显著高于12年生和3年生杉木林(P < 0.05),而3个林龄的土壤微生物群落对多聚物和酚酸类利用强度的差异却不显著(P>0.05)(表 3),推测38年生杉木林土壤微生物群落中以碳水化合物为代谢底物的微生物种群较12年生和3年生杉木林明显增加。
|
|
Shannon-Wiener多样性指数(H′)用于评估土壤中微生物群落的丰富度,Pielou均匀度指数(J)用于评估土壤中微生物群落的均匀度,Simpson优势度指数(D)评估土壤中微生物群落的优势度,McIntosh多样性指数(U)表征基于土壤中微生物群落多维空间上的丰富度,McIntosh均匀度指数(E)表征基于土壤中微生物群落多维空间上的均匀度(杨永华等,2000;申卫收等,2008)。多样性指数越大表明微生物群落多样性越高。38年生与3年生杉木林相比,微生物群落的5种多样性指数之间的差异显著(P < 0.05),而38年生和12年生杉木林之间的5种多样性指数差异不显著(P>0.05)。12年生和3年生杉木林之间,Shannon-Wiener多样性指数、Simpson优势度指数之间的差异显著(P < 0.05)(表 4)。此结果表明,38年生杉木林土壤微生物群落多样性显著高于3年生杉木林。
|
|
对3种林龄杉木林下土壤样品72 h各类碳源C-R值进行主成分分析(图 3)(Garland et al., 2001; Perston et al., 2002)。其中第1主成分和第2主成分的方差贡献率为75.09%,因此,变异主要来源于第1和第2主成分。在主成分分析中,样本之间距离的大小代表样本间相似程度,进而反映样本间微生物群落代谢功能差异的大小,距离越近,代谢功能差异程度越小(Grove et al., 2004;Hadwin et al., 2006)。由图 3可知,38年生杉木林位于第3象限、12年生杉木林位于第2象限、3年生杉木林位于第1象限,3种林龄土壤样本分布比较分散,说明随着杉木林龄的变化,土壤微生物群落的代谢功能发生明显变化;对碳源的利用程度也产生差异,说明不同林龄杉木土壤微生物群落之间存在显著差异。

|
图 3 不同林龄土壤微生物群落功能多样性的主成分分析 Fig. 3 Principal analysis on function diversity of soil microbial community at different stand age. |
对不同林龄杉木林下土壤样品168 h各类碳源的C-R值做热图分析(图 4)。38年生和12年生杉木林土壤微生物群落能够代谢31种碳源底物,而3年生杉木林土壤微生物群落仅能代谢19种碳源底物。不同林龄杉木土壤微生物群落对丙酮酸甲酯、D-半乳糖醛酸、吐温-40、吐温-80、D-甘露醇、L-丝氨酸、N-乙酰-D-葡萄糖胺和D-葡萄糖胺酸的利用强度较大。3年生杉木林土壤微生物群落不能利用β-甲基-D-葡萄糖苷、D-半乳糖酸-γ-内脂、L-天冬酰胺酸、Ⅰ-赤藓糖醇、2-羟基苯甲酸、L-苯基丙氨酸、4-羟基苯甲酸、D-纤维二糖、α-丁酮酸、α-D-乳糖和D, L-α-磷酸甘油。
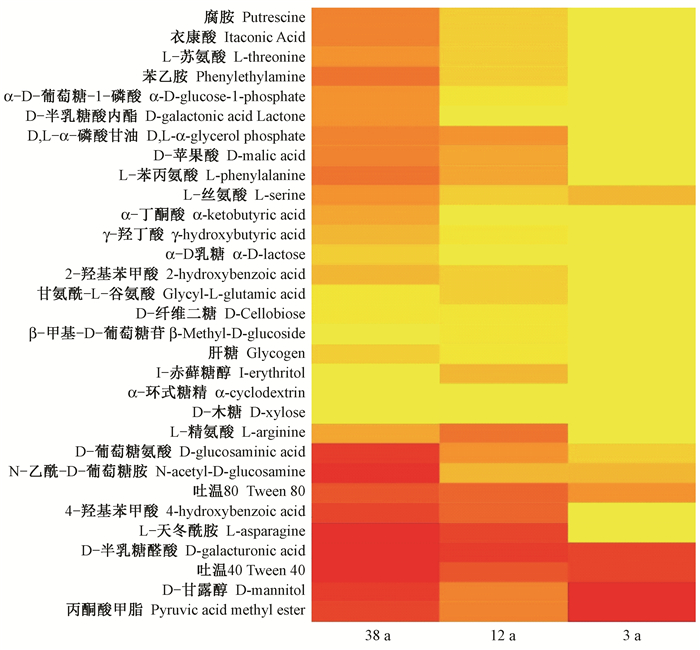
|
图 4 微生物群落利用31种碳源底物的热图 Fig. 4 The heatmap of microbial communities depending on utilization carbon substrates in Biolog EcoPlate |
5种多样性指数均与土壤全氮和pH呈显著正相关,与碳氮比呈显著负相关(P < 0.05)(表 5)。Shannon-Wiener多样性指数、Simpson优势度指数和McIntosh均匀度指数与速效钾呈显著正相关(P < 0.05),Pielou均匀度指数与碱解氮呈显著正相关(P < 0.05)。而5种多样性指数与土壤含水量和有机碳的相关性均不显著,这说明土壤全氮含量、pH值、速效钾和碳氮比能够显著影响微生物群落的代谢功能。
|
|
土壤中全氮,碱解氮和速效钾含量均呈现38年生> 12年生> 3年生的趋势,并且38年生杉木林显著高于3年生杉木林,这与吴永铃等(2011)报道的杉木人工林土壤表土层全氮、碱解氮和速效钾含量均呈现成熟林>幼龄林>中龄林的趋势不一致;有机碳含量呈现38年生> 12年生> 3年生的趋势,与曹小玉等(2014)报道的有机碳含量呈现成熟林>幼龄林>中龄林的趋势不一致。12年生杉木林土壤全氮、碱解氮、速效钾和有机碳含量高于3年生是本研究与其他研究结果的差异所在。12年生杉木处于快速生长阶段,理应消耗更多的养分和有机碳,但12年生全氮、碱解氮、速效钾和有机碳含量会大于3年生的原因需要进一步研究。C:N是土壤N矿化的重要指标,并且C:N越小越有利于微生物的代谢和N的矿化(Springob et al., 2003),这与本研究中,C:N随林龄的增加而下降,土壤微生物的代谢活性则与之相反是一致的,这也可能是N元素含量增加的重要原因。N、K元素可以促进微生物的生长(陆爽等,2011),pH值可以影响土壤微生物多样性(O’Donnell et al., 2001)和微生物群落对碳源的利用(White et al., 2005)。在本研究中,5种微生物多样性指数和pH、全氮和碳氮比显著相关(表 5),表明杉木人工林土壤微生物群落与化学性质之间存在显著的相互作用。
在培养0~24 h,土壤微生物群落的代谢活性很低,说明此时间段是微生物群落的滞后期,而24~ 96 h代谢活性明显高于其他培养时间段,则此时间段为微生物群落的指数期(Qu et al., 2009)。在168 h的培养过程中,不同林龄杉木土壤微生物群落利用碳源的强度和种类均存在较大差异(图 1,图 2),不同林龄杉木土壤微生物群落利用31种碳源的AWCD均呈现出38年生>12年生>3年生的规律,当把31种碳源划分成6大类时,AWCD也呈现出同样的规律。38年生杉木林土壤样品的H′、J、D、U和E均高于12年生和3年生,3年生杉木林的5种多样性指数均最低(表 4),这与焦如珍等(1997)和盛炜彤等(2003)采用平板培养法发现杉木林土壤微生物数量呈现出幼龄林>中龄林,中龄林 < 成熟林的变化规律不一致,这可能是因为所选择的林龄的不同,并且3年生杉木林在栽植之前经历了炼山,林下植被多样性低(贾亚运等,2016;林开敏等,2001)、微生物群落结构单一(刘丽等,2009)且受人为扰动较多有关。刘丽等(2009)研究也表明,3年生杉木林土壤微生物群落的多样性和丰富度最低。随着林龄的增长,树冠密闭,人为干扰强度下降,土壤微生物群落组成逐渐恢复,代谢功能多样性逐渐升高。12年生杉木林林分密度较38年生大,对养分的摄取量大,可能导致12年生杉木林地土壤微生物群落丰富度和均一度低于38年生杉木林,从而导致代谢功能的差异。热图分析结果表明,38年生和12年生杉木林土壤微生物群落能够代谢31种碳源底物,而3年生杉木林土壤微生物群落仅能代谢19种碳源底物,说明随着杉木林生长年限的延长,土壤微生物群落代谢功能增强。
4 结论38年生杉木林表土层(0~20 cm)微生物群落对31种碳源的平均利用率和6大类碳源的利用率及其5种多样性指数均最高,3年生杉木林最低,并且38年生杉木林土壤微生物群落的代谢活性和多样性指数显著高于3年生杉木林,12年生林分微生物群落有所恢复,38年生林分的林下植被种类和盖度远大于12年生杉木林,是微生物群落代谢活性增强的主要原因。土壤pH、全氮和碳氮比与微生物群落多样性之间具有显著的相关性,即土壤pH、全氮和碳氮比是影响微生物群落代谢功能变化的主要土壤因子。随着林龄的变化,土壤化学性质以及林下植被盖度的变化对土壤微生物均有显著影响,并且适当延长杉木林的种植年限将有利于土壤微生物群落功能多样性的增加,从而有利于维持土壤生态系统功能以及杉木人工林可持续经营管理。
范瑞英, 杨小燕, 王恩姮, 等. 2013. 黑土区不同林龄落叶松人工林土壤微生物群落功能多样性的对比研究. 北京林业大学学报, 35(2): 63-68. (Fan R Y, Yang X Y, Wang E H, et al. 2013. Comparative studies on functional diversity of soil microbial community of larch plantations with different ages in black soil region, northeastern China. Journal of Beijing Forestry University, 35(2): 63-68. [in Chinese]) |
贾亚运, 周丽丽, 吴鹏飞, 等. 2016. 不同发育阶段杉木人工林林下植被的多样性. 森林与环境学报, 36(1): 36-41. (Jia Y Y, Zhou L L, Wu P F, et al. 2016. Characterization of understory community of Cunninghamia lanceolata plantations at different developmental stages. Journal of Forest and Environment, 36(1): 36-41. [in Chinese]) |
焦如珍, 杨承栋, 孙启武, 等. 2005. 杉木人工林不同发育阶段土壤微生物数量及其生物量的变化. 林业科学, 41(6): 163-165. (Jiao R Z, Yang C D, Sun Q W, et al. 2005. Changes in soil microbial amount and biomass during the development of Chinese fir plantation. Scientia Silvae Sinicae, 41(6): 163-165. DOI:10.3321/j.issn:1001-7488.2005.06.028 [in Chinese]) |
焦如珍, 杨承栋, 屠星南, 等. 1997. 杉木人工林不同发育阶段林下植被、土壤微生物、酶活性及养分的变化. 林业科学研究, 10(4): 373-379. (Jiao R Z, Yang C D, Tu X N, et al. 1997. The change of undergrowth, soil microorganism, enzyme activity and nutrient in different developing stage of the Chinese Fir plantation. Forest Research, 10(4): 373-379. DOI:10.3321/j.issn:1001-1498.1997.04.006 [in Chinese]) |
李世朋, 蔡祖聪, 杨浩. 2008. 不同植被下红壤性质对细菌碳源利用的影响. 应用与环境生物学报, 14(6): 793-797. (Li S P, Cai Z C, Yang H. 2008. Effect of red soil properties under different vegetation types on bacterial carbon source utilization. Chinese Journal of Applied and Environmental Biology, 14(6): 793-797. [in Chinese]) |
林开敏, 俞新妥, 黄宝龙, 等. 2001. 杉木人工林林下植物物种多样性的动态特征. 应用与环境生物学报, 7(1): 13-19. (Lin K M, Yu X T, Huang B L, et al. 2001. Dynamic characteristics of undergrowth plant diversity in Chinese fir plantations. Chinese Journal of Applied and Environmental Biology, 7(1): 13-19. DOI:10.3321/j.issn:1006-687X.2001.01.003 [in Chinese]) |
刘丽, 段争虎, 汪思龙, 等. 2009. 不同发育阶段杉木人工林对土壤微生物群落结构的影响. 生态学杂志, 28(12): 2417-2423. (Liu L, Duan Z H, Wang S L, et al. 2009. Effects of Cunninghamia lanceolata plantations at different developmental stages on soil microbial community structure. Chinese Journal of Ecology, 28(12): 2417-2423. [in Chinese]) |
陆爽, 张霞, 谭勇, 等. 2011. 栽培红花生长期土壤微生物与土壤理化因子动态. 草业科学, 28(12): 2084-2091. |
鲁顺保, 张艳杰, 陈成榕, 等. 2013. 基于BIOLOG指纹解析三种不同森林类型土壤细菌群落功能差异. 土壤学报, 50(3): 618-623. (Lu S B, Zhang Y J, Chen C R, et al. 2013. Analysis of functional differences between soil bacterial communities in three different types of forest soils based on biology fingerprint. Acta Pedologica Sinica, 50(3): 618-623. [in Chinese]) |
申卫收, 林先贵, 张华勇, 等. 2008. 不同施肥处理下蔬菜塑料大棚土壤微生物活性及功能多样性. 生态学报, 28(6): 2685-2686. (Shen W S, Lin X G, Zhang H Y, et al. 2008. Microbial activity and functional diversity in soils used for the commercial production of cucumbers and tomatoes in polytunnel greenhouse, under different fertilization. Acta Ecologica Sinica, 28(6): 2685-2686. [in Chinese]) |
盛炜彤, 杨承栋, 范少辉. 2003. 杉木人工林的土壤性质变化. 林业科学研究, 16(4): 377-385. (Sheng W T, Yang C D, Fan S H. 2003. Variation of soil properties of Chinese fir plantation. Forest Research, 16(4): 377-385. DOI:10.3321/j.issn:1001-1498.2003.04.001 [in Chinese]) |
王丹, 戴伟, 王兵, 等. 2010. 杉木人工林不同发育阶段土壤性质变化的研究. 北京林业大学学报, 32(3): 59-63. (Wang D, Dai W, Wang B, et al. 2010. Changes of soil properties at different developmental stages of Chinese fir plantations. Journal of Beijing Forestry University, 32(3): 59-63. [in Chinese]) |
王珍, 曹光球, 张月全, 等. 2017. 凋落物配比对杉木土壤微生物碳代谢多样性的影响. 福建林学院学报, 37(2): 148-154. (Wang Z, Cao G Q, Zhang Y Q, et al. 2017. Responses of carbon metabolism diversity of topsoil microbial to the litterfall addition in Cunninghamia laneolata plantation. Journal of Forest and Environment, 37(2): 148-154. [in Chinese]) |
魏志超, 黄娟, 刘雨晖, 等. 2017. 不同发育阶段杉木人工林土壤细菌类群特征. 西南林业大学学报, 37(5): 122-129. (Wei Z C, Huang J, Liu Y H, et al. 2017. Community characteristics of soil bacteria of Cunninghamia laneolata plantations at different development stages. Journal of Southwest Forestry University, 37(5): 122-129. [in Chinese]) |
吴永铃, 王兵, 赵超, 等. 2011. 杉木人工林不同发育阶段土壤肥力综合评价研究. 西北农林科技大学学报, 39(1): 69-75. (Wu Y L, Wang B, Zhao C, et al. 2011. Comprehensive evaluation of soil fertility in different developing stages of Chinese fir plantations. Journal of Northwest AF University, 39(1): 69-75. [in Chinese]) |
徐秋芳, 钱信标. 1998. 杉木林地土壤微生物数量的分析研究. 浙江林业科技, 18(1): 33-36. (Xu Q F, Qian X B. 1998. Study on soil microorganism quantity in Cunninghamia lanceolata forest land. Journal of Zhejiang Forestry Science and Technology, 18(1): 33-36. [in Chinese]) |
杨永华, 姚健, 华晓梅. 2000. 农药污染对土壤微生物群落功能多样性的影响. 微生物学杂志, 20(2): 23-25. (Yang Y H, Yao J, Hua X M. 2000. Effect of pesticide pollution against functional microbial diversity in soil. Journal of Microbiology, 20(2): 23-25. [in Chinese]) |
中国科学院南京土壤研究所. 1978. 土壤理化分析. 上海: 上海科学技术出版社. (Institute of Soil Science, Chinese Academy of Sciences. 1978. Soil physical and chemical analysis. Shanghai: Shanghai Scientific & Technical Publishers. [in Chinese]) |
Bell T, Newman J A, Silverman B W, et al. 2005. The contribution of species richness and composition to bacterial services. Nature, 436(7054): 1157-1160. DOI:10.1038/nature03891 |
Chen F L, Zheng H, Zhang K, et al. 2013. Changes in soil microbial community structure and metabolic activity following conversion from native Pinus massoniana plantations to exotic Eucalyptus plantations. Forest Ecology & Management, 291: 65-72. |
Choi K H, Dobbs F C. 1993. Comparison of two kinds of Biolog micro-plates (GN and ECO) in their ability to distinguish among aquatic microbial communities. Microbioal Meth, 36(3): 203-213. |
Classen A T, Boyle S I, Haskins K E, et al. 2003. Community-level physiological profiles of bacteria and fungi: plate type and incubation temperature influences on contrasting soils. FEMS Microbiology Ecology, 44(3): 319-328. DOI:10.1016/S0168-6496(03)00068-0 |
Degens B P, Schipper L A, Sparling G P, et al. 2000. Decreases in organic C reserves in soils can reduce the catabolic diversity of soil microbial communities. Soil Biology and Biochemistry, 32(2): 189-196. DOI:10.1016/S0038-0717(99)00141-8 |
Fierer N, Jackson R B. 2006. The diversity and biogeography of soil bacterial communities. Proceedings of the National Academy of Sciences of the United States of America, 103(3): 626-631. DOI:10.1073/pnas.0507535103 |
Garland J L, Mills A L, Young J S. 2001. Relative effectiveness of kinetic analysis vs single point readings for classifying environmental samples based on community-level physiological profiles (CLPP). Soil Biology and Biochemistry, 33(7/8): 1059-1066. |
Grove J A, Kautola H, Javadpour S, et al. 2004. Assessmentof changes in the microorganism community in a biofilter. Biochemical Engineering Journal, 18(2): 111-114. DOI:10.1016/S1369-703X(03)00182-7 |
Hadwin A M, Del Rio L F, Pinto L J, et al. 2006. Microbial communities in wetlands of the Athabasca oil sands: genetic and metabolic characterization. Fems Microbiology Ecology, 55(1): 68-78. DOI:10.1111/fem.2006.55.issue-1 |
Laverman A M, Braster M, Röling W F M, et al. 2005. Bacterial community structure and metabolic profiles in a forest soil exhibiting spatially variable net nitrate production. Soil Biology and Biochemistry, 37(9): 1581-1588. DOI:10.1016/j.soilbio.2005.01.019 |
Ling N, Deng K Y, Song Y, et al. 2014. Variation of rhizosphere bacterial community in watermelon continuous mono-cropping soil by long-term application of a novel bioorganic fertilizer. Microbiological Research, 169(7/8): 570-578. |
Liu B R, Jia G M, Chen J, et al. 2006. A review of methods for studying microbial diversity in soils. Pedosphere, 16(1): 18-24. DOI:10.1016/S1002-0160(06)60021-0 |
Marschner P, Neumann G, Kania A, et al. 2002. Spatial and temporal dynamics of the microbial community structure in the rhizosphere of cluster roots of white lupin (Lupinus albus L. ). Plant and Soil, 246(2): 167-174. DOI:10.1023/A:1020663909890 |
O'Donnell A G, Seasman M, Macrae A, et al. 2001. Plants and fertilizers as drivers of change in microbial community structure and function in soils. Plant and Soil, 232(1/2): 135-145. DOI:10.1023/A:1010394221729 |
Oren A, Steinberger Y. 2008. Catabolic profles of soil fungal communities along a geographic climatic gradient in Israel. Soil Biology and Biochemistry, 40(10): 2578-2587. DOI:10.1016/j.soilbio.2008.05.024 |
Pielou E C. 1975. Mathematical ecology. Journal of Animal Ecology, 47(3): 1024. |
Preston-Mafham J, Boddy L, Randerson P F. 2002. Analysis of microbial community functional diversity using sole-carbon-source utilization profilies a critique. FEMS Microbiology Ecology, 42(1): 1-14. |
Qu Y D, Su Z Y, Peng G X, et al. 2009. Soil microbial functional diversity in a montane evergreen broadleaved forest of Chebaling following the huge ice storm in south China. Acta Ecologica Sinica, 29(11): 6156-6164. |
Smalla K, Wachtendorf U, Heuer H, et al. 1998. Analysis of BIOLOG GN substrate utilization patterns by microbial communities. Applied and Environmental Microbiology, 64(4): 1220-1225. |
Springob G, Kirchmann H. 2003. Bulk soil C to N ratio as a simple measure of net N mineralization from stabilized soil organic matter in sandy arable soils. Soil Biology & Biochemistry, 35(4): 629-632. |
Tirol-Padre A, Ladha J K. 2004. Assessing the reliability of permanganate-oxidizable carbon as an index of soil labile carbon. Soil Science Society of America Journal, 68(3): 969-978. DOI:10.2136/sssaj2004.9690 |
Ward D M, Weller R, Bateson M M. 1990. 16S rRNA sequences reveal numerous uncultured microorganisms in a nature community. Nature, 345(6270): 63-65. DOI:10.1038/345063a0 |
White C, Tardif J C, Adkins A, et al. 2005. Functional diversity of microbial communities in the mixed boreal plain forest of central Canada. Soil Biology and Biochemistry, 37: 1359-1372. DOI:10.1016/j.soilbio.2004.12.007 |
Zak J C, Willig M R, Moorhead D L, et al. 1994. Functional diversity of microbial communities: a quantitative approach. Soil Biology and Biochemistry, 26(9): 1101-1108. DOI:10.1016/0038-0717(94)90131-7 |
 2019, Vol. 55
2019, Vol. 55

