文章信息
- 马涛, 黄志嘉, 朱映, 林娜, 肖强, 何余容, 温秀军.
- Ma Tao, Huang Zhijia, Zhu Ying, Lin Na, Xiao Qiang, He Yurong, Wen Xiujun.
- 尺蛾科昆虫性信息素组分特征及应用进展
- Progress in Sex Pheromone Components in Geometrid Species (Lepidoptera: Geometridae) and Their Applications
- 林业科学, 2019, 55(5): 152-162.
- Scientia Silvae Sinicae, 2019, 55(5): 152-162.
- DOI: 10.11707/j.1001-7488.20190517
-
文章历史
- 收稿日期:2018-08-06
- 修回日期:2018-12-14
-
作者相关文章
2. 华南农业大学农学院 广州 510642;
3. 中国农业科学院茶叶研究所 杭州 310008
2. College of Agriculture, South China Agricultural University Guangzhou 510642;
3. Tea Research Institute, Chinese Academy of Agricultural Science Hangzhou 310008
尺蛾隶属鳞翅目(Lepidoptera)尺蛾科(Geometridae),截至目前,全球已描述23 000多种,与夜蛾科(Noctuidae)和螟蛾科(Pyralidae)一并成为鳞翅目的3大科(Scoble, 1999;Yuvaraj et al., 2018)。尺蛾寄主植物广泛,危害很大,严重时造成植株死亡,多数为重要的农林害虫,如油桐尺蠖(Buasra suppressaria)、春尺蠖(Apocheima cinerarius)、国槐尺蠖(Semiothisa cinerearia)、桑尺蠖(Phthonandria atrilineata)、茶尺蠖(Ectropis obliqua)和灰茶尺蠖(Ectropis grisescens)等。部分尺蛾科的雌虫翅退化,或者无翅,不能飞翔,限制了它们的活动范围;这类无翅类群,如白桦尺蛾属(Phigalia)、松尺蛾属(Erannis)、秋尺蛾属(Operophtera)的种类,可能是为了更好适应寒冷的环境,完成种群的繁衍,它们的生活习性比较特殊,大多数1年发生1代,化蛹多在树下土中(朱弘复,1979;舒庆惠,1988;汪学俭等,2014)。
近些年,随着“昆虫化学生态学”领域的快速发展,围绕这一领域相继召开了国际化学生态学大会(International Society of Chemical Ecology)、亚太化学生态学大会(Asia-Pacific Association of Chemical Ecologists)和国内化学生态学学术会议(Chinese Association of Chemical Ecology)等。同时,加上人类对环境越来越重视,国际上对化学农药使用的限制越来越严格,许多国家对使用农药都有明确规定。因此,昆虫性信息素在害虫监测和防治中具有很大的应用潜力,越来越受到人们重视。不论是用作害虫发生动态预测预报,还是用诱捕法或干扰交配法直接防治,均有利于保护天敌,提高防治效果,减少化学农药的用量,减轻污染,保护环境,具有显著的生态效益、经济效益和社会效益(马涛等,2012;2013;2016)。在此基础上还深入研究了昆虫信息素在昆虫体内的生物合成以及内分泌调节机制(Jurenka et al., 1991;Hull et al., 2010;Ding et al., 2015)、昆虫嗅觉化学感受器及其感受机理(Mitsuno et al., 2008;Liu et al., 2010;Walter, 2013)、昆虫性信息素信息传导、编码、加工处理及其与行为反应的关系等(Nakagawa et al., 2005;Jarriault et al., 2009),进而为利用昆虫行为控制方法来监测、防治害虫提供理论依据,并可利用分子生物学技术探讨昆虫之间的化学通讯的奥秘。
由于尺蛾科昆虫性信息素组分碳链较长,结构复杂,多数为不饱和烃类化合物,严重影响了全球尺蛾类昆虫性信息素组分的化学鉴定及野外应用。本文通过对已鉴定的尺蛾科昆虫性信息素进行综述,分析其性信息素组分化合物的结构和双键位置,以及在尺蛾科各亚科、属、种之间的分布特征,为今后鉴定未知尺蛾性信息素活性组分,以及利用昆虫性信息素对我国尺蛾类害虫进行有效的绿色防控等提供参考。
1 鳞翅目昆虫性信息素的最新分类自第1个昆虫性信息素组分(反10,顺12-十六碳二烯醇,E10, Z12-16OH)从蚕蛾(Bombyx mori)(50万头蚕蛾性信息素腺体中获得280 g粗提物,浓缩得到12 mg的性信息素组分)中鉴定开始,昆虫性信息素的研究已有将近60年的历史(Butenandt et al., 1959;Dickschat, 2014;马涛等,2018)。目前以鳞翅目昆虫性信息素的研究最为详细广泛,而毛翅目昆虫性信息素组分跟鳞翅目昆虫极为相似,因此,将毛翅目划分为鳞翅目的姊妹组(Yuvaraj et al., 2018)。基于对鳞翅目昆虫性信息素的产生释放模式、独特的化学机构及生物合成途径等,将目前的鳞翅目和毛翅目昆虫性信息素组分主要划分为4大类(TypeⅠ、TypeⅡ、TypeⅢ、Type 0)(Millar, 2000;Ando et al., 2011;Löfstedt et al., 2016;Yuvaraj et al., 2017);进而通过文献检索,得出已报道的鳞翅目昆虫各个总科之间性信息组分(性引诱剂)的系统进化及分布,每一昆虫性信息素为单一或多元组分,多元组分则具有特定的组成比例,在种与种之间的化学通讯联系中起着生殖隔离的作用,其中凤蝶总科昆虫性信息素尚未鉴定(图 1)。

|
图 1 鳞翅目及毛翅目昆虫性信息素组分类型分布系统树(改自Yuvaraj et al., 2017;2018) Fig. 1 Phylogenetic tree of the major lepidopteran lineages and the sister order Trichoptera with the proposed evolution of the different sex pheromone types (adapted from Yuvaraj et al., 2017; 2018) |
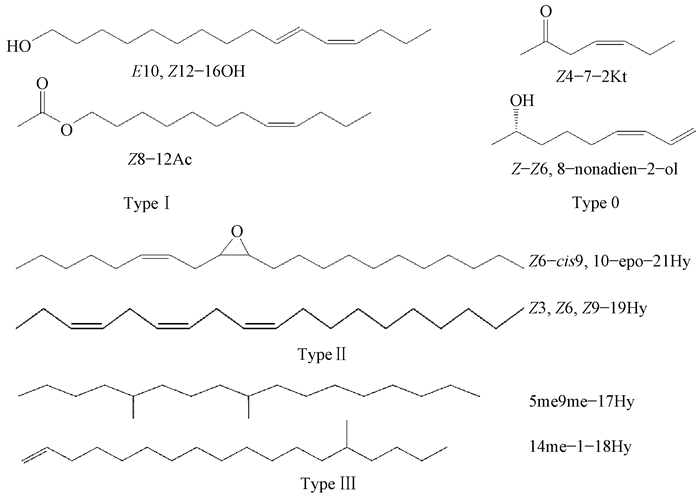
根据鳞翅目昆虫性信息素化学末端官能团及碳原子数目的差异可知:Type Ⅰ类型信息素主要为含有C10—C18直链烷烃,碳链末端具有醇、醛或者醋酸酯类官能团的化学结构,这部分信息素组分可达到已鉴定种类的75%,分布于多个总科中,像香梨优斑螟(Euzophera pyriella)的为顺9,反12-十四碳二烯醇(Z9, E12-14OH)(Ma et al., 2014)、绿翅绢野螟(Diaphania angustalis)的为反10,反12-十六碳烯醛(E10, E12-16Ald)和反10,反12-十六碳烯醇(E10, E12-16OH)(Ma et al., 2017),梨小食心虫(Grapholitha molesta)的为顺8-十二碳醋酸酯(Z8-12Ac)、反8-十二碳醋酸酯(E8-12Ac)、顺8-十二碳烯醇(Z8-12OH)(杨兴翠等,2015)。Type Ⅱ类型信息素为C17—C23的不饱和碳氢化合物以及相对应的环氧衍生物,可占到15%(Tóth et al., 1989;Ando et al., 1997, 2004;Wakamura et al., 2001)。Type Ⅲ类信息素组分,不同于Type Ⅰ和Type Ⅱ,该类昆虫具有特殊化的生物合成模式,其组分主要含有C17—C23并携带1个或多个甲基分支,仅仅出现在少数的鳞翅目昆虫中(Ando et al., 2004;Löfstedt et al., 2016)。Type 0类信息素组分为短链的仲醇或酮类化合物,这类化合物跟植物挥发物(volatile organic compounds,VOCs)的结构相似,仅仅集中在鳞翅目中比较古老的家系中(毛顶蛾总科和微蛾总科)和毛翅目,故而被认为是一些古老的信息素类型(Kozlov et al., 1996;Löfstedt et al., 1997;Löfstedt et al., 1994;2016)(图 2)。
|
图 2 鳞翅目昆虫性信息素的4种类型 Fig. 2 The four types of sex pheromone components of Lepidoptera Z:顺式双键Z-double bond;E:反式双键E-double bond;OH:醇Alcohol;Ac:醋酸酯Acetate;Kt:酮类Keto compounds;Hy:无末端功能团Absence of a terminal functional group;epo:顺式-环氧环cis-epoxy ring;me:甲基侧链Methyl branch.下同The same below. |
尺蛾科主要分为6或者9亚科系统,Prout提出的6亚科系统的单系地位并不可靠,从而形成了目前的9亚科系统(Scoble, 1999),目前全球已鉴定出信息素组分的尺蛾,分布在灰尺蛾亚科(Ennominae)、尺蛾亚科(Geometrinae)、沙尺蛾亚科(Alsophilinae)、姬尺蛾亚科(Sterrhinae)、花尺蛾亚科(Larentiinae)和星尺蛾亚科(Oenochrominae),共计93属158种昆虫性信息素组分得到鉴定,仅仅只有姬尺蛾亚科的昆虫信息素组分类型主要为Type Ⅰ,其余亚科昆虫信息素主要为Type Ⅱ(表 1)(El-Sayed, 2018)。而我国鉴定的尺蛾类昆虫性信息素鲜有报道,这方面工作与国外存在显著差距。
|
|
通过已鉴定出的性信息素组分特征分析(图 3),尺蛾科昆虫性信息素组分主要为不饱和的碳氢化合物及相对应的环氧衍生物或者带有甲基侧链的烃类化合物(C17—C23),一般含有2~4个双键(3个双键的种类最多),其中部分性信息素组分具有手性异构现象(S或R构象),进而构成外消旋体,因此,这类化合物相对于其他科昆虫的性信息素组分,更难于鉴定;其次为醇、醛、醋酸酯类、丁酸类、酮类化合物,这些简单化合物仅仅出现在27种尺蛾中,占到已鉴定昆虫的17.09%(El-Sayed, 2018)。

|
图 3 尺蛾科昆虫性信息素组分的不同类型 Fig. 3 The different types of sex pheromone components of Geometridae Ald:醛类Aldehyde;Acid:羧酸Carboxylic acid;R:右旋R configuration;S:左旋S configuration. |
此外,有些尺蛾具有独特的性信息素组分,像沙尺蛾亚科的Alsophila pometaria和尺蛾亚科的Maxates versicauda microptera性信息素组分含有4个双键(Wong et al., 1984a);只有一种炔基烃类化合物(Y9, Z6-19Hy)出现在灰尺蛾亚科的Brephos notha中(Subchev et al., 1986);E4, Z6, Z9-19Hy和Z6, Z9-trans-4S, 5S-epoxy-19Hy仅仅为Bupalus piniarius的性信息素组分(Francke et al., 1998);Z6, Z9-19-3Kt为Peribatodes rhomboidaria的性信息素组分(Buser et al., 1985;Tóth et al., 1987),这几种化合物并未出现在其他尺蛾中。
还有一些尺蛾性信息素组分为碳链不同长度的混合物构成,如Theria rupicapraria的性信息素组分为C20和C21的Z6, Z9二烯烃混合物(Szöcs et al., 1996);Epirrhoe sperryi的性信息素组分为C18和C19的Z3, Z6, Z9三烯烃混合物(Wong et al., 1985;Millar et al., 1992);舒涤尺蛾(Dysstroma citrata)的性信息素组分为C20和C21的Z3, Z6, Z9三烯烃混合物(Wong et al., 1985);Dysstroma brunneata ethela 的性信息素组分为Z3, Z6-9S, 10R-epo-20Hy和Z3, Z6-9S,10R-epo-21Hy(Wong et al., 1985)。
甲基侧链类性信息素组分也在尺蛾类昆虫中出现,作为一种比较特殊的性信息素组分,主要为Lambdina属和Nepytia属昆虫的性信息素组分,像2me5Sme-17Hy和3S13Rme-17Hy等结构(Ando et al., 2015)。
通过对尺蛾性信息素组分结构的分析,可知尺蛾昆虫性信息素组分多数为烃类和环氧类化合物,这对性信息素的鉴定工作有着巨大的考验。
3 尺蛾科昆虫性信息素的协同与拮抗行为环氧化合物的手性特征也是特别重要的,一种对映体具有高度活性,而另一对映体可能完全没有活性或者具有一定的抑制作用。但是,有些对映体之间也有协同作用,如Semiothisa signaria dispuncta和Epelis truncataria更多的被Z6, Z9-cis-3, 4-epo-17Hy所引诱,并非一种对映体的浓缩物(Millar et al., 1990a),然而当时的分析技术无法得出雌性性信息素对映体的混合物,随着气相色谱手性固定相技术的发展,从Ascotis selenaria cretacea分析得到了性信息素组分为Z6, Z9-3R, 4S-epo-19Hy和Z6, Z9-3S, 4R-epo-19Hy的混合物,其比例为33:38,可对雄蛾产生较好的行为反应(Ando et al., 1997)。
有些性信息素组分不同异构体(环氧结构和双键位置)也可对雄蛾产生抑制反应,如Euchlaena madusaria的性信息素组分为Z6-cis-9, 10-epo-19Hy和Z6, Z9-19Hy,但是Z9-cis-6, 7-epo-19Hy可抑制雄蛾的行为反应(Millar et al., 1991);另一尺蛾Sicya macularia的性信息素组分为Z6, Z9-3S, 4R-epo-19Hy和Z3, Z6, Z9-19Hy,同样它的异构体Z3, Z9-cis-6, 7-epo-19Hy也可对雄蛾产生拮抗作用(Millar et al., 1990a);有些性信息素组分不同链接长度也可对其产生拮抗作用,像Plagodis alcoolaria雄蛾对其性信息组分(Z3, Z9-6R, 7S-epo-20Hy和Z3, Z6, Z9-20Hy)产生较好的行为反应,且野外效果显著;但是Z3, Z9-6R, 7S-epo-19Hy可引起雄蛾更高的EAG反应,灵敏性强于Z3, Z9-6R, 7S-epo-20Hy,然而前者在野外诱捕过程中,可产生拮抗作用(Millar et al., 1991a);此外,不同结构类型的化合物也可对雄蛾产生拮抗作用,像柠条尺蠖(Paleacrita vernata)的性信息素组分为Z3, Z6, Z9-20Hy,Z3, Z6, Z9-19Hy和Z6, Z9-19Hy,全部为直链化合物,但是环氧化合物Z6, Z9-cis-3, 4-epo-19Hy可对柠条尺蠖雄蛾产生抑制反应(Millar et al., 1990b)。
4 尺蛾科昆虫性信息素的分布特征尺蛾性信息素不同亚科之间的分布也存在差异,像尺蛾亚科和沙尺蛾亚科昆虫的性信息素组分均为直链的烃类化合物,无环氧结构(Wong et al., 1984b;Yamakawa et al., 2011);灰尺蛾亚科,花尺蛾亚科和星尺蛾亚科昆虫的性信息素组分既有直链烃类化合物,又有手性异构现象的环氧化合物(Millar et al., 1990a;Ando et al., 1993;Tóth et al., 1994;Szöcs et al., 2002;Yasui et al., 2005);而尺蛾类昆虫性信息素组分在不同亚科之间也有一定的重叠性,像Z3, Z6, Z9-20Hy存在于灰尺蛾亚科,尺蛾亚科和花尺蛾亚科的多种昆虫中;Z3, Z9-6R, 7S- epo-19Hy,Z3, Z6-9R, 10S-epo-21Hy存在于花尺蛾亚科和灰尺蛾亚科中,各个亚科之间的性信息素组分重叠率不高;但同一性信息素组分在同一亚科之间的重叠率较高,像Z3, Z6, Z9-19Hy存在于灰尺蛾亚科的25属29种、花尺蛾亚科的4属7种和沙尺蛾亚科Alsophila属的3种昆虫中,目前已知Z3, Z6, Z9-19Hy在所有化合物中出现频次最高,说明该化合物在尺蛾类昆虫的化学通讯交流中起着非常重要的作用;E7, Z9-12Ac存在于姬尺蛾亚科Idaea属的9种昆虫中(该属已鉴定13种尺蛾的性信息素组分)(Ando et al., 1987;Szöcs et al., 1987;Grichanov et al., 1995;Zhu et al., 1996;Marek et al., 2000);Z3, Z9-6S, 7R-epo-21Hy出现在花尺蛾亚科Xanthorhoe属的4种昆虫中(该属已鉴定6种尺蛾的性信息素组分)(Millar et al., 1991a;Szöcs et al., 2002)。
尺蛾性信息素组分的分布,也与碳原子数目相关,C17类化合物主要分布在灰尺蛾亚科,目前除了尺蛾亚科的3种昆虫[Pamphlebia rubrolimbraria rubrolimbraria、赤线尺蛾(Culpinia diffusa)、Idiochlora ussuriaria),其他4个亚科均无C17类化合物;其次为C19类化合物出现频次较高,而C20—C21类化合物,比较少见;C22类化合物出现的频次更低,像Z3, Z6, Z9-22Hy,目前报道仅仅作为Mesoleuca ruficillata的性引诱剂,但该化合物并非该虫的雌性产生(Wong et al., 1985;Millar et al., 1991a)。
这些性信息素组分在不同亚科之间、同亚科不同属之间、同亚科同属不同种之间的重叠分布以及不同亚科性信息素组分的碳原子数目,说明不同昆虫之间的性信息素组分具有较大的关联性(马涛等,2013)。
5 尺蛾科昆虫性信息素的生物合成途径鳞翅目昆虫性信息素的生物合成途径研究最为广泛,其组分为相应结构的脂肪酸在各种酶类作用下,经过多种反应或碳链加长等,进一步修饰而成(赵远等,2006),目前已报道的尺蛾性信息素组分(烃类和环氧化合物)的生物合成途径基本大致相同(图 4),其性信息素前体化合物是具有相似结构的脂肪酸类化合物(亚麻油酸Z9, Z12-18COOH或亚麻酸Z9, Z12, Z15-18COOH),经过还原脱羧、还原、环氧化、氧化可以得到C17和C18的烃类和相对应的环氧化合物;或者经碳链加长(Chain extension)得到C20、C22和C24脂肪酸,然后还原脱羧、环氧化得到C19、C21和C23的烃类和相对应的环氧化合物;或还原、环氧化得到C20和C22的烃类和相对应的环氧化合物(Millar, 2000);而性信息素生物合成激活神经肽(pheromone biosynthesis activating neuropeptide,PBAN)是调控蛾类性信息素体内合成的重要物质(Raina et al., 1989;Rafaeli et al., 2003;Blomquist et al., 2011;Jurenka, 2017),首先在咽下神经节复合体中合成,存于心侧体,受到刺激到释放进而直接促进雌性信息素的合成,主要途径是调节相关酶的活性来调控前体化合物脂肪酸的还原脱羧;像去头的Ascotis selenaria cretacea雌蛾的信息素组分为Z3, Z6, Z9-19Hy,并无组分Z3, Z6-cis-9, 10-epo-19Hy,但是人为给雌蛾注射PBAN,性信息素组分的生成量恢复正常,环氧类化合物出现,同时,Z3, Z6, Z9-19Hy的含量却在降低(Ando et al., 1997),表明昆虫性信息素的合成与PBAN密切相关,由于昆虫性信息素的生物合成及相关机理均取得了一定的进展,研究技术相对成熟,因此,对于一些未释放性信息素组分的尺蛾,可人为注射PBAN,进而诱导产生性信息素化合物。

|
图 4 不饱和多烯烃类或者环氧化合物的生物合成途径 Fig. 4 Biosynthetic pathways of polyene hydrocarbon and epoxide compounds |
我国学者也对尺蛾类昆虫性信息素进行了研究,主要集中在国槐尺蠖、桑尺蠖、油桐尺蠖、银花尺蠖(Heterolocha jinyinhuaphaga)、柠条尺蠖、茶尺蠖、灰茶尺蠖、春尺蠖等,如国槐尺蠖主要开展了性信息素组分的生物学特性及鉴定,室内分析得到了Z3, Z6, Z9-19Hy和Z6, Z9-cis-3, 4-epo-17Hy,但林间诱捕尚未报道(任自立等,1991;Li et al., 1993;孔祥波等,2012);银花尺蠖的研究报道主要突显了性信息素的提取时间、所用溶剂及性信息素粗提物的性诱效果,尚未对其化学结构进行探讨(刘清琪等,1981;曾孝农等,1981);柠条尺蠖鉴定出了3个性信息素组分Z3, Z6, Z9-20Hy,Z3, Z6, Z9-19Hy和Z6, Z9-19Hy(冯帅,2015),但是该虫在20世纪90年代已被国外学者报道,并具有很好的林间引诱活性(Millar et al., 1990b);而油桐尺蠖作为桉树的主要害虫,短期可将大片桉树(Eucalyptus)林叶片吃光,但其性信息素初步研究仅仅在1983年被报道(王淑芬等,1983),之后再无有关报道。随着桉树产业的快速增长,油桐尺蠖作为一种比较重要的林业害虫,其性信息素组分鉴定难度、组分含量等问题值得关注和进一步探讨。因此,我国对尺蛾性信息素的研究多数集中在室内性信息素生物学、性信息素组分的鉴定及电生理测定,尤其关于性信息素的野外诱捕试验鲜有报道。
我国对于尺蛾性信息素研究报道最多的是茶尺蠖、灰茶尺蠖和春尺蠖,前2种是茶树的主要食叶害虫,而春尺蠖因雌蛾无翅,可作为尺蛾无翅类种群的代表。
6.1 茶尺蠖和灰茶尺蠖茶尺蠖和灰茶尺蠖是外部形态极为相似的近缘种,一度统称为茶尺蠖。当年虽然茶尺蠖的性信息素早已完成了分离、鉴定和人工化学合成,得出4种主要组分Z3, Z9-6, 7-epo-18Hy,Z3, Z6, Z9-22Hy,Z3, Z6, Z9-24Hy,Z9, Z12-18Ald,其中Z3, Z9-6, 7-epo-18Hy是引起茶尺蠖求偶反应的主要组分,但是田间应用效果不明显(Yao et al., 1991;殷坤山等,1993)。直到2014年研究明确茶园害虫茶尺蠖存在灰茶尺蠖和茶尺蠖2近缘种(席羽等,2014),进而在2016年研究获得灰茶尺蠖的2种性信息素组分,并确定为Z3, Z9-6, 7-epo-18Hy和Z3, Z6, Z9-18Hy,两者比例为4:1,剂量为800 μg时引诱效果最佳,且阐述了有关诱捕器的设置高度及类型,明确诱捕器悬挂至茶冠下40 cm处引诱效果最佳,此外,由于桶型诱捕器不用多次更换粘虫板,操作方便,诱蛾空间大,不存在船型诱捕器和三角形诱捕器诱蛾达到饱和的现象(Ma et al., 2016;Wang et al., 2018)。但是灰茶尺蠖性信息素组分却对茶尺蠖雄蛾没有引诱效果,表明这2种近缘种的性信息素化学通讯系统存在一定的差异,这也可能是导致在过去研究的茶尺蠖性信息素田间效果不明显的原因。目前,灰茶尺蠖性信息素产品已在全国茶园大面积推广应用。
如今茶尺蠖的性信息素又被重新鉴定,得出3种组分Z3, Z9-6, 7-epo-18Hy、Z3, Z6, Z9-18Hy和Z3, Z9-6, 7-epo-19Hy,其中Z3, Z9-6, 7-epo-19Hy作为一种新的组分出现在雌蛾的腺体中,3种组分均具有明显的EAG反应及风洞趋性反应(Luo et al., 2017),但相关野外诱捕试验仍未见报道,因此,Z3Z9-6, 7-epo-19Hy在茶尺蠖化学通讯系统的作用还需进一步探讨。
6.2 春尺蠖尺蛾雌蛾无翅或退化种类全球约记录100多种,我国对相关类群的研究较晚,而春尺蠖为我国该类种群中最具经济意义的一种,该虫严重危害我国北方林区的杨(Populus)、柳(Salix)、榆(Ulmus)等,经常大面积暴发(李燕,2011;陈应武等,2017),因此,科研人员相继探讨春尺蠖的性信息素,室内鉴定出春尺蠖的性信息素组分(Z4-14Ac和Z6-14Ac),此外也通过化学合成技术得到了2种性信息素标样(来晓倩等,2013),但是目前关于该虫的林间诱捕效果并无报道。春尺蠖于土中化蛹,由于雌蛾无翅,雌蛾出土后主要沿树干上爬,因而常用粘虫胶控制雌蛾的上爬,大多数雄蛾也会被粘虫胶粘住(赵志新等,2013);由于雄蛾具翅,因此推断并非雄蛾直接飞入粘虫胶(图 5),可能受到春尺蠖雌蛾的吸引,所以雌蛾正常释放性信息素。但是目前报道鉴定的春尺蠖性信息素为C14的单烯醋酸酯(闫祺等,2011),且仅仅室内验证了该虫的GC-EAD反应,而尚无野外引诱效果的报道,说明该虫的性信息素组分有待于进一步商榷。

|
图 5 春尺蠖雌蛾求偶及性信息素吸引雄蛾 Fig. 5 Female calling behavior and attractive to males by emitting a sex pheromone A:雌蛾求偶及成虫交配Calling and mating behavior of A. cinerarius;B:雄蛾被性信息素吸引Males attracted by sex pheromone of A. cinerarius females. |
近年来,化学农药的大量使用使“3R”问题显得更为突出,而昆虫性信息素作为一种高效环保、专一性强的新型绿色防虫技术,不仅可以用来监测害虫的发生动态,指导害虫防治,还可直接诱杀或者干扰两性间的化学通讯联络,减少两性间的交配率,因此,昆虫性信息素作为害虫综合防治策略(intergrated pest management, IPM)中的有效途径,可显著增强生态效益,越来越受到人们的关注,尤其在美国已被视为生物合理化农药(Biorational pesticides)。目前仍有许多重要的农林害虫性信息素组分急需鉴定,而尺蛾性信息素组分多数为Type Ⅱ型结构,具有较长的碳链、双键数量和手性异构现象,这些严重影响了尺蛾类害虫性信息素的鉴定及野外应用。
现全球已明确尺蛾科5亚科93属158种昆虫的性信息素组分,但是多数昆虫的性信息素组分均为国外学者研究并报道,而我国对于尺蛾类害虫的性信息素研究较少,尤其是昆虫性信息素的鉴定工作,与国外仍存在很大的差距;然而昆虫性信息素组分的鉴定(尤其是释放比例)及野外应用,是昆虫嗅觉感受机理、昆虫性信息素神经传导、雄蛾触角叶对性信息素组分的编码机制等相关研究的前提。如今随着分子生物学技术的快速发展,多数重要害虫的性信息素组分虽未见报道,但相继开展的害虫性信息素的分子生态学,如触角转录组及嗅觉基因分析、性信息素结合蛋白基因克隆及原核表达、性信息素结合蛋白基因序列及表达分析等,可从尺蛾性信息素进化的角度探讨生物物种进化方向,进而从分子生物学化学通讯机制方面推动昆虫性信息素的研究。
通过描述尺蛾性信息素组分在不同亚科之间、同亚科不同属之间、同亚科同属不同种之间的重叠分布,并利用昆虫性信息素组分的重叠分布特征,可为同亚科、同属之间害虫性信息素的研究提供借鉴。若研究对象性信息素组分释放量甚微或者现有仪器设备无法检测到性信息素活性组分,可借鉴已鉴定昆虫的性信息素组分,利用标准化合物进行电生理反应、室内风洞行为试验和野外诱捕试验,从而缩小性信息素组分的范围,降低性信息素组分的鉴定难度。
明确性信息素组分很重要,但性信息素缓释载体也是影响野外诱捕效果的重要因素。由于尺蛾类性信息素组分均为烃类化合物,而不同缓释载体可导致性信息素组分发生异构化,因此应选取合适的缓释载体,实现性信息素组分均一稳定的释放。
陈应武, 夏彦飞. 2017. 不同沙丘类型对柠条林春尺蠖发生的影响. 河南农业科学, 46(2): 69-72. (Chen Y W, Xia Y F. 2017. Effects of different types of dunes on occurrence of Apocheima cinerarius in Caragana korshinski shrubs. Journal of Henan Agricultural Sciences, 46(2): 69-72. [in Chinese]) |
冯帅. 2015.柠条尺蠖生殖生物学及性信息素的基础研究.太谷: 山西农业大学硕士学位论文. (Feng S. 2015. Basic research on biology and sex pheromone for Paleacrita vernata. Taigu: MS thesis of Shanxi Agricultural University. [in Chinese]) |
孔祥波, 王鸿斌, 张真. 2012. 槐庶尺蛾性信息素腺体EAG活性成分绝对构型的鉴定(英文). 昆虫学报, 55(2): 162-167. (Kong X B, Wang H B, Zhang Z. 2012. Determination of the absolute configuration of an EAG activecomponent in the sex pheromone gland of Semiothisa cinerearia Bremer et Grey (Lepidoptera: Geometridae). Acta Entomologica Sinica, 55(2): 162-167. [in Chinese]) |
来晓倩, 闫祺, 韦卫, 等. 2013. 春尺蠖性信息素类似物的合成及活性成分筛选. 农药, 52(3): 165-170. (Lai X Q, Yan Q, Wei W, et al. 2013. Synthesis of sex pheromone candidates of Apocheima cinerarius Erschoff and screening of the activity. Agrochemicals, 52(3): 165-170. [in Chinese]) |
李燕. 2011. 春尺蠖防治技术. 天津农业科学, 17(3): 147-148. (Li Y. 2011. Prevention and control technologies of Apocheima cinerarius Erschoff. Tianjin Agricultural Sciences, 17(3): 147-148. DOI:10.3969/j.issn.1006-6500.2011.03.044 [in Chinese]) |
刘清琪, 庄文选, 曲庆沐, 等. 1981. 银花尺蠖性信息素的研究——雌蛾性信息素粗提物的性诱效果. 中药通报, (4): 2-3. (Liu Q Q, Zhuang W X, Qu Q M, et al. 1981. Studies on pheromone from Heterolocha jinyinhuaphaga (1), the effect of sex pheromone gland extracts. Bulletin of Chinese Materia Medica, (4): 2-3. [in Chinese]) |
马涛, 林娜, 周丽丽, 等. 2018. 性信息素迷向干扰防控害虫的研究进展及应用前景. 林业科学研究, 31(4): 172-182. (Ma T, Lin N, Zhou L L, et al. 2018. Research progress and application prospect of insect sex pheromone mating disruption. Forest Research, 31(4): 172-182. [in Chinese]) |
马涛, 刘志韬, 孙朝辉, 等. 2016. 香梨优斑螟性信息素化学合成及雄蛾数量动态监测. 环境昆虫学报, 38(1): 138-142. (Ma T, Liu Z T, Sun Z H, et al. 2016. Synthesis of sex pheromone and field population dynamics in Euzophera pyriella (Lepidoptera: Pyralidae). Journal of Environmental Entomology, 38(1): 138-142. [in Chinese]) |
马涛, 温秀军, 李兴文. 2012. 昆虫性信息素人工合成技术研究进展. 世界林业研究, 25(6): 46-50. (Ma T, Wen X J, Li X W. 2012. Research advance in artificial synthesis of insect sex pheromone. World Forestry Research, 25(6): 46-50. [in Chinese]) |
马涛, 张蒙, 朱雪姣, 等. 2013. 螟蛾总科昆虫性信息素活性组分及结构特征. 生态学杂志, 32(12): 3378-3384. (Ma T, Zhang M, Zhu X J, et al. 2013. Active components and structural features of insect sex pheromones in Pyraloidea. Chinese Journal of Ecology, 32(12): 3378-3384. [in Chinese]) |
任自立, 赵刚, 徐建华, 等. 1991. 国槐尺蠖性信息素的生物学研究. 昆虫学报, 34(3): 271-277. (Ren Z L, Zhao G, Xu J H, et al. 1991. Biological studies on the sex pheromone of the Sophora geometrid Semiothisa cinerearia Bremer et Grey. Acta Entomologica Sinica, 34(3): 271-277. [in Chinese]) |
舒庆惠. 1988. 白桦尺蠖的生物学特性与防治. 北京林业大学学报, 10(3): 111-118. (Shu Q H. 1988. Biomass and control of Phigalia djakanovi Moltreht. Journal of Beijing Forestry University, 10(3): 111-118. [in Chinese]) |
汪学俭, 王辉锋. 2014. 尺蛾科雌蛾无翅类群重要害虫春尺蠖的研究综述. 山地农业生物学报, 33(4): 84-88. (Wang X J, Wang H F. 2014. The literautre review of Apocheima cinerarius (Erschoff) which belong to wingless geometrid moths. Journal of Mountain Agriculture and Biology, 33(4): 84-88. DOI:10.3969/j.issn.1008-0457.2014.04.019 [in Chinese]) |
王淑芬, 唐大武. 1983. 油桐尺蠖成虫期生物学特性及性信息素研究初报. 中南林学院学报, 3(1): 18-27. (Wang S, Tang D W. 1983. A preliminary study on biological characteristics of the adult Tung tree Geometer (Buzura supressaria Guenée) and it's sex pheromone. Journal of Central South Forestry University, 3(1): 18-27. [in Chinese]) |
席羽, 殷坤山, 唐美君, 等. 2014. 浙江茶尺蠖地理种群已分化成为不同种. 昆虫学报, 57(9): 1117-1122. (Xi Y, Yin K S, Tang M J, et al. 2014. Geographic populations of the tea geometrid, Ectropis obliqua (Lepidoptera: Geometridae) in Zhejiang, eastern China have differentiated into different species. Acta Entomologica Sinica, 57(9): 1117-1122. [in Chinese]) |
闫祺, 韦卫, 侯雪玲, 等. 2011. 春尺蠖性信息素活性成分的提取和GC-MS鉴定. 昆虫学报, 54(3): 368-372. (Yan Q, Wei W, Hou X L, et al. 2011. Extraction and GC-MS identification of active components of sex pheromone from Apocheima cinerarius Erschoff (Lepidoptera: Geometridae). Acta Entomologica Sinica, 54(3): 368-372. [in Chinese]) |
杨兴翠, 马涛, 易思雨, 等. 2015. 性信息素微胶囊迷向防治梨小食心虫田间试验. 中国生物防治学报, 31(3): 410-415. (Yang X C, Ma T, Yi S Y, et al. 2015. Mating disruption control of Grapholitha molesta using sex pheromone microcapsle emulsion. Chinese Journal of Biological Control, 31(3): 410-415. [in Chinese]) |
殷坤山, 洪北边, 尚稚珍, 等. 1993. 茶尺蠖性信息素生物学综合研究. 自然科学进展, 3(4): 28-34. (Yin K S, Hong B B, Shan Z Z, et al. 1993. Biological study on tea geometrid (Ectropis obliqua) pheromone. Progress in National Science, 3(4): 28-34. [in Chinese]) |
曾孝农, 刘清琪, 时成华, 等. 1981. 银花尺蠖性信息素的研究——二、性信息素提取的适宜时间和溶剂. 中药通报, (5): 5-6. (Zeng X N, Liu Q Q, Shi C H, et al. 1981. Studies on pheromone from Heterolocha jinyinhuaphaga —(2)Appropriate time and solvent of sex pheromone extraction. Bulletin of Chinese Materia Medica, (5): 5-6. [in Chinese]) |
赵志新, 郭小军, 王刚, 等. 2013. 无公害粘虫胶防治春尺蠖的效果. 安徽农业科学, 41(4): 1526-1527. (Zhao Z X, Guo X J, Wang G, et al. 2013. Control of Apocheima cinerarius with the sticky insect glue. Journal of Anhui Agricultural Sciences, 41(4): 1526-1527. DOI:10.3969/j.issn.0517-6611.2013.04.047 [in Chinese]) |
赵远, 胡志刚, 陈克平. 2006. 鳞翅目昆虫性信息素合成的分子机制研究进展. 蚕业科学, 32(4): 548-554. (Zhao Y, Hu Z G, Chen K P. 2006. Research advance on molecular mechanism of sex pheromone biosynthesis in Lepidoptera. Canyekexue, 32(4): 548-554. DOI:10.3969/j.issn.0257-4799.2006.04.019 [in Chinese]) |
朱弘复. 1979. 尺蛾科三新属三新种. 昆虫学报, 22(1): 73-76. (Zhu H F. 1979. Three new genera and three new species of the family geometridea. Acta Entomologica Sinica, 22(1): 73-76. [in Chinese]) |
Ando T, Inomate S I, Yamamoto M. 2004. Lepidopteran sex pheromones. //Schulz S. The chemistry of pheromones and other semiochemicals. Berlin, Heidelberg, New York: Springer, 51-96.
|
Ando T, Koike M, Uchiyama M, et al. 1987. Lepidopterous sex attractants with a conjugated diene system. Agricultural and Biological Chemistry, 51(10): 2691-2694. |
Ando T, Ohsawa H, Ueno T, et al. 1993. Hydrocarbons with a homoconjugated polyene system and their monoepoxy derivatives: sex attractants of geometrid and noctuid moths distributed in Japan. Journal of Chemical Ecology, 19(4): 787-798. DOI:10.1007/BF00985009 |
Ando T, Ohtani K, Yamamoto M, et al. 1997. Sex pheromone of Japanese giant looper, Ascotis selenaria cretacea: identification and field tests. Journal of Chemical Ecology, 23(10): 2413-2423. DOI:10.1023/B:JOEC.0000006683.58028.1e |
Ando T, Yamakawa R. 2011. Analyses of lepidopteran sex pheromones by mass spectrometry. Trends in Analytical Chemistry, 30(7): 990-1002. DOI:10.1016/j.trac.2011.03.010 |
Ando T, Yamakawa R. 2015. Chiral methyl-branched pheromones. Natural Product Report, 32(7): 1007-1041. DOI:10.1039/C4NP00138A |
Blomquist GJ, Jurenka R, Schal C, et al. 2011. Pheromone production: biochemistry and molecular biology//Gilbert L I. Insect endocrinology. Academic Press, San Diego, CA, 523-567.
|
Buser H R, Guerin P M, Tóth M, et al. 1985. (Z, Z)-6, 9-nonadecadien-3-one and (Z, Z, Z)-3, 6, 9-nonadecatriene: identification and synthesis of sex pheromone components of Peribatodes rhomboidaria. Tetrahedron Letters, 26(4): 403-406. DOI:10.1016/S0040-4039(00)61895-6 |
Butenandt A, Beckmann R, Stamm D, et al. 1959. Vber den sexuallockstoff den seidenspinners Bombyx mori. Reindarstellung und Konstitution. Zeitschrift für Naturforschung B, 14(4): 283-284. |
Dickschat J S. 2014. Capturing volatile natural products by mass spectrometry. Natural Product Report, 31(6): 838-861. DOI:10.1039/c3np70080a |
Ding B J, Löfstedt C. 2015. Analysis of the Agrotis segetum pheromone gland transcriptome in the light of sex pheromone biosynthesis. BMC Genomics, 16: 711. DOI:10.1186/s12864-015-1909-2 |
El-Sayed A M.[2018-07-21].The pherobase: database of pheromones and semiochemicals. http://www.pherobase.com.
|
Francke W, Brunnemann U, Bergmann J, et al. 1998. Semiochemistry at junctions: volatile compounds from desert locusts, caddisflies, and geometrid moths. Int Symp Insect Pheromones, 2nd, Wageningen, Netherlands, 71-73.
|
Grichanov I Y, Bulyginskaya M A, Bukzeeva O N, et al. 1995. Ecogeographical variation of species specificity of the artificial sex attractants of Lepidoptera. Russian Journal of Ecology, 26(5): 349-352. |
Hull J J, Lee M J, Matsumoto S. 2010. Gqα-linked phospholipase Cβ1 and phospholipase Cγ are essential components of the pheromone biosynthesis activating neuropeptide (PBAN) signal transduction cascade. Insect Molecular Biology, 19(4): 553-566. |
Jarriault D, Gadenne C, Rospars J P, et al. 2009. Quantitative analysis of sex-pheromone coding in the antennal lobe of the moth Agrotis ipsilon: a tool to study network plasticity. Journal of Experimental Biology, 212(8): 1191-1201. DOI:10.1242/jeb.024166 |
Jurenka R, Jacquin E, Roelofs W L. 1991. Control of the pheromone biosynthetic pathway in Helicoverpa zea by the pheromone biosynthesis activating neuropeptide (PBAN). Archives of Insect Biochemistry and Physiology, 17(2/3): 81-91. |
Jurenka R. 2017. Regulation of pheromone biosynthesis in moths. Current Opinion in Insect Science, 24: 29-35. DOI:10.1016/j.cois.2017.09.002 |
Kozlov M V, Zhu J, Philipp P, et al. 1996. Pheromone specificity in Eriocrania semipurpurella (Stephens) and E. sangii (Wood) (Lepidoptera: Eriocraniidae) based on chirality of semiochemicals. Journal of Chemical Ecology, 22(3): 431-454. DOI:10.1007/BF02033647 |
Li Z M, Yao E Y, Liu T L, et al. 1993. Structural elucidation of sex pheromone components of the Geometridae Semiothisa cinerearia (Bremer et Grey) in China. Chinese Journal of Chemistry, 11(3): 251-256. |
Liu R H, Lehane S, He X L, et al. 2010. Characterisations of odorant-binding proteins in the tsetse fly Glossina morsitans morsitans. Cellular and Molecular Life Sciences, 67(6): 919-929. DOI:10.1007/s00018-009-0221-1 |
Löfstedt C, Hansson B S, Petersson E, et al. 1994. Pheromonal secretions from glands on the 5th abdominal sternite of hydropsychid and rhyacophilid caddisflies (Trichoptera). Journal of Chemical Ecology, 20(1): 153-169. DOI:10.1007/BF02065998 |
Löfstedt C, Kozlov M. 1997. A phylogenetic analysis of pheromone communication in primitive moths//Cardé R T, Minks A K. Insect pheromone research-new directions. New York: Chapman & Hall, 473-489.
|
Löfstedt C, Wahlberg N, Millar J M. 2016. Evolutionary patterns of pheromone diversity in lepidoptera//Allison J D, Cardé R T. Pheromone communication in moths: evolution, behavior and application. Berkeley: University of California Press, 43-78.
|
Luo Z X, Li Z Q, Cai X M, et al. 2017. Evidence of premating isolation between two sibling moths: Ectropis grisescens and Ectropis obliqua (Lepidoptera: Geometridae). Journal of Economic Entomology, 110(6): 2364-2370. DOI:10.1093/jee/tox216 |
Ma T, Li Y Z, Sun Z H, et al. 2014. (Z, E)-9, 12-Tetradecadien-1-ol: A major sex pheromone component of Euzophera pyriella (Lepidoptera: Pyralididae) in Xinjiang, China. Florida Entomologist, 97(2): 496-503. DOI:10.1653/024.097.0221 |
Ma T, Liu Z T, Wang C, et al. 2017. Production, identification, and field evaluation of sex pheromone from calling females in Diaphania angustalis (Lepidoptera: Crambidae). Environmental Science and Pollution Research, 24(31): 24485-24493. DOI:10.1007/s11356-017-0119-7 |
Ma T, Xiao Q, Yu Y G, et al. 2016. Analysis of tea geometrid (Ectropis grisescens) pheromone gland extracts using GC-EAD and GC×GC/TOFMS. Journal of Agricultural and Food Chemistry, 64(16): 3161-3166. DOI:10.1021/acs.jafc.6b00339 |
Marek J, Krampl F, Hrdy I. 2000. (E, Z)-7, 9-dodecadien-1-yl acetate acts as attractant for males of the genus Idaea (Lepidoptera: Geometridae: Sterrhinae). Plant Protection Science, 36(3): 95-100. DOI:10.17221/PPS |
Millar J G, Giblin M, Barton D, et al. 1990a. Synthesis and field testing of enantiomers of 6Z, 9Z-cis-3, 4-epoxydienes as sex attractants for geometrid moths. Journal of Chemical Ecology, 16(7): 2317-2339. DOI:10.1007/BF01026941 |
Millar J G, Giblin M, Barton D, et al. 1990b. Identification and field testing of female-produced sex pheromone components of the spring cankerworm, Paleacrita vernata Peck (Lepidoptera: Geometridae). Journal of Chemical Ecology, 16(12): 3393-3409. DOI:10.1007/BF00982106 |
Millar J G, Giblin M, Barton D, et al. 1991. Synthesis and field screening of chiral monounsaturated epoxides as lepidopteran sex attractants and sex pheromone components. Journal of Chemical Ecology, 17(5): 911-929. DOI:10.1007/BF01395599 |
Millar J G, Giblin M, Barton D, et al. 1991a. Chiral lepidopteran sex attractants: blends of optically active C20 and C21 diene epoxides as sex attractants for geometrid and noctuid moths (Lepidoptera). Environmental Entomology, 20(2): 450-457. DOI:10.1093/ee/20.2.450 |
Millar J G, Giblin M, Barton D, et al. 1992. Sex pheromone components of the geometrid moths Lobophora nivigerata and Epirrhoe sperryi. Journal of Chemical Ecology, 18(7): 1057-1068. DOI:10.1007/BF00980062 |
Millar J G. 2000. Polyene hydrocarbons and epoxides: a second major class of lepidopteran sex attractant pheromones. Annual Review of Entomology, 45: 575-604. DOI:10.1146/annurev.ento.45.1.575 |
Mitsuno H, Sakurai T, Murai M, et al. 2008. Identification of receptors of main sex-pheromone components of three Lepidopteran species. European Journal of Neuroscience, 28(5): 893-902. DOI:10.1111/ejn.2008.28.issue-5 |
Nakagawa T, Sakurai T, Nishioka T, et al. 2005. Insect sex-pheromone signals mediated by specific combinations of olfactory receptors. Science, 307(5715): 1638-1642. DOI:10.1126/science.1106267 |
Rafaeli A, Jurenka R. 2003. PBAN regulation of pheromone biosynthesis in female moths//Blomquist G J, Vogt R C. Insect pheromone biochemistry and molecular biology. Elsevier, Amsterdam, 107-136.
|
Raina A K, Jaffe H, Kempe T G, et al. 1989. Identification of a neuropeptide hormone that regulates sex pheromone production in female moths. Science, 244(4906): 796-798. DOI:10.1126/science.244.4906.796 |
Scoble M J. 1999. Geometrid moths of the world: a catalogue (Lepidoptera, Geometridae). London: The Natural History Museum, Collingwood & Apollo Books, xxvi + 1016.
|
Subchev M A, Ganev J A, Vostrowsky O, et al. 1986. Screening and use of sex attractants in monitoring of geometrid moths in Bulgaria. Zeitschrift für Naturforschung C, 41(11/12): 1082-1086. |
Szöcs G, Tóth M, Bestmann H J, et al. 1987. Polyenic hydrocarbons as sex attractants for geometrids and amatids (Lepidoptera) found by field screening in Hungary. Zeitschrift für Naturforschung C, 42(1/2): 165-168. |
Szöcs G, Tóth M, Francke W, et al. 1996. Homologous polyenic hydrocarbons in the sex pheromones of winter geometrids (Lepidoptera). ISCE Prague, 178.
|
Szöcs G, Tóth M, Francke W. 2002. Sex attractants for lepidopterous species: pure enantiomers or racemates of epoxydienes. ISCE Hamburg, 36.
|
TóthM, Buser H R, Peña A, et al. 1989. Identification of (3Z, 6Z)-1, 3, 6-, 10-epoxyheneicosatriene and (3Z, 6Z)-1, 3, 6-9, 10-epoxyeicosatriene in the sex pheromone of Hyphantria cunea. Tetrahedron Letters, 30(26): 3405-3408. DOI:10.1016/S0040-4039(00)99256-6 |
Tóth M, Szöcs G, Francke W, et al. 1987. Field activity of sex pheromone components of Peribatodes rhomboidaria. Entomologia Experimentalis et Applicata, 44(2): 199-204. DOI:10.1111/eea.1987.44.issue-2 |
Tóth M, Szöcs G, Francke W, et al. 1994. Pheromonal production of and response to optically active epoxydienes in some geometrid moths (Lepidoptera: Geometridae). Zeitschrift für Naturforschung C, 49(7/8): 516-521. |
Wakamura S, Arakaki N, Yamamoto M, et al. 2001. Posticlure: a novel trans-epoxide as a sex pheromone component of the tussock moth, Orgyia postica (Walker). Tetrahedron Letters, 42(4): 687-689. DOI:10.1016/S0040-4039(00)02038-4 |
Walter L S. 2013. Odorant reception in insects: roles of receptors, binding proteins, and degrading enzymes. Annual Review of Entomology, 58: 373-391. DOI:10.1146/annurev-ento-120811-153635 |
Wang Z B, Ma T, Mao T F, et al. 2018. Application technology of the sex pheromone of the tea geometrid Ectropis grisescens (Lepidoptera: Geometridae). International Journal of Pest Management, 64(4): 372-378. DOI:10.1080/09670874.2018.1447170 |
Wong J W, Palaniswamy P, Underhill E W, et al. 1984a. Novel sex pheromone components from the fall cankerworm moth, Alsophila pometaria. Journal of Chemical Ecology, 10(3): 463-473. DOI:10.1007/BF00988092 |
Wong J W, Palaniswamy P, Underhill E W, et al. 1984b. Sex pheromone components of fall cankerworm moth-Alsophila pometaria. Synthesis and field trapping. Journal of Chemical Ecology, 10(11): 1579-1596. DOI:10.1007/BF00988426 |
Wong J W, Underhill E W, MacKenzie S L, et al. 1985. Sex attractants for geometrid and noctuid moths. Field trapping and electroantennographic responses to their hydrocarbons and monoepoxydiene derivatives. Journal of Chemical Ecology, 11(6): 727-756. |
Yamakawa R, Duc Do N, Kinjo M, et al. 2011. Novel components of the sex pheromones produced by emerald moths: identification, synthesis, and field evaluation. Journal of Chemical Ecology, 37(1): 105-113. DOI:10.1007/s10886-010-9895-y |
Yao E Y, Li Z M, Luo Z Q, et al. 1991. Report on structural elucidation of sex pheromone components of a tea pest (Ectropis obliqua Prout). Progress in National Science, 1(6): 565-569. |
Yasui H, Wakamura S, Arakaki N, et al. 2005. Identification of a sex pheromone component of the geometrid moth Milionia basalis pryeri. Journal of Chemical Ecology, 31(3): 647-656. DOI:10.1007/s10886-005-2052-3 |
Yuvaraj J K, Andersson M N, Anderbrant O, et al. 2018. Diversity of olfactory structures: a comparative study of antennal sensilla in Trichoptera and Lepidoptera. Micron, 111: 9-18. DOI:10.1016/j.micron.2018.05.006 |
Yuvaraj J K, Corcoran J A, Andersson M N, et al. 2017. Characterization of odorant receptors from a non-ditrysian moth, Eriocrania semipurpurella sheds light on the origin of sex pheromone receptors in Lepidoptera. Molecular Biology and Evolution, 34(11): 2733-2746. DOI:10.1093/molbev/msx215 |
Zhu J W, Ryrholm N, Ljungberg H, et al. 1996. Olefinic acetates, delta-9, 11-14:OAc and delta-7, 9-12:OAc used as sex pheromone components in three geometrid moths, Idaea aversata, I. straminata, and I. biselata (Geometridae, Lepidoptera). Journal of Chemical Ecology, 22(8): 1505-1526. DOI:10.1007/BF02027728 |
 2019, Vol. 55
2019, Vol. 55

