文章信息
- 张茜茜, 杨庆朋, 刘亮, 王清涛, 李菲, 郭丽丽, 郝立华, 曹旭, 范晓懂, 梁伟佳, 郑云普.
- Zhang Xixi, Yang Qingpeng, Liu Liang, Wang Qingtao, Li Fei, Guo Lili, Hao Lihua, Cao Xu, Fan Xiaodong, Liang Weijia, Zheng Yunpu.
- 环剥对毛白杨树干表面CO2通量及其温度敏感性的影响
- Effects of Girdling on Stem CO2 Efflux and Its Temperature Sensitivity of Populus tomentosa
- 林业科学, 2019, 55(5): 1-10.
- Scientia Silvae Sinicae, 2019, 55(5): 1-10.
- DOI: 10.11707/j.1001-7488.20190501
-
文章历史
- 收稿日期:2018-06-29
- 修回日期:2018-10-28
-
作者相关文章
2. 中国科学院沈阳应用生态研究所 中国科学院森林生态与管理重点实验室 沈阳 110016;
3. 河北工程大学园林与生态工程学院 邯郸 056038
2. Key Laboratory of Forest Ecology and Management, Chinese Academy of Sciences Institute of Applied Ecology, Chinese Academy of Sciences Shenyang 110016;
3. School of Landscape and Ecological Engineering, Hebei University of Engineering Handan 056038
森林自养呼吸是陆地生态系统碳循环过程的重要组成部分(Maier et al., 2004; King et al., 2006; Piao et al., 2010; Galbraith et al., 2013; Antonio et al., 2014),森林生态系统总初级生产力(gross primary productivity, GPP)的50%~70%通过自养呼吸进入到大气中(Luyssaert et al., 2007; Wood et al., 2012; Rowland et al., 2014)。全球森林生态系统的自养呼吸过程每年向大气释放约44~ 55 Pg C(Wang et al., 2010; Maier et al., 2010; Yang et al., 2012),占整个大气CO2含量的1/15,相当于化石燃料燃烧释放CO2的6~7倍(Xu et al., 2001; DeLucia et al., 2007)。作为森林生态系统碳循环过程的重要组成部分,树干表面CO2通量(Es)约占整个森林生态系统自养呼吸的12%~42%(Teskey et al., 2002; Maier et al., 2006),且森林生态系统树干表面CO2通量及其温度敏感性的改变还可能在一定程度上对气候变暖产生反馈作用(King et al., 2006; Piao et al., 2010; Galbraith et al., 2013)。因此,探讨树干表面CO2通量及其温度敏感性的影响机制有助于解析森林生态系统碳固定对于全球变暖进程产生影响的正、负效应。
树干表面CO2通量是指林木树体木质部、韧皮部和形成层等组织的活细胞通过有氧呼吸生理代谢产生CO2气体到达树干表面的总量,涉及到一系列复杂的生理生化反应和物理扩散过程(王秀伟等, 2011)。树干组织活细胞进行的自养呼吸是产生CO2的主动过程,而树干表面CO2通量却是由扩散系数和浓度梯度等物理因子共同决定的被动过程,它不仅受到活细胞自养呼吸产生CO2浓度的影响(Maier et al., 2006;Saveyn et al., 2008;朱丽薇等, 2011),还受溶解在木质部液流中CO2浓度的影响(Saveyn et al., 2008; Davidson et al., 2006; Thornley et al., 2000;王秀伟等, 2013)。同时,基于Michaelis-Menten方程的理论认为底物供应状况会对呼吸的表观温度敏感性(Q10值)产生影响(Davidson et al., 2006)。然而,大多数基于过程的树干表面CO2通量估算模型却均将Q10假定为恒定值(Q10=2),而并不随底物供应状况的改变而发生变化(Thornley et al., 2000),这就必然导致对树干表面CO2通量的估算产生一定偏差。此外,碳水化合物(carbohydrates)不仅是植物光合反应的主要产物,同时还是树干呼吸生理代谢过程重要的底物。树木冠层所合成的大部分光合产物都会在树体内经过次生代谢过程转化成木质素、纤维素、半纤维素和果胶等结构性碳水化合物直接参与植物体结构与形态的构建过程(郑云普等, 2014)。另有小部分的光合产物以非结构性碳水化合物(主要包括葡萄糖、蔗糖、果糖及果聚糖等可溶性糖和不溶性的淀粉)的形式储存在树体的不同器官或组织内,为植物的生长和代谢过程提供能量,其在树体中含量的变化很大程度影响着树木的生长状况以及树干表面CO2通量等多种关键过程(张海燕等, 2013; 张海燕等, 2013)。非结构性碳水化合物作为树干内生理生化反应的主要底物形式,其供应状况对树干表面CO2通量产生影响的机制尚不清楚,探讨树干非结构性碳水化合物变化,有助于深入理解光合产物供应状况对树干表面CO2通量的影响机制,进一步明确森林生态系统通过固定CO2的形式对减缓全球气候变暖产生的正效应。
近年来,随着全球气候变暖等环境问题的日益加剧,人工林的可持续经营已成为当前重要的研究热点之一。就人工林而言,在最大限度提供木材的同时,通过固定CO2减缓全球气候变暖进程是人工林生态系统必然的发展趋势。农田防护林是一种典型的农林复合生态系统,为我国北方地区人工林建设的重要组成部分,它不仅能够有效防止水土流失,还有利于改善农田生态系统的小气候,成为区域农业生产重要的生态保护屏障。毛白杨(Populus tomentosa)作为华北平原区农田防护林的主栽树种之一,长期以来人们主要关注的是其经济价值和防护效益,而忽视其在陆地生态系统碳循环方面所起到的关键性作用。如何通过科学合理的经营和管理措施,使毛白杨农田防护林具有防护和经济价值的同时再产生一定的生态效益,是亟待解决的关键问题。环剥是热带产脂树种或果树常用的管理措施之一,主要目的是提高树脂或水果的产量和品质,但环剥对毛白杨防护林生态效益方面的研究关注较少。此外,环剥处理还可能改变光合产物的供应状况。目前关于环剥如何改变光合产物供应状况,进而影响毛白杨树干呼吸过程还存在较大的不确定性。鉴于此,本文以毛白杨农田防护林为研究对象,通过环剥处理改变光合产物供应,连续监测毛白杨树干表面CO2通量和树干温度变化,旨在探明光合产物供应对树干表面CO2释放通量及其温度敏感性的影响机制。
1 材料与方法 1.1 试验地概况本研究的样地设置在河北省邯郸市南郊区的典型毛白杨农田防护林内(114°30′E,36°25′N)。该研究区属于典型的暖温带半湿润大陆性季风气候,日照充足,雨热同期,四季交替明显。该地区多年平均降雨量548.9 mm,主要集中在7—8月份,年平均气温14 ℃,最冷月份(1月)平均气温-2.5 ℃,最热月份(7月)平均气温27 ℃,全年无霜期200天,年日照2 557 h。研究样地内的土壤质地以粉砂和轻壤为主;pH值7.5~8.0;土壤有机质含量较低,为6~10 g·kg-1;全N含量为0.5~0.7 g·kg-1。
1.2 样地选择及试验设计本研究于2015年11月份在试验区建立3个30 m × 30 m的样地,并在每个研究样地内随机选取2个样方(10 m × 10 m),分别作为对照和环剥处理,各个样方之间相距10 m,即本研究中以3个样地作为空间上完全重复样本。随机在每个样方内选取2株长势良好、生长状况相似的毛白杨(对照和环剥处理各有6株,共计12株)(表 1)用于树干表面CO2通量和树干温度的长期连续监测(图 1a)。

|
图 1 毛白杨树干环剥处理及表面CO2通量监测 Fig. 1 Stem girdling treatments and surface CO2 efflux measurements of Populus tomentosa |
|
|
树干表面CO2通量测定采用Li-Cor 6400便携式光合作用测量仪配套使用的土壤呼吸测量气室(LI-6400-09)。先将PVC环的一端切割成弧形以匹配树干的弧度,另一端磨平以连接土壤呼吸测量室(图 1b)。分别在选择的毛白杨树干1 m和1.5 m高度南向安装用于树干表面CO2通量测定的PVC环(内径10 cm,深度5 cm)。安装前轻微刮掉表层树皮,尽量确保树干表面的平整性,但不能损伤到形成层组织。用硅胶将呼吸环固定在树干表面上,检查其密封性,确保不漏气。在呼吸环的右侧5 cm位置钻取一个深约3 cm的细孔,使Li-Cor 6400自带的温度探头刚好插进树干,在监测树干表面CO2通量的同时测量树干温度(图 1b)。在对树干表面CO2通量监测4个多月后,于2016年8月26日在树干距离地面1.3 m处进行环剥处理。
选择树体上约1.3 m处较平滑的部位(即位于上述已安装2个PVC环的中间位置),将高度为5 cm的树皮、韧皮部和形成层组织轻轻剥掉(图 1c)。环剥时需注意上刀要直立切割,下刀切割时要外宽内窄,稍有倾斜,以防止雨水存积和病菌滋生。剥离的皮层用刀尖轻轻去除, 不留残余皮层,此过程要注意避免对木质部组织造成机械损伤。在整个环剥处理过程中,继续不间断地监测树干表面CO2通量和树干温度(图 1d)。对照组的树木除不进行环剥处理外,其他自然条件均与环剥处理的树木保持一致。
1.4 可溶性糖含量的测定利用生长锥钻取树芯样品。选取样品的木质部位置,在液氮内研磨后称取干燥的粉末状样品60 mg,加入80%乙醇10 mL,24 h萃取后4 000 r·min-1离心10 min,将离心后的上清液倾入容量瓶;在残留沉淀物中再加入80%乙醇5 mL,继续离心5 min,获取上清液;定容后用于可溶性糖浓度测定(Hendrix et al., 1995)。
1.5 数据处理与分析| $A = \frac{{{{\rm{ \mathsf{ π} }}^2}}}{{720}}{D_{\rm{c}}}{D_{\rm{s}}}\arcsin \left({\frac{{{D_{\rm{c}}}}}{{{D_{\rm{s}}}}}} \right)^\circ $ | (1) |
式中,A指PVC环所围的树干面积,Dc指PVC环的直径,Ds指树干直径。
| $H = \left[ {{V_{\rm{c}}} - {{\left({{D_{\rm{c}}}/2} \right)}^2}\mathit{\boldsymbol{\pi }}d} \right]/{\left({{D_{\rm{c}}}/2} \right)^2}{\mathit{\boldsymbol{\pi }}_{\rm{o}}} $ | (2) |
式中,H指有效插入深度,Vc和Dc指树干上PVC环的体积和直径,d为气室插入PVC环的有效深度。
| ${E_{\rm{s}}} = {\beta _0}{{\rm{e}}^{{\beta _1}T}} $ | (3) |
式中,Es指在温度为T时的树干表面CO2通量,β0为当树干温度为零时的树干CO2释放通量,β1为温度系数,T为树干温度。
根据公式(3)拟合出树干表面CO2通量和树干温度的关系后,计算出树干温度为15 ℃时的树干表面CO2通量,即可将树干表面CO2通量统一矫正为15 ℃时的基础呼吸速率(R15)。
采用SPSS 21.0软件对数据进行分析处理,利用单因素方差(One-way ANOVA)分析环剥处理对毛白杨树干表面CO2通量及其温度敏感性影响的显著性,采用Sigmaplot软件绘图。
2 结果与分析 2.1 环剥对树干温度、树干表面CO2通量及可溶性糖浓度的影响整个研究期内(2016年4月—2017年4月)对照组(non-girdled, NG)、环剥点上部(above girdle, AG)和环剥点下部(below girdle, BG)的树干温度(Tstem)呈现一致的“钟形”变化趋势,即Tstem随季节变化先升高后降低,最高的Tstem均出现在2016年9月(约34 ℃),而2017年1月份的Tstem最低仅为3 ℃(图 2a)。在树干环剥前,NG、AG和BG在生长季的树干表面CO2通量(Es)差异不明显,均随树干温度的改变呈现较为一致的变化(图 2b)。环剥处理30天后,在生长季NG、AG和BG的Es差异开始显著增加,即环剥处理导致AG的Es升高57%和BG的Es降低43%(图 2b)。随着季节的变化毛白杨进入非生长季,NG、AG和BG的Es数值差异不大,但仍同Tstem呈现相似的变化趋势(图 2b)。另外,环剥处理导致生长季(2016年10月份)可溶性糖浓度AG (62.1 mg·g-1)和BG (69.8 mg·g-1)比NG(79.9 mg·g-1)分别降低28.7%和14.5%。然而,环剥处理使非生长季可溶性糖浓度BG(75.6 mg·g-1)相比NG(70.3 mg·g-1)增加约10%,但却导致AG的可溶性糖浓度(61.3 mg·g-1)降低约15%(图 2c)。
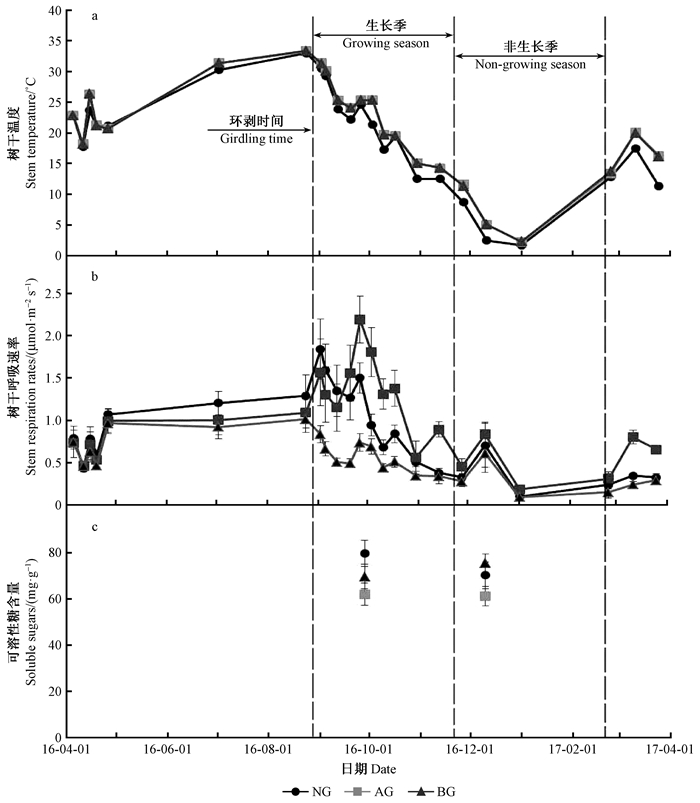
|
图 2 环剥对树干温度、树干表面CO2通量及可溶性糖浓度的影响 Fig. 2 Effects of girdling on stem temperature, stem surface CO2 efflux and soluble sugar concentration NG、AG、BG分别为对照组、环剥上部、环剥下部。下同。 NG, AG, and BG shows non-girdled, above girdle, and below girdle. The same below. |
在整个研究期内NG、AG和BG的Es均同Tstem之间存在较好的指数函数关系,但环剥明显降低Tstem对Es变化的解释率,即NG的Tstem可以解释Es变化的92%,而AG和BG的Tstem分别解释Es变化的86%和81% (图 3a)。对整个研究期划分为生长季和非生长季后,不同季节的Es和Tstem也同样存在较好的指数函数关系,且在生长季或非生长季NG的Tstem对Es变化解释率均高于AG和BG,即环剥在不同季节均降低Tstem对Es变化的解释率。生长季NG的Tstem解释Es变化的93%,而环剥处理下AG和BG的Tstem分别决定Es变化的66%和77%(图 3b)。在非生长季NG、AG和BG的Tstem对Es变化解释率分别为84%、76%和52%(图 3c)。另外,在生长季AG(66%)的Tstem对Es变化解释率低于BG(77%),而在非生长季却呈现出相反的规律,即在非生长季AG(75%)的Tstem对Es变化的解释率高于BG(52%)。
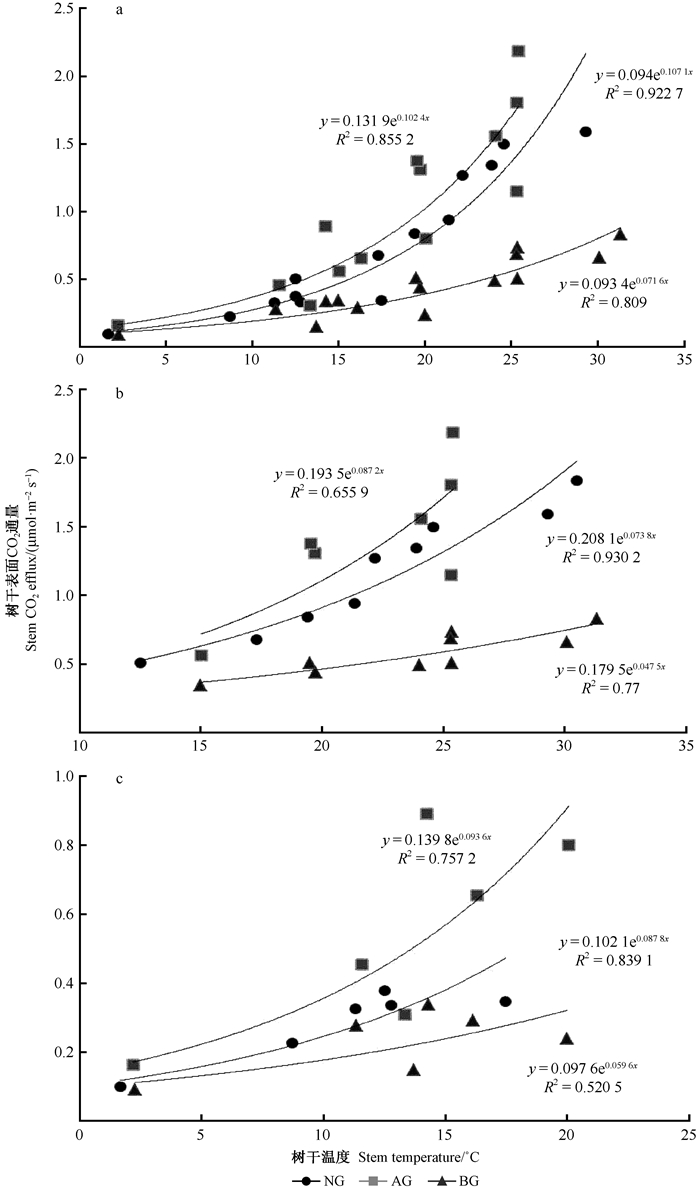
|
图 3 环剥对树干表面CO2通量(Es)和树干温度(Tstem)关系的影响 Fig. 3 Effects of girdling on the relationship between stem surface CO2 efflux (Es) and stem temperature (Tstem) a.整个研究期(2016年4月—2017年4月)Whole experimental period from April 2016 to April 2017;b.生长季Growing season; c.非生长季Non-growing season.下同。The same below. |
在整个研究期,环剥导致树干表面CO2通量温度敏感性(Q10)呈现降低的趋势,但NG、AG和BG之间的差异均未达到显著水平(P>0.05)(图 4a)。然而,环剥导致生长季BG的树干表面CO2通量温度敏感性(Q10)显著降低21%(P < 0.05),AG的Q10增加14%(P>0.05),且AG在生长季的Q10明显高于BG约50%(P < 0.01)(图 4b)。另外,环剥导致非生长季树干表面CO2通量的Q10呈现与生长季相似的变化趋势,即环剥导致非生长季AG的Q10升高,而BG的Q10降低,尽管NG、AG和BG之间Q10的差异并不显著(P>0.05)(图 4c)。
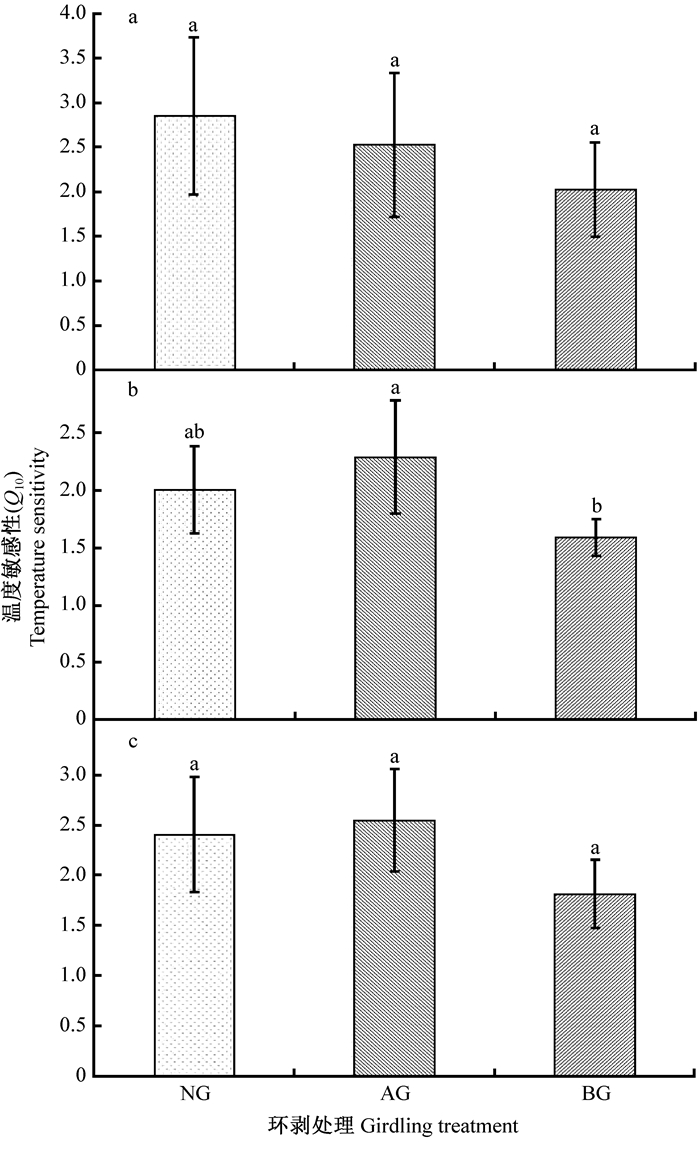
|
图 4 环剥对树干表面CO2通量温度敏感性(Q10)的影响 Fig. 4 Effects of girdling on the temperature sensitivity of stem surface CO2 efflux |
为了比较相同树干温度下环剥和非环剥毛白杨林木树干表面CO2通量的差异,将树干表面CO2通量统一矫正为15 ℃时的基础呼吸速率(R15)。整个研究期内,环剥导致AG的R15分别比NG和BG显著提高55%(P<0.05)和124%(P<0.001),但NG和BG之间R15的差异却并不显著(P>0.05)(图 5A)。生长季环剥条件下AG的R15为BG的1.4倍(P<0.001),且NG的R15显著高于BG约77%(P<0.01)(图 5B)。尽管非生长季环剥也同样导致AG和BG的R15呈现与生长季相似的变化趋势(AG升高50%和BG降低58%),但环剥对R15产生的影响却未达到显著水平(P>0.05)(图 5c)。
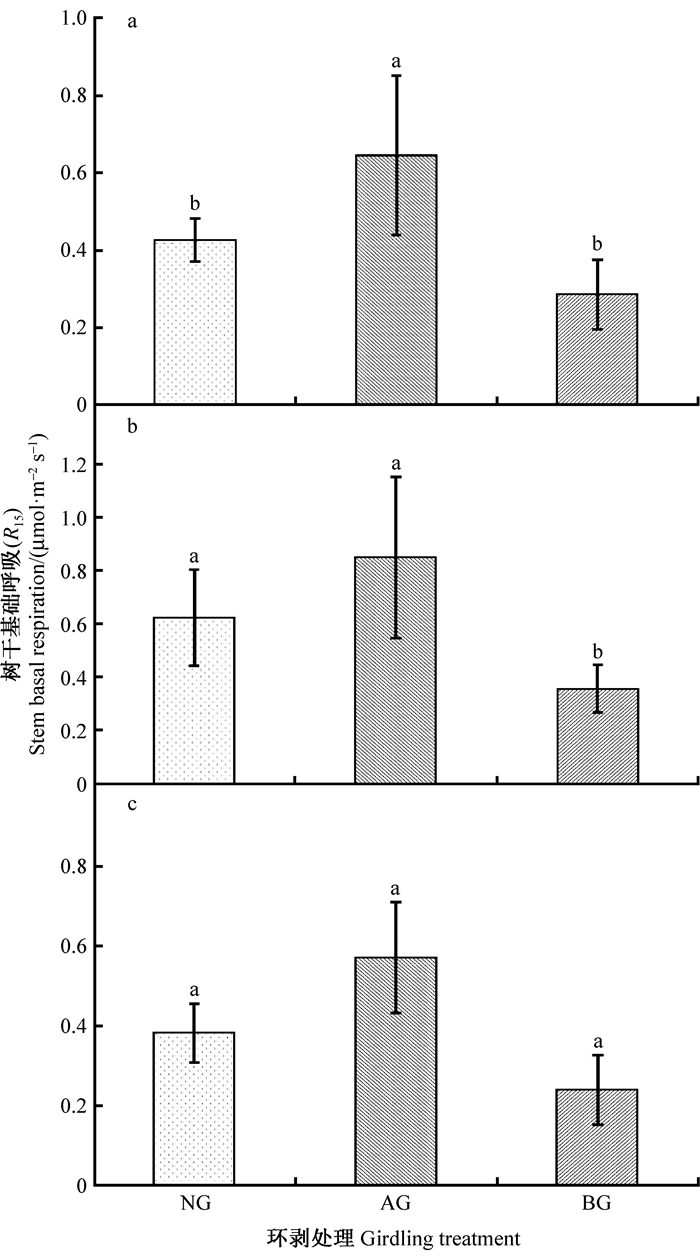
|
图 5 环剥对树干基础呼吸的影响 Fig. 5 Effects of stem girdling on the stem basal respiration |
树干液流速度、组织含氮量、树木生长速率、树干温度以及大气CO2浓度等多个因素均直接或间接影响林木的树干表面CO2通量(Edwards et al., 2002; Wertin et al., 2008; 王秀伟等, 2011; 2013)。另外,非结构性碳水化合物(carbohydrates)不仅是森林冠层光合反应过程的产物,还是林木树干呼吸过程的主要底物形式,故此树体非结构性碳水化合物含量直接反映树干呼吸过程的底物供应状况(王秀伟等, 2011)。然而,通过环剥树干改变光合产物供应状况进而影响树干表面CO2通量的研究较少(Maier et al., 2010),光合产物同树干表面CO2通量的关系至今未有较好的解释(Lavigne et al., 2004; Zhao et al., 2009; 朱丽薇等, 2011)。本研究中生长季环剥导致AG和BG的可溶性糖浓度分别低于NG约30%和15%,表明树干环剥处理阻断了光合同化产物由源到汇的纵向运输,对毛白杨林冠光合反应速率产生抑制作用,导致环剥样地树干的可溶性糖含量低于对照样地。此外,值得关注的是非生长季BG的可溶性糖浓度高于AG和NG,表明毛白杨可能在非生长季将根部储存的可溶性糖或淀粉沿树干向上运输,为树干的维持呼吸过程提供能量物质(王文杰等, 2007)。
目前,树干环剥改变光合产物供应进而影响树干表面CO2通量的研究较少(Edwards et al., 2002),且多数研究基于林木幼苗(Wertin et al., 2008),而高大树木的光合产物从树冠合成后再运输到树干需要经过较长的距离,光合产物在树体中的迁移、转化和分配状况对树干表面CO2通量的影响更加复杂(Zha et al., 2004)。本研究发现,树干环剥处理后毛白杨林木AG的Es显著高于BG,表明树干环剥可能阻断了韧皮部纵向运输光合产物的路径(Wang et al., 2006),导致大量非结构性碳水化合物(NSC)在环剥点上方累积(Zhao et al., 2009),而环剥点下方的NSC随着树干表面CO2通量的消耗逐渐减少(Ogawa et al., 2006;Maier et al., 2010),且无法得到冠层光合产物的输入和补充,表明树干韧皮部、形成层和木质部的代谢活动与林木冠层的光合反应过程紧密耦合(Wertin et al., 2008)。本研究中生长季AG的可溶性糖含量低于BG主要是由于AG的Es显著高于BG而造成的,即环剥处理30天后,环剥树干上部(AG)较高的Es相比环剥点下部(BG)消耗更多的光合产物,故AG剩余的可溶性糖含量低于BG,表明毛白杨树干经环剥处理后,树体非结构性碳水化合物含量降低(王文杰, 2007),光合产物的供应状况改变(Ogawa et al., 2006; Wang et al., 2006),进而影响树干表面CO2通量(Maier et al., 2010)。
以往研究发现,树干呼吸的Q10存在较大的时空变率(Jiang et al., 2003;王淼等, 2008; 石新立等, 2010),野外实测的树干表面CO2通量和树干温度数据拟合得到的Q10值仅反映树干表面CO2通量的表观温度敏感性,并不代表其对温度变化的真实响应(Yang et al., 2012)。本研究发现,环剥点上部(AG)的Q10值均高于环剥点下部(BG)的Q10值,直接支持了上述观点。从理论上来讲,树干表面CO2通量的Q10值可能受多种因素影响,而冠层输入的光合产物作为树干呼吸过程的基质,直接或间接决定着林木树干表面CO2通量温度敏感性的变异程度(Ogawa et al., 2006;Maier et al., 2010)。同时,基于Michaelis-Menten方程[R=(Vmax×C)/(Km+C)]的理论认为最大反应速率(Vmax)和半饱和常数(Km)均具有温度敏感性,当底物供应低时(C与Km相当),Vmax和Km的温度敏感性相互抵消,造成呼吸总温度敏感性的下降;反之,当底物供应高时(C≫Km),呼吸温度敏感性主要取决于Vmax的温度敏感性(Yang et al., 2012)。另外,由于生长呼吸不随树干温度的变化而改变,而维持呼吸却对树干温度的变化极其敏感(Brito et al., 2010),故不同季节维持呼吸和生长呼吸所占比例的差异也可能混淆光合产物对Q10值的影响。方差分析的结果显示,生长季AG和BG的Q10值差异较为显著,而在非生长季的差异并不显著。笔者认为,造成树干呼吸AG和BG的Q10值在不同季节产生差异的原因可能是由于在生长季生长呼吸和维持呼吸共同作用导致了其具有较高的温度敏感性;在非生长季以维持呼吸占据主导作用,而维持呼吸对温度的高度敏感性高于生长季的Q10值,且环剥上部较多的营养物质积聚,使得上部的维持呼吸较活跃,故在非生长季环剥上部的Q10值仍要大于环剥下部的Q10值(Wang et al., 2003)。因此,该Q10值并不反映树干呼吸过程的真实敏感性,而是与其他因素混淆在一起的表观温度敏感性(Brito et al., 2010;Yang et al., 2012)。
林木在生长季的树干基础呼吸速率(R15)明显高于非生长季(Zha et al., 2004),表明树干组织在生长季的代谢活性更高,且同时可以得到冠层输入更多光合产物(Damesin et al., 2002)。以往研究已经实证冠层光合作用改变呼吸底物的供应状况(Zha et al., 2004),进而影响树干表面CO2通量(Maier et al., 2010)。本研究结果表明,毛白杨的树干基础呼吸在生长季和非生长季的差别较大,这可能是由于生长季的树干呼吸包含维持呼吸和生长呼吸2个部分,即树干呼吸过程不仅要保证活细胞正常的生理代谢,还要为树干合成新的组织提供能量(Wertin et al., 2008)。非生长季的树干呼吸仅维持呼吸,此时树干停止细胞分裂和生长,故非生长季的树干表面CO2通量明显低于生长季。本研究中生长季和非生长季环剥点上部的毛白杨树干基础呼吸均高于环剥点下部,这也间接证明环剥上部具有较大的代谢活性,且环剥点上部具有比较充足的光合作用产物供应,使得环剥点上部的树干基础呼吸明显高于环剥点下部。
4 结论1) 环剥阻断了光合产物的输入,分别提高环剥点上部的可溶性糖含量和降低环剥点下部的可溶性糖含量。
2) 环剥通过改变树体可溶性糖含量导致环剥点上部的树干表面CO2通量及其温度敏感性上升,而环剥点下部的树干表面CO2通量及其温度敏感性下降。
3) 毛白杨树干表面CO2通量及其温度敏感性对环剥的响应在不同季节(生长季和非生长季)存在明显差异。
石新立, 王传宽, 许飞, 等. 2010. 四个温带树种树干呼吸的时间动态及其影响因子. 生态学报, 30(15): 3994-4003. (Shi X L, Wang C K, Xu F, et al. 2010. Temporal dynamics and influencing factors of stem respiration for four temperate tree species. Chinese Journal of Ecology, 30(15): 3994-4003. [in Chinese]) |
王淼, 武耀祥, 武静莲. 2008. 长白山红松针阔叶混交林主要树种树干呼吸速率. 应用生态学报, 19(5): 956-960. (Wang M, Wu Y X, Wu J L. 2008. Stem respiration of dominant tree species in broad-leaved Korean pine mixed forest in Changbai Mountains. Journal of Applied Ecology, 19(5): 956-960. [in Chinese]) |
王文杰, 胡英, 王慧梅, 等. 2007. 环剥对红松(Pinus koraiensis)韧皮部和木质部碳水化合物的影响. 生态学报, 27(8): 3472-3481. (Wang W J, Hu Y, Wang H M, et al. 2007. Effects of girdling on carbohydrates in the xylem wood and phloem bark of Korean pine(Pinus koraiensis). Chinese Journal of Ecology, 27(8): 3472-3481. DOI:10.3321/j.issn:1000-0933.2007.08.046 [in Chinese]) |
王秀伟, 毛子军. 2013. 输导组织结构对液流速度和树干CO2释放通量的影响. 北京林业大学学报, 35(4): 58-63. (Wang X W, Mao Z J. 2013. Effects of conducting tissue structure on sap flow density and stem CO2 efflux. Journal of Beijing Forestry University, 35(4): 58-63. [in Chinese]) |
王秀伟, 毛子军, 孙涛, 等. 2011. 春、秋季节树干温度和液流速度对东北3树种树干表面CO2释放通量的影响. 生态学报, 31(12): 3358-3367. (Wang X W, Mao Z J, Sun T, et al. 2011. Effects of temperature and sap flow velocity on CO2 efflux from stems of three tree species in spring and autumn in Northeast China. Chinese Journal of Ecology, 31(12): 3358-3367. [in Chinese]) |
张海燕, 王传宽, 王兴昌, 等. 2013. 白桦和紫椴树干非结构性碳水化合物的空间变异. 应用生态学报, 24(11): 3050-3056. (Zhang H Y, Wang C K, Wang X C, et al. 2013. Spatial variation of non-structural carbohydrates in Betula platyphylla and Tilia amurensis stems. Journal of Applied Ecology, 24(11): 3050-3056. [in Chinese]) |
郑云普, 王贺新, 娄鑫, 等. 2014. 木本植物非结构性碳水化合物变化及其影响因子研究进展. 应用生态学报, 25(4): 1188-1194. (Zheng Y P, Wang H X, Lou X, et al. 2014. Changes of non-structural carbohydrates and its impact factors in trees: a review. Journal of Applied Ecology, 25(4): 1188-1194. [in Chinese]) |
朱丽薇, 赵平, 倪广艳, 等. 2011. 荷木树干CO2释放通量的个体间差异及树干液流的效应. 应用与环境生物学报, 17(4): 447-452. (Zhu L W, Zhao P, Ni G Y, et al. 2011. Differences of stem CO2 efflux among individual trees of Schima superba and effects of sap fiow. Journal of Applied and Environmental Biology, 17(4): 447-452. [in Chinese]) |
Antonio C L, da Costa, Daniel B M, et al. 2014. Ecosystem respiration and net primary productivity after 8-10 years of experimental through-fall reduction in an eastern Amazon forest. Plant Ecology & Diversity, 7(1/2): 7-24. |
Brito P, Morales D, Wieser G, et al. 2010. Spatial and seasonal variations in stem CO2 efflux of Pinus canariensis at their upper distribution limit. Trees-Structure and Function, 24(3): 523-531. DOI:10.1007/s00468-010-0423-z |
Davidson E A, Janssens I A, Luo Y Q. 2006. On the variability of respiration in terrestrial ecosystems: moving beyond Q10. Global Change Biology, 12(2): 154-164. |
Damesin C, Ceschia E, Le Goff N, et al. 2002. Stem and branch respiration of beech: from tree measurements to estimations at the stand level. New Phytologist, 153(1): 159-172. DOI:10.1046/j.0028-646X.2001.00296.x |
DeLucia E H, Drake J E, Thomas R B, et al. 2007. Forest carbon use efficiency: is respiration a constant fraction of gross primary production. Global Change Biology, 13(6): 1157-1167. DOI:10.1111/gcb.2007.13.issue-6 |
Edwards N T, Tschaplinski T J, Norby R J. 2002. Stem respiration increases in CO2-enriched sweetgum trees. New Phytologist, 155(2): 239-248. DOI:10.1046/j.1469-8137.2002.00458.x |
Galbraith D, Malhi Y, Affum-Baffoe K, et al. 2013. Residence times of woody biomass in tropical forests. Plant Ecology & Diversity, 6(1): 139-157. |
Hendrix D L. 1993. Rapid extraction and analysis of nonstructural carbohy drates in plant tissues. Crop Science, 33: 1306-1311. DOI:10.2135/cropsci1993.0011183X003300060037x |
Jiang L F, Shi F C, Zu Y G, et al. 2003. Study on stem respiration of Larix gmelinii of different ages and its relationship to environmental factors. Bulletin Botanical Research, 67(3): 227-230. |
King A W, Gunderson C A, Post W M, et al. 2006. Atmosphere-plant respiration in a warmer world. Science, 312: 536-537. DOI:10.1126/science.1114166 |
Lavigne M B, Little C H A, Riding R T. 2004. Changes in stem respiration rate during cambial reactivation can be used to refine estimates of growth and maintenance respiration. New Phytologist, 162: 81-93. DOI:10.1111/nph.2004.162.issue-1 |
Luyssaert S, Lnglima L, Jung M, et al. 2007. CO2 balance of boreal, temperate, and tropical forests derived from a global database. Global Change Biology, 13(12): 2509-2537. DOI:10.1111/gcb.2007.13.issue-12 |
Maier C A, Albaugh T J, Allen H L, et al. 2004. Respiratory carbon use and carbon storage in mid-rotation loblolly pine (Pinus taeda L. ) plantations: the effect of site resources on the stand carbon balance. Global Change Biology, 10(8): 1335-1350. |
Maier C A, Clinton B D. 2006. Relationship between stem CO2 efflux, stem sap velocity and xylem CO2 concentration in young loblolly pine trees. Plant, Cell and Environment, 29(8): 1471-1483. DOI:10.1111/pce.2006.29.issue-8 |
Maier C A, Johnsen K H, Clinton B D, et al. 2010. Relationships between stem CO2 efflux, substrate supply, and growth in young loblolly pine trees. New Phytologist, 185(2): 502-513. DOI:10.1111/j.1469-8137.2009.03063.x |
Ogawa K. 2006. Stem respiration is influenced by pruning and girdling in Pinus sylvestris. Scandinavian Journal of Forest Research, 21(4): 293-298. DOI:10.1080/02827580600866188 |
Piao S L, Luyssaert S, Ciais P, et al. 2010. Forest annual carbon cost: a global-scale analysis of autotrophic respiration. Ecology, 91(3): 652-661. DOI:10.1890/08-2176.1 |
Rowland L, Hil T C, Stahl C, et al. 2014. Evidence for strong seasonality in the carbon storage and carbon use efficiency of an Amazonian forest. Global Change Biology, 20(3): 979-991. DOI:10.1111/gcb.2014.20.issue-3 |
Saveyn A, Steppe K, McGuire M A, et al. 2008. Stem respiration and carbon dioxide efflux of young Populus deltoides trees in relation to temperature and xylem carbon dioxide concentration. Oecologia, 154(4): 637-649. DOI:10.1007/s00442-007-0868-y |
Thornley J H M, Cannell M G R. 2000. Modelling the components of plant respiration: representation and realism. Annals of Botany, 85(1): 55-67. DOI:10.1006/anbo.1999.0997 |
Teskey R O, McGuire M A. 2002. Carbon dioxide transport in xylem causes errors in estimation of rates of respiration in stems and branches of trees. Plant Cell and Environment, 25(11): 1571-1577. DOI:10.1046/j.1365-3040.2002.00961.x |
Wang W J, Yang F J, Zu Y G, et al. 2003. Stem respiration of a larch (Larix gmelini) plantation in northeast China. Acta Botanica Sinica, 45(12): 1387-1397. |
Wang W J, Zu Y G, Wang H M, et al. 2006. Newly-formed photosynthates and respiration rate of girdled stems of Korean pine (Pinus koraiensis Sieb. Et Zucc.). Photosynthetica, 44(1): 147-150. DOI:10.1007/s11099-005-0172-1 |
Wang M, Guan D X, Han S J, et al. 2010. Comparison of eddy covariance and chamber-based methods for measuring CO2 flux in a temperate mixed forest. Tree Physiology, 30: 149-163. DOI:10.1093/treephys/tpp098 |
Wertin T M, Teskey R O. 2008. Close coupling of whole-plant respiration to net photosynthesis and carbohydrates. Tree Physiology, 28(12): 1831-1840. DOI:10.1093/treephys/28.12.1831 |
Wood T E, Cavaleri M A, Reed S C. 2012. Tropical forest carbon balance in a warmer world: a critical review spanning microbial- to ecosystem-scale processes. Biological Reviews of the Cambridge Philosophical Society, 87(4): 912-927. DOI:10.1111/j.1469-185X.2012.00232.x |
Xu M, DeBiase T A, Qi Y, et al. 2001. Ecosystem respiration in a young ponderosa pine plantation in the Sierra Nevada Mountains. Tree Physiology, 21(5): 309-318. DOI:10.1093/treephys/21.5.309 |
Yang Q P, Xu M, Chi Y G, et al. 2012. Temporal and spatial variations of stem CO2 efflux of three species in subtropical China. Journal of Plant Ecology, 5(2): 229-237. DOI:10.1093/jpe/rtr023 |
Zha T S, Kellomaki Z, Wang K Y, et al. 2004. Seasonal and annual stem respiration of Scots pine trees under boreal conditions. Annals of Botany, 94(6): 889-896. DOI:10.1093/aob/mch218 |
Zhao P, Hölscher D. 2009. The concentration and efflux of tree stem and the role of xylem sap flow. Frontiers of Biology in China, 4(1): 47-54. DOI:10.1007/s11515-008-0106-y |
 2019, Vol. 55
2019, Vol. 55

