文章信息
- 李洪果, 陈达镇, 许靖诗, 刘光金, 庞晓东, 叶金辉, 莫小文, 谌红辉.
- Li Honguo, Chen Dazhen, Xu Jingshi, Liu Guangjin, Pang Xiaodong, Ye Jinhui, Mo Xiaowen, Chen Honghui.
- 濒危植物格木天然种群的表型多样性及变异
- Phenotypic Diversity and Variation in Natural Populations of Erythrophleum fordii, an Endangered Plant Species
- 林业科学, 2019, 55(4): 69-83.
- Scientia Silvae Sinicae, 2019, 55(4): 69-83.
- DOI: 10.11707/j.1001-7488.20190408
-
文章历史
- 收稿日期:2018-06-22
- 修回日期:2018-08-28
-
作者相关文章
2. 梧州市林政稽查支队 梧州 543002;
3. 北海市林业技术推广站 北海 536000;
4. 博白县林业局 博白 537600;
5. 北流市民乐镇林业站 北流 537403;
6. 陆川县沙坡镇林业站 陆川 537714
2. Forestry Administration Inspection Detachment of Wuzhou Wuzhou 543002;
3. Forestry Technology Extension Station of Beihai Beihai 536000;
4. Bobai Forestry Bureau Bobai 537600;
5. Minle Forestry Station Beiliu 537403;
6. Shapo Forestry Station Luchuan 537714
遗传多样性广泛存在于物种及其基因组之中(Soares et al., 2015),作为物种应对环境适应性的潜力,其在制定育种策略和濒危物种保存等方面有着积极意义(Hake et al., 2015;Forcada et al., 2014)。植物在进化过程中,不断与周围环境进行选择与被选择的作用,最终形成许多外在形态和内在生理上的适应策略,这些生态适应特征即为表型性状(胡启鹏等,2008)。表型多样性是遗传多样性的直接体现,是基因与环境在长期进化过程中共同作用的结果。利用表型性状的差异来检测种群的遗传多样性是长期以来最简便易行的方法。研究表明,濒危植物和动物较非濒危种往往表现出更少的遗传多样性(Spielman et al., 2004;Pinsky et al., 2014),因此,种群数量对物种的稳定遗传有一定影响,维持种群有效样本的保有量是濒危动植物收集和保护的关键。
格木(Erythrophleum fordii)是我国热带亚热带地区珍贵的用材和绿化树种,同时也具有较高的药用价值,木材结构致密坚实,极耐腐,有“铁木”之称,是优良的工业、家具和工艺品用材。格木在我国主要分布在广西、广东中南部、福建南部和台湾东海岸(中国科学院植物研究所,1989),其中心分布区在广西博白、合浦、陆川一带(郑万钧,1985),也有学者认为越南、老挝是格木的中心分布区,并基于广西的表型变异最丰富,推测我国福建、广东的格木种群是广西种群的自然延伸(赵志刚等,2009)。但受限于国土面积,越南的格木分布并不多(有记录的仅为2.5 hm2人工林),大致位于与广西接壤的越南中北部地区;老挝的资源数量未知,只是根据气候环境适生推测其有分布。所以,从资源数量来看,格木天然林资源中我国应占大多数,广西的天然林资源在我国的格木资源分布中又占多数,加之广西可能是格木在我国的中心分布区,而物种中心分布区的种群往往具有更高的遗传多样性,可作为种质资源收集保存和遗传多样性研究的重点(T L怀特等,2013)。因此,广西的格木天然种群似可作为格木表型多样性及变异规律研究的关键种群,有必要进行更广泛的取材和更深入的研究。
长期以来,由于筑路修桥、城市发展等因素造成的过度砍伐、大面积毁林等,导致格木天然林急剧减少,部分地区已经消失(黄忠良等,1997)。虽然格木当前已被列为国家二级保护植物,各县市林业局宣传和保护力度较大,同时市场上也杜绝了格木木材交易,但前期破坏性开发造成的格木生境碎片化现状未见有恢复措施,大多数格木仍处于孤立木、散生木和小群落的生存状态,时刻面临雷击、野火和盗伐等的威胁。格木种子自然萌发难和苗期存活率低等特性致使格木天然更新困难,难以仅依靠自身实现种群延续(赵志刚,2011),而经营周期长、木材生长缓慢、自然干形差等原因也造成社会层面上栽植积极性不高,难以通过人们的自发行为实现种群数量的恢复,偶有国有林场等部门用格木造林,也与格木遗传多样性的保护无关。整体而言,格木种群尤其是天然林种群,仍处于种群数量持续减少的状态,现有就地保存的方式不足以保证格木天然种群脱离濒危状态,也不利于格木天然种群的多样性保护和稳定遗传。因此,开展格木在我国中心分布区种群的表型多样性研究,了解不同种群的表型变异特征和多样性水平,参照其地理变异规律在种群样本数量稀少的分布区引入合适的种源造林,对格木天然林种群的多度恢复和遗传多样性保护具有重要意义。
1 材料与方法 1.1 试验材料在广西壮族自治区2017年名木古树调查的基础上,于2017年10、11月从格木在我国的中心分布区及周边共8个县市收集114个格木单株的果荚及种子,样品的分布范围见图 1,各种群的样本数及地理气候因子信息见表 1。原则上每种群的样本数应在10株以上,但部分种群由于样本偏少或采样困难等原因,样本数不足10株。用高枝剪、攀登板等工具从树上采集成熟的果荚及种子,择发育正常、无病虫害的果荚及种子带回实验室进行测量。
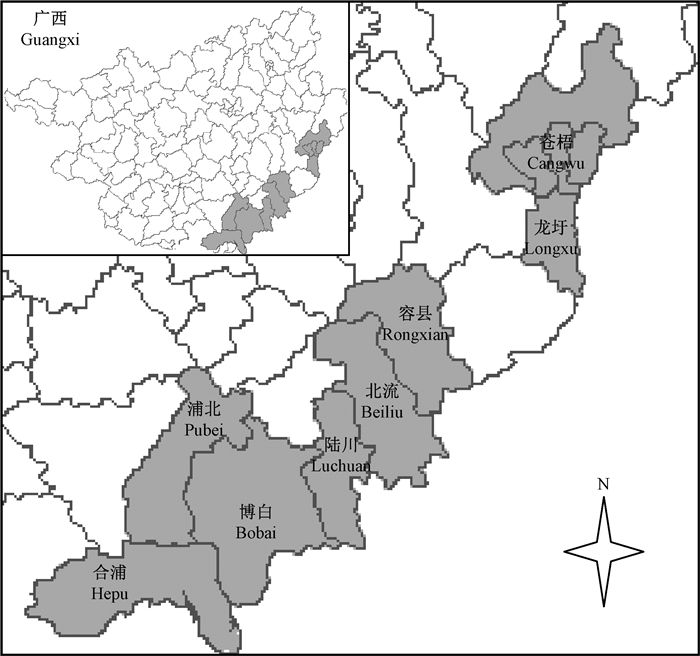
|
图 1 采集样品分布 Fig. 1 Collection samples distribution of Erythrophleum fordii |
|
|
测量果荚的7个表型性状,每个性状测量10次,取平均值作为实测值,其中果荚长、果荚指数、果荚宽、果荚面积、果荚周长5个性状用万深叶面积分析系统测量,测量结果精确至0.000 1;每荚种子数人工数取;果荚厚度用游标卡尺测量,精确到0.01 mm。测量种子的6个表型性状,每个性状测量25次,取平均值作为实测值,其中种子长、种形指数、种子宽、种子面积、种子周长5个性状用万深叶面积分析系统测量,测量结果精确至0.000 1,种子厚度用游标卡尺测量,精确到0.01 mm。经纬度信息来自当地政府门户网站,气象数据来自中国气象数据网(1981—2010年)。
1.3 数据处理与分析 1.3.1 巢式方差分析和多重比较在R3.5.0软件中对13个表型性状进行巢式方差分析和多重比较。其线性模型为:Yijk=μ+αi+βj(i)+εijk。式中,Yijk为第i个种群的第j个个体的第k个观测值,μ为总体平均值,αi为第i个种群的效应值,βj(i)为第i个种群内第j个个体的效应值,εijk为第ijk个观测值的试验误差(尚帅斌等,2015;李珊等,2016)。
1.3.2 相关性分析、主成分分析和聚类分析在SPSS19.0软件中进行相关性分析、主成分分析和聚类分析等。相关性分析,基于样本表型性状的测量均值,采用Pearson相关系数和双尾检验进行分析。主成分分析,先将样本表型性状的原始测量数据利用Z得分法标准化,以消除量纲和数量级,经KMO检测判断适合主成分分析后(KMO>0.7),再进行主成分分析。聚类分析,根据主成分分析的结果,基于因子得分系数矩阵,提取贡献率最大的第1和第2主成分,基于组间连接法和欧式距离平方做群体间的聚类分析。
1.3.3 多样性参数的计算在Excel软件中计算各性状的变异系数(CV)、表型分化系数(Vst) (葛颂等, 1988)和Shannon-Wiener指数(H)(Buss, 1995)。CV表明性状变异的离散程度,公式CV=σ/x×100%,σ和x分别为性状的标准差和均值。Vst描述表型变异在种群间贡献的大小,公式为Vst=σt/s2/(σt/s2+σs2),σt/s2和σs2分别为种群间和种群内方差值。Shannon-Wiener指数(H)说明该性状表型变异的丰富及均匀程度,公式为 H=-∑Piln(Pi),式中,Pi=ni/N,Pi表示某表型性状第i个代码出现的频率,ni为某表型性状出现的次数,N为样本数;在计算Shannon-Wiener指数前先将测量数据分成10级,转换为质量性状,<x-2σ为第1级,≥x+2σ为第10级,每级相差0.5σ。
2 结果与分析 2.1 格木果荚与种子表型性状变异格木种质资源的果荚及种子表型性状变异见表 2。13个表型性状的变异系数7.544 6%~18.868 5%,均值12.410 9%。果荚的表型变异更加丰富,其中果荚面积的变异系数最大(18.868 5%),变异幅度为2 735.879 8~6 479.232 9 mm2,果荚宽度的变异系数最小(10.359 7%),变异幅度为29.054 7~47.757 2 mm。种子的6个表型性状中,种子面积的变异系数最大(13.771 3%),变异幅度为119.333 1~263.588 9 mm2,种子长度变异系数最小(7.544 6%),变异幅度为13.643 5~ 19.739 7 mm。13个表型性状的变异系数,由大到小分别为:PA(果荚面积)>PNS(每荚种子数)>PT(果荚厚)>PP(果荚周长)>SA(种子面积)>PSI(果荚指数)>PL(果荚长度)>ST(种子厚)>PW(果荚宽)>SP(种子周长)>SW(种子宽)>SSI(种形指数)>SL(种子长)。变异系数的分析结果表明:格木的表型性状变异相对集中稳定,物种层面上表型性状的离散程度较轻,尚未形成地理上的种群分化,短期内不易形成亚种或地理小种。
|
|
13个表型性状的遗传多样性指数(H)在1.911 1~2.103 9之间,均值为2.027 8。其中果荚周长(PP)的遗传多样性指数最高(2.103 9),种形指数(SSI)的遗传多样性指数最低(1.911 1)。13个表型性状的遗传多样性从高到低分别为:PP>PW>ST>PA>PSI>PL>SW>SA>SP>SL>PNS>PT>SSI。Shannon-Wiener多样性指数的分析结果表明:格木在个体水平上存在较为丰富的表型变异,这为格木制定保护策略提供了方向,即应优先保存各个种群中有特殊表型的单株,因为在表型性状分布较为集中的背景下,特殊表型往往也是稀有表型,具有较高的保护价值;相反,性状出现频率较高的单株可以适当减少保存株数。
植物不同表型性状的极值往往反映该性状在不同环境条件下的进化及适应性潜力。13个表型性状的极大值为极小值的1.395 2(种形指数)~2.805 6(每荚种子数)倍。果荚的7个表型性状中,每荚种子数(PNS)的极大值与极小值的比值最大(2.805 6),果荚周长(PP)的极大值与极小值的比值最小(1.577 7);种子的6个表型性状中,种子面积(SA)的极大值与极小值的比值最大(2.208 9),种形指数(SSI)的极大值与极小值的比值最小(1.395 2)。13个表型性状的进化及适应性潜力从高到低分别为:PNS>PA>SA>PT>PW>PSI>PL>SW>PP>SP>ST>SL>SSI。13个表型性状的极值分析表明,果荚和种子大小等测量性状具有较高的进化或适应性潜力,种子形状的进化及适应性潜力最小。
表型性状的变异系数分析、多样性分析和极值分析都表明,果荚性状中的果荚大小、种子性状中的种子大小等性状较其他性状变异更为丰富,而种形指数(SSI)表现最为稳定,无论果荚和种子的长、宽及其他性状如何变化,是小粒种子还是大粒种子,种子形状都始终保持稳定。
2.2 格木果荚与种子表型变异来源及种群变异规律格木13个表型性状在种群间和种群内的方差分析结果(表 3)表明,13个表型性状在种群内和种群间均存在极显著差异,说明格木果荚及种子的形态性状在种群间和种群内都存在一定程度的变异。
|
|
13个表型性状的均值、标准差和多重比较(表 4)表明,P1种群的果荚长指标较小,果荚面积、果荚周长、果荚厚度、种子厚度均为最大,表现为大果荚、饱满种子的特征;P2、P4种群的果荚长指标较小,果荚宽、果荚面积、果荚周长、种子长、种子宽、种子面积、种子周长指标分别为最小和次小,表现为果荚小、种子多、种子小的特征;P3和P5种群的13个表型测量指标均居中,没有特殊的表型特征;P6种群的果荚指数、果荚厚度、每荚种子数、种子厚度均为最小,果荚长、果荚面积和果荚周长等指标较小,而种子长、种子面积、种子周长为最大,表现为果荚小、种子数少,种子大而薄、种子不饱满等败育种子的特征,这与该分布区资源数量稀少,样本长期处于孤立木和小种群状态,结实率低的事实相符;P7种群的果荚指数最大而种形指数最小,表现为果荚长而窄、种子短而宽,这与格木种子在果荚内沿果荚一侧横向排列的方式相符;P8种群的果荚最宽、种形指数最大而果荚指数次小,表现为果荚长而宽、种子短而宽的特征。
|
|
变异系数CV表示种群内表型性状的变异特征,变异系数越大,表型性状的离散程度越大。由表 5可知,8个种群的变异系数在8.852 9%(P1)~13.984 8%(P5)之间,均值为12.410 9%。在种群水平上:8个种群的13个表型性状变异系数均值均未达到15%,说明格木表型性状的变异水平较低;8个种群的果荚表型性状变异系数均大于种子表型性状的变异系数,说明格木果荚的表型变异较种子更为丰富;8个种群中,P5、P7种群的表型变异相对丰富,P1种群的表型变异水平最低。P1、P2、P3和P4种群的果荚及种子表型的变异系数均未达到15%,说明这些种群的果荚及种子表型性状都处于较低的变异水平。P5、P6、P7和P8种群果荚的7个表型性状变异系数达到了15%以上,说明这4个种群的果荚表型变异相对丰富,其中P6种群果荚的表型变异最为丰富。在物种水平上,除了果荚面积(PA)、果荚厚度(PT)和每荚种子数(PNS)外,其他10个表型性状的变异系数均未达到15%,说明除前述3个性状外,其余10个性状较为稳定;13个表型性状中,果荚面积表型变异最为丰富,而种子长度的表型变异水平最低。格木种子的表型性状无论在种群水平上还是在物种水平上,表型变异系数均未达到15%,说明格木种子的表型变异水平极低。
|
|
Shannon-Wiener指数反映不同表型性状的丰富及均匀程度,8个种群13个表型性状的多样性见表 6。由表 6可知,8个种群的Shannon-Wiener指数(H)在0.920 9(P6)~1.885 6(P8)之间,均值为1.474 7。果荚和种子的表型多样性指数均为容县(P8)种群最大,陆川(P6)种群最小,8个种群的表型多样性指数从高到低分别为:容县(P8)>龙圩(P5)>博白(P2)>浦北(P7)>合浦(P4)>苍梧(P3)>北流(P1)>陆川(P6)。因此,容县和龙圩种群是遗传多样性保护和种质资源收集的重点区域。一般而言,种群表型多样性的高低通常与样本数多少有很大关系,样本数多的种群往往具有更高的表型多样性,对比种群样本数占比和多样性占比发现,苍梧(P3)、北流(P1)、陆川(P6)等样本数少的种群其多样性占比远高于样本数量占比,似可认为这些种群的样本具有更高的表型多样性及变异,在种质资源收集过程中也应予以重视。
|
|
表型分化系数Vst是种群间变异占总变异的百分比,用以估算种群间的表型分化情况。由表 7可知,13个格木表型性状在种群间的表型分化系数在38.674 0%~7.476 5%之间,平均为21.857 9%。种群间方差分量占总变异的11.948 9%,种群内占40.387 1%,说明格木表型在种群间和种群内均存在一定程度的变异,但种群内的变异是其表型变异的主要来源,种群内的多样性大于种群间的多样性。
|
|
由表 8可知,13个表型性状间大多存在显著或极显著相关性。格木果荚长度与果荚指数、果荚宽度、果荚面积、每荚种子数、种子长度、种子宽度、种子面积和种子周长呈极显著相关,说明较长的果荚往往也是较大的果荚,其包含的种子数相应较多,且种子较大。果荚指数与果荚宽、种子长、种形指数呈极显著负相关,与果荚周长和每荚种子数呈极显著正相关,这与格木种子在果荚一侧横向排列,种子的长宽分别对应果荚的宽和长相符。果荚宽度与果荚面积、果荚周长、种子长、种形指数、种子宽、种子面积、种子周长呈极显著正相关,与果荚的厚度显著正相关,说明宽果荚往往也是较大的果荚,并伴随有大粒种子的特征。果荚面积与果荚厚、每荚种子数、种子长、种形指数、种子宽、种子面积、种子周长和种子厚度呈极显著正相关,也说明大果荚伴随大粒种子和饱满种子的特征。果荚周长与每荚种子数、种子长、种子宽、种子面积和种子周长呈极显著正相关。果荚厚度与每荚种子数显著正相关,与种子厚度极显著正相关,说明较厚的果荚往往包含更饱满的种子,可能由于营养较为充足,果荚中的种子数也有相应增加的情况。每荚种子数与种子宽、种子面积和种子周长呈显著负相关,与种子厚度呈极显著正相关,说明果荚中种子越小,每荚种子数越多,种子越饱满果荚也越厚。种子长与种形指数、种子宽、种子面积和种子周长呈极显著正相关,与种子厚度呈极显著负相关;种形指数与种子宽度成极显著负相关;种子宽度与种子面积和种子周长呈极显著正相关,与种子厚度呈极显著负相关;种子面积与种子周长呈极显著正相关,与种子厚度呈极显著负相关;种子周长与种子厚度呈极显著负相关。种子表型性状间的相关性说明,长粒种子、宽粒种子往往也是大粒种子,但是种子过大也伴随有种子变薄而不饱满的情况,这可能意味着畸形或败育种子产生。
|
|
格木表型性状与地理生态因子的相关性分析结果(表 9)表明,格木果荚及种子性状与地理生态因子间的相关性不强。表型性状中,果荚长度、果荚指数、果荚周长、果荚厚度、每荚种子数、种形指数和种子厚度与所有地理及生态因子间无相关性。地理生态因子中,相对湿度、经度与所有表型性状间无相关性。
|
|
果荚宽度与年均温和1月均温呈显著负相关,与纬度呈显著正相关;果荚面积与年降雨量呈显著负相关;种子长度、种子宽度和种子面积与7月均温呈显著负相关;种子周长与年均温和7月均温呈显著负相关。以上说明,气温高、降雨量大的分布区,格木往往具有果荚较小、种子较小的特征。随着纬度增加,年均温等温度指标降低,果荚宽度有增加的趋势,结合果荚及性状间的相关性分析结果,果荚宽度增加往往伴随着果荚长度、果荚面积、种子长、种子宽和种子面积等测量指标的增加,意味着随着纬度的增加、气温的降低,格木果荚及种子有变大的趋势。
2.7 格木果荚与种子表型性状的主成分分析和聚类分析样本表型性状的原始测量数据标准化后,KMO检测值为0.723 (>0.7),适合做主成分分析。通过对格木13个表型性状进行主成分分析(表 10),得到4个特征根大于1的主成分,累积贡献率为87.382%。第1主成分主要包含果荚长、果荚宽、果荚面积和果荚周长等与果荚大小有关的性状,以及种子长、种子宽、种子面积和种子周长等与种子大小有关的性状,主要表征果荚及种子大小;第2主成分主要包含每荚种子数和种子厚度等,主要表征每个果荚包含种子的粒数和饱满程度;第3主成分主要是种形指数,主要表征种子的长宽比;第4主成分主要是果荚的厚度,主要表征果荚厚度及其中种子的饱满程度。
|
|
8个种群间用组间连接法基于欧氏距离聚类,得到种群聚类图 2A。由图 2A可知,8个种群根据表型性状可以分为3类:第1类为P2和P4种群,主要位于格木分布区的最南端,年均温、1月和7月均温等温度指标均较高,主要特征为果荚狭长且小,其中的种子也较小。第2类为P1、P3、P5、P7和P8种群,该类种群主要位于格木分布区的中部和北部,各项温度指标相对较低,主要特征为果荚及其中的种子均较大。第3类为P6种群,该种群位于8个天然分布区的中间衔接部,该种群在果荚形态上接近第1类,属于狭长的小果荚,但其种子形态上又接近第2类,属于大粒种子,这可能与其所处的地理位置有关,兼具了第1、2类群格木果荚与种子的表型特征;考虑到该种群又有果荚厚度和种子厚度小,每荚种子数少且普遍不饱满等特征,也可能是该种群由于资源数量稀少,发生了种群衰退和种子败育。
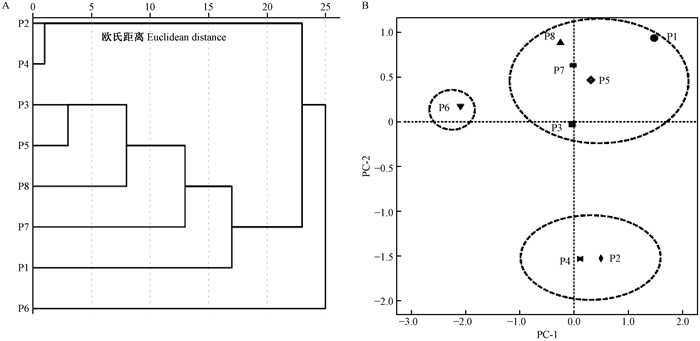
|
图 2 基于表型性状的格木种群聚类关系和种群位置关系 Fig. 2 UPGMA cluster and relationship based on the phenotypic traits of 8 populations in Erythrophleum fordii |
第1和2主成分的贡献率分别为44.880%和19.198%,基于第1、2主成分绘制散点图(图 2B)。图 2B表明,格木表型性状与种群的地理分布有一定的相关性,其中P3、P5、P7种群受地理因子影响较小,其余5个种群受地理因子影响均较大。结合相关性分析和聚类分析的结果,认为格木表型性状主要受年均温等温度因子的影响,格木的果荚及种子呈现出由南至北逐渐增大的趋势。
3 讨论 3.1 格木种质资源表型性状的多样性及变异规律格木表型多样性水平中等(H=2.027 8),这与同为二级保护植物杜仲(Eucommia ulmoides)的雌性资源表型遗传多样性指数(2.016 0)(李洪果等,2017)接近,大于杜仲雄性资源(1.918 1)和新疆野杏(Armeniaca vulgaris)(0.993 5)(李洪果等,2018;刘娟等,2015),小于非濒危种灰楸(Catalpa fargesii)(2.043 7)和西伯利亚杏(Armeniaca sibirica)(2.648 0)(李秀兰等,2013;尹明宇等,2017)。8个种群的表型多样性指数从高到低分别为:容县>龙圩>博白>浦北>合浦>苍梧>北流>陆川。因此,容县、龙圩等表型多样性高的种群是种质资源收集保存和遗传多样性保护的重点区域,但研究同时也发现北流、陆川等样本数少的种群其多样性占比远高于样本数量占比,这些种群的样本可能具有更高的表型多样性及变异,在种质资源收集过程中也应加以重视。
格木表型性状的离散程度较轻(CV=12.410 9%),各个性状分布相对集中,无论在种群水平上还是物种水平上,格木的表型性状都相对稳定,不易发生种群分化。格木13个表型性状中果荚面积的变异系数最大,种子长度的变异系数最小,此结果与赵志刚等(2009)的研究结果相同,即果荚长宽乘积变异系数最大(16.84%),种子长度变异系数最小(6.58%)。格木的表型变异系数与青海云杉(Picea crassifolia)(11.17%)和濒危树种水青树(Tetracentron sinense)(12.56%)的变异系数(王娅丽等,2008;李珊等,2016)接近,大于山东稀有种小果白刺(Nitraria sibirica)(9.34%)(董昕等,2017),小于非濒危种砂生槐(Sophora moorcroftiana)(19.39%)、西伯利亚杏(20.15%)(林玲等,2014;尹明宇等,2017)。
变异系数和Shannon-Wiener多样性指数反映种质资源多样性的不同内涵。本研究表明格木种质资源的表型性状在变异程度上具有多样性,但在数量分布上不均衡,各个表型性状分布相对集中,变异性状所占比例较少,说明具有特殊表型的格木种质资源更具保护和保存价值,在种质资源收集保存时应优先收集保存,反之,可适当减少保存株数。
3.2 格木表型性状的变异来源及分化格木13个表型性状在种群间和种群内均存在极显著差异,说明这些性状在种群间和种群内均存在丰富的变异,格木种群内的变异远大于种群间。这与大多数林木种群的表型变异来源相同,即变异来源主要来源于种群内,种群内的变异大于种群间的变异。虽然格木种群内变异远大于种群间的变异,但种群间的变异反映了地理、生殖隔离上的差异,是种内多样性的重要体现,其意义要大于种群内的变异(李斌等,2002)。格木种群的平均表型分化系数为21.857 9%,与海南岛青梅(Vatica mangachapoi)(18.31%)(尚帅斌等,2015)近似,较青海云杉(31.20%)、长柄扁桃(Amygdalus pedunculata)(45.90%)(柳江群等,2017)、水青树(46.69%)、小果白刺(40.71%)等树种的表型分化系数要小,这也说明格木的表型性状不易发生种群分化。格木各性状的分化系数变化幅度在7.476 5%(种形指数)~38.674 0%(果荚宽度)之间,说明种子形状最不易发生分化,果荚宽度较其他性状发生分化的可能性要高。格木在物种及种群水平上表型性状分化程度较低可能与所选种群均来自广西,种群间距离较小且从南到北呈连续分布有关。一方面,自然分布范围小,分布区内土壤气候条件等相对一致,通过自然选择实现种群间分化的可能性不高;另一方面在格木自然分布范围内,种群近乎连续分布,种群间基因交流频繁,限制了种群间的遗传分化,即使目前格木生境呈现碎片化的状态,但是这种状态持续的时间相对较短,尚未有足够的时间形成与生殖隔离有关的遗传分化。
植物表型性状是个体基于内在基因对环境变化所做出的形态调整,是植物对环境异质性的一种适应(胡启鹏等,2008)。本研究通过分析格木在物种水平、种群水平上的表型多样性及变异特征,获得了一些科学规律,但尚不能明确这些表型差异有多少是由个体遗传因素造成的,有多少是环境因素所致;后期可通过布设种源家系试验林,待其进入结实性状稳定期后(20年),采用重新测量的方式进一步明确表型性状的变异来源及其大小,或通过布设长期样地,收集种群的坡向、坡位、土壤理化性质、生境微生物等信息后,选择主要因素采用建立模型的方式确定。
3.3 格木表型变异与地理生态因子间的相关性不同植物对环境因子的适应机制和敏感程度的差异导致其呈现不同的地理变异规律,如苦楝(Melia azedarach)的果核长度、种子宽度等表型性状由南向北有增大的趋势(陈丽君等,2014);栀子(Gardenia jasminoides)野生居群的叶片表型与经度呈负相关,而果实表型与经度呈正相关(邓绍勇等,2015)。格木13个表型性状之间大多存在显著或极显著相关,总体而言,果荚狭小,往往对应种子较小、饱满且每荚种子数较多;果荚宽大,往往具有大粒种子。格木表型性状与地理气候因子的相关性分析表明,大多数表型性状与地理气候因子间的相关性不强。仅果荚宽度、种子周长等性状与温度指标呈负相关,与纬度呈正相关,即格木在气温高、降雨量大的地区往往具有小果荚、小种子的特征,随着温度指标降低和纬度增加,格木果荚及种子有变大的趋势。这与赵志刚等(2009)的研究结果相似,随着海拔升高、气温下降和降雨量增加,种子变大。另外,本研究未发现前人研究中格木果荚形态与经度的负相关关系(赵志刚等,2009),可能是之前选择的种群从西到东大致沿经度带状连续分布,经度跨度大(9.1°),本研究所选种群从南至北大致沿纬度带状连续分布,经度跨度较小(2.07°)的原因。
对于大多数生境不连续的濒危物种而言,种群数量大小可能会影响植物的表型。一个种群的有效样本数长期较少且处于孤立状态,可能会因近交衰退造成果实及种子等表型性状的改变,进而导致种实败育、种群灭绝(T L怀特等,2013)。但是致使发生表型改变的时间跨度一般较长,也因树种和其繁殖特性而异。从民间传承的格木家具、器物、建筑、桥梁等的数量来看,历史上格木在广西的天然分布较多,而格木种群受到大规模干扰基本上是近100年以内的事情。因此,似可认为当前格木因种群数量不同导致表型性状差异的可能性相对较低。然而,目前格木生境碎片化严重,大多处于孤立木、散生木和小群落的生存状态,其主要以虫媒传粉、大粒硬实种子的特性也使得格木难以远距离传播更新。因此,如不采取人为干预,格木的自交率将长期处于较高水平,不利于其种群延续和稳定遗传。
对于林木天然种群而言,其个体年龄往往难以判断,通常根据径级和生长量大致判断其树龄,在含有公孙树的种群中,幼龄林木在到达形态稳定期前可能与成熟林木在表型上存在差异。格木木材密度大、硬度高,属于慢生的长周期树种,实生苗通常在定植15年后开始结实(胸径约12 cm),结实前几年种子质量不高,可能存在种实各项表型指标不稳定的情况,20年以后种子质量相对稳定(胸径约16 cm),种实等各项表型指标也进入稳定期,一般不再发生改变(朱积余等,2006;唐继新等,2015),暂未发现格木单株进入结实稳定期后,其种实表型性状有随时间发生变化的证据。本研究是在2017年广西壮族自治区名木古树调查的基础上采样,取样单株大多属于格木名木古树(100年以上),胸径最大为134 cm(龙圩区广平镇调村),树龄约1 300年;胸径最小约为23 cm(容县十里镇杨外村),树龄为37年,其余单株的胸径介于二者之间,均为成熟林木。格木单株进入结实稳定期后,果荚及种子表型性状是否会随径级的增加而改变有待持续观测做进一步的验证。
3.4 格木种质资源的保护策略格木作为热带亚热带地区的珍优乡土阔叶树种,在优质木材、城市绿化和中药材开发等方面颇具发展前景和应用价值。虽然当前被列为国家二级保护植物,但前期破坏性开发造成的格木生境碎片化现状未见有恢复措施,加之格木天然更新难的特性,导致格木天然林种群的数量仍处于持续减少状态。为更好地保护格木现有的天然种群,实现格木资源的可持续利用,提出如下建议:1)鉴于格木表型变异以种群内为主、表型分化水平低和表型性状分布集中、稀有表型占比少等特征,开展格木种质资源收集保存时,可适当减少种群数,增加种群内的个体数,加强对具有特殊表型格木单株的收集。2)应持续加强现有格木天然林种群和单株的保护力度,通过收集种质资源,建立格木基因库,同时对数量少的种群开展多度恢复工作,防止种群发生自交衰退。本研究调查时发现,个别种群由于数量太少,似已丧失繁衍能力,如北海市铁山港区种群仅发现6株天然格木,3株为孤立木,果荚和种子极少且虫害严重、发育畸形,未收集到正常的果荚及种子,3株为散生小老头树,均已多年未结实,该种群正濒临灭绝;另一数量少的陆川群体,仅发现2株孤立木和1个盗伐后萌芽形成的次生小群落,该种群结实量少,果荚和种子多数畸形,种子薄而不饱满,这些表型可能是该分布区特殊的地理气候因子所致,但参照铁山港种群,因种群数量长期较少而发生自交衰退和种实败育的可能性也很大。3)应加强格木南、北原生分布区衔接地带种群的数量恢复工作,如北流、陆川等种群。调查发现格木南部的分布区,如合浦、博白、浦北分布区的资源数量相对较多,北部分布区,如容县、龙圩、苍梧分布区资源数量也较多,而南北分布区的中间衔接部北流和陆川种群资源数量稀少,格木南北连续的原生分布带有断裂的可能。4)铁山港、陆川和北流种群的格木亟需保护和恢复种群数量。基于就近引种的原则,北海市铁山港区和陆川县的格木天然林种群引入具有狭小果荚、小粒饱满种子特征的合浦、博白种源应有更好的适应性。北流市格木天然林数量也很少,但该分布区种子大而饱满,质量较高,仅需利用本地种源增加种群数量,如引种,宜引入大粒的北部种源区种子。其他县市格木种群也宜通过政府干预,利用本地种源,以种植行道树等方式适当增加本地区格木种群的数量。
4 结论1) 格木在个体水平上存在较为丰富的变异,与此同时,格木的表型性状相对集中稳定(稀有表型占比少),不易发生群体分化,具有特殊表型的格木种质资源具有更高的保存价值。2)种群内的变异是格木表型变异的主要来源,格木的种质资源收集保存可适当减少种群数量,增加种群内个体数量,优先收集有特殊表型的单株。3)容县和龙圩等多样性指数较高的种群是格木种质资源多样性保护和收集保存的重点区域;因样本数较少导致种群多样性指数偏低,但种群多样性占比较高的陆川、北流种群也应广泛收集保存。4)格木果荚及种子的表型性状与年均温等温度因子相关性明显,北部分布区普遍为宽大果荚和大粒种子,南部分布区则多为狭长果荚和小粒种子,因此,温度因子应是影响格木表型及分布最主要的因子,这一特征为格木的引种栽培提供了依据。5)通过探讨格木的传粉特性、生长特性和种子特征,结合本研究调查的格木天然种群生存现状,认为格木天然林资源的保育,需要人为干预,应及早对资源数量较少的种群开展资源多度恢复工作。
陈丽君, 邓小梅, 丁美美, 等. 2014. 苦楝种源果核及种子性状地理变异的研究. 北京林业大学学报, 36(1): 15-20. (Chen L J, Deng X M, Ding M M, et al. 2014. Geographic variation in traits of fruit stones and seeds of Melia azedarach. Journal of Beijing Forestry University, 36(1): 15-20. [in Chinese]) |
邓绍勇, 曹泉, 余林, 等. 2015. 栀子野生居群叶片和果实性状的表型多样性. 林业科学研究, 28(2): 289-296. (Deng S Y, Cao Q, Yu L, et al. 2015. Phenotypic diversity of leaf and fruit traits of natural Gardenia jasminoides population. Forest Research, 28(2): 289-296. [in Chinese]) |
董昕, 王磊, 鲁仪增, 等. 2017. 山东稀有植物小果白刺天然群体表型变异研究. 林业科学研究, 30(2): 293-299. (Dong X, Wang L, Lu Y Z, et al. 2017. Phenotypic variation of Nitraria sibirica natural population in Shandong. Forest Research, 30(2): 293-299. [in Chinese]) |
葛颂, 王明庥, 陈岳武. 1988. 用同工酶研究马尾松群体的遗传结构. 林业科学, 24(4): 399-409. (Ge S, Wang M X, Chen Y W. 1988. An analysis of population genetic structure of Masson pine by isozyme technique. Scientia Silvae Sinicae, 24(4): 399-409. [in Chinese]) |
胡启鹏, 郭志华, 李春燕, 等. 2008. 植物表型可塑性对非生物环境因子的响应研究进展. 林业科学, 44(5): 135-142. (Hu Q P, Guo Z H, Li C Y, et al. 2008. Advance at phenotypic plasticity in plant responses to abiotic factors. Scientia Silvae Sinicae, 44(5): 135-142. DOI:10.3321/j.issn:1001-7488.2008.05.025 [in Chinese]) |
黄忠良, 郭贵仲, 张祝平. 1997. 渐危植物格木的濒危机制及其繁殖特性的研究. 生态学报, 17(6): 671-676. (Huang Z L, Guo G Z, Zhang Z P. 1997. A study about endangered mechanism of Erythrophleum fordii. Acta Ecologica Sinica, 17(6): 671-676. [in Chinese]) |
李斌, 顾万春, 卢宝明. 2002. 白皮松天然群体种实性状表型多样性研究. 生物多样性, 10(2): 181-188. (Li B, Gu W C, Lu B M. 2002. A study on phenotypic diversity of seeds and cones characteristics in Pinus bungeana. Biodiversity Science, 10(2): 181-188. DOI:10.3321/j.issn:1005-0094.2002.02.008 [in Chinese]) |
李洪果, 杜庆鑫, 王淋, 等. 2017. 利用表型数据构建杜仲雌株核心种质. 分子植物育种, 15(12): 5197-5209. (Li H G, Du Q X, Wang L, et al. 2017. Establishment of female core collection of Eucommia ulmoides Oliv. based on phenotypic characters. Molecular Plant Breeding, 15(12): 5197-5209. [in Chinese]) |
李洪果, 杜红岩, 贾宏炎, 等. 2018. 利用表型性状构建杜仲雄性资源核心种质. 分子植物育种, 16(2): 591-601. (Li H G, Du H Y, Jia H Y, et al. 2018. Establishment of male core collection of Eucommia ulmoides based on phenotypic traits. Molecular Plant Breeding, 16(2): 591-601. [in Chinese]) |
李珊, 甘小洪, 憨宏艳, 等. 2016. 濒危植物水青树叶的表型性状变异. 林业科学研究, 29(5): 687-697. (Li S, Gan X H, Han H Y, et al. 2016. Leaf phenotypic traits of Tetracentron sinense, an endangered plant species. Forest Research, 29(5): 687-697. DOI:10.3969/j.issn.1001-1498.2016.05.010 [in Chinese]) |
李秀兰, 贾继文, 王军辉, 等. 2013. 灰楸形态多样性分析及核心种质初步构建. 植物遗传资源学报, 14(2): 243-248. (Li X L, Jia J W, Wang J H, et al. 2013. Morphological diversity analysis and preliminary construction of core collection of Catalpa fargesii Bur. Journal of Plant Genetic Resources, 14(2): 243-248. DOI:10.3969/j.issn.1672-1810.2013.02.009 [in Chinese]) |
林玲, 王军辉, 罗建, 等. 2014. 砂生槐天然群体种实性状的表型多样性. 林业科学, 50(4): 137-143. (Lin L, Wang J H, Luo J, et al. 2014. Phenotypic diversity of seed and fruit traits in natural populations of Sophora moorcroftiana. Scientia Silvae Sinicae, 50(4): 137-143. [in Chinese]) |
刘娟, 廖康, 刘欢, 等. 2015. 新疆野杏种质资源表型性状多样性研究. 西北植物学报, 35(5): 1021-1030. (Liu J, Liao K, Liu H, et al. 2015. Phenotypic diversity of wild Apricot germplasm resources in Xinjiang. Acta Botanica Boreali-Occidentalia Sinica, 35(5): 1021-1030. [in Chinese]) |
柳江群, 尹明宇, 左丝雨, 等. 2017. 长柄扁桃天然种群表型变异. 植物生态学报, 41(10): 1091-1102. (Liu J Q, Yin M Y, Zuo S Y, et al. 2017. Phenotypic variations in natural populations of Amygdalus pedunculata. Chinese Journal of Plant Ecology, 41(10): 1091-1102. [in Chinese]) |
尚帅斌, 郭俊杰, 王春胜, 等. 2015. 海南岛青梅天然居群表型变异. 林业科学, 51(2): 154-162. (Shang S B, Guo J J, Wang C S, et al. 2015. Phenotypic variations in natural populations of Vatica mangachapoi in Hainan, China. Scientia Silvae Sinicae, 51(2): 154-162. [in Chinese]) |
唐继新, 贾宏炎, 麻静, 等. 2015. 南亚热带珍稀濒危树种格木生长规律研究. 中南林业科技大学学报, 35(7): 37-44. (Tang J X, Jia H Y, Ma J, et al. 2015. Study on the growth law of a rare and endangered tree species of Erythrophleum fordii in south subtropical area of China. Journal of Central South University of Forestry & Technology, 35(7): 37-44. [in Chinese]) |
T L怀特, W T亚当斯, D B尼尔. 2013.森林遗传学.崔建国, 李火根, 译.北京: 科学出版社, 230-250. (White T L, Adams W T, Neale D B. 2013. Forest Genetics. Translated by Cui J G and Li H G. Beijing: Science Press, 230-250.) |
王娅丽, 李毅, 陈晓阳. 2008. 祁连山青海云杉天然群体表型性状遗传多样性分析. 林业科学, 44(2): 70-77. (Wang Y L, Li Y, Chen X Y. 2008. Phenotypic diversity of natural population in Picea crassifolia in Qilian mountains. Scientia Silvae Sinicae, 44(2): 70-77. DOI:10.3321/j.issn:1001-7488.2008.02.011 [in Chinese]) |
尹明宇, 高福玲, 乌云塔娜. 2017. 内蒙古西伯利亚杏种质资源表型多样性研究. 植物遗传资源学报, 18(2): 242-252. (Yin M Y, Gao F L, Wuyun Tana. 2017. High-level genetic diversity of Siberian Apricot(Armeniaca sibirica) in Inner Mongolia revealed by phenotyping. Journal of Plant Genetic Resources, 18(2): 242-252. [in Chinese]) |
赵志刚. 2011.珍稀濒危树种格木保护生物学研究.北京: 中国林业科学研究院博士学位论文. (Zhao Z G. 2011. Conservation biology of Erythrophleum fordii Oliv., a rare and endangered tree species in south China. Beijing: PhD thesis of Chinese Academy of Forestry.) http://d.wanfangdata.com.cn/Thesis_D603382.aspx |
赵志刚, 郭俊杰, 沙二, 等. 2009. 我国格木的地理分布与种实表型变异. 植物学报, 44(3): 338-344. (Zhao Z G, Guo J J, Sha E, et al. 2009. Geographic distribution and phenotypic variation of fruit and seed of Erythrophleum fordii in China. Bulletin of Botany, 44(3): 338-344. DOI:10.3969/j.issn.1674-3466.2009.03.011 [in Chinese]) |
郑万钧. 1985. 中国树木志. 北京: 中国林业出版社, 1207-1209. (Zheng W J. 1985. Records of Chinese trees. Beijing: China Forestry Publishing House, 1207-1209. [in Chinese]) |
中国科学院植物研究所. 1989. 中国珍稀濒危植物. 上海: 上海教育出版社, 188-190. (Institute of Botany, The Chinese academy of Science. 1989. Rare and endangered plants in China. Shanghai: Shanghai Education Publishing House, 188-190. [in Chinese]) |
朱积余, 廖培来. 2006. 广西名优经济树种. 北京: 中国林业出版社, 61-64. (Zhu J Y, Liao P L. 2006. Famous and high-quality economic tree species in Guangxi. Beijing: China Forestry Publishing House, 61-64. [in Chinese]) |
Buss G R. 1995. Microsatellite and amplified sequence length polymorphisms in cultivated and wild soybean. Genome, 38(4): 715-723. DOI:10.1139/g95-090 |
Forcada J, Hoffman J I. 2014. Climate change selects for heterozygosity in a declining fur seal population. Nature, 511(7510): 462-475. DOI:10.1038/nature13542 |
Hake S, Ross-Ibarra J. 2015. Genetic, evolutionary and plant breeding insights from the domestication of maize. Elife, 4(4): 61-71. |
Pinsky M L, Palumbi S R. 2014. Meta-analysis reveals lower genetic diversity in overfished populations. Molecular Ecology, 23(1): 29-39. DOI:10.1111/mec.12509 |
Soares M P, Weiss G. 2015. The Iron age of host-microbe interactions. EMBO Reports, 16(11): 1482-1500. DOI:10.15252/embr.201540558 |
Spielman D, Brook B W, Frankham R. 2004. Most species are not driven to extinction before genetic factors impact them. Proceedings of the National Academy of Sciences of the United States of America, 101(42): 15261-15264. DOI:10.1073/pnas.0403809101 |
 2019, Vol. 55
2019, Vol. 55

