文章信息
- 刘嵘, 陈美玲, 刘贤淼, 费本华.
- Liu Rong, Chen Meiling, Liu Xianmiao, Fei Benhua.
- 树脂铸型法研究毛竹材细胞壁的纹孔特征
- Characteristics of Pits in Moso Bamboo(Phyllostachys edulis) Revealed by Resin Casting
- 林业科学, 2019, 55(4): 196-202.
- Scientia Silvae Sinicae, 2019, 55(4): 196-202.
- DOI: 10.11707/j.1001-7488.20190421
-
文章历史
- 收稿日期:2017-02-27
- 修回日期:2017-07-21
-
作者相关文章
纹孔(pit)是植物细胞的细胞壁上未经次生加厚而留下的孔洞或凹陷部分(Cosgrove,2005),既是细胞或组织间进行物质联系的要塞和“阀门”(Meyra et al., 2007),也是内部复合毛细管系统中极其重要的结构因子(鲍甫成等,2003)。竹子属于单子叶植物,生长极其迅速,需要安全高效的水分和营养物质供应路径,但竹子节间无横向输导组织(Liese et al., 2015;Choat et al., 2008),其组织细胞构成与木材差别较大,且二者在细胞壁纹孔结构上也存在差异(Carlquist et al., 2010),因此纹孔这一物理通道在水分和营养物质供应中扮演着极其重要的角色。此外,在竹材加工利用过程中,纹孔是水分以及防霉剂、阻燃剂等出入竹材单元的关键通道(鈴木寧,1952),系统研究纹孔特征对于解决竹材横向渗透差等难题、提高竹材利用效率具有重要意义。成竹材质致密坚硬,相应在观测手段和研究方法上也颇具挑战,这可能是目前对成竹纹孔结构功能探讨较少的重要原因(刘嵘,2017;刘嵘等,2017)。
树脂铸型(resin casting)是一种再现物体空隙三维空间的模板法(Stieber,1981;Fujii,1993),其将低分子质量且体积收缩较小的树脂浸注到组织细胞的孔洞空间内并固化,然后用药剂去除细胞壁等组织物质,只留下树脂部分,细胞的树脂铸型可以直观展示细胞壁上孔洞部分的立体结构,但该方法多见于木材研究中,竹材的相关研究几乎未见。毛竹(Phyllostachys edulis)是我国南方重要的散生竹种,生长周期短,分布范围广,通常4年材性便相对稳定(江泽慧,2007;Fei et al., 2016;Nirmala et al., 2018)。本研究以4年生毛竹作为试验对象,运用树脂铸型技术,观察毛竹单个细胞铸型和维管束部分铸型上的纹孔形态、结构和分布排列,研究毛竹材细胞壁的纹孔特征,以期为竹子生长发育机制的深入研究和竹材高效利用提供理论依据。
1 材料与方法 1.1 制样4年生毛竹,平均胸径15 cm,采自安徽省黄山市太平试验基地(118°13′E, 30°3′N)。为降低取样位置对试验结果的干扰,将刚露出地面的竹节记为第1节,于第10节中部的竹环面中心位置选取试验材料[图 1,约300 mm(L)× 5 mm(T)× 5 mm(R)]。新鲜竹块置于80 ℃温水中软化7天,采用滑走切片机(M2000R,Leica,Germany)制取横纵切面后干燥,记为Ssl;新鲜竹条液氮过冷,置于冷冻干燥仪(LABCONCO Free Zone,US)冷冻干燥后,用双面刀撕裂成小竹片,记为Ssp;20 mm(L)× 5 mm(T)× 5 mm(R)竹条用于树脂铸型。

|
图 1 树脂铸型示意(导管) Fig. 1 Schematic diagram of resin casting procession(vessel as an example) |
铸型方法如图 1所示。树脂渗透:竹条先用连续浓度梯度乙醇脱水,再用低分子质量双组分树脂BS浸泡渗透;树脂固化:竹条和树脂在离心管内抽真空后,置于60 ℃恒温箱内聚合72 h;组织消化:先在V (H2O2:HOAc)=1:1的混合溶液中浸泡24 h脱除木素,再用浓硫酸浸泡24 h除去细胞壁上的多糖类物质;最后进行清洗干燥,获得单个细胞铸型和空间范围内多个细胞连接的立体铸型网络,记为Src。
本研究采用苯乙烯的相对密度为0.906(25 ℃)。铸型过程中所用树脂的收缩问题,参照国际标准ISO3521,采用密度法测定树脂体积收缩率:
| $ {V_{\rm{s}}} = \frac{{{\rho _{\rm{c}}} - {\rho _0}}}{{{\rho _{\rm{e}}}}} \times 100\% 。$ |
式中:Vs为树脂总体积收缩率(%);ρ0为固化前树脂密度(g·cm-3),用比重计测得;ρc为固化后树脂密度(g·cm-3),参照国标GB 1463浮力法测定。
1.3 纹孔观测样品用导电胶固定在样品托上进行离子溅射镀膜后(离子溅射仪阴极金属为铂金,Bal-Tec,Germany;时间90 s,电流30 mA,工作距离50 mm,镀膜厚度约8 nm),于场发射环境扫描电镜FEG-ESEM(XL30 ESEM FEG, FEI Company, US)下观察纹孔结构。纹孔孔径大小为树脂铸型上纹孔孔径测量值与树脂体积收缩率的乘积。纹孔结构参数统计样本量均为150个,通过ImageProPlus图像处理软件进行分析。
2 结果与分析 2.1 纹孔铸型特点树脂铸型适合复制包含细胞壁上纹孔结构在内的质外体空间,是一种直观展示纹孔真实三维结构的方式。低分子质量树脂渗透、填充细胞孔洞空间并固化,贴合原来细胞壁实质与孔洞的交界面,以树脂实体的形式暴露出原本隐藏在细胞壁内部的孔洞空间(图 1);而在其他解剖方式(比如切片和离析等)下,一般难以观察到纹孔内部空间全貌,不易对应细胞空间位置和类型等信息。纹孔树脂铸型在这些问题上有一定优势,相比AFM、纳米CT等新兴技术,在操作和观测上都相对简单方便。
整体而言,竹材组织细胞上纹孔铸型难度从导管、薄壁细胞到纤维细胞依次增大。导管分子壁薄腔大,纹孔的数量和孔径在3种细胞中较为突出,铸型完整度较好;纤维细胞的腔小且纹孔道狭长,铸型后留下的树脂较少,结构容易被破坏。另外,铸型效果也受铸型用树脂流动性以及竹材纹孔膜渗透性等影响。
2.2 单类型细胞的纹孔铸型1) 导管纹孔 图 2a、b中上半部分分别为毛竹原生木质部环纹导管和后生木质部导管,下半部分为对应这2种类型导管的树脂铸型。可见导管树脂铸型能较直观呈现导管分子的内壁雕纹,原生木质部导管的螺纹或环纹增厚结构在铸型上反映明显,后生木质部导管上的纹孔三维结构也被很好复制,纹孔在靠近维管束几何中心位置侧的导管壁上密集分布,而另一侧则十分稀少或基本没有(图 2b、e)。

|
图 2 导管纹孔 Fig. 2 Pits in vessel elements a、b:原生木质部环纹导管和后生木质部导管,上半部分为Ssp中的导管,下半部分为Src中的同类型导管;c:后生木质部小导管的铸型,穿孔板(星标),两导管间的连接(箭头),三导管间的纹孔连接处(三角形);d:具缘纹孔对结构;e:维管束部分铸型,V为后生木质部大导管, F为小导管铸型(m);g:放大的具缘纹孔铸型。 a, b: Annular vessel and metaxylem vessel, the upper half is vessel element and the lower half is cast of the same-type, respectively; c: Casts of smaller metaxylem and perforation plate(asterisked), connection of two elements(arrowed) and three ones(marked triangle); d: Structure of bordered pits; e: Casts of vascular border, V is metaxylem elements; F is smaller vessel element(m); g: Magnification of bordered pit cast. |
后生木质部小导管在竹材原生木质部物质运输中具有重要作用,以往可能因为常规解剖方式下不易被发现而较少被关注(Dusotoit-Coucaud et al., 2014;Carlquist,2012)。本研究发现大量结构相对完整的此类导管铸型,在导管半径平面常有2~5个直径20~80 μm的孔纹小导管相邻排列(图 2e)。壁上分布有大量具缘纹孔,管间纹孔式对列或互列。通过树脂铸型易观察到,导管通过边缘水平或具一定斜度的端壁穿孔板进行上下连接(图 2c),管间通过具缘纹孔对连接(图 2d、图 5b),具缘纹孔的内部结构(图 2g)清晰可见。

|
图 5 毛竹纤维细胞纹孔 Fig. 5 Pits in fibercell wall of mosobamboo a:样品Ssl中纤维细胞纵切面及细胞壁上的纹孔(箭头);b:样品Src中纤维之间的纹孔连接(箭头),纤维细胞腔铸型(星标);c:纤维细胞纹孔道铸型(箭头)。 a: Longitudinal section of fiber cells and pits(arrowed)in cell wall from Ssl; b: Pit connection(arrowed)of fibers and cell cavity(asterisked)from Src; c: Pit cavity(arrowed)of a fiber cast. |
树脂铸型能很好展现纹孔的三维结构特征,并可对纹孔口和纹孔膜大小、纹孔腔深度(细胞壁厚度)以及导管壁厚等进行定量测量。毛竹导管长轴方向上纹孔口和纹孔膜的尺寸变动较大,短轴方向上纹孔结构各参数如图 3所示。
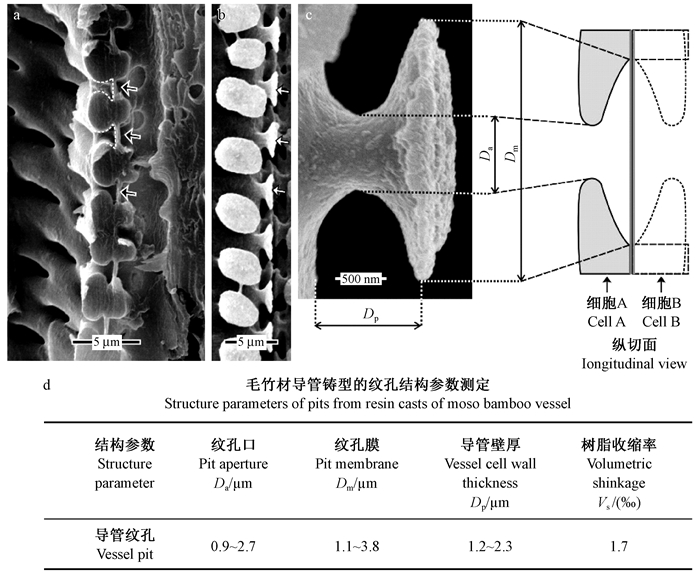
|
图 3 导管纹孔结构参数的测定示意 Fig. 3 Schematic of quantitative characteristics of pits a:竹材组织Ssl中导管具缘纹孔的剖面;b:树脂铸型Src中的导管具缘纹孔侧面图像;c:具缘纹孔的结构参数测定示意,其中Da为纹孔口大小,Dm为纹孔膜大小,Dp为纹孔腔深度即导管壁厚度。 a: Resin casts of three small vessel members, and an enlarged view; b: Connections of members in transverse and longitudinal direction; c: Bordered pit pairs between vessel element in longitudinal direction. Da, Dm and Dp for diameter of pit aperture, pit membrane and pit cavity respectively. |
2) 薄壁细胞纹孔 薄壁细胞内常含有淀粉颗粒,纹孔内口被遮挡住(图 4a);自然撕开的竹材样品,细胞壁可能被撕裂,纹孔口结构易遭破坏(图 4b)。树脂铸型则较少受到类似限制。基本组织中的薄壁细胞铸型,一般连接比较松散;而维管束内薄壁细胞,易获得如图 3c中与木质部连在一起的细胞铸型群体,能观察到大量结构完好的纹孔对。这是因为薄壁细胞间以及与导管之间的纹孔通道相对较多,树脂更容易渗透通过更多数量的细胞。该处也常有一些胞腔较小、长度较长的长细胞(图 6a、图 4f),壁上分布有大量纹孔,这可能是竹类植物生长过程中介于大输导量的导管与常规薄壁细胞之间的一种缓冲机制。长细胞和短细胞上都有大量纹孔,纹孔道深度与细胞壁壁厚对应,短细胞的胞壁一般比长细胞的薄,而即使是长细胞间厚度也有一定差异。另外,部分薄壁细胞的纹孔呈现对列或互纹纹孔排列方式(图 4e)。
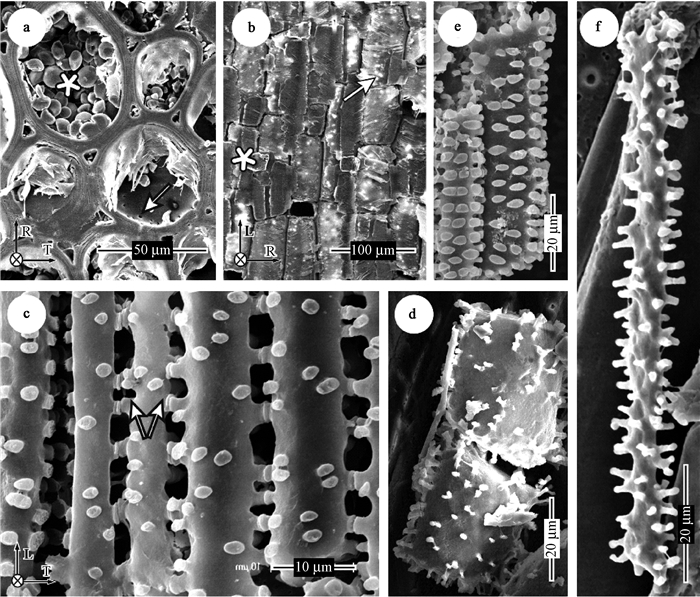
|
图 4 毛竹薄壁细胞的纹孔 Fig. 4 Pits in parenchymal cell wall of moso bamboo a, b:Ssl(横切面)和Ssp(纵剖面)中的薄壁组织,淀粉颗粒(星号),单纹孔(箭头);c:样品Src中的薄壁细胞;d:短细胞和长细胞铸型;e:部分呈对列或互列排列的薄壁细胞纹孔。 a, b: Transection of Ssl and longitudinal section of Ssp of parenchyma cell and starch(asterisked) and pit opening(arrowed); c: Parenchyma cells and pit pairs(arrowed)from Src; d: Short cell cast; e: Opposite and alternate pitting parenchyma(casts). |
3) 纤维细胞纹孔 纤维细胞壁上的纹孔小且分布稀疏(图 5a),纹孔道狭长(图 5c),无论是直接观测还是树脂铸型都有各自局限:纤维离析后不易观察到纹孔的微细结构;切片制作往往难以达到理想效果,且涉及软化等特殊处理;竹材纤维细胞壁厚腔小,树脂完全渗透需克服较大的毛细管张力,留下的树脂铸型相对脆弱,易在清洗等操作中脱落折断,影响纹孔结构完整度。图 5b为纤维鞘的部分铸型,可见纤维细胞间的纹孔对结构,纹孔道铸型边缘并非完全水平,可以看到很窄的类似纹孔缘结构造成的较小倾斜,但对于是否为具缘纹孔无法定论。关于纤维细胞壁上的纹孔类型归属长久以来意见不一,具缘纹孔、单纹孔或二者皆存的结论均有(刘波,2008;刘主凰,2011)。在原有解剖认识的基础上,改进完善工艺,选择更适用的铸型物质,若能得到数量足够且结构较完整的纹孔铸型,应该可以明确判断。
2.3 细胞间纹孔通道树脂铸型后阶段,适当控制清洗力度,可得到多个细胞相连的铸型群体。图 6展示了原生木质部导管间、薄壁细胞间、导管与薄壁细胞间等纹孔分布及连接形式。纤维细胞、薄壁细胞与导管间的纹孔连接情况在图 2中也有所体现。

|
图 6 毛竹细胞间纹孔通道 Fig. 6 Pits connection between cells in moso bamboo a:薄壁细胞间纹孔连接(三角标)与导管间的纹孔对连接(箭头)铸型;b:后生木质部小导管间及与薄壁细胞的纹孔连接铸型;c:维管束部分铸型,普通薄壁细胞(三角标)和特殊长形薄壁细胞(箭头),后生木质部小导管(星标)。 a: Pit connection among parenchyma cells(marked triangle) and between parenchyma and metaxylem vessel(arrowed); b: Pit connection of smaller metaxylem vessel(arrowed) and parenchyma cells around(asterisked); c: Part of vascular bundle casts, normal parenchyma and special long cell(arrowed), smaller metaxylem vessel(asterisked). |
大量相连的网络状树脂铸型,既揭示了细胞或组织之间如何通过纹孔相互连接,实际也直接呈现了特定流体在竹材内部扩散或渗透的途径和通道,因为铸型用的树脂便是一种流体。图 6表明,树脂在纵向的连贯性远高于横向,也与竹材内部纵向渗透远远大于横向的结论一致(Cho et al., 2013)。木质部周围的铸型连接紧密(图 6c),这是因为该区域细胞间纹孔分布多,树脂由导管渗透经过纹孔再进入的细胞数量也多,并且细胞腔大,细胞壁相对薄,留下的树脂铸型相应强度也较好。
3 结论与讨论毛竹成竹材质坚硬,常规组织切片制作有一定难度,而树脂铸型法可同时获得细胞腔、纹孔腔和细胞间隙空间的模板,细胞树脂铸型能够很好揭示竹材纹孔形态结构和分布特点以及空间范围内细胞间纹孔通道的三维网络,并能直接呈现特定流体在竹材内部扩散或渗透的路径。但是,由于得到的是复制结构,存在有赝像的可能,如图 4d和图 5c中都可观察到纹孔结构铸型存在歪斜等变形现象,因此树脂铸型作为较理想的辅助方法,可与离析、切片等直接观察方式的解剖方法结合运用。毛竹后生木质部大导管纹孔的纹孔缘结构明显,纹孔在侧壁上选择性分布,纹孔铸型中纹孔口和纹孔膜分别为0.9~2.7 μm和1.1~3.8 μm。在2个大导管之间有1个至数个小导管错落或相邻分布,其侧壁上具有大量具缘纹孔,相互间以具缘纹孔对连接。通过维管束铸型可明显观察到,基本组织中和维管束内薄壁细胞的纹孔差异较大,后者纹孔数量更多,尤其是紧邻木质部附近的薄壁细胞更具特殊性;纤维细胞上纹孔稀疏,纹孔小且纹孔道狭长,疑似有具缘纹孔结构;维管束细胞间通过纹孔结构、细胞腔和细胞间隙相互连接的方式构成流体移动的空间网络通道。后续应对各类型纹孔的特征参数进行更详尽的测量和统计分析,以便全面深入开展毛竹材纹孔特征的研究。
鲍甫成, 赵有科, 吕建雄. 2003. 杉木和马尾松木材渗透性与微细结构的关系研究. 北京林业大学学报, 25(1): 1-5. (Bao F C, Zhao Y K, Lü J X. 2003. Relationship between permeability and fine structure of common Chinese fir and massion pine wood. Journal of Beijing Forestry University, 25(1): 1-5. [in Chinese]) |
刘波. 2008.毛竹发育过程中细胞壁形成的研究.北京: 中国林业科学研究院博士学位论文. (Liu B. 2008. Formation of cell wall in developmental culms of Phyllostachys pubescens. Beijing: PhD thesis of Chinese Academy of Forestry.[in Chinese]) http://cdmd.cnki.com.cn/Article/CDMD-82201-2008136701.htm |
鈴木寧. 1952. 竹材の研究(第7報)竹材柔細胞腔の空気及び液体に対する閉鎖について. 東京大学農学部演習林報告, 43: 151-157. (Suzuki Y. 1952. Studies on bamboo(Ⅶ)-Stopping of pit pore in bamboo parenchyma cell and its effect on gas and liquid permeability into bamboo. Tokyo University Agriculture Department Exercise Forest Report, 43: 151-157. [in Chinese]) |
刘嵘. 2017.毛竹材细胞壁的纹孔特征研究.北京: 中国林业科学研究院博士学位论文. (Liu R. 2017.Characteristics of pits in bamboo cell wall. Beijing: PhD thesis of Chinese Academy of Forestry.[in Chinese]) |
刘嵘, 杨淑敏, 李晖, 等. 2017. 毛竹材导管分子的纹孔特征. 南京林业大学学报:自然科学版, 41(6): 163-168. (Liu R, Yang S M, Li H, et al. 2017. Characteristics of pits in the vessel element of moso bamboo. Journal of Nanjing Forestry University:Natural Sciences Edition, 41(6): 163-168. [in Chinese]) |
刘主凰. 2011.福建主要竹材纤维特性的研究.福州: 福建农林大学硕士学位论文. (Liu Z H. 2011. Study on fiber properties of chief bamboo species in Fujian province. Fuzhou: MS thesis of Fujian Agriculture and Forestry University.[in Chinese]) http://cdmd.cnki.com.cn/Article/CDMD-10389-1011164591.htm |
江泽慧. 2007. 世界竹藤. 北京: 中国林业出版社.
|
Carlquist S, Schneider E L. 2010. Origins and nature of vessels in monocotyledons. 12. Pit membrane microstructure diversity in tracheary elements of Astelia. Pacific Science, 64(4): 607-618. DOI:10.2984/64.4.607 |
Carlquist S. 2012. Monocot xylem revisited:new information, new paradigms. The Botanical Review, 78(2): 87-153. DOI:10.1007/s12229-012-9096-1 |
Cho D, Jin M K, Kim D. 2013. Phenolic resin infiltration and carbonization of cellulose-based bamboo fibers. Materials Letters, 104(3): 24-27. |
Choat B, Cobb A R, Jansen S. 2008. Structure and function of bordered pits:new discoveries and impacts on whole-plant hydraulic function. New Phytologist, 177(3): 608-626. DOI:10.1111/nph.2008.177.issue-3 |
Cosgrove D J. 2005. Growth of the plant cell wall. Nature Reviews Molecular Cell Biology, 6(11): 850-861. DOI:10.1038/nrm1746 |
Dusotoit-Coucaud A, Brunel N, Tixier A, et al. 2014. Hydrolase treatments help unravel the function of intervessel pits in xylem hydraulics. Physiologia Plantarum, 150(3): 388-396. DOI:10.1111/ppl.2014.150.issue-3 |
Fei B H, Gao Z M, Wang J, et al. 2016, Biological, anatomical, and chemical characteristics of bamboo//Yoon S K, Ryo F, Adya P S. Secondary xylem biology. Elsevier, Netherlands, 283-306.
|
Fujii T. 1993. Application of resin casting method to wood anatomy. Plant Morphology, 5(1): 3-18. DOI:10.5685/plmorphol.5.3 |
Liese W, Tang T K H. 2015. Properties of the bamboo culm, bamboo. Springer, 227. |
Meyra A G, Kuz V A, Zarragoicoechea G J. 2007. Geometrical and physicochemical considerations of the pit membrane in relation to air seeding:the pit membrane as a capillary valve. Tree Physiology, 27(10): 1401-1405. DOI:10.1093/treephys/27.10.1401 |
Nirmala C, Bisht M S, Bajwa H K, et al. 2018. Bamboo:a rich source of natural antioxidants and its applications in the food and pharmaceutical industry. Trends in Food Science & Technology, 77: 91-99. |
Stieber J. 1981. A new method of examining vessels. Annals of Botany, 48(3): 411-414. DOI:10.1093/oxfordjournals.aob.a086143 |
 2019, Vol. 55
2019, Vol. 55

