文章信息
- 孙婷玉, 王艳丽, 沈李元, 吴小芹, 朱丽华, 叶建仁.
- Sun Tingyu, Wang Yanli, Shen Liyuan, Wu Xiaoqin, Zhu Lihua, Ye Jianren.
- 培养基成分对黑松体胚发育成熟的影响
- Impact of Medium Components on Somatic Embryo Maturation in Pinus thunbergii
- 林业科学, 2019, 55(4): 178-186.
- Scientia Silvae Sinicae, 2019, 55(4): 178-186.
- DOI: 10.11707/j.1001-7488.20190419
-
文章历史
- 收稿日期:2017-09-03
- 修回日期:2018-02-19
-
作者相关文章
2. 南方现代林业协同创新中心 南京 210037
2. Collaborative Innovation Center of Sustainable Forestry in Southern Nanjing 210037
松材线虫(Bursaphelenchus xylophilus)病是松树上的一种毁灭性传染病,被许多国家列为检疫对象;在我国于1982年首次在南京中山陵发现,已扩散到苏、皖、浙、赣等10多个省(市),每年发生面积达10万hm2,直接经济损失25亿元(叶建仁,2010)。近年来其在我国的扩散趋势越来越明显,现已成为我国一种重要入侵病原生物(赵捷等,2017; 林丽等,2017)。黑松(Pinus thunbergii)是松材线虫病的高度感病树种, 在我国山东、安徽、浙江、福建、江苏等省均有种植,全国总面积约159 300 hm2。我国黑松林的健康受到松材线虫病的严重威胁。2004年,江苏省有害生物入侵预防和控制重点实验室从日本引进了一批珍贵的抗松材线虫病黑松种质资源,并建立了基因库(吴小芹等, 2009)。由于基因库中的母树种子产量有限,并且受到季节、环境等条件的限制,所以,江苏省有害生物入侵预防和控制重点实验于2008年开始抗性黑松体细胞胚胎发生的研究,并先后成功诱导抗性黑松胚性细胞团,建立抗性黑松体细胞胚发生体系(孙婷玉,2014;孙婷玉等,2015)。目前该体系存在体胚发育不一致、产胚率低的问题,需要进一步优化。
体细胞胚胎发生是一个复杂的过程,大量研究表明,基本培养基的成分及浓度对松属树种的分化至关重要,其中培养基种类、聚乙二醇(polyethylene glycol,PEG)、活性炭(active carbon, AC)、脱落酸(abscisic acid,ABA)、糖种类及浓度对体细胞胚的成熟发育起着至关重要的作用,因而选择合适的成熟培养基对体胚发育成熟尤为重要。ABA能促进体胚的成熟,抑制裂生多胚以及畸形胚的产生。ABA与AC组合促进了马尾松(P. massoniana)体细胞胚的形成(黄健秋等,1995),而AC对湿地松(P. elliottii)ESM(embryonal suspensor mass)进行成熟预处理,再将其转入成熟培养基中,获得了早期子叶胚(吴丽君,2009)。松属树种体胚的成熟还需要高渗透压的刺激作用,通常使用PEG作为渗透剂来提高培养基的渗透压,没有PEG调节培养基渗透压,几乎不可能获得子叶胚(Uddin, 1993)。糖除了可以作为ESM的碳源外,也是重要的渗透剂,体细胞胚成熟阶段使用适当浓度的糖,不仅可以促进体胚的发生还能有效抑制畸形胚的出现,另外糖的种类对体胚的发育也十分重要,目前研究发现,麦芽糖对体胚的成熟的作用要大于其他种类的糖(Bozhkov et al., 2002)。只有在各种因素都适合体细胞胚成熟的条件下才能获得优良的成熟体细胞胚。本试验对ABA、PEG、AC等影响抗性黑松体细胞胚发育成熟的因素进行一系列的研究,进一步探索抗性黑松体细胞胚发育成熟的条件,提高抗性黑松体细胞胚的数量和质量。这对抗性黑松的育种,选择优良家系的快速繁殖,实现抗松材线虫病苗木的大量繁殖、生产具有重要意义。
1 材料与方法 1.1 材料来源和培养方法以抗性黑松胚性细胞#1337(2013年诱导的37家系胚性细胞)、#1537(2015年诱导的37家系胚性细胞)、#1637 (2016年诱导的37家系胚性细胞)作为成熟培养的试验材料,各无性系在增殖培养基生长约10个月,将增殖阶段生长优良,显微观察后处于后期原胚阶段的胚性细胞团转至设计的成熟培养基中。培养方法:胚性细胞团在固体增殖培养基上继代生长至第10天,使用灭菌(75%乙醇擦拭、紫外灭菌30 min)的电子天平称量1 g胚性细胞团,采用50 mL无菌量筒(紫外灭菌30 min)量取30 mL培养液中于100 mL的三角瓶中,将1 g胚性细胞团转至100 mL的三角瓶中,手动搅拌至细胞团分散,置于90 r·min-1摇床上,25 ℃,黑暗培养7~8天。随后,取3 mL沉淀悬浮细胞进行继代增殖,每星期继代增殖1次至胚性细胞全部均匀散落于培养液。将继代4次的胚性细胞充分摇匀,取2 mL(鲜质量约200 mg)胚性悬浮细胞喷洒在不同组分固体成熟培养基上。本研究的成熟培养基组分包括麦芽糖(30、45、60 g·L-1),ABA (0、5、10、20、30、50 mg·L-1),PEG8000 (0、50、75、100、125、150 g·L-1),AC(1、2、3 g·L-1),凝固剂(琼脂6、8、10、12 g·L-1,植物凝胶2、2.5、3、3.5 g·L-1)以及麦芽糖、ABA、PEG 3因素的组合。
1.2 糖浓度对抗性黑松体细胞胚发育成熟的影响将诱导的抗性黑松#1337胚性细胞系作为成熟培养的试验材料,转接到基本培养基为DCR, 麦芽糖分别为30、45、60 g·L-1,肌醇1 g·L-1,谷氨酰胺1.5 g·L-1,500 mg·L-1水解酪蛋白,250 mg·L-1 2-(N-吗啡啉)乙磺酸, ABA 20 mg·L-1,琼脂8 g·L-1的成熟培养基上,每个处理5皿,重复3次,3个月后统计出胚情况。
1.3 ABA浓度对抗性黑松体细胞胚发育成熟的影响将抗性黑松#1337转接在以DCR为基本培养基,ABA浓度分别为0、5、10、20、30、50 mg·L-1的处理,添加麦芽糖30 g·L-1、肌醇1 g·L-1、谷氨酰胺1.5 g·L-1、500 mg·L-1水解酪蛋白、250 mg·L-1 2-(N-吗啡啉)乙磺酸、琼脂8 g·L-1的成熟培养基上,每个处理5皿,重复3次。3个月后观察出胚情况。
1.4 PEG8000对抗性黑松体胚发育成熟的影响将抗性黑松#1337转接在DCR基本培养基,添加麦芽糖30 g·L-1、ABA 20 mg·L-1、肌醇1 g·L-1、谷氨酰胺1.5 g·L-1、500 mg·L-1水解酪蛋白、250 mg·L-1 2-(N-吗啡啉)乙磺酸、琼脂8 g·L-1的成熟培养基上,PEG8000浓度分别为0、50、75、100、125、150 g·L-1,每个处理5皿,重复3次。3个月后观察出胚情况。
1.5 AC对抗性黑松体胚发育成熟的影响将抗性黑松#1337胚性细胞转接在以DCR基本培养基,添加麦芽糖30 g·L-1、肌醇1 g·L-1、ABA 20 mg·L-1、谷氨酰胺1.5 g·L-1、130 g·L-1 PEG8000、500 mg·L-1水解酪蛋白、250 mg·L-1 2-(N-吗啡啉)乙磺酸、琼脂8 g·L-1,活性炭(AC)浓度分别为1、2、3 g·L-1的成熟培养基上,每个处理5皿,重复3次。3个月后观察体胚发育情况。
1.6 凝固剂对抗性黑松体胚发育成熟的影响采用琼脂和植物凝胶2种凝固剂,以相应的浓度(琼脂6、8、10、12 g·L-1,植物凝胶2、2.5、3、3.5 g·L-1)添加到设计的培养基中,另外添加麦芽糖30 g·L-1、肌醇1 g·L-1、谷氨酰胺1.5 g·L-1、500 mg·L-1水解酪蛋白、250 mg·L-1 2-(N-吗啡啉)乙磺酸、ABA 20 mg·L-1、PEG130 g·L-1,每个处理5皿,重复3次。3个月后观察体胚发育情况。
1.7 麦芽糖、ABA、PEG8000互作对抗性黑松体胚发育成熟的影响选择麦芽糖、ABA、PEG 3个浓度,采用L9(34)的正交试验设计进行试验(表 1)。将ESM转接至设计的培养基中,每个处理5皿,重复3次,3个月后观察体胚发育情况。所有培养基在灭菌前pH值调至5.8,高压灭菌(121 ℃、20 min)。
|
|
成熟阶段的培养条件采用培养温度25(±1) ℃,光照强度36 μmol·m-2s-1,光照16 h,黑暗8 h。出胚数为每个皮氏培养皿体细胞胚个数,数据采用Excel处理,用SPSS软件进行方差分析和差异显著性检验。
2 结果与分析 2.1 糖浓度对抗性黑松体胚发育成熟的影响如表 2所示:抗性黑松体细胞胚的成熟培养基中, 添加30 g·L-1麦芽糖时,成熟培养基上获得体细胞胚数量少,体细胞胚瘦弱,颜色白,基部呈半透明聚拢状态;添加45 g·L-1麦芽糖,成熟体细胞胚数量最多,体细胞胚发育正常,形成结构完整的体细胞胚;麦芽糖60 g·L-1时,成熟体胚,数量减少,长度较短,子叶明显可见,但胚轴短。部分培养皿里出现无胚轴发育的畸形体细胞胚,可见麦芽糖是影响体胚发育成熟的重要因素。
|
|
由图 1可知:成熟培养基中不添加ABA时,胚性细胞不能形成体细胞胚。当ABA浓度为5~20 mg·L-1时,随着ABA浓度的增加,体细胞胚数量显著增加。ABA浓度为20 mg·L-1,成熟培养基中观察到体细胞胚数量最多。当ABA浓度为30 mg·L-1时,成熟培养基中体细胞胚数量与ABA 20 mg·L-1时无显著变化。当ABA浓度为50 mg·L-1时,成熟培养基中体细胞胚数量较ABA 20 mg·L-1显著降低。因此,体胚发育成熟ABA浓度适宜保持在20~30 mg·L-1。
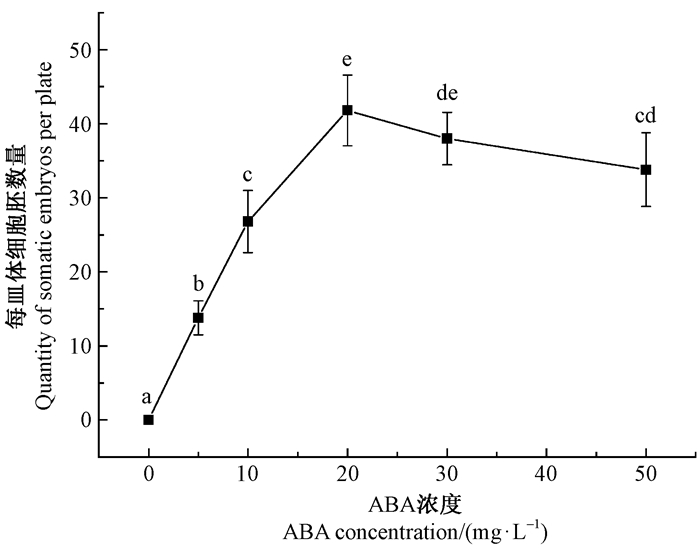
|
图 1 ABA浓度对抗性黑松体胚发育成熟的影响 Fig. 1 Somatic embryos maturation in various concentration of ABA |
PEG8000对抗性黑松体细胞胚发生的影响显著。在不添加PEG8000的成熟培养基上, 没有获得体细胞胚。PEG8000浓度50 ~125 g·L-1时,胚性细胞产生体细胞胚数量随着浓度的增加而显著增加,PEG8000浓度为125 g·L-1,成熟培养基上获得体细胞胚数量最多;浓度增至150 g·L-1时,体细胞胚数量明显减少(图 2)。因此,PEG浓度125 g·L-1为体细胞胚发育成熟的最佳浓度。

|
图 2 PEG8000浓度对抗性黑松体胚发育成熟的影响 Fig. 2 Somatic embryos maturation in various concentration of PEG8000 |
抗性黑松体细胞胚的成熟培养基中当AC浓度为1 g·L-1时,抗性黑松ESM在成熟培养基中能明显增殖, 但胚性细胞向成熟发育阶段转化的少,形成体细胞胚数量较少;当AC浓度为2 g·L-1时,活性炭在培养基中均匀分散,在培养早期ESM在成熟培养基中也能增殖, 其后胚性细胞向成熟发育阶段转化的较多,形成体细胞胚数量较多,且结构完整、发育正常;当AC浓度为3 g·L-1时,成熟培养基颜色明显加深,较少ESM在成熟培养基上增殖,胚性细胞向成熟阶段转化的少,形成体细胞胚数量少,且形成的体细胞胚大多数发育到柱状胚阶段后不再继续发育,出现明显的体胚发育停滞阶段(图 3)。由此可见,在抗性黑松体胚发育成熟阶段,较适宜的AC浓度为2 g·L-1。

|
图 3 AC浓度对抗性黑松体胚发育成熟的影响 Fig. 3 Effect of AC concentration on somatic embryos maturation of P.thunbergii A: AC 1 g·L-1;B: AC 2 g·L-1;C: AC 3 g·L-1 |
研究发现(表 3):添加低浓度琼脂,成熟培养基都不能凝固,胚性细胞无法生长,也无体细胞胚形成。当琼脂浓度增加至10 g·L-1时,成熟培养基底部凝固,但表面不凝固。当琼脂浓度增加至12 g·L-1时,培养基仍不能完全凝固,胚性细胞在添加琼脂的成熟培养基上衰亡,无体细胞胚形成。更换培养基凝固剂为植物凝胶,浓度2 g·L-1时,培养基凝固,表面偏软,胚性细胞产生体细胞胚。当植物凝胶浓度增为3 g·L-1时,成熟培养上获得的体细胞胚多,结构发育完整。当植物凝胶浓度为3.5 g·L-1,成熟培养基凝固、表面偏硬。胚性细胞在成熟培养基上生长1周,可见细胞表面颜色变白、干燥,3个月后体胚发育至子叶胚前期停滞,不能正常发育。因此,在抗性黑松体胚发育成熟阶段宜选用植物凝胶的浓度为3 g·L-1。
|
|
将抗性黑松#1337、#1537及#1637胚性细胞转接在麦芽糖、ABA、PEG8000组合(表 4)的成熟培养基上,培养3个月,观察和统计体胚发育成熟状况。研究发现抗性黑松不同胚性细胞系在9种不同培养基中体胚的数量和形态存在一定差异(表 4)。组合不一,效果也不一。3个胚性细胞系中#1537产生体细胞胚数量最多,#1637次之,#1337产生体细胞胚数量最少。这说明抗性黑松胚性细胞产生体细胞胚存在明显的遗传差异。在设计的9种成熟培养基组合中,胚性细胞产生体细胞胚最多的成熟培养基组合为麦芽糖45 g·L-1、ABA 10 mg·L-1、PEG8000 125 g·L-1。对3个胚性细胞系在适宜的成熟培养基中获得的体细胞胚数量进行方差分析(表 5)可知,PEG8000和ABA对胚性细胞#1337产生体细胞胚有极显著影响,且PEG8000与ABA的交互作用以及PEG8000、ABA、麦芽糖3因素的交互作用均对胚性细胞#1337产生体细胞胚有极显著影响。而麦芽糖、麦芽糖与ABA的交互作用对胚性细胞系#1337产生体细胞胚有显著影响。在胚性细胞系#1537及#1637中,麦芽糖、ABA和PEG8000以及3因素之间的交互作用均对产生体细胞胚有极显著影响。
|
|
|
|
对抗性黑松各无性系产生体细胞胚数量进行极差分析(表 6),结果表明,在不同的麦芽糖、ABA和PEG组合中,不同无性系生产体细胞胚数量呈现出不同的变化趋势:胚性细胞系#1337,麦芽糖在P2水平(45 g·L-1)极差最大,而ABA和PEG在P1(分别为10 mg·L-1和125 g·L-1)水平极差最大。说明胚性细胞系#1337最佳的组合为麦芽糖45 g·L-1 + ABA 10 mg·L-1 + PEG 125 g·L-1;胚性细胞系#1537和#1637,麦芽糖、ABA和PEG都在P1(分别为30 g·L-1、10 mg·L-1和125 g·L-1)水平极差最大。说明#1537和#1637最佳的组合为麦芽糖30 g·L-1+ ABA 10 mg·L-1 + PEG 125 g·L-1;在3个无性系中PEG均为胚性细胞产生体细胞胚的主要影响因子,对抗性黑松体细胞胚发育成熟的影响最大。
|
|
胚性细胞转变为体细胞胚是一个复杂的过程,受多种因素的影响,在离体培养条件下,应尽量保持与合子胚发育相似的环境,以提高成熟体细胞胚的数量和质量。提高蔗糖浓度或用甘露醇或山梨醇代替部分蔗糖可促进体细胞胚成熟(Roberts et al., 1991)。陈金慧(2003)认为,用蔗糖作渗透剂对胚性细胞系的伤害较小;而火炬松(Pinus taeda)和高加索冷杉(Abies nordmanniana)在体胚发育成熟培养时,用麦芽糖代替蔗糖却取得较好的效果(Laine et al., 1990;Nagmani et al., 1993)。华北落叶松(Larix principis-rupprechtii)在体胚发育成熟培养时,以麦芽糖代替蔗糖能有效地提高其体细胞胚成熟频率和生根转植株率(齐力旺等,2004)。本研究发现,在抗性黑松体细胞胚发育成熟培养基中,麦芽糖具有重要作用。添加45 g·L-1麦芽糖,获得的成熟体细胞胚数量最多,继续增加麦芽糖浓度至60 g·L-1,体细胞胚出现胚头膨大、胚柄短小或不发育的畸形体细胞胚。说明抗性黑松体细胞胚成熟培养基中麦芽糖较适宜浓度为45 g·L-1。ABA的作用主要是防止裂生多胚(cleavage polyembryos),促进胚胎单个胚分化并发育成熟。Jain等(1989)发现了裸子植物的种子发育过程中有内源ABA水平的变化,并发现发育中种子的内源ABA水平高于体细胞胚。Roberts(1991)认为ABA可以防止多胚产生和抑制体胚早熟萌发。不同树种以及同一树种的不同基因型之间,在诱导体细胞胚成熟时所需的ABA浓度有很大的不同,红云杉(Picea rubens)需要相对较高的外源ABA(10~50 μmol·L-1)来维持正常的发育,抑制其早熟萌发(Harry et al.,1991);而白云杉(Picea glauca)和黑云杉(Picea mariana)体细胞胚的生长则需较低浓度的ABA(4.4~15 μmol·L-1)(Attree et al., 1991;Dong et al., 1997)。本研究发现ABA浓度20 mg·L-1时抗性黑松体胚细胞数量最多,且体胚生长良好,胚头胚柄结构发育完整。
松属树种的体细胞胚发生研究中发现,体细胞胚发育成熟都需要经过一段时间的高渗培养(Stasolla et al., 2003)。一定浓度的PEG可产生一种与干旱条件下相似的水分胁迫,降低体细胞胚的含水量,促进体细胞胚成熟(崔凯荣等,2000)。Lipavská等(2000)在对挪威云杉(Picea abies)体细胞胚成熟过程中碳水化合物状况的研究中发现,添加PEG可以改变体胚中可溶性糖含量的变化,进而影响体胚的发育。本研究发现抗性黑松体细胞胚发育成熟过程中PEG8000对胚性细胞产胚的影响显著。在不添加PEG8000的成熟培养基上, 没有获得体细胞胚。PEG8000浓度为125 g·L-1时成熟培养基上获得体细胞胚数量最多。
活性炭的作用主要是吸附代谢废物和残留激素,为体细胞胚发育提供更加合适的环境。Gupta等(1985)的研究发现在含有ABA的分化培养基中加入活性炭, 有改善体细胞顶端分生组织发育的作用,使其发育更加接近合子胚。Pullman等(2003)在花旗松(Pseudotsuga menziesii)体细胞胚发生的研究中,添加AC浓度为2.5 g·L-1能促进体胚的形成。Gupta等(2008)在研究针叶树体细胞胚发生时也发现培养基中添加2.5 g·L-1的AC对体细胞胚成熟有利。黄健秋等(1995)研究发现马尾松(P. massoniana)体细胞胚发生植株再生时1 g·L-1 AC与ABA同时使用可促进子叶胚的形成。而吴丽君(2008)在研究湿地松(P. elliottii)体细胞胚发生时则先用含3 g·L-1 AC的无激素培养基进行成熟预培养,然后再转入成熟培养基,但后期没有获得体细胞胚。本研究发现在抗性黑松体细胞胚成熟培养基中添加2 g·L-1AC时,胚性细胞形成体细胞胚数量较多,且结构完整,发育正常。
凝固剂使培养基具有支撑作用,其种类、含量等影响培养基结构及植物对营养的吸收。许多研究表明,植物凝胶对植物胚性愈伤组织的诱导效果显著,总体诱导效果优于琼脂(王贺飞等,2006;张巧等,2010)。长期以来,植物组织培养中一直用琼脂作为凝固剂,44 ℃以下呈凝固状。但琼脂往往含有许多杂质,对培养物会产生复杂的影响。植物凝胶是一类新的凝固剂,在植物组织培养中具有通气性好、凝固温度高、含杂质少等优点(张巧等,2010)。先前的研究发现成熟培养基添加100 g·L-1PEG6000时,即使琼脂浓度增加到40 g·L-1也不能使培养基凝固(程方,2010)。梁素婷(2013)在研究马尾松体细胞胚发生时发现8 g·L-1的琼脂最适合其体细胞胚的成熟培养,继续增大琼脂浓度,会引起细胞失水直至死亡。本研究发现成熟培养基添加100 g·L-1PEG8000时, 琼脂凝固剂培养基均不能凝固,改用2 g·L-1植物凝胶培养基开始凝固。植物凝胶为3 g·L-1时,成熟培养基获得的体细胞胚最多。由此可见,琼脂不适合作为抗性黑松体细胞胚成熟培养的凝固剂,植物凝胶是体细胞胚发育成熟较适宜的培养基凝固剂。
唐巍等(1997)发现在附加4 mg·L-1 ABA和75 g·L-1 PEG的LP培养基上,湿地松早期原胚发育形成粗壮的子叶胚。吴丽君(2009)在湿地松体细胞胚成熟时添加PEG为20%,但并未获得成熟的体细胞胚。程方(2010)对湿地松体细胞胚成熟进行研究,并成功获得体细胞胚,研究发现ABA和PEG互作对湿地松体细胞胚成熟的影响很大,10 mg·L-1ABA、50 g·L-1PEG6000是获得湿地松体细胞胚最佳组合。本研究发现体细胞胚发育成熟阶段各无性系间存在一定的差异。胚性细胞系#1337体细胞胚发育成熟的最佳组合为麦芽糖45 g·L-1 + ABA 10 mg·L-1 + PEG 125 g·L-1;胚性细胞系#1537和#1 637发育成熟最佳的组合为麦芽糖30 g·L-1 + ABA 10 mg·L-1 + PEG 125 g·L-1;PEG8000对抗性黑松各无性系体细胞胚发育成熟的影响最大;PEG8000和ABA对胚性细胞系#1337、#1537和#1637体胚发育成熟均具有极显著影响。而麦芽糖对胚性细胞系#1337产生体细胞胚有显著影响。
4 结论抗性黑松体胚发育成熟过程中,麦芽糖45 g·L-1、ABA 20~30 mg·L-1、PEG8000 125 g·L-1、AC 2 g·L-1和植物凝胶3 g·L-1对体细胞胚成熟都具促进作用。30 g·L-1麦芽糖、10 mg·L-1ABA、125 g·L-1PEG为抗性黑松体胚发育成熟的最佳组合。
陈金慧, 施季森, 诸葛强, 等. 2003. 杂交鹅掌楸体细胞胚胎发生研究. 林业科学, 39(4): 49-53. (Chen J H, Shi J S, Zhuge Q, et al. 2003. Studies on the somatic embryogenesis of liriodendron hybrids(L.chinense×L.tulipifera).. Scientia Silvae Sinicae, 39(4): 49-53. DOI:10.3321/j.issn:1001-7488.2003.04.008 [in Chinese]) |
程方. 2010.抗性湿地松组培技术研究及再生植株性状评价.南京: 南京林业大学硕士学位论文. (Cheng F. 2010. Study on the tissue culture technology of resistance to slash pine and evaluation of regeneration plant traits. Nanjing: MS thesis of Nanjing Forestry University.[in Chinese]) |
崔凯荣, 邢更生, 周功克, 等. 2000. 植物激素对体细胞胚胎发生的诱导与调节. 遗传, 22(5): 349-354. (Cui K R, Xin G S, Zhou G K, et al. 2000. The induced and regulatory effects of plant hormones in somaitc embryogenesis. Hereditas, 22(5): 349-354. DOI:10.3321/j.issn:0253-9772.2000.05.023 [in Chinese]) |
黄健秋, 卫志明, 许智宏. 1995. 马尾松成熟合子胚的体细胞胚胎发生和植株再生. 植物学报, 37(4): 289-294. (Huang J Q, Wei Z M, Xu Z H. 1995. Somatic embryogenesis and plantlet regeneration from callus of mature zygotic embryos of masson pine. Acta Botanica Sinica, 37(4): 289-294. [in Chinese]) |
梁素婷. 2013.抗病马尾松器官发生植株再生与体胚发生研究.南京: 南京林业大学硕士学位论文. (Liang S T. 2013. Study on plant regeneration by organogenesis and somatic embryogenesis in resistance masson pine. Nanjing: MS thesis of Nanjing Forestry University.[in Chinese]) |
林丽, 周蕾, 潘珺, 等. 2017. 无菌和带菌松材线虫对赤松的致病性. 林业科学, 53(5): 82-87. (Lin L, Zhou L, Pan J, et al. 2017. Pathogenicity of aseptic and germ-carrying Bursaphelenchus xylophilus on Pinus densiflora.. Scientia Silvae Sinicae, 53(5): 82-87. [in Chinese]) |
齐力旺, 韩一凡, 韩素英, 等. 2004. 麦芽糖、NAA及ABA对华北落叶松体细胞胚成熟及生根的影响. 林业科学, 40(1): 52-58. (Qi L W, Han Y F, Han S Y, et al. 2004. Effects on maltose, NAA and ABA on somatic maturation and radicle rooting of Larix principis-rupprechtii.. Scientia Silvae Sinicae, 40(1): 52-58. [in Chinese]) |
孙婷玉. 2014.抗性黑松体胚发生及低温保存技术.南京: 南京林业大学硕士学位论文. (Sun T Y. 2014. Somatic embryogenesis and cryopreservation method of Pinus thunbergii resistant to Bursaphelenchus xylophilus. Nanjing: MS thesis of Nanjing Forestry University.[in Chinese]) |
孙婷玉, 叶建仁, 吴小芹, 等. 2015. 抗松材线虫病黑松胚性愈伤组织诱导. 东北林业大学学报, 9(9): 96-99. (Sun T Y, Ye J R, Wu X Q, et al. 2015. Induction of embryonic callus from Pinus thunbergii resistance to pine wilt disease. Journal of Northeast Forestry University, 9: 96-99. DOI:10.3969/j.issn.1000-5382.2015.09.019 [in Chinese]) |
唐巍, 欧阳藩, 郭仲琛. 1988. 火炬松合子胚愈伤组织的器官发生和植株再生. 实验生物学报, 31(1): 87-93. (Tang W, Ouyang F, Guo Z C. 1988. Organogenesis and plant regeneration of zygotic embryo in loblolly pine (Pinus taeda L.). Acta Biologiae Experimentalis Sinica, 31(1): 87-93. [in Chinese]) |
唐巍, 欧阳藩, 郭仲琛. 1997. 湿地松体细胞胚胎发生和植株再生. 植物资源与环境, 6(2): 8-11. (Tang W, Ouyang F, Guo Z C. 1997. Plantlet regeneration via somatic embryogenesis in Slash pine. Journal of Plant Resources and Environment, 6(2): 8-11. [in Chinese]) |
王贺飞, 柴明良. 2006. 4种固化剂对若干草坪草愈伤组织诱导的影响. 园艺学报, 3(2): 437-440. (Wang H F, Chai M L. 2006. Effect of four brands of gelling agents on callus induction from mature seeds of several turfgrass species. Acta Horticulturae Sinica, 3(2): 437-440. DOI:10.3321/j.issn:0513-353X.2006.02.048 [in Chinese]) |
吴丽君. 2009. 湿地松合子胚发育与体胚诱导的研究. 福建林学院学报, 29(3): 243-246. (Wu L J. 2009. Study on development course of zygotic embryos and initiation of somatic embryos of Slash pine. Journal of Fujian College of Forestry, 29(3): 243-246. DOI:10.3969/j.issn.1001-389X.2009.03.010 [in Chinese]) |
吴小芹, 张艺, 谢小桃, 等. 2009. 外生菌根菌对抗性抗性黑松和赤松不同家系生长影响. 林业工程学报, 23(1): 19-22. (Wu X Q, Zhang Y, Xie X T, et al. 2009. Effect of ectomycorrhizal fungi (EMF) on growth of the Pinus densiflora and P.thunbergii family trees resistant-Bursaphelenchus xylophilus.. Journal of Forestry Engineering, 23(1): 19-22. [in Chinese]) |
叶建仁. 2010. 松材线虫病诊断与防治技术. 北京: 中国林业出版社. (Ye J R. 2010. Techlonogy of diagnosis and treatment of pine wilt disease. Beijing: China Forestry Publishing House. [in Chinese]) |
张巧, 汪静儿, 林君, 等. 2010. 不同凝固剂对陆地棉体细胞胚胎发生和植株再生的影响. 棉花学报, 22(1): 3-9. (Zhang Q, Wang J E, Lin J, et al. 2010. Effects of different gelling agents on the somatic embryogenesis and plant regeneration in upland cotton. Cotton Science, 22(1): 3-9. DOI:10.3969/j.issn.1002-7807.2010.01.001 [in Chinese]) |
赵捷, 韩骁, 石娟. 2017. 低温条件下松材线虫在中国的风险分布区预测. 生物安全学报, 26(3): 191-198. (Zhao J, Han X, Shi J. 2017. Potential distribution of Bursaphelenchus xylophilus in China due to adaptation cold conditions. Journal of Biosafety, 26(3): 191-198. DOI:10.3969/j.issn.2095-1787.2017.03.003 [in Chinese]) |
Attree S M, Moore D, Sawhney V K. 1991. Enhance maturation and desiccation tolerance of white spruce somatic embryos:effect of a non-plasmolyzing water stress and abscisic acid. Annals of Botany, 68(6): 519-525. DOI:10.1093/oxfordjournals.aob.a088291 |
Bozhkov M R, Nagmani R. 2002. Initiation of embryogenic culture and somatic embryo development in loblolly pine. Canadian Journal of Forestry Research, 20(6): 810-817. |
Dong J Z, Perras M R, Abrams S R, et al. 1997. Gene expression patterns and uptake and fate of fed ABA in white spruce somatic embryo tissues during maturation. Journal of Experimental Botany, 48(307): 277-287. |
Gupta P K, Diane H, Bonnie L. 2008. Methods for producing cotyledonary pine embryos utilizing a gibberellin. United States, Patent7381562B2.
|
Gupta P K, Durzan D J. 1985. Shoot multiplication from mature trees of Douglas-fir (Pseudotsuga menziesii) and sugar pine (Pinus lambertiana). Plant Cell Report, 4(4): 177-179. DOI:10.1007/BF00269282 |
Harry I S, Thorpe T A. 1991. Somatic embryogenesis and plant regeneration from mature zygotic embryos of red spruce. Botanical Gazette, 152(4): 446-452. DOI:10.1086/337905 |
Jain S M, Dong N, Newton R J. 1989. Somatic embryogenesis in slash pine from immature embryos cultured in vitro.. Plant Science, 65(2): 233-241. DOI:10.1016/0168-9452(89)90070-8 |
Laine E, David A. 1990. Somatic embryogenesis in immature embryos and protoplasts of Pinus caribaea.. Plant Science, 69(2): 215-224. DOI:10.1016/0168-9452(90)90120-D |
Lipavská H, Svobodová H, Albrechtová J, et al. 2000. Carbohydrate status during somatic embryo maturation in Norway spruce. In Vitro Cellular and Developmental Biology-Plant, 36(4): 260-267. DOI:10.1007/s11627-000-0048-9 |
Nagmani R, Diner A M, Sharma G C. 1993. Somatic embryogenesis in longleaf pine (Pinus palustris). Canadian Journal of Forestry Research, 23(23): 873-876. |
Pullman G S, Zhang Y, Phan B H. 2003. Brassinolide improves embryogenic tissue initiation in conifers and rice. Plant Cell Reports, 22(2): 96-104. DOI:10.1007/s00299-003-0674-x |
Roberts D R. 1991. Abscisic acid and mannitol promote early development, maturation and storage protein accumulation in somatic embryos of interior spruce. Physiologia Plantarum, 83(2): 247-254. DOI:10.1111/ppl.1991.83.issue-2 |
Stasolla C, van Z L, Egertsdotter U, et al. 2003. The effects of polyethylene glycol on gene expression of developing White Spruce somatic embryos. Plant Physiology, 131(1): 49-60. DOI:10.1104/pp.015214 |
Uddin R M. 1993. Somatic embryogenesis in gymnosperms. United States, Patent 5187092.
|
 2019, Vol. 55
2019, Vol. 55

