文章信息
- 刘俊祥, 于永畅, 郎蓬蓬, 孙振元.
- Liu Junxiang, Yu Yongchang, Lang Pengpeng, Sun Zhenyuan.
- 旱柳枝条叶绿体光化学特征的径向异质性
- Radical Heterogeneity of Photochemical Characteristics of Chloroplasts in Current-year Twigs of Salix matsudana
- 林业科学, 2019, 55(3): 36-42.
- Scientia Silvae Sinicae, 2019, 55(3): 36-42.
- DOI: 10.11707/j.1001-7488.20190304
-
文章历史
- 收稿日期:2018-01-18
- 修回日期:2018-04-10
-
作者相关文章
木本植物枝条中的叶绿体能将线粒体呼吸释放和木质部蒸腾流中扩散的CO2回收固定,虽其光合速率不及叶片的十分之一,但对于本植物特别是落叶树种的生长、防御、生殖和生存至关重要(Cernusak et al., 2015; Pfanz et al., 2002)。木本植物幼嫩枝条可将大部分呼吸释放的CO2回收,增加植株的碳收益,维持植株的碳平衡(Wittmann et al., 2001; 2006; Damesin, 2003; Berveiller et al., 2007);光合释放的氧气对避免枝条内部的缺氧症起决定作用(Wittmann et al., 2014);在叶片光合受阻或叶片脱落期间,枝条光合产生的同化物和同化力为木本植物的生存延续提供物质和能量的保障(Eylesa et al., 2009)。枝条叶绿体分布在树皮中的活组织,包括栓内层、皮层、韧皮部、形成层等(Berveiller et al., 2007),在木质部的木薄壁组织甚至髓心中仍可发现有叶绿体(Dima et al., 2006; Berveiller et al., 2007; Yiotis et al., 2009)。
经树皮对光的反射、吸收,仅部分绿光、红光能够透射到枝条内部,其光强沿枝条的径向衰减(Wittmann et al., 2015)。叶绿体的发育、光合色素的合成均受光的调控,枝条内部组织空间光环境的差异决定了叶绿体结构和功能的组织特异性。目前,关于枝条光合对不同器官碳积累的贡献及其在逆境下生理作用的研究较多(Eylesa et al., 2009; Saveyn et al., 2010; Schmitz et al., 2012; Vandegehuchte et al., 2015),而枝条叶绿体的光化学特征及其组织特异性还少有相关报道。
旱柳(Salix matsudana)是我国北方地区重要的速生用材、园林绿化和水土保持树种,栽培分布广,生态适应性强。旱柳幼嫩枝条四季常绿,枝条中绿色光合细胞丰富,由表皮至髓心均可检测到叶绿素荧光信号(刘俊祥等, 2018),是研究枝条光合作用的典型落叶树种。因此,本研究拟明确旱柳当年生枝条光合-光响应特性,阐明枝条组织间光合色素组成和光能转化效率的差异,解析枝条叶绿体光化学特征的组织特异性,以期确定不同组织对枝条光合碳同化的贡献,揭示叶绿体光化学特性对枝条内异质性光环境的响应与适应机制,为探索光环境变化下叶绿体结构、功能的特化提供理论依据。
1 材料与方法 1.1 材料培养与实验设计2014年春季,从中国林业科学研究院内的1株旱柳成年雌株(胸径42 cm,树高约15 m)树冠上选取直径1.5(±0.5) cm的1年生枝条,剪成15 cm长的插穗,露地扦插培养,株行距1.5 m×2 m,最外侧设置为保护行,常规养护管理。2016年7月,从保护行内的30株旱柳无性系随机选3株,在其南向1.5 m高度处取长度为70(±10) cm的当年生枝条,1株用于原位测定枝条的暗呼吸速率和光合-光响应曲线;将第2株的枝条分为树皮、木质部和髓心3部分,测定不同组织的光合色素含量;在第3株枝条中部截取0.2 cm厚的横切片,测定不同光强下的实际光化学效率和相对电子传递速率。重复随机取样6次。
1.2 试验方法 1.2.1 枝条光合-光响应曲线的测定为避免伤呼吸对枝条气体交换参数结果的影响,在测定的前1周将待选植株当年生枝条中部15 cm长枝段上的叶片去除。在晴天上午9:00—11:00,应用配以6400-22 L可控光簇状叶室和6400-18RGB光源的便携式光合仪Li-6400 (Licor, 美国)测定无叶片中部枝条的暗呼吸速率(Rd)和光响应曲线。设定叶室温度为25 ℃,相对湿度70%,CO2浓度450 μmol ·mol-1,光质为9 :1的红蓝光。将枝条夹在叶室内暗适应30 min以上,测定暗呼吸速率后打开200 μmol ·m-2s-1的活化光,活化20 min后在1 500、1 200、1 000、800、600、400、200、100、80、50和20 μmol ·m-2s-1的光强梯度下测定枝条的CO2释放速率(Rl),按照公式(1)计算不同光强下枝条的光合速率(A);按照公式(2)计算枝条光合对呼吸释放CO2的再固定率(Refixationrate, Rf)。
| $ A=\left| {{R}_{\text{d}}}-{{R}_{\text{l}}} \right|, $ | (1) |
| $ {{R}_{\text{f}}}=A/{{R}_{\text{d}}}。$ | (2) |
取树皮、木质部、髓心组织鲜样,称质量、去离子水清洗、滤纸吸干后用液氮充分研磨,加入80%丙酮10 mL于黑暗中浸提至沉淀为白色,2 000 g离心10 min后将上清液用80%丙酮定容,依据高俊凤的方法(2006)测定光合色素的浓度(mg ·L-1)。测定树皮、木质部和髓心的绝对含水量(gH2O ·gDW-1),根据取样鲜质量换算组织样本的干质量,以干质量计算不同组织样本光合色素的含量(mg ·gDW-1)。
1.2.3 枝条横切片PSⅡ最大光化学效率和实际光化学效率的测定参考Wittmann等(2016)的方法,应用Imaging PAM叶绿素荧光仪(Walz,德国)测定枝条横切片的最大光化学效率和不同光强下的实际光化学效率及相对电子传递速率。
1) 吸光系数(Abs, absorptivity)的测定应用Mini探头,根据在红光和近红外光照射下枝条横切面成像像素的差异,按照公式(3)计算不同组织的吸光系数。
| $ \text{Abs}=1-(R/\text{NIR})。$ | (3) |
式中,Abs为吸光系数;R为照射红光后的成像像素; NIR为照射近红外光后的成像像素。
2) 光化学效率和电子传递速率的测定将枝条横切片用湿润的滤纸包裹,暗适应30 min后置于Imaging PAM的Micro探头上,测定初始荧光FO和最大荧光FM。
Wittmann等(2016)的研究结果表明,光强小于54 μmol ·m-2s-1时不会发生枝条皮层组织叶绿体电子传递的光抑制,本试验以54 μmol ·m-2s-1为中位光照强度,设置荧光-光响应曲线的光强梯度为3、17、30、54、78、113、153 μmol ·m-2s-1,在每一光强下活化2 min,测定不同光强下横切片的稳态荧光(FS)和光下最大荧光(FM′)。测试期间在枝条横切片上表面覆盖湿润的滤纸,防止切片脱水。
应用Imaging Win v2.3.2软件在枝条横切面建立树皮、木质部和髓心的选区(AOI, area of interesting),读取不同组织的FO和FM,FS和FM′的观测值,按照公式(4)、(5)和(6)计算不同组织的最大光化学效率(FV/FM, maximum photochemical efficiency)、实际光化学效率(ΦPSⅡ, effectively photochemical activity)和相对电子传递速率(rETR, relative electron transport rate)。
| $ {{F}_{\text{V}}}/{{F}_{\text{M}}}=\left({{F}_{\text{M}}}-{{F}_{\text{O}}} \right)/\text{ }{{F}_{\text{M}}};$ | (4) |
| $ {{\mathit{\Phi }}_{PS Ⅱ}}=\left({{F}_{\text{M}}}^{\prime }-\text{ }{{F}_{\text{S}}} \right)/\text{ }{{F}_{\text{M}}}^{\prime };$ | (5) |
| $ \text{rETR}=\text{PAR}\times \text{Abs}\times 0.5\times {{\mathit{\Phi }}_{\text{PSⅡ}}}。$ | (6) |
用SigmaPlot10.0软件整理试验数据并绘图。应用SPSS19.0软件的单因素方差分析结合Tukey多重比较在0.05水平上检验不同处理间的差异显著性。
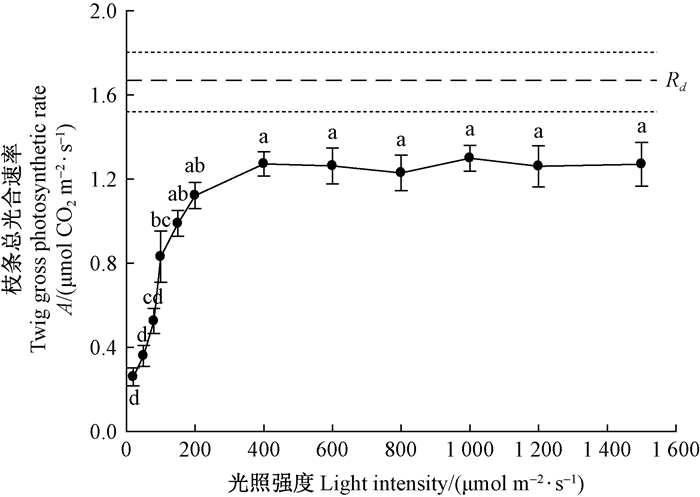
2 结果与分析 2.1 旱柳当年生枝条光合速率的光响应由图 1可知,旱柳当年生枝条的暗呼吸速率为1.66 μmolCO2 ·m-2s-1。在20~400 μmol ·m-2s-1的光照强度范围内,旱柳当年生枝条的光合速率随光合有效辐射强度的增加显著升高。当光强超过400 μmol ·m-2s-1时,枝条的光合速率趋于稳定,在400~1 500 μmol ·m-2s-1范围内枝条的光合速率无显著变化。由此可知,旱柳当年生枝条的光饱和点约为400 μmol ·m-2s-1。饱和光强下旱柳当年生枝条的光合速率可达到1.27 μmolCO2 ·m-2s-1,能将暗呼吸释放CO2(1.66 μmolCO2 ·m-2s-1)的77%固定回收。
|
图 1 旱柳当年生枝条的光合-光响应曲线 Fig. 1 Curve of gross photosynthetic rate response of twig to increasing light intensities 图中数据为均值±标准误,不同光强间的小写字母不同表示差异显著(P < 0.05),虚线表示暗呼吸速率的均值,点画线表示暗呼吸速率的均值±标准误。 Data in the figure were mean ± standard error (SE), the different low case letters between light intensities indicate significant difference at the level of P < 0.05, the dashed and dotted lines represent the mean and mean ±SE values of dark respiration. |
由表 1可知,旱柳枝条的树皮、木质部和髓心中都有叶绿素的分布,不同组织间的叶绿素含量存在显著差异。叶绿素a在树皮中的含量最高,显著高于木质部和髓心。树皮和髓心中的叶绿素b含量无显著差异,但二者均显著高于木质部,分别是木质部的8.38和11.00倍。树皮中的总叶绿素含量是髓心的1.83倍,木质部的15.90倍。叶绿素b与叶绿素a比例呈现出由树皮至髓心显著升高的趋势,髓心中叶绿素b与叶绿素a的比例是树皮的5.08倍。树皮中的类胡萝卜素含量、类胡萝卜素与叶绿素的比例均显著高于木质部,而在髓心中未检测到类胡萝卜素的分布。
|
|
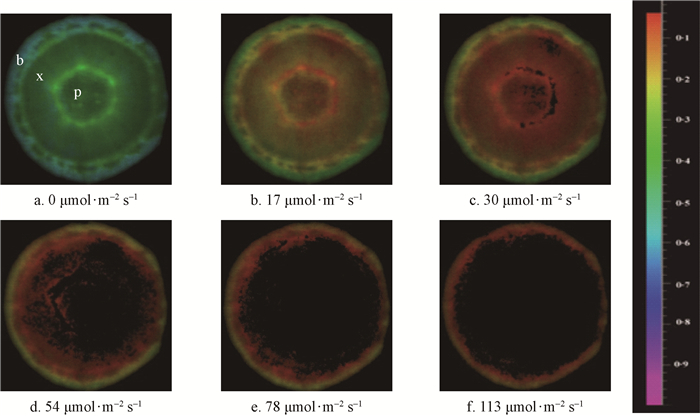
由图 2可知,随着光强的增加,整个横切面光化学效率的成像面积不断缩小,观测值不断降低。在17 μmol ·m-2s-1的活化光下,整个横切面均可检测到实际光化学效率;当光强达到30 μmol ·m-2s-1时,部分髓心的成像消失;光强升至54 μmol ·m-2s-1时,髓心整体消失,木质部仅局部可检测到实际光化学效率信号;光强升至78 μmol ·m-2s-1时,仅剩树皮具有实际光化学效率的成像,当光强继续升高至113 μmol ·m-2s-1时,树皮实际光化学效率的成像面积和观测值进一步随之减少和降低。
|
图 2 不同光强下枝条横切片光化学效率的成像变化 Fig. 2 Changes in photochemical efficiency imaging of twig cross sectionexposed to different light intensities b:树皮Bark;x:木质部Xylem,p:髓心Pith. |
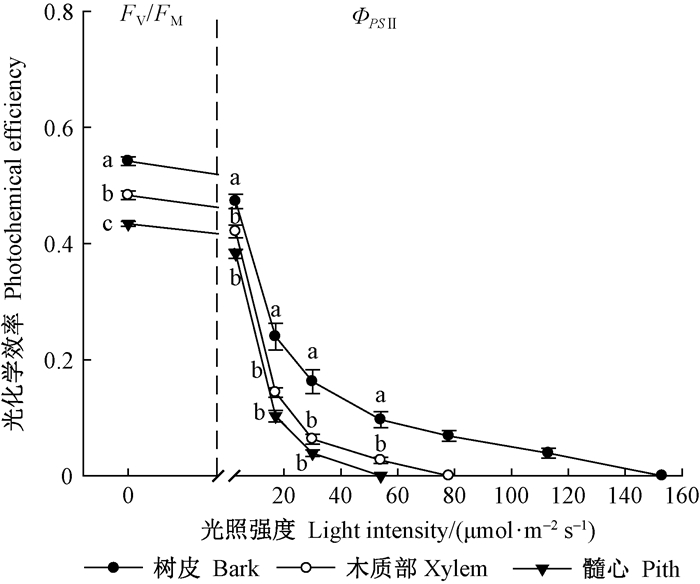
由图 3可知,旱柳当年生枝条不同组织间的最大光化学效率差异显著,呈现出由树皮至髓心显著降低的趋势,树皮的最大光化学效率为0.542,显著高于木质部和髓心。不同组织的实际光化学效率均随着光强的升高而显著降低(P < 0.05),在光强达到54 μmol ·m-2s-1时,髓心的实际光化学效率降为0;光强升至78μmol ·m-2s-1时,木质部的实际光化学效率被完全抑制;树皮叶绿体在光强达到153 μmol ·m-2s-1时,失去了光化学转化能力。不同光强下组织间的实际光化学效率差异显著,在3~113 μmol ·m-2s-1范围内,树皮的实际光化学效率显著高于木质部和髓心。
|
图 3 旱柳枝条横切片树皮、木质部和髓心的最大光化学效率和实际光化学效率 Fig. 3 The Fv/Fm and ΦPSⅡ of bark, xylem and pith in twig cross sections of S.matsudana |
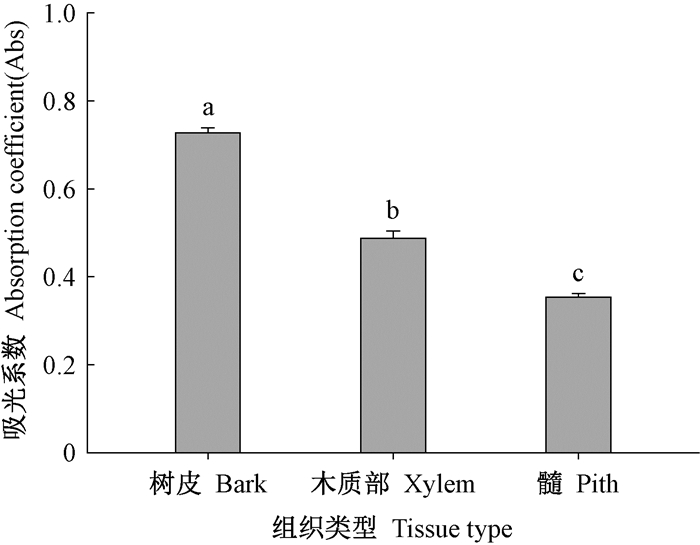
由图 4可知,枝条不同组织间的吸光系数具有显著差异,由表皮至髓心呈显著降低的径向变化趋势。树皮的吸光系数为0.73,分别是木质部和髓心的1.49和2.09倍。
|
图 4 枝条横切片中树皮、木质部和髓心的吸光系数 Fig. 4 The Abs of bark, xylem and pith in twig cross sections |
由图 5可知,随着光强的增加,枝条中不同组织的相对电子传递速率呈先升高后下降的趋势,在3~54 μmol ·m-2s-1的范围内,树皮的相对电子传递速率显著高于木质部和髓心。木质部和髓心的光饱和点出现在17 μmol ·m-2s-1,当光强达到54 μmol ·m-2s-1时,髓心的电子传递被完全抑制,光强升高至78 μmol ·m-2s-1时,木质部的电子传递停止。树皮在78 μmol ·m-2s-1时的电子传递速率最高,至153 μmol ·m-2s-1时电子传递停止。
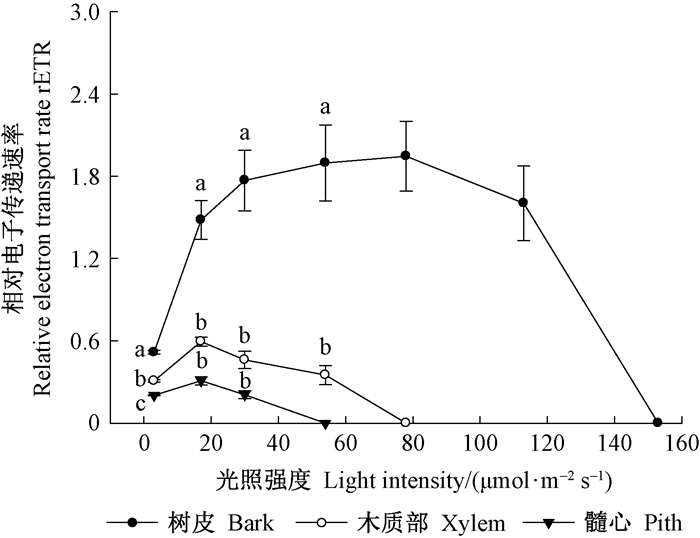
|
图 5 不同光强下枝条横切片中树皮、木质部和髓心的相对电子传递速率 Fig. 5 The rETR of bark, xylem and pith in twig cross sectionsexposed to differentlight intensities |
木本植物枝条光合速率具有物种特异性,但均与其暗呼吸速率呈正相关,大部分树种的总光合速率集中在1~3 μmolCO2 ·m-2s-1的范围内,相对再固定率在73%左右(Wittmann et al., 2001; Aschan et al., 2001; Damesin, 2003)。Berveiller等(2007)对已发表的常绿、落叶树种的当年生枝条总光合速率(y)与暗呼吸速率(x)数据进行回归分析,提出了二者的模拟方程y=0.76x-0.061(r2=0.92;P < 0.01)。饱和光强下旱柳当年生枝条的总光合速率达到1.27 μmolCO2 ·m-2s-1,可将77%呼吸释放的CO2回收固定,与已报道的落叶树种相比具有较高的相对再固定率。
叶绿体光合色素的合成依赖于光的参与。Wittmann等(2015)以4种阔叶树种的当年生枝条为样本研究了枝条内不同组织的光学特性,结果表明透过外树皮约剩余34%的光量子密度可传递至皮层组织,其中红光的透过率最高,蓝光的透过率最低;而透过树皮(外树皮和内树皮)后仅有3%的光可达到木质部,蓝光基本消失,光质以红光为主。在旱柳当年生枝条中,树皮的总叶绿素含量显著高于木质部和髓心,分别是木质部和髓心的15.90和1.83倍,表明树皮中的绿色组织是枝条光合的主要载体。旱柳当年生枝条木质部主要由导管、纤维和木薄壁组织组成,而叶绿体主要分布于射线薄壁细胞和轴向薄壁细胞中,本研究中木质部光合色素含量是以单位木质部干质量衡量的,这可能是导致木质部总叶绿素含量与树皮和髓心不在同一数量级上的原因。尽管在径向方向光不能透过树皮和木质部达到髓心(Wittmann et al., 2015),但在旱柳当年生枝条髓心中仍可检测到叶绿素和光化学活性,说明髓心可接收到光满足叶绿体的发育,这可能与光在茎中的轴向传递有关(Sun et al., 2003;2005)。与总叶绿素含量的径向分布规律不同,叶绿素b与叶绿素a的比例随枝条深度的增加呈显著升高的趋势,较高的叶绿素b比例有利于木质部和髓心中的叶绿体在低光环境下对光能的捕捉和传递(蔡锡安等,2015)。树皮中的类胡萝卜素含量、类胡萝卜素与叶绿素的比例均显著高于木质部,这对于保护树皮绿色光合组织免受光损伤和其他氧化胁迫伤害进而保障枝条光合作用有重要意义(Yang et al., 2002)。
旱柳当年生枝条不同组织的最大光化学效率呈现出由树皮至髓心显著降低的趋势,这与叶绿素的分布规律相同。与最大光化学效率相比,实际光化学效率能直接体现光反应过程中叶绿体的光能转化。本研究的结果表明,树皮绿色组织的实际光化学效率显著高于木质部和髓心。与Wittmann等(2015)的研究结果相一致,即旱柳当年生枝条不同组织的吸光系数与光梯度正相关。由于树皮绿色组织的吸光系数、实际光化学效率和电子传递速率显著高于木质部和髓心,证明树皮绿色组织在枝条光合中充当的主导作用。叶绿体的光化学效率不仅受光合色素组成的影响,还决定于叶绿体的亚细胞器结构。叶绿体的发育受组织微环境光梯度的调控,与枝条皮层组织薄壁细胞中的叶绿体相比,髓和木射线中叶绿体的类囊体数量少,大部分为基质类囊体,很少有基粒类囊体的存在(Buns et al., 1993)。由枝条外皮层到中皮层、内皮层、木质部,叶绿体中基粒的高度和密度逐渐降低(Pfanz et al., 2002)。由于叶绿素含量、类囊体数量及基粒类囊体比例均随着光梯度的降低而减少,介导叶绿体PSII最大光化学效率、实际光化学效率和电子传递速率由树皮到木质部、髓心呈显著下降的趋势。
4 结论枝条光合可将77%呼吸消耗的碳回收固定。不同组织的光合色素和光化学效率呈现随径向深度增加而显著降低的规律,树皮绿色组织是枝条光合的主要载体。树皮绿色组织具有较强的光保护能力,木质部和髓心通过调整光合色素比例最大限度地捕捉组织中有限的光能。
蔡锡安, 曾小平, 陈远其. 2015. 树干皮层光合作用-生理生态功能和测定方法. 生态学报, 35(21): 6909-6922. (Cai X A, Zeng X P, Chen Y Q. 2015. Stem corticular photosynthesis:ecophysiological functions and their measurement. ActaEcologicaSinica, 35(21): 6909-6922. [in Chinese]) |
高俊凤. 2006. 植物生理学实验指导. 北京: 高等教育出版社, 74-77. (Gao J F. 2006. Experimental guidance for plant physiology. Beijng: Higher education press, 74-77. [in Chinese]) |
刘俊祥, 于永畅, 郎蓬蓬, 等. 2018. 旱柳枝条皮层叶绿体的光化学特性及结构的特化. 林业科学, 54(5): 30-35. (Liu J X, Yu Y C, Lang P P, et al. 2018. The photochemical characteristics and structural specialization of cortex chloroplast in twig of Salix matsudana. Scientia Silvae Sinicae, 54(5): 30-35. [in Chinese]) |
Aschan G, Wittmann C, Pfanz H. 2001. Age-dependent bark photosynthesis ofaspen twigs. Trees, 15(7): 431-437. DOI:10.1007/s004680100120 |
Berveiller D, Kierzkowski D, Damesin C. 2007. Interspecific variability of stem photosynthesis among tree species. Tree Physiology, 27(1): 53-61. |
Buns R, Acker G, Beck E. 1993. The plastids of the yew tree (Taxus baccata L.):ultrastructure and immunocytochemical examination of chloroplastic enzymes. Botanica Acta, 106(1): 32-41. DOI:10.1111/plb.1993.106.issue-1 |
Cernusak L A, Cheesman A W. 2015. The benefits of recycling:how photosynthetic bark can increase drought tolerance. New Phytologist, 208(4): 995-997. DOI:10.1111/nph.13723 |
Damesin C. 2003. Respiration and photosynthesis characteristics of current-yearstems of Fagus sylvatica: from the seasonal pattern to an estimation over the year. New Phytologist, 3: 465-475. |
Dima E, Manetas Y, Psaras GK. 2006. Chlorophyll distribution pattern in innerstem tissues:evidence from epifluorescence microscopy and reflectance measurements in 20 woody species. Trees, 20(4): 515-521. DOI:10.1007/s00468-006-0067-1 |
Eylesa A, Pinkard E A, O'Gradyap, et al. 2009. Role of corticular photosynthesis following defoliation in Eucalyptus globulus. Plant, Cell &Environment, 32(8): 1004-1014. |
Pfanz H, Aschan G, Langenfeld-Heyser R, et al. 2002. Ecologyand eco-physiology of tree stems:corticular and wood photosynthesis. Naturwissenschaften, 89(4): 147-162. DOI:10.1007/s00114-002-0309-z |
Saveyn A, Steppe K, Ubierna N, et al. 2010. Woody tissue photosynthesis and its contribution to trunk growth and bud development in young plants. Plant, Cell & Environment, 33(11): 1949-1958. |
Schmitz N, Egerton J, Lovelock C, et al. 2012. Light-dependent maintenance of hydraulic function in mangrove branches:do xylary chloroplasts play a role in embolism repair?. New Phytologist, 195(1): 40-46. DOI:10.1111/j.1469-8137.2012.04187.x |
Sun Q, Yoda K, Suzuki H. 2005. Internal axial light conduction in the stems androots of herbaceous plants. Journal of Experimental Botany, 56(409): 191-203. |
Sun Q, Yoda K, Suzuki M, et al. 2003. Vascular tissue in the stem and roots of woody plants can conduct light. Journal of Experimental Botany, 54(387): 1627-1635. DOI:10.1093/jxb/erg167 |
Vandegehuchte M W, Bloemen J, Vergeynst L L, et al. 2015. Woody tissue photosynthesis in trees:salve on the wounds of drought?. New Phytologist, 208(4): 998-1002. DOI:10.1111/nph.13599 |
Wittmann C, Aschan G, Pfanz H. 2001. Leaf and twig photosynthesis of youngbeech (Fagus sylvatica) and aspen (Populus tremula) trees grown under differentlight intensity regimes. Basic & Applied Ecology, 2(2): 145-154. |
Wittmann C, Pfanz H, Loreto F, et al. 2006. Lightinduced reduction of carbon release from branches of birch trees:corticularphotosynthesis, photorespiration or inhibition of mitochondrial respiration?. Plant, Cell & Environment, 29(6): 1149-1158. |
Wittmann C, Pfanz H. 2014. Bark and woody tissue photosynthesis:a means toavoid hypoxia or anoxia in developing stem tissues. Functional Plant Biology, 41(9): 940-953. DOI:10.1071/FP14046 |
Wittmann C, Pfanz H. 2016. The optical, absorptive and chlorophyll fluorescence properties ofyoung stems of five woody species. Environmental and Experimental Botany, 121: 83-93. DOI:10.1016/j.envexpbot.2015.05.007 |
Yang C W, Peng C L, Duan J, et al. 2002. Responses of chlorophyll fluorescence and carotenoids biosynthesis to high light stress in rice seedling leaves at different leaf position. Acta Botanica Sinica, 44(11): 1303-1308. |
Yiotis C, Petropoulou Y, Manetas Y. 2009. Evidence for light-independent andsteeply decreasing PSⅡ efficiency along twig depth in four tree species. Photosynthetica, 47(2): 223-231. DOI:10.1007/s11099-009-0036-1 |
 2019, Vol. 55
2019, Vol. 55

