文章信息
- 周婧, 杨琦, 李钢, 徐静.
- Zhou Jing, Yang Qi, Li Gang, Xu Jing.
- 红树属植物内生真菌多样性及其代谢产物研究进展
- Advances in Endophytic Fungi Diversity and Secondary Metabolites in Rhizophora Plants
- 林业科学, 2019, 55(1): 89-102.
- Scientia Silvae Sinicae, 2019, 55(1): 89-102.
- DOI: 10.11707/j.1001-7488.20190111
-
文章历史
- 收稿日期:2017-04-20
- 修回日期:2018-08-09
-
作者相关文章
2. 海南大学材料与化工学院 热带岛屿资源先进材料教育部重点实验室 海口 570228
2. Key Laboratory of Advanced Materials of Tropical Island Resources of Ministry of Education College of Materials and Chemical Engineering, Hainan University Haikou 570228
植物内生真菌是栖息在植物内部,尤其是根、茎、叶,但对寄主无明显危害的微生物,几乎所有的维管束植物及禾本科植物体都含有内生真菌(Zhang et al., 2006)。关于内生真菌的研究具有悠久的历史,研究表明,植物内生真菌类群丰富,每种植物至少含有1种内生真菌(Verma et al., 2007)。近20年来,植物内生真菌受到相当大的关注,内生真菌次生代谢产物具有防治植物病虫害、生物抗菌活性、抗肿瘤活性等作用(Azevedo et al., 2000)。内生真菌不完全具有专一性,同一种内生真菌可侵染多种宿主,并且同一种内生真菌可分离于宿主的不同部位(Cohen et al., 2006)。因此,可以选择不同科属植物或在不同环境下的同一种植物作为分离内生真菌的研究对象(Jalgaonwala et al., 2011)。内生真菌和宿主之间的作用受到它们基因控制和生长环境的调控(Moricca et al., 2008)。当内生真菌存在于恶劣生长环境下,为抵御外在环境或宿主的作用可能代谢出结构新颖和生物活性强的物质,那么来自于药用或是恶劣生长环境下的植物,如红树林植物,内生真菌可能是产生丰富活性或新颖结构化合物的重要资源(Ding et al., 2016; Huang et al., 2016; Zheng et al., 2016)。本文总结了红树属植物内生真菌资源研究的概况,分析了近10年红树属Rhizophora内生真菌代谢产物的生物活性,提出了内生真菌及活性物质的未来研究方向,为今后研究工作提供参考。
1 红树属植物内生真菌红树林分布于热带和亚热带30°N和37°S范围内,是热带和亚热带海岸和河口潮间带的特殊海洋生态类群,是陆地和海洋生境之间动态过渡的重要生态系统(Gopal et al., 2006)。红树林生态系统的关键不仅在于维持着海岸生物多样性,而且直接或间接地有利于人类的活动(Koch et al., 2009)。
根据国际红树林生态系统研究结果,全球有61种真红树植物(Wang et al., 2014)。中国有26种真红树植物,其中,海南省有24种(中国科学院中国植物志编辑委员会,2004)。文献统计表明,全球范围内红树属植物一共有8种,分别是红海榄(Rhizophora stylosa)、红树(R. apiculata)、红茄苳(R. mucronata)、美洲红树(R. mangle)、R. harrisonii、R. racemosa、树冬红树(R. annanalayana)、萨摩红树(R. samoensis)(表 1),主要分布于中国、印度、泰国和巴西等国。在中国大陆只有红海榄、红树、红茄苳和美洲红树,其中红茄苳和美洲红树为引进种,本地种红海榄和红树主要分布于广东、广西和海南等沿海地带(中国科学院中国植物志编辑委员会,2004)。
|
|
红树林真菌是构成海洋真菌的第二大真菌生态群(Xing et al., 2011)。Schmit(2003)首次从澳大利亚红树林中分离内生真菌,后续可见到中国、泰国、印度尼西亚、巴西和印度等国有关红树林内生真菌分离鉴定及多样性的研究报道。目前已超过280种红树林内生真菌被分离鉴定(徐静,2015)。近几年关于红树林内生真菌的研究越来越多,以印度、巴西、中国和泰国的研究为主。红树属植物中的内生真菌研究也较为广泛,红树属内生真菌已达到23目41科64属,且从红树、红海榄、红茄苳和美洲红树中分离出内生真菌分别隶属于27属、26属、26属和23属。有10个属为红树、红海榄和红茄苳中的共同属,分别是枝顶孢属(Acremonium)、链格孢属(Alternaria)、曲霉属(Aspergillus)、枝孢属(Cladosporium)、间座壳属(Diaporthe)、小丛壳属(Glomerella)、青霉属(Penicillium)、拟盘多毛孢属(Pestalotiopsis)、茎点霉属(Phoma)和拟茎点霉属(Phomopsis);然而只有4个属与美洲红树是共同属,这可能是由于红树、红海榄和红茄苳主要分布在太平洋和印度洋沿岸的岛屿和沿海地区,而美洲红树主要分布于太平洋东部和大西洋的群岛。Arfi等(2011)对红海榄根茎叶内生真菌的多样性研究发现,子囊菌纲(Ascomycetes)、担子菌纲(Basidiomycetes)的真菌在红海榄植株中分布极少。红树属内生真菌中子囊菌比担子菌丰富,主要是因为大多数担子菌都是属于腐生菌(Agrios et al., 2005)。红树属内生真菌的多样性随年龄增加而增强,Kumaresan等(2002)研究了红树植物幼年期、中年期和老年期叶片中的内生真菌的多样性,发现老年期的内生真菌多样性明显高于幼年期。红树属内生真菌多样性和丰富度也受到降水量影响,Wanderley等(2012)研究不同时节美洲红树内生真菌的变化,发现在旱季叶点霉属(Phyllosticta)作为美洲红树的优势菌属,Berger Parker优势指数为44.3%,而在雨季球座菌属(Guignardia)作为美洲红树的优势菌属,优势指数为29.4%。红树属内生真菌在宿主中生长具有专一性和广谱性,Ananda等(2002)研究了印度4种红树林植物内生真菌,发现从中分离出的30种内生真菌,没有同一种内生真菌同时分离自4种植物,而海南和广东两地的红海榄中都含有曲霉属和青霉属真菌(Xing et al., 2011; Liu et al., 2007)。
红树属植物中的优势内生真菌主要分布于曲霉属、枝孢属、毛壳属(Chaetomium)、镰刀菌属(Fusarium)、毛色二孢属(Lasiodiplodia)、青霉属、拟盘多毛孢属、拟茎点霉属、茎点霉属、叶点霉属(Phyllosticta)、木霉属(Trichoderma)等(表 1)。Piapukiew等(2010)对泰国红树林内生真菌的研究发现,红茄苳的优势内生真菌是叶点霉属、拟盘多毛孢属和枝孢属。还有更早些关于其他地区红树属内生真菌分离多样性的报道,但部分研究是关于红树属内生真菌与宿主之间的专一性和普遍性,以及在植株不同部位(根、茎、叶、花、胚轴)或不同季节影响下的红树属内生真菌的分离率(Suryanarayanan et al., 2001; Ananda et al., 2002)。
2 红树属内生真菌代谢产物红树属内生真菌的代谢产物主要包括生物碱类、萜类、香豆素类、色酮类、醌类、杂氧蒽醌类、肽类、酚酸类、内酯类和其他类化合物(徐静, 2015)。
2.1 生物碱类现已从红树属植物可培养内生真菌代谢产物中分离鉴定出生物碱类化合物66种(图 1)。从红海榄内生真菌Fusarium equisetin AGR12发酵提取物中分离得到2种已知的环状乙酰型植物毒素equisetin(1)和epi-equisetin(2)(Wheeler et al., 1999; Wang et al., 2011; )。这2种化合物均具有中度抗细菌活性,化合物(1)对部分革兰氏阳性菌具有选择性抗菌活性(Burmeister et al., 1974)。从红海榄可培养内生真菌Penicillium chrysogenum PXP-55发酵提取物中分离出6种新的脑苷脂类化合物chrysogesides A-E(3—7)、pyridone ketones(8)和2种新的吡啶酮类生物碱chrysogedones A和B(9, 10)。其中化合物(6)对产气肠杆菌(Enterobacter aerogenes)有抑制活性,最小抑制浓度(minimum inhibitory concentration,MIC)值为1.72 μmol·L-1(Peng et al., 2011)。从红茄苳内生拟盘多毛孢(Pestalotiopsis sp. JCM2A4)的发酵粗提物中发现了5种新的N取代酰胺衍生物pestalotiopamides A-E(12—16)和1种新的琥珀酰亚胺类化合物Pestalotiopsiod A(11)(Xu et al., 2009a; 2011b; 2011c)。从红海榄叶片内生小巢状曲菌(Aspergillius nidulans MA-143)发酵产物中分离得到6种都含有4-phenyl-3, 4-dihydroquinolin-2-one结构单元的新化合物:aniduquinolones A-C(17—19)、6-depxyaflaquinolone E(20)、isoaflaquinolone E(21)、14-hydroxyaflaquinolone F(22)和1种已知物aflaquinolone A(23)。其中化合物17、19和23对海虾(Artemia salina)表现出生物致死活性,半数致死量(median lethal dose, LD50)值分别为7.1、4.5和5.5 μmol·L-1(An et al., 2013)。从红树内生真菌Penicillium camemberti OUCMDZ-1492的发酵提取物中分离出6种新的吲哚二萜生物碱(24—29)和21-isopentenylpaxilline(30)、paxilline(31)、dehydroxypaxilline(32)和emindole(33)、paspaline(34)5种已知类似物。其中化合物(24)、(26—28)和(30—33)均显出强H1N1流感病毒抑制活性,IC50值为6~80 μmol·L-1(Fan et al., 2013)。从红海榄茎中内生细极链格孢菌(Alternaria tenuissima EN-192)的代谢产物中分离得到paspaline(34)和3种已知类似物penijianthine A(35)、paspalinine(36)和penitrem(37)。红树叶片组织中内生拟茎点霉菌(Phomopsis sp. PSU-MA214)代谢能够产出苯乙醇化合物homonitroester(37)(Rukachaisirikul et al., 2012)。从红树叶的内生真菌Phomopsis sp. PSU-MA214的代谢产物中分离出化合物phomonitroester(38)(Klaiklay et al., 2012a)。从红海榄的内生真菌Aspergillus nidulans MA-143发酵分离到4种新喹唑酮类生物碱aniquinazolines A-D(39—42)。这4个喹唑酮类生物碱对海虾有强致死活性(LD50值分别是1.27、2.11、4.95、3.42 μmol·L-1)(An et al., 2013)。从红海榄内生真菌Penicillium oxalium EN-201大米发酵提取物中分离到2种新的吲哚生物碱penioxamide A(43)、18-hydroxydecaturin (44)和1种已知的化合物decaturin B(45)(Zhang et al., 2016)。从红海榄内生真菌Mucor irregularis QEN-189发酵提取物中分离得到6种新的吲哚二萜类生物碱rhizovarins A-F(46—50, 53)和14种已知类似物:secopentrem D(51)、PC-M4(52)、penijianthine A(54)、penitrem A-F(55—60)、paxilline(61)、27-O-acetylpaxillin(62)、13-deoxy-27-O-acetylpaxillin(63)、10-deoxy-13-deoxypaxilline(64)、10β-hydroxy-13-desoxypaxilline(65)。其中化合物46、47、50、55、57、60、65对肺癌细胞A549和白血病原髓细胞HL-60均有抑制活性,对肺癌细胞A549的IC50为4~12 μmol·L-1,对白血病原髓细胞HL-60的IC50为2~10 μmol·L-1(Gao et al., 2016)。红树的内生绿色木霉菌(Hypocrea virens)能产生异喹啉生物碱2-methylimidazao[1, 5-b]isoquinoline-1, 3, 5(2H)-tione(66)(Liu et al., 2011)。
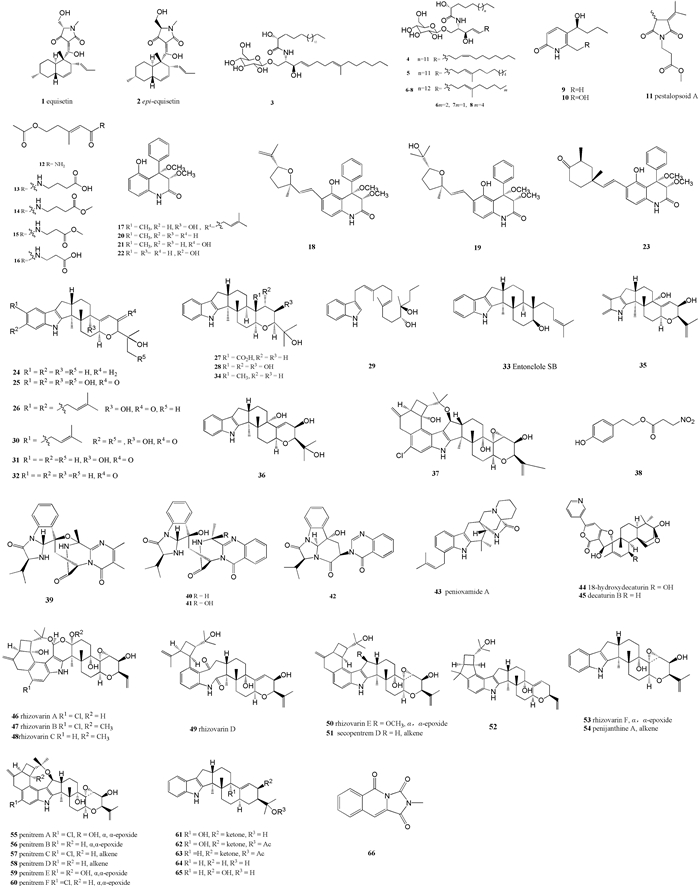
|
图 1 红树属内生真菌产生的生物碱化合物 Fig. 1 Alkaloids produced by mangrove endophytic fungi |
现已从红树属植物内生可培养真菌代谢产物中分离出萜类化合物18种(图 2)。从红海榄内生间座壳菌中分离得到1种具有三环内酯结构的新倍半萜diaporol A(67),8种新的补身烷型倍半萜diaporol B-I(68—75)和2种已知物3β-hydroxyconfertifolin(76)和diplodiatoxin(77)。从红树内生真菌Flavodon flavus PSU-MA201发酵产物中分离得到1种典型的多取代perhydroazulene tremulane类似化合物tremulenolide A(78),该化合物对金黄色葡萄球菌(Staphylococcus aureus ATCC25923)和新型隐球菌(Cryptococcus neoformans ATCC90113)有中度抑菌活性,MIC值均为128 μg·mL-1(Klaiklay et al., 2013)。从红茄苳内生拟盘多毛孢中分离出1种已知的补身烷型倍半萜altiloxin B(79)(Hemberger et al., 2013)。从红树内生枝顶孢菌中分离出2种已知真菌毒素8-deoxytrichothecin(80)和trichodermol(81)(Rukachaisirikul et al., 2012a)。在红树内生真菌尖孢镰刀菌(Fusarium oxysporum)代谢产物中分离得到具有抗癌活性的化合物紫杉醇(82)(Elavariasi et al., 2013)。从红茄苳叶片组织中的内生拟盘多毛孢代谢产物中分离得到2种具有柔性结构的补身烷型倍半萜-环青霉醛酸的新骨架化合物pestalotiopens A和B(83, 84)(Hemberger et al., 2013)。
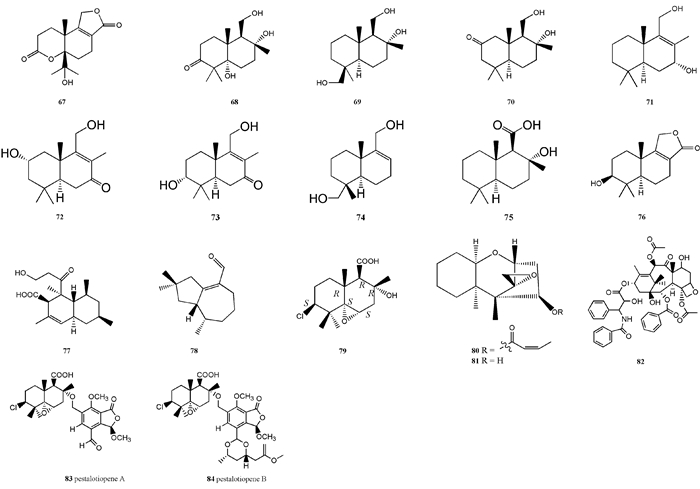
|
图 2 红树属内生真菌产生的萜类化合物 Fig. 2 Terpenoids produced by mangrove endophytic fungal |
现已从红树属植物可培养内生真菌代谢产物中分离出香豆素类化合物22种(图 3)。从红茄苳叶内生拟盘多毛孢菌的发酵产物中分离得到6种新的香豆素pestalasins A-E(85—89)、pestalotiopisorin A(91)及1种已知化合物3-hydroxymethyl-6, 8-dimethoxycoumarin(90),这是在红树林微生物中首次发现香豆素类成分(Xu et al., 2009a; 2009b)。从红树内生枝顶孢菌(Acremonium sp. PSU-MA70)代谢产物中分离到7种新的结构类似物acremonones B-H(92—98)(Rukachaisirikul et al., 2012a)。从R. harrisonii的叶片内生拟盘多毛孢菌Pestalotiopsis clavispora代谢产物中分离出4种新结构类似物pestaprones A-C(99—101)、(R)-periplanetin D(103)和1种已知的结构类似物similanpyrone B(102) (Hemphill et al., 2016)。
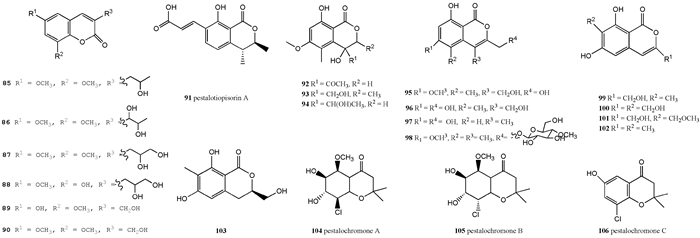
|
图 3 红树属内生真菌产生的香豆素类化合物 Fig. 3 Coumarins produced by mangrove endophytic fungi |
现已从红树属植物可培养内生真菌代谢产物中分离出色酮类化合物13种(图 4)。从红树的内生真菌Pestalotiopsis sp. PSU-MA69代谢产物中分离出3种在红树林内生真菌中较为罕见的氯代四氢色酮类衍生物pestalochromones A-C(104—106)(Klaiklay et al., 2012b)。从红茄苳内生拟盘多毛孢(Pestalotiopsis sp.)代谢产物中分离出一系列罕见的亲脂性取代基的新色酮类化合物pestalotiopsones A-F(107—112)和1种已知物5-carbomethoxymethyl-heptyl-7-hydroxychromone(113)。从红海榄内生可培养真菌Phomopsis sp.33#的发酵产物中分离出4个新色酮类衍生物phomopsichin A-D(114—117)和1种已知物phomoxanthone A(118),这5种化合物(114—118)对乙酰胆碱酯酶(AchE)、α-葡聚糖苷酶、DPPH自由基和羟基自由基有弱抑制作用,同时对18种植物病原细菌有弱抑制活性(Huang et al., 2016)。从R. harrisonii叶片中的内生拟盘多毛孢菌Pestalotiopsis clavispora中分离出1种新的聚酮类衍生物pestalpolyol 1(119),该化合物(119)对小鼠淋巴瘤细胞L5178Y具有强抑制活性,IC50值为4.1 μmol·L-1,对白血病细胞HL-60、肝癌细胞SMMC-7721、肺癌细胞A-549、乳腺癌细胞MCF-7和人结肠癌细胞SW480有抑制作用,IC50值分别为10.4、11.3、2.3、13.7和12.4 μmol·L-1(Hemphill et al., 2016)。
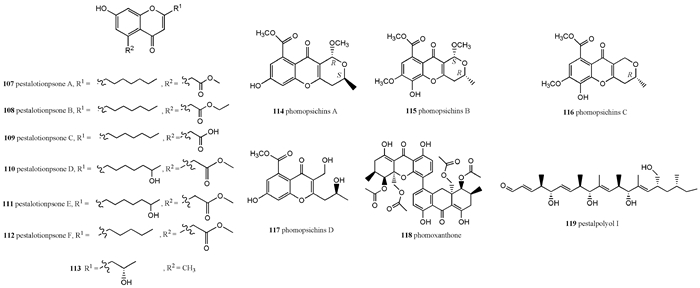
|
图 4 红树属内生真菌产生的色酮类化合物 Fig. 4 Chromones produced by mangrove endophytic fungi |
现已从红树属植物内生可培养真菌代谢产物中分离出醌类化合物15种(图 5)。从红树叶的内生真菌拟茎点霉菌(Phomopsis sp. PSU-MA214)中分离出1种新的四氢蒽醌衍生物(120)和5种已知的蒽醌(121—125)。其中化合物120具有乙基四氢蒽醌的结构,对金黄色葡萄球菌(Staphylococcus aureus ATCC25923)和耐甲氧西林金黄色葡萄球菌(S.aureus SK1)有抗菌活性(Klaiklay et al., 2012a)。从红海榄茎的内生真菌细枝链格孢菌(Alternsria tenuissima EN-192)中分离到3种已知的三环alternarene化合物(126—128),其中化合物126对水产养殖病原菌鳗弧菌Vibrio anguillarum显示出中度抗菌活性(Sun et al., 2013)。从红树枝条内生真菌Pestalotiopsis sp. PUS-MA69的发酵液中分离出1种新的氧杂蒽酮pestaloxanthone(129)和2种类似已知物isosulochrin dehydrate(130)、chloroisosulochrin dehydrate(131)(Klaiklay et al., 2012b)。从红茄苳内生拟茎点霉菌(Phomopsis sp. IM 41-1)的大米发酵培养提取物中分离到1种四氢化氧杂蒽酮二聚体已知物phomoxanthone A(132)和1种结构类似的新化合物12-O-deacetyl-phomoxanthone A(133)(Shiono et al., 2012)。从R. harrisonii叶片的内生拟盘多毛孢菌(Pestalotiopsis clavispora)分离到1种已知物pestaxanthone(134)(Hemphill et al., 2016)。

|
图 5 红树属内生真菌产生的醌类化合物 Fig. 5 Anthraquinones produced by mangrove endophytic fungi |
现已从红树属植物内生可培养真菌代谢产物中分离出肽类化合物4种(图 6)。从红树内生枝顶孢菌(Acremonium sp.PSU-MA70)中分离得到4种已知物,2种环状缩酚酞guangomides A和B(135, 136),2种二酮哌嗪类Sch 54794和Sch 54796(137, 138)(Rukachaisiriku et al., 2012a)。
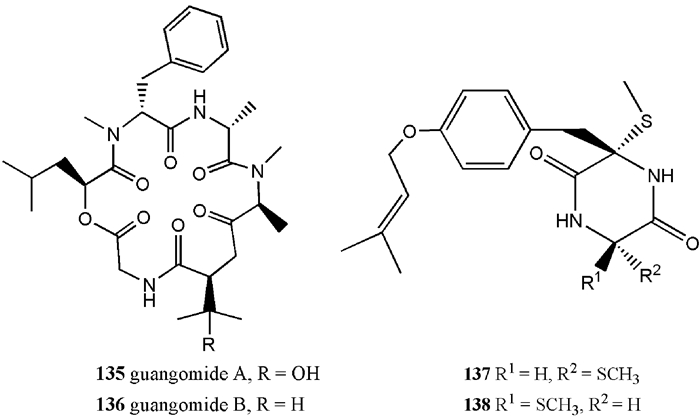
|
图 6 红树属内生真菌产生的肽类化合物 Fig. 6 Peptides produced by mangrove endophytic fungi |
现已从红树属植物内生可培养真菌代谢产物中分离出酚酸类化合物11种(图 7)。从红树内生拟盘多毛孢菌Pestalotiopsis sp. PSU-MA69中分离得到4种新的二苯醚pestalotethers A-D(141, 143-145)、3个已知物pestheic acid(142)、chloroisosulochrin(139)和isosulochrin(140)(Klaiklay et al., 2012c)。从R. harrisonii的叶片中内生拟盘多毛孢菌中分离到1种新化合物norpestaphthlide A(146)和3种已知物(R, S)-5, 7-dihydroxy-3-(1-hydroxyethyl)phthalide(148)和pestaphthalides A和B(147, 149)。

|
图 7 红树属内生真菌产生的酚酸类化合物 Fig. 7 Phenolics produced by mangrove endophytic fungi |
现已从红树属植物内生可培养真菌代谢产物中分离出内酯类化合物35个(图 8)。从红茄苳内生拟盘多毛孢分离到7种苯乙醇内酯类化合物dothiorelones A(150)、cytosporones C(151)和新化合物cytosporones J-N(152—156)。其中化合物156对人口腔表皮样癌KB细胞、淋巴癌细胞Raji和人成骨肉瘤细胞Mg-63具有细胞毒性(Xu et al., 2009a)。从红茄苳内生拟盘多毛孢(Pestalotiopsis sp.)大米培养基大量发酵产物中发现了2种新的缩酚酸环醚类化合物Pestalotiollides A和B(166, 167),8个新的吡喃酮类化合物pestalotiopyrones A-H(157—164)和1种已知物nigroporapyrone D(165)(Xu et al., 2011a)。从红树和红茄苳中的2株内生拟盘多毛孢Pestalotiopsis sp. PSU-MA92和Pestalotiopsis sp. PSU-MA119代谢产物中分离出3种新的α-吡喃酮Pestalotiopyrrones A-C(168—170)、2种新的seiricurolides大环内酯pestalotioprolides A(171)和B(173)和2种已知化合物seiricurolides(174)和2-hydroxy-3′, 4′-didehydropenicillide(172)(Rukachaisirikul et al., 2012b),其中化合物168—171是pestalotioprolides A-C的重复命名(Xu et al., 2009b)。到目前为止,已报道的天然产物中,苯乙醇内酯类的碳骨架非常罕见(Brady et al., 2000)。从红树内生真菌Pestalotiopsis sp. PSU-MA69发酵产物中分离到1种新的丁烯酸内酯pestalolide(175)和1种已知的植物毒素内类物seridin(176)(Klaiklay et al., 2012b)。从红树枝条内生枝顶孢属Acremonium sp. PSU-MA70菌代谢产物中分离得到1种新的苯酞衍生物acremonide(177),1种新的缩酚酸环醚acremonone A(179),2种已知物(+)-brefelin A(180)和5, 7-dimethoxy-3, 4-dimethyl-3-hydroxyphthalide(178) (Rukachaisirikul et al., 2012a)。从R. harrisonii的内生拟盘多毛孢菌发酵提取物中,分离得到3种已知物,2-epi-herbarumin Ⅱ(183)、大环内酯pestalotiollides A和B(181, 182)。为有效调控美洲红树内生桃干枯病菌(Leucostoma persoonii)的生物合成,激发Cytosporones类化合物的产生,通过表观遗传修饰的方法,成功诱导产生1种已知的强抗细菌的三羟基内酯类化合物Cytosporones E(184)(Beau et al., 2012)。该化合物(184)对恶性疟原虫Plasmodium falciparum有强抗感染活性,IC50值为13 μmol·L-1;对人肺癌细胞A549具有强抑制活性,IC50值为437 μmol·L-1;对耐甲氧西林金黄色葡萄球菌有强抑制作用,MIC值为72 μmol·L-1(Brady et al., 2000)。

|
图 8 红树属内生真菌产生的内酯类化合物 Fig. 8 Lactones produced by mangrove endophytic fungi |
现已从红树属植物内生可培养真菌代谢产物中分离出其他类化合物11种(图 9)。从红树的内生浅黄囊孔菌(Flavodon flavus PSU-MA201)中分离得到1种新difuranylmethane衍生的呋喃脂肪酸flavodonfuran(185)(Klaiklay et al., 2013)。从红树内生枝顶孢菌Acremonium sp.PSU-MA70中分离得到2个已知物4-methyl-1-phenyl-2, 3-hexanediol(189)和(2R, 3R)-4-methyl-1-phenyl-2, 3-pentanediol(190)(Rukachaisirikul et al., 2012a)。Xu等(2009b)从红茄苳内生拟盘多毛孢(Pestalotiopsis sp.)中分离到1种新的烯酸类化合物pestalotiopin A(187),2种简单的已知物2-anhydromevalonic acid(186)和p-hydroxyl benzadehyde(188)。从红树的内生拟茎点霉属Phomopsis sp. PSU-MA214中分离得到1种已知的苯乙醇羟丙酸(191)和1种已知的丁酰胺类化合物butanamide(192)(Klaiklay et al., 2012b);从红树内生拟盘多毛孢菌Pestalotiopsis sp. PSU-MA69中分离得到1种已知的炔类杀线虫剂(S)-penipratynolene(193),1种已知的DNA损伤剂anofinic acide(194)和p-hydroxybenzoic acid methyl ester(195)(Klaiklay et al., 2012b)。

|
图 9 红树属内生真菌产生的其他类化合物 Fig. 9 Other compounds produced by mangrove endophytic fungi |
本文总结了红树属中常见的内生真菌及内生真菌分泌的次生代谢产物和生物活性。近10年的文献表明:现已分离的红树属内生真菌隶属于23目41科64属,在中国、泰国、印度尼西亚、巴西和印度等国均有学者对红树林内生真菌的多样性进行相关研究(表 2),且已有超过280种红树林内生真菌被分离鉴定(徐静,2015)。因为需要从这些内生真菌中分离次生代谢产物,这些学者均选用了传统的培养基分离法来分离可培养的内生真菌,植物体内除去可培养的内生菌外还有90%传统方法无法分离的内生真菌信息,这些信息可通过高通量测序的方法来获得。因此,有必要在对红树属植物内生真菌后续的研究中引入高通量测序的方法(邹运,2015)。此外,也少有学者深入研究红树属内生真菌多样性与宿主环境之间的关系。
3.2 红树属植物内生真菌代谢产物丰富的内生真菌及其宿主特殊的生长环境使其代谢出陆源真菌无法比拟的丰富结构化合物,能为新药的开发和筛选提供丰富的新化合物和模式结构(林文翰, 2005)。笔者根据文献统计,近十年从红树属植物内生真菌代谢产物中分离鉴定出的化合物共计195种,从来源上看主要来自于红海榄(66种)、红树(64种)、红茄苳(50种)、R. harrisonii(14种)以及美洲红树1个,其中涉及R.rocemosa、树冬红树、萨摩红树内生真菌及其次生代谢产物的研究未见报道。195种化合物中,首次分离出的新化合物106种,主要来自于红海榄(37种)、红茄苳(39种)、红树(23种)以及R. harrisonii(7种)。从化合物分类来看为生物碱类(66种)、萜类(18种)、香豆素类(22种)、色酮类(13种)、醌类(15种)、肽类(4种)、酚酸类(11种)、内酯类(35种)、其他类(11种)。
内生真菌中拟盘多毛孢属、青霉和毛霉是分泌化合物的重要资源。尤其是,据笔者统计,拟盘多毛孢内生真菌分泌次生代谢产物的能力最强,占总数的42.56%。红海榄内生真菌产生化合物最多(33.85%),其次是红树(24.10%)和红茄苳(23.59%)。R.rocemosa中的内生真菌代谢产物的化合物尚未鉴定。Xu等(2010)对中国南海红茄苳内生拟盘多毛孢次生代谢产物的研究表明,其代谢产物不仅具有丰富的多样性和复杂的化学结构,而且较容易分出新化合物,为新药物的开发和研究提供了较为丰富的基础材料。
内生真菌次生代谢产物的种类和分泌量会随着培养基成分和培养条件的变化而变化,综述中的部分次生代谢产物表现出良好的抗肿瘤、抗菌和抗氧化活性,但是以中度或较弱的生物活性为主,这可能是筛选过程中的偏差所致,其特定生理活性可能会在其他的生物活性筛选模型中显现。采用有效的生物活性模型,从红树属植物中筛选到具有强生物活性的内生真菌,并借助活性追踪发酵产物,是挖掘潜在药物先导化合物的重要前提。
此外,化合物82为紫杉醇,是一种作用机制独特、效果好的抗癌药物,从美国太平洋紫杉(Taxus brevifolia)树皮和木材中分离获得(Wani et al., 1971; Harrison et al., 1996),后续发现内生真菌也可代谢产生紫杉醇及其类似物(Xu et al., 2006; Chen et al., 2009)。直接从树皮中提取对植物的破坏较大,如果利用微生物工程技术对能分离出紫杉醇的内生真菌进行发酵培养,既能保护美国太平洋紫杉植物,还能大量利用紫杉醇资源。
4 结论与展望 4.1 结论红树属植物具有丰富的内生真菌,现有的研究还不能全面地反映其内生真菌的多样性。红树属内生真菌次生代谢产物资源丰富,在药物开发利用方面具有巨大的潜力和应用前景。
4.2 展望为了全面地了解红树属植物内生真菌的多样性,在接下来的研究中,一方面应注意使用高通量测序等方法对不可培养内生真菌的种类进行测量分析,另一方面还要加强对R.rocemosa、树冬红树、萨摩红树等未见文献报道的物种展开相关研究;此外,还可以进一步研究红树属植物内生真菌多样性与环境之间的关系。在红树属内生真菌次生代谢产物药物开发方面,要注意加强通过不同培养条件诱导、生物活性筛选模型的研究,从而充分挖掘每一株内生真菌在抗肿瘤、抗菌、抗氧化等生物活性物质代谢的潜力,最终分离出更多高生物活性的代谢产物。
高剑. 2013.红树内生真菌多样性及其生态分布.湛江: 广东海洋大学硕士学位论文. (Gao J. 2013. Diversity and ecological distribution of endophytic fungi associated with mangroves. Zhanjiang: MS thesis of Guangdong Ocean University.[in Chinese]) |
林文翰. 2005.红树附生微生物的化学成分研究. "863"计划资源环境技术领域办公室.DT新材料.厦门: 第三届海洋高技术论坛, 41-47. (Lin W H. 2005. Studies on the chemical constituents of epiphytic microorganisms of Mangrove. "863" Program Office in the Field of Resources, Environment and Technology. DT New Material. Xiamen: The 3th High Tech Marine Forum, 41-47.[in Chinese]) |
徐静. 2015. 红树林微生物天然产物化学研究. 北京: 科学出版社. (Xu J. 2015. Natural Products of Mangrove-Derived Microbes. Beijing: Science Press. [in Chinese]) |
中国科学院中国植物志编辑委员会. 2004.中国植物志.第52卷.第2册.北京: 科学出版社, 127-130. (Editorial Committee of Flora of Chinese Academy of Sciences. 2004. Flora of China. Vol.52(2).Beijing: Science Press, 127-130.[in Chinese]) |
邹运. 2015.两种地衣中内生真菌物种多样性的比较研究.济南: 山东师范大学硕士学位论文. (Zou Y. 2015. Comparative study of species diversity of endolichenic fungi in two kinds of lichens. Jinan: MS thesis of Shandong Normal University.[in Chinese]) |
Agrios. 2005. Plant Pathology. 5th ed. London: Elsevier Academic Press.
|
An C Y, Li X M, Li C S, et al. 2013. Aniquinazolines A-D, four new quinazolinone alkaloids from marine-derived endophytic fungus Aspergillus nidulans. Marine Drugs, 11(7): 2682-2694. DOI:10.3390/md11072682 |
Ananda K, Sridhar K R. 2002. Diversity of endophytic fungi in the roots of mangrove species on the west coast of India. Canadian Journal of Microbiology, 48(10): 871-878. DOI:10.1139/w02-080 |
Arfi Y, Buée M, Marchand C, et al. 2011. Multiple markers pyrosequencing reveals highly diverse and host-specific fungal communities on the mangrove trees Avicennia marina and Rhizophora stylosa. FEMS Microbiol Ecol, 79: 433-444. |
Beau J, Mahid N, Burda W N, et al. 2012. Epigenetic tailoring for the production of anti-infective cytosporones from the marine fungus Leucostoma persoonii. Marine Drugs, 10(4): 762-774. |
Brady S F, Wagenaar M M, Singh M P, et al. 2000. The cytosporones, new octaketide antibiotics isolated from an endophytic fungus. Organic Letters, 32: 4043-4046. |
Buatong J, Phongpaichit S, Rukachaisirikul V, et al. 2011. Antimicrobial activity of crude extracts from mangrove fungal endophytes. World Journal of Microbiology & Biotechnology, 27: 3005-3008. |
Burmeister H R, Bennett G A, Vesonder R F, et al. 1974. Antibiotic produced by Fusarium equiseti NRRL 5537. Antimicrobial Agents & Chemotherapy, 5(6): 634-639. |
Chen J, Qiu X, Wang R, et al. 2009. Inhibition of human gastric carcinoma cell growth in vitro and in vivo by cladosporol isolated from the paclitaxel-producing strain Alternaria alternata var. monosporus. Biological & Pharmaceutical Bulletin, 32(12): 2072-2074. |
Cohen S D. 2006. Host selectivity and genetic variation of Discula umbrinella, isolates from two oak species:Analyses of intergenic spacer region sequences of ribosomal DNA. Microbial Ecology, 52(3): 463-469. DOI:10.1007/s00248-006-9073-5 |
Ding B, Wang Z, Huang X, et al. 2016. Bioactive α-pyrone meroterpenoids from mangrove endophytic fungus Penicillium sp. Natural Product Research, 30(24): 2805-2812. DOI:10.1080/14786419.2016.1164702 |
Elavarasi A, Rathna G S, Kalaiselvam M. 2012. Taxol producing mangrove endophytic fungi Fusarium oxysporum, from Rhizophora annamalayana. Asian Pacific Journal of Tropical Biomedicine, 2(2): S1081-S1085. DOI:10.1016/S2221-1691(12)60365-7 |
Fan Y, Yi W, Liu P, et al. 2013. Indole-diterpenoids with anti-H1N1 activity from the aciduric Fungus Penicillium camemberti OUCMDZ-1492. Journal of Natural Products, 76(7): 1328-1336. DOI:10.1021/np400304q |
Fl D S S, Romãodumaresq A S, Lacava P T, et al. 2013. Species diversity of culturable endophytic fungi from Brazilian mangrove forests. Current Genetics, 59(3): 153-166. |
Gao S S, Li X M, Williams K, et al. 2016. Rhizovarins A-F, indole-diterpenes from the mangrove-derived endophytic fungus Mucor irregularis QEN-189. Journal of Natural Products, 79(8): 2066-2074. DOI:10.1021/acs.jnatprod.6b00403 |
Godoy M D, de Lacerda L D. 2015. Mangroves response to climate change:A review of recent findings on mangrove extension and distribution. Anais Da Academia Brasileira De Ciências, 87(2): 651-667. DOI:10.1590/0001-3765201520150055 |
Gopal B, Chauhan M. 2006. Biodiversity and its conservation in the Sundarban Mangrove Ecosystem. Aquatic Sciences, 68(3): 338-354. DOI:10.1007/s00027-006-0868-8 |
Harrison J W, Scrowston R M, Lythgoe B. 1996. Taxine. Part Ⅳ. The constiuents of taxine-Ⅰ. J Chem Soc, 95: 641-655. |
Hemberger Y, Xu J, Wray V, et al. 2013. Pestalotiopens A and B:Stereochemically challenging flexible sesquiterpene-cyclopaldic acid hybrids from Pestalotiopsis sp. Chemistry-A European Journal, 19(46): 15556-15564. DOI:10.1002/chem.v19.46 |
Hemphill C F P, Daletos G, Liu Z, et al. 2016. Polyketides from the Mangrove-derived fungal endophyte Pestalotiopsis clavispora. Tetrahedron Letters, 57(19): 2078-2083. DOI:10.1016/j.tetlet.2016.03.101 |
Huang M, Li J, Liu L, et al. 2016. Phomopsichin A-D; four new chromone derivatives from mangrove endophytic fungus Phomopsis sp. 33#. Marine Drugs, 14(11): 215-220. |
Jalgaonwala R E, Mohite B V, Mahajan R T. 2011. A review:Natural products from plant associated endophytic fungi. Journal of Microbiology and Biotechnology Research, 1(2): 21-32. |
Klaiklay S, Rukachaisirikul V, Phongpaichit S, et al. 2012a. Anthraquinone derivatives from the mangrove-derived fungus Phomopsis sp. PSU-MA214. Phytochemistry Letters, 5(4): 738-742. DOI:10.1016/j.phytol.2012.08.003 |
Klaiklay S, Rukachaisirikul V, Phongpaichit S, et al. 2013. Flavodonfuran:a new difuranylmethane derivative from the mangrove endophytic fungus Flavodon flavus PSU-MA201. Natural Product Research, 27(19): 1722-1726. DOI:10.1080/14786419.2012.750315 |
Klaiklay S, Rukachaisirikul V, Tadpetch K, et al. 2012b. Chlorinated chromone and diphenyl ether derivatives from the mangrove-derived fungus Pestalotiopsis sp. PSU-MA69. Tetrahedron, 68(10): 2299-2305. |
Koch E W, Barbier E B, Silliman B R, et al. 2009. Non-linearity in ecosystem services:temporal and spatial variability in coastal protection. Frontiers in Ecology & the Environment, 7(1): 29-37. |
Kumaresan V, Suryanarayanan T S. 2002. Endophyte assemblages in young, mature and senescent leaves of Rhizophora apiculata: evidence for the role of endophytes in mangrove litter degradation. Fungal Diversity, 9(2): 81-91. |
Liu A R, Wu X P, Xu T. 2007. Research advances in endophytic fungi of mangrove. Chin J App Ecol, 13: 366-378. |
Liu T, Li Z L, Wang Y, et al. 2011. A new alkaloid from the marine-derived fungus Hypocrea virens. Natural Product Research, 25(17): 1596-1599. DOI:10.1080/14786419.2010.490916 |
Moricca S, Ragazzi A. 2008. Fungal endophytes in Mediterranean oak forests:a lesson from Discula quercina. Phytopathology, 98(4): 380-386. DOI:10.1094/PHYTO-98-4-0380 |
Osorio J A, Wingfield M J, Roux J. 2014. A review of factors associated with decline and death of mangroves, with particular reference to fungal pathogens. South African Journal of Botany, 103: 295-301. |
Peng X, Wang Y, Sun K, et al. 2011. Cerebrosides and 2-pyridone alkaloids from the halotolerant fungus Penicillium chrysogenum grown in a hypersaline medium. Journal of Natural Products, 74(5): 1298-1302. DOI:10.1021/np1008976 |
Piapukiew J, Whalley A J S, Sihanonth P. 2010. Endophytic fungi from mangrove plant species of Thailand:their antimicrobial and anticancer potentials. Botanica Marina, 53(6): 555-564. |
Rukachaisirikul V, Rodglin A, Phongpaichit S, et al. 2012b. α-pyrone and seiricuprolide derivatives from the mangrove-derived fungi Pestalotiopsis spp. PSU-MA92 and PSU-MA119. Phytochemistry Letters, 5(1): 13-17. DOI:10.1016/j.phytol.2011.08.008 |
Rukachaisirikul V, Rodglin A, Sukpondma Y, et al. 2012a. Phthalide and Isocoumarin derivatives produced by an Acremonium sp. isolated from a mangrove Rhizophora apiculata. Journal of Natural Products, 75(5): 853-858. |
Rukachaisirikul V, Sommart U, Phongpaichit S, et al. 2008. Metabolites from the endophytic fungus Phomopsis sp. PSU-D15. Phytochemistry, 69: 783-787. DOI:10.1016/j.phytochem.2007.09.006 |
Schmit J P, Shearer C A. 2003. A checklist of mangrove-associated fungi, their geographical distribution and known host plants. Mycotaxon, 85(1): 423-477. |
Shiono Y, Sasaki T, Shibuya F, et al. 2013. Isolation of a phomoxanthone A derivative, a new metabolite of tetrahydroxanthone, from a Phomopsis sp. isolated from the mangrove, Rhizhopora mucronata. Natural Product Communications, 8(12): 1735. |
Sun H, Gao S S, Li X M, et al. 2013. Chemical constituents of marine mangrove-derived endophytic fungus Alternaria tenuissima EN-192. Chinese Journal of Oceanology and Limnology, 31(2): 464-470. DOI:10.1007/s00343-013-2106-2 |
Suryanarayanan T S, Kumaresan V, Johnson J A. 1998. Foliar fungal endophytes from two species of the mangrove Rhizophora. Canadian Journal of Microbiology, 44(10): 1003-1006. DOI:10.1139/w98-087 |
Suryanarayanan T S, Senthilarasu G, Muruganandam V. 2001. Endophytic fungi from Cuscuta reflexa and its host plants. Fungal Diversity, 4: 117-123. |
Tarman K, Safitri D, Setyaningsih I. 2014. Endophytic fungi isolated from Rhizophora mucronata and their antibacterial activity. Squalen Bulletin of Marine & Fisheries Postharvest & Biotechnology, 8(2): 69-76. |
Ukoima H N, Ikata M. 2013. Mycoparasitism on some fungal isolates of Rhizophora racemosa Linn. American Journal of Scientific Research, 84: 139-144. |
Verma V C, Gond S K, Kumar A, et al. 2007. The endophytic mycoflora of bark, leaf, and stem tissues of Azadirachta indica A. Juss (Neem) from Varanasi (India). Microbial Ecology, 54(1): 119-125. |
Wanderley Costa I P, Maia L C, Cavalcanti M A. 2012. Diversity of leaf endophytic fungi in mangrove plants of Northeast Brazil. Brazilian Journal of Microbiology, 43(3): 1165-1173. DOI:10.1590/S1517-83822012000300044 |
Wang J, Lu W, Min C, et al. 2011. The endophytic fungus AGR12 in the stem of Rhizophora stylosa Griff and its antibacterial metabolites. Chinese Journal of Antibiotics, 36(2): 102-106. |
Wang Y, Zhu H, Tam N F Y. 2014. Polyphenols, tannins and antioxidant activities of eight true mangrove plant species in South China. Plant and Soil, 374(1): 549-563. |
Wani M C, Taylor H L, Wall M E, et al. 1971. Plant antitumor agents.Ⅵ.The isolation and structure of taxol, a novel antileukemic and antitumor agent from Taxus brevifolia. J Chem Soc, 93(9): 2325-2327. DOI:10.1021/ja00738a045 |
Wheeler M H, Stipanovic R D, Puckhaber L S. 1999. Phytotoxicity of equisetin and epi-equisetin isolated from Fusarium equiseti and F. pallidoroseum. Mycological Research, 103(8): 967-973. DOI:10.1017/S0953756298008119 |
Wier A M, Tattar T A, Klekowski E J. 2000. Disease of red mangrove (Rhizophora mangle) in Southwest Puerto Rico caused by Cytospora rhizophorae. Biotropica, 32(2): 299-306. |
Xing X, Guo S. 2011. Fungal endophyte communities in four Rhizophoraceae mangrove species on the south coast of China. Ecological Research, 26(2): 403-409. DOI:10.1007/s11284-010-0795-y |
Xu F, Tao W, Cheng L, et al. 2006. Strain improvement and optimization of the media of taxol-producing fungus Fusarium maire. Biochemical Engineering Journal, 31(1): 67-73. DOI:10.1016/j.bej.2006.05.024 |
Xu J, Aly A H, Wray V, et al. 2009b. Polyketide derivatives of endophytic fungus Pestalotiopsis sp. isolated from the Chinese mangrove plant Rhizophora mucronata. Journal of Natural Products, 72(4): 662-665. |
Xu J, Ebada S S, Proksch P. 2010. Pestalotiopsis, a highly creative genus:chemistry and bioactivity of secondary metabolites. Fungal Diversity, 44: 15-31. DOI:10.1007/s13225-010-0055-z |
Xu J, Kjer J, Sendker J, et al. 2009a. Cytosporones, coumarins, and an alkaloid from the endophytic fungus Pestalotiopsis sp. isolated from the Chinese mangrove plant Rhizophora mucronata. Bioorganic & Medicinal Chemistry, 17(20): 7362-7367. |
Xu J, Kjer J, Sendker J, et al. 2011a. Chromones from the endophytic fungus Pestalotiopsis sp. isolated from the Chinese mangrove plant Rhizophora mucronata. Tetrahedron Letters, 52: 21-25. |
Xu J, Lin Q, Wang B, et al. 2011b. Pestalotiopamide E, a new amide from the endophytic fungus Pestalotiopsis sp. Journal of Asian Natural Products Research, 13: 373-376. DOI:10.1080/10286020.2011.554829 |
Zang L Y, Wei W, Guo Y, et al. 1992. Sesquiterpenoids from the mangrove-derived endophytic fungus Diaporthe sp. Journal of Natural Products, 75(10): 1744-1749. |
Zhang P, Li X, Wang B G. 2016. Secondary metabolites from the marine algal-derived endophytic fungi:Chemical diversity and biological activity. Planta Medica, 82(9/10): 832-842. DOI:10.1055/s-00000058 |
Zhang W, Becker D, Cheng Q. 2006. A mini-review of recent W. O. patents (2004-2005) of novel anti-fungal compounds in the field of anti-infective drug targets. Recent Patents on Anti-Infective Drug Discovery, 1(2): 225-230. |
Zheng C J, Huang G L, Xu Y, et al. 2016. A new benzopyrans derivatives from a mangrove-derived fungus Penicillium citrinum from the South China Sea. Natural Product Research, 30(7): 821-827. |
 2019, Vol. 55
2019, Vol. 55

