文章信息
- 刘辉, 吴小芹, 任嘉红, 陈丹.
- Liu Hui, Wu Xiaoqin, Ren Jiahong, Chen Dan.
- 荧光假单胞菌与红绒盖牛肝菌共接种对杨树根际土壤酶活性及微生物多样性的影响
- Effect of Co-Inoculation with Pseudomonas fluorescens and Xerocomus chrysenteron on the Soil Enzyme Activity and Microbial Diversity in Poplar Rhizosphere
- 林业科学, 2019, 55(1): 22-30.
- Scientia Silvae Sinicae, 2019, 55(1): 22-30.
- DOI: 10.11707/j.1001-7488.20190103
-
文章历史
- 收稿日期:2017-09-11
- 修回日期:2018-09-30
-
作者相关文章
2. 安徽师范大学环境科学与工程学院 芜湖 241003
2. College of Environmental Science and Engineering, Anhui Normal University Wuhu 241003
土壤微生物作为林地生态系统中重要的成员,参与了几乎全部的物质循环和能量代谢,是土壤组分中最活跃的部分,对林木营养供给有着重要意义(Moscatelli et al., 2001)。接种土壤微生物,特别是植物根际促生微生物(plant growth promoting rhizomicroorganisms, PSM),是一种环境友好、经济有效的提高作物产量和品质的方法(Abbasi et al., 2011)。溶磷细菌(phosphate-solubilizing bacteria, PSB)与菌根真菌(mycorrhizal fungi)作为PSM的重要成员,两者互作对宿主植物生长和养分吸收影响的研究大多集中在农作物的丛枝菌根真菌(arbuscular mycorrhizae fungi, AMF)与PSB的互作效应和机制上(Kim et al., 1998;Duponnois et al., 2003;Zaidi et al., 2007;Bouhraoua et al., 2015),而与林业生产密切相关的外生菌根真菌(ectomycorrhizal fungi, ECF)与PSB互作的研究报道不多。笔者课题组前期研究了荧光假单胞菌(Pseudomonas fluorescens)JW-JS1与红绒盖牛肝菌(Xerocomus chrysenteron, Xc)共接种对NL-895杨(Populus × euramericana ‘Nanlin-895’)生长和光合效应的影响,两者互作表现出显著的正交互效应(刘辉等,2012;姚如斌等,2012)。
外源微生物的引入对生态系统会产生一定的影响。潘超美等(2000)对玉米(Zea mays)接种VA菌根真菌发现,玉米根系土壤中的细菌、放线菌等数量和微生物生物量明显增加,菌根形成改善了根区土壤的微生态环境;张昕等(2005)研究表明,施入黄瓜(Cucumis sativus)根际土壤生防菌株对土壤中的微生物群落产生了一定的影响;李世贵(2010)将2株黄瓜枯萎病生防菌施入黄瓜根际土壤中发现土壤中细菌群落多样性降低,而放线菌和真菌群落多样性逐步增加;任嘉红等(2016)在美洲黑杨(Populus deltoides)根际引入吡咯伯克霍尔德氏菌(Burkholderia pyrrocinia)JK-SH007后促进了根际土壤微生物的整体活性和功能多样性,在一定程度上丰富了土壤微生物种群,有利于保持和促进土壤肥力和健康状况。目前,研究微生物群落功能主要通过2种方式:一种是通过土壤酶活性变化探讨微生物群落功能的变化;另一种是基于“碳源利用水平”的代谢指纹法来探讨微生物群落功能的变化。关于溶磷细菌与外生菌根真菌互作对土壤微生物群落结构和功能影响的研究鲜有报道。鉴于此,本研究通过分析JW-JS1菌株与Xc菌株互作对NL-895杨根际土壤酶活性和微生物群落结构和功能的影响,旨在探明外源功能微生物的引入对土壤根际微环境的影响,为进一步揭示溶磷细菌与外生菌根真菌的互作关系提供理论基础。
1 材料与方法 1.1 试验材料 1.1.1 供试菌株溶磷细菌:荧光假单胞菌JW-JS1,由本实验室从杨树根际土壤中筛选获得,保藏于中国典型培养物保藏中心CCTCC,保藏编号是:CCTCC M 209027。外生菌根真菌:红绒盖牛肝菌(Xerocomus chrysenteron, 简称Xc),保存于南京林业大学森林病理实验室。
1.1.2 供试培养基综合马铃薯培养基(ZPD):马铃薯200.0 g,葡萄糖20.0 g,K2HPO4 2.0 g,MgSO4·7H2O 0.5 g,维生素VB 0.01 g,琼脂20.0 g,蒸馏水1 000 mL,pH自然(盛江梅等,2014);细菌活化培养基(NA):牛肉膏3.0 g,蛋白胨10.0 g,NaCl 5.0 g,琼脂18.0 g,蒸馏水1 000 mL,pH7.2~7.4;细菌液体发酵培养基(NB):为NA培养基不加琼脂。
1.1.3 供试植物NL-895杨插条采自江苏省泗洪县陈圩林场苗圃,插条截自2年生NL-895苗木,选择长约15 cm、粗约2 cm的健康插条,备用。
1.1.4 菌剂制备溶磷菌剂制备:将供试菌株活化后,用接种环取少量接种于装有50 mL NB培养基的100 mL三角瓶中,30℃,180 r·min-1振荡培养72 h的发酵液(菌液浓度约为1×109 cfu·mL-1)即为溶磷菌剂。
外生菌根真菌菌剂制备(曾丽琼,2010):采用ZPD培养基平板培养外生菌根真菌Xc,将其作为母菌种备用。固体扩大培养基为蛭石:玉米粉:麸皮(8 :1 :1)的比例充分混合,搅拌均匀,然后加入ZPD液体培养基(以手握紧有水渗出但不下滴为准),取约400 g基质装入培养袋中,并用包装绳扎好袋口。在1.01×106 Pa灭菌90 min,冷却后,在无菌条件下将Xc母菌种接种于该固体培养基,置于25 ℃恒温培养,待菌丝长满培养基后即为外生菌根真菌固体菌剂,备用。
1.1.5 盆栽基质基质土壤(pH7.56,有机质2.65 g·kg-1)采自南京林业大学校园后山,与砂子、蛭石按2:1:1的比例混合并搅拌均匀,采用甲醛熏蒸处理1周后,待基质中无甲醛气味即可,备用。
1.2 试验方法 1.2.1 试验设计设共接种JW-JS1+Xc、单接种JW-JS1、单接种Xc、空白对照(CK)4个不同处理,以上处理20个重复。取适量无菌盆栽基质(约2.5 kg)装入苗盆中,在土层表面覆盖约25 g的Xc的固体菌剂,再加入盆栽基质至总质量约为5.0 kg,将NL-895杨插穗扦插至苗盆,每盆3根,压实土壤,浇水,置于植物生长室常温培养;1周后,在插穗周围用无菌玻璃棒打孔,将JW-JS1菌剂采用灌根方法施入苗盆,每盆50 mL,使土壤中细菌浓度约为1×107 cfu·g-1,以未添加菌剂的盆栽苗为对照(CK),置于植物生长室统一管理,光照为12 h·d-1,适时浇水,待出芽后每盆保留最上端芽体大小基本一致的1根插条,并摘去其他侧芽。分别于接种后30、90和150天取盆栽苗的根际土壤,每个处理随机选取3个重复,带回实验室根据不同试验目的采取不同处理。
1.2.2 杨树根际土壤酶活性的测定对采集的杨树根际土样分别进行土壤磷酸酶、脱氢酶及转化酶活性的测定。其中,土壤酸性磷酸酶的测定采用Tabatabai等(1969)的方法;土壤脱氢酶的测定采用中国科学院南京土壤研究所微生物室(1985)的方法;土壤转化酶的测定采用关松荫(1986)的方法。
1.2.3 杨树根际微生物群落多样性分析土壤微生物功能多样性采用BIOLOG-GN2微平板测定。称取不同接种处理150天的NL-895杨根际新鲜土样10.0 g(同时另取1份土样测定含水率,用于数据的校准)加入装有90 mL 0.85% NaCl无菌溶液的三角瓶中,封口后在摇床上震荡20 min(200 r·min-1),按10倍梯度稀释法稀释到10-3浓度用于接种。接种量150 μL,每样1板,3个重复,将接种好的测试板加盖置于25 ℃下恒温培养8天,连续培养192 h,期间每隔24 h用BIOLOG读板仪在590 nm下读数(余贤美等,2014)。
微生物整体活性指标采用平均颜色变化率(average well color development,AWCD)来表示,计算公式如下:AWCD=∑(Ci-R)/n,其中Ci为各反应孔的吸光值,R为对照孔的吸光值,n为培养基孔数,BIOLOG-GN2微平板n值为95,Ci-R<0的孔在计算中记为0(Kelly et al., 1998)。
采用培养96 h的数据计算Shannon指数、Simpson指数、McIntosh指数和碳源利用丰富度指数。其中,Shannon-Wiener指数(H)用于评估物种的丰富度,Simpson指数(D)用于评估某些最常见种的优势度,McIntosh指数(U)用于评估群落物种均匀度,碳源利用丰富度指数(S)指被利用碳源的总数,具体计算公式(Garland, 1997;徐万里等,2015):
| $ H = - \sum {\left({{P_i} \times \ln {P_i}} \right)} ; $ |
| $ D = 1 - \sum {{P_i}^2} ; $ |
| $ \mathit{U} = \sqrt {\sum {n_i^2} } ; $ |
S=被利用的碳源总数目(每孔中(Ci-R)>0.25的孔数)。
式中,Ci为各反应孔的吸光值,R为对照孔的吸光值;Pi为第i个非对照孔中的吸光值与所有非对照孔吸光值总和的比值,即Pi=(Ci-R)/∑(Ci-R);ni是第i孔的相对吸光值(Ci-R)。
1.3 数据分析采用Excel 2007和SPSS 22.0软件对数据进行统计分析。采用单因素(one-way ANOVA)和Duncan法进行方差分析和多重比较(α=0.05)。利用Excel 2007作图。图表中数据为平均值±标准差。
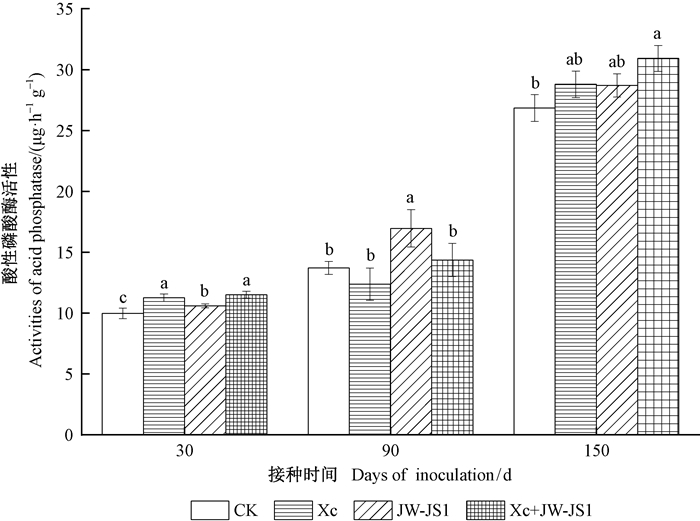
2 结果与分析 2.1 共接种JW-JS1+Xc对NL-895杨根际土壤酶活性的影响 2.1.1 对NL-895杨根际土壤磷酸酶活性的影响土壤磷酸酶是土壤中及植物体内重要的水解酶,在利用有机磷及调节植物磷营养方面具有重要作用。由图 1可知,在处理期内,不同接种处理的NL-895杨根际土壤酸性磷酸酶活性总体呈上升趋势。其中,接种30天时,各接种处理均能显著提高NL-895杨根际土壤酸性磷酸酶的活性,共接种JW-JS1 + Xc与单接种Xc之间差异不显著、而与单接种JW-JS1和CK差异显著,比CK增长了15.47%;接种90天时,单接种JW-JS1土壤酸性磷酸酶显著高于其他接种处理和CK,比CK增长了23.77%,共接种JW-JS1+Xc、单接种Xc和CK之间差异不显著;接种150天时,各接种处理均能显著提高NL-895杨根际土壤酸性磷酸酶的活性,共接种JW-JS1+Xc土壤酸性磷酸酶显著高于其他接种处理和CK,比CK增长15.21%。
|
图 1 共接种JW-JS1与Xc对NL-895杨根际土壤酸性磷酸酶活性的影响 Fig. 1 Effect of co-inoculation JW-JS1 and Xc on soil acid phosphatase activity of NL-895 poplar CK:对照;Xc:红绒盖牛肝菌;JW-JS1:荧光假单胞菌JW-JS1;Xc + JW-JS1:红绒盖牛肝菌Xc +荧光假单胞菌JW-JS1。小写字母表示在0.05水平差异显著。下同。 CK: The control; Xc: Xerocomus chrysenteron; JW-JS1: Pseudomonas fluorescens JW-JS1; Xc+JW-JS1: Xerocomus chrysenteron + Pseudomonas fluorescents JW-JS1. Data with different letters are significantly different at 0.05 leve.The same below. |
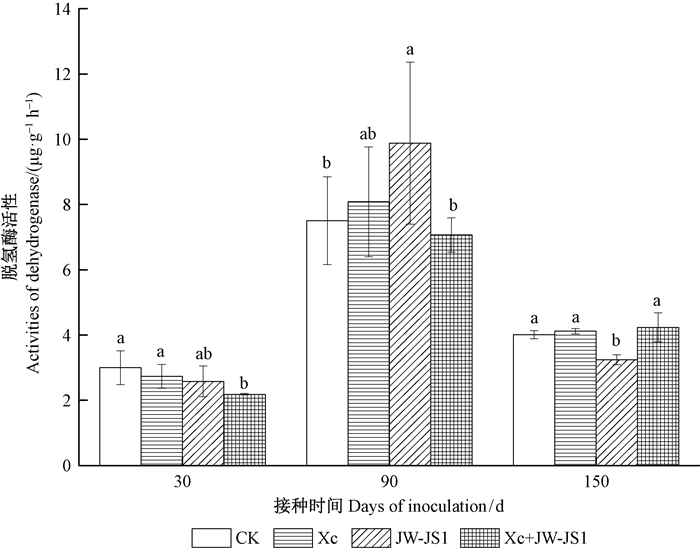
土壤脱氢酶普遍存在于活体微生物中。在土壤生态中,可以反映处理体系中微生物的量及其对有机物的降解能力。由图 2可知,在处理期内,NL-895杨根际土壤脱氢酶活性总体呈上升-下降趋势。在不同处理期内,各接种处理之间对NL-895杨根际土壤脱氢酶活性的影响不同。接种30天时,各接种处理均显著低于CK,表明接种初期对土壤脱氢酶的活性呈现抑制效应;接种90天时,与接种30天时相比,各处理土壤脱氢酶活性均大幅增强。其中,单接种JW-JS1增幅最大,活性显著高于其他接种处理和CK,比CK增长了31.73%。接种150天时,各接种处理NL-895杨根际土壤脱氢酶活性略有下降,共接种JW-JS1 + Xc与单接种Xc和CK之间差异不显著,而与单接种JW-JS1存在显著差异。
|
图 2 共接种JW-JS1与Xc对NL-895杨根际土壤脱氢酶活性的影响 Fig. 2 Effect of co-inoculation JW-JS1 and Xc on soil dehydrogenase activity of NL-895 poplar |
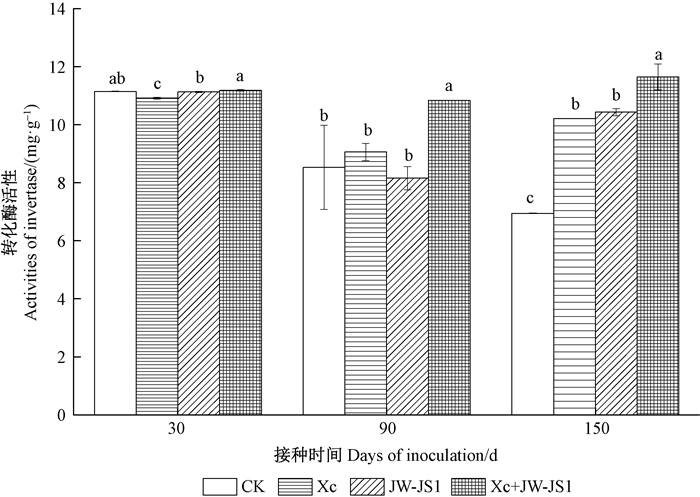
土壤转化酶又名蔗糖酶,可促进蔗糖水解生成葡萄糖和果糖,对增加土壤的可溶性营养具有重要作用,为土壤生物体提供充分能源物质。转化酶活性高说明土壤生物活性高,土壤状况良好。由图 3可知,在处理期内,NL-895杨根际土壤转化酶活性总体呈下降—上升趋势。共接种JW-JS1 + Xc NL-895杨根际土壤转化酶活性均不同程度的高于其他单接种处理和CK。接种30、90和150天时,共接种JW-JS1 + Xc NL-895杨根际土壤转化酶活性显著高于其他单接种处理和CK,比CK增长了0.36%、27.08%和67.63%。其中,接种30天时,单接种JW-JS1或Xc和CK之间差异不显著,接种90天时,单接种Xc和CK之间差异不显著,但两者与单接种JW-JS1差异显著;接种150天时,共接种JW-JS1 + Xc与单接种JW-JS1、Xc和CK之间差异显著,单接种Xc和JW-JS1之间差异不显著。
|
图 3 共接种JW-JS1与Xc对NL-895杨根际土壤转化酶活性的影响 Fig. 3 Effect of co-inoculation JW-JS1 and Xc on soil invertase activity of NL-895 poplar |
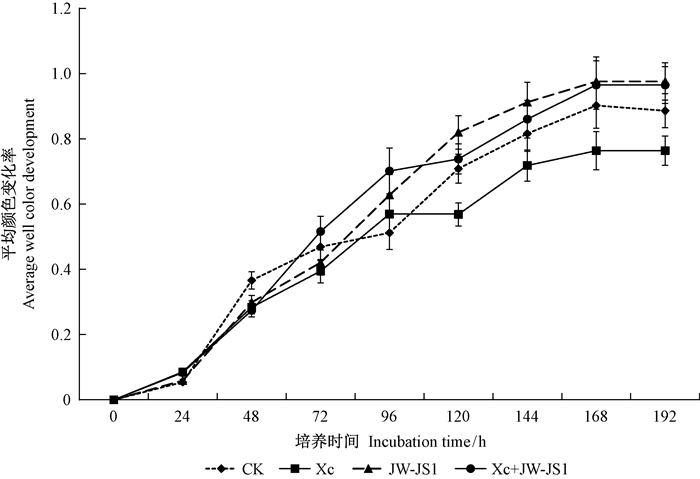
土壤微生物对BIOLOG微孔中碳源的利用情况采用平均颜色变化率(AWCD)来表示。AWCD可反映土壤微生物利用碳源的能力和代谢活性,其值越高表明土壤中微生物群落代谢活性也就越高,可用以评测土壤微生物整体活性的高低(Garland, 1997)。由图 4可知,接种150天后,不同处理土壤微生物群落代谢的AWCD值随时间变化曲线的形状符合一般微生物利用基质的规律,即存在明显的适应期、对数期和稳定期。不同接种处理土壤微生物AWCD值总体均呈先上升后稳定趋势,在144 h趋于平衡。此外,在培养初期(0 ~ 24 h)单接种Xc和共接种JW-JS1 + Xc的AWCD值明显高于单接种JW-JS1和CK,微生物群落的活性较强,碳源开始被明显利用,而单接种JW-JS1和CK的AWCD值很小,说明24 h内碳源基本未被利用;在培养24~96 h时,微生物呈指数增长,144 h后趋于平缓进入稳定期,此时表现为单接种JW-JS1、双接种JW-JS1+Xc>CK>单接种Xc;单接种Xc的AWCD值120 h后一直低于CK,表明单接种Xc土壤微生物对碳源的利用能力较低,该接种处理抑制了土壤微生物的活性。综上所述,共接种JW-JS1 + Xc在较长一段时间内能够提高土壤微生物对碳源的利用率,比单接种Xc或JW-JS1和CK对提高微生物群落活性的贡献率更大。
|
图 4 NL-895杨根际土壤微生物培养过程中AWCD值变化 Fig. 4 AWCD changes during incubation of soil microbial communities in rhizosphere of NL-895 poplar |
生物多样性指数描述了生物的类型数和丰富程度,在一定情况下可以反映生物群落物种的丰富程度及分配比例。由表 1可知,不同接种处理NL-895杨根际土壤微生物群落的Shannon丰富度指数、Simpson优势度指数、McIntosh均匀度指数和碳源利用丰富度指数差异显著(P< 0.05)。其中,共接种JW-JS1+Xc的Shannon丰富度指数和Simpson优势度指数明显低于单接种Xc或JW-JS1和CK,表明共接种JW-JS1+Xc降低了土壤微生物群落的物种丰富度,对土壤微生物群落中最常见的物种产生了明显的抑制作用;共接种JW-JS1 + Xc的McIntosh均匀度指数又明显高于单接种JW-JS1或Xc与CK,表明共接种JW-JS1+Xc提高了土壤微生物群落的物种均一性,降低了物种的多样性,3个指数均体现接种处理菌株的优势种效应,接种处理菌株繁殖速度快,数量多从而降低NL-895杨根际土壤微生物物种的多样性;共接种JW-JS1 + Xc和单接种JW-JS1的McIntosh均匀度指数和碳源利用丰富度指数明显高于单接种Xc和CK且差异显著,表明JW-JS1菌株活性较高,属于杨树根际优势种群,这与AWCD值的曲线变化趋势相一致。
|
|
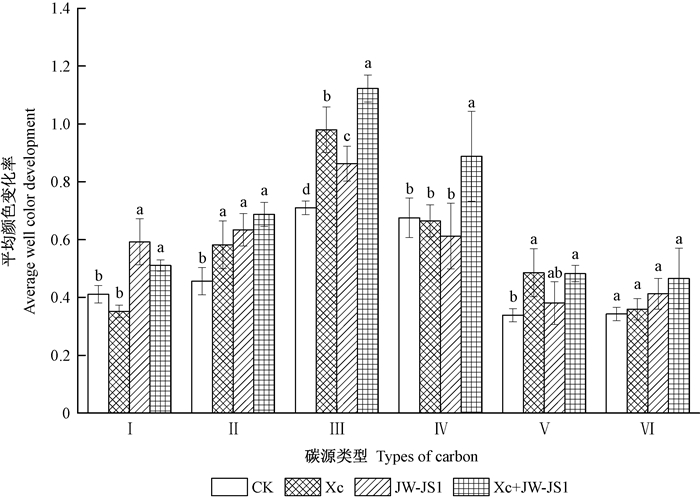
土壤微生物多样性反映了群落总体的变化,但未能反映微生物群落代谢的详细信息,研究土壤微生物对不同碳源利用能力的差异,有助于更全面地了解微生物群落代谢功能特性(孔维栋等,2005)。根据BIOLOG-GN2板的碳源类型,将95种碳源分为碳水化合物类、羧酸类、氨基酸类、胺/氨类、聚合物类和其他类,观察不同处理微生物利用碳源的吸光值变化。从图 5中可知,与CK相比,接种处理均提高了NL-895杨根际土壤微生物对6类碳源的利用率(AWCD)(其中其他类差异不显著),共接种JW-JS1+Xc显著高于单接种Xc或JW-JS1(P < 0.05)。其中,碳水化合物类的AWCD值表现为JW-JS1、Xc+JW-JS1>CK、Xc;羧酸类的AWCD值表现为Xc+JW-JS1、JW-JS1、Xc>CK;氨基酸类的AWCD值表现为Xc+JW-JS1>Xc>JW-JS1>CK;胺/氨类的AWCD值表现为Xc+JW-JS1>CK、Xc、JW-JS1;聚合物类的AWCD值表现为Xc、Xc+JW-JS1>JW-JS1>CK;其他类的AWCD值各处理间差异不显著,这也说明了不同接种处理对NL-895杨根际土壤微生物的群落代谢功能产生了显著性的影响。
|
图 5 不同接种处理NL-895杨根际土壤微生物对6类碳源的利用情况 Fig. 5 Effects of different inoculation on six groups of carbon sources utilization by soil microbial in rhizosphere soil of NL-895 poplar Ⅰ.碳水化合物类;Ⅱ.羧酸类;Ⅲ.氨基酸类;Ⅳ.胺/氨类;Ⅴ.聚合物类;Ⅵ.其他类。不同字母间代表在0.05水平差异显著。 Ⅰ.Carbohydrates; Ⅱ.Carboxylic acids; Ⅲ.Amino acids; Ⅳ.Amines; Ⅴ.Polymers; Ⅵ.Others. Different letters indicate significant difference at 0.05 level. |
土壤中的生物化学过程都是在土壤酶的催化作用下进行的(曹慧等,2003)。土壤酶系参与了土壤的发生和发育以及土壤肥力的形成和演化的过程,是土壤营养代谢的重要驱动力,其活性是土壤肥力评价的重要指标之一,可反映出土壤中各种养分代谢活性的强度和方向(关松荫,1986;武晓森等,2015)。提高土壤酶活性可以促进土壤的代谢循环,导致土壤养分形态发生相应变化,改善土壤性质和土壤肥力,从而有利于提高植物根际土壤的生产力水平(任嘉红等,2016)。付晓峰等(2016)将溶磷细菌和丛枝菌根真菌接种南方红豆杉(Taxus chinensis var. mairei)后显著增加了土壤酶(酸性磷酸酶、脱氢酶、转化酶)活力,且双接种的促进作用最为明显。本研究发现,与CK相比,无论是单接种JW-JS1或Xc,还是共接种JW-JS1 + Xc均可显著提高NL-895杨土壤酸性磷酸酶、脱氢酶和转化酶的活性,尤其是共接种JW-JS1 + Xc增幅更大,这些土壤酶活性的增加有利于NL-895杨苗木的苗高、地径及总生物量显著提高(刘辉等,2012;姚如斌等,2012),这也表明共接种JW-JS1 + Xc能够通过增强NL-895杨根际土壤酶的活性,促进土壤养分活化从而有利于NL-895杨的吸收和利用。
微生物群落结构的变化直接影响到土壤的质量和健康状况,土壤微生物多样性指数反映了根际土壤微生物群落中物种丰度及其各类型物种间的分布,多样性指数越高,土壤中微生物多样性越丰富,土壤微生态系统越复杂,功能越稳定(罗希茜等,2009;任嘉红等,2016)。BIOLOG技术用于环境微生物结构和功能多样性的研究具有灵敏度高、分辨率强、测定简便等优点,且不需要分离培养纯种微生物,可最大限度地保留微生物群落原有的代谢特征(Graham et al., 2005;田雅楠等,2011)。利用BIOLOG系统研究土壤微生物群落对碳底物利用能力至今仍是一个快速简便的好方法,可获得大量土壤微生物群落结构和功能多样性方面的信息(郑华等,2007)。本研究表明:与CK相比,无论是单接种JW-JS1或Xc,还是共接种JW-JS1 + Xc NL-895杨根际土壤微生物的AWCD值和土壤微生物多样性指数和功能多样性指数均显著增加,Shannon丰富度指数、Simpson优势度指数和McIntosh均匀度指数和碳源利用丰富度指数与CK相比均具有一定差异,尤其是共接种JW-JS1 + Xc,这说明无论是单独引入JW-JS1或Xc,还是JW-JS1+Xc共同引入对NL-895杨根际土壤微生物的整体活性有一定程度的促进作用,这可能是外源功能菌进入土壤环境后,营养物质充足适合生长,大量繁殖,种群的数量大幅度增加,微生物群落生理代谢活性高,对微平板上碳源的利用能力强,与Zhang等(2008)和付晓峰等(2016)等研究结果基本一致。
此外,共接种JW-JS1 + Xc NL-895杨根际土壤微生物的Shannon丰富度指数、Simpson优势度指数明显低于单接种Xc或JW-JS1与CK,而McIntosh均匀度指数和碳源利用丰富度指数又明显高于单接种Xc或JW-JS1与CK;单接种JW-JS1的McIntosh均匀度指数较CK差异显著(P < 0.05),说明共接种JW-JS1 +Xc和单接种JW-JS1均显著提高了土壤微生物群落的物种均一性,这可能是由于引入的JW-JS1菌株来源于杨树根际,快速适应后大量繁殖提高了NL-895杨根际土壤微生物群落的物种均一性,而降低了微生物种群的多样性,而功能多样性指数的结果正好验证了AWCD值的变化趋势。通过分析不同接种处理对NL-895杨根际微生物利用碳源情况发现,与CK相比,各接种处理提高了NL-895杨根际土壤微生物对6类碳源的利用率(AWCD)(其他类差异不显著),共接种JW-JS1 + Xc显著高于单接种Xc或JW-JS1,这充分说明不同接种处理对NL-895杨根际土壤微生物的群落代谢功能产生了显著性的影响。因此,今后可考虑进行溶磷细菌与外生菌根真菌复合菌剂的开发与推广应用,以达到有效解决杨树种植过程中存在的地力衰退问题。
随着分子生物学的发展,现有新的技术手段,如微生物的生物标记物分析法PLFA分析法、基于PCR技术的DGGE / TGGE技术、ARDRA技术和T-RFLP及其他分子生物学技术(SSCP、RISA等)已被广泛应用,今后可以结合多种方法对溶磷细菌与外生菌根真菌互作效应对根际土壤微生物群落的影响作进一步研究,以提供更加全面可靠的微生物多样性信息。
4 结论溶磷细菌荧光假单胞菌JW-JS1与外生菌根真菌红绒盖牛肝菌单接种、双接种均对NL-895杨根际土壤酸性磷酸酶、脱氢酶和转化酶活性和土壤微生物功能多样性具有一定的促进作用,这说明外源接种溶磷细菌、外生菌根真菌可以有效提高土壤酶活性,改善土壤微生物的种群结构,增加微生物的生命活动,提高土壤肥力状况,进而促进了NL-895杨的生长。此外,双接种JW-JS1 + Xc对NL-895杨根际土壤酶活性和微生物功能多样性指数的促进作用显著优于单接种,说明两者之间存在一定的互作关系,具有进一步应用的潜力。
曹慧, 孙辉, 杨浩, 等. 2003. 土壤酶活性及其对土壤质量的指示研究进展. 应用与环境生物学报, 9(1): 105-109. (Cao H, Sun H, Yang H, et al. 2003. A review:soil enzyme activity and its indication for soil quality. Chinese Journal of Applied and Environmental Biology, 9(1): 105-109. DOI:10.3321/j.issn:1006-687X.2003.01.025 [in Chinese]) |
付晓峰, 张桂萍, 张小伟, 等. 2016. 溶磷细菌和丛枝菌根真菌接种对南方红豆杉生长及根际微生物和土壤酶活性的影响. 西北植物学报, 36(2): 353-360. (Fu X F, Zhang G P, Zhang X W, et al. 2016. Effects of PSB and AMF on growth microorganisms and soil enzyme activities in the rhizosphere of Taxus chinensis var. mairei seedlings. Acta Botanica Boreali-Occidentalia Sinica, 36(2): 353-360. [in Chinese]) |
关松荫. 1986. 土壤酶及其研究法. 北京: 农业出版社. (Guan S Y. 1986. Methods of soil enzymes. Beijing: Agriculture Publishing House. [in Chinese]) |
孔维栋, 刘可星, 廖宗文, 等. 2005. 不同腐熟程度有机物料对土壤微生物群落功能多样性的影响. 生态学报, 25(9): 2291-2296. (Kong W D, Liu K X, Liao Z W, et al. 2005. Effects of organic matters on metabolic functional diversity of soil microbial community under pot incubation conditions. Acta Ecologica Sinica, 25(9): 2291-2296. DOI:10.3321/j.issn:1000-0933.2005.09.022 [in Chinese]) |
李世贵. 2010.两种木霉菌对黄瓜枯萎病菌生防作用及根际土壤微生物影响研究.北京: 中国农业科学院博士学位论文. (Li S G. 2010. Biocontrol action of two Trichoderma species against Fusarium oxysporium f. sp. cucumerinum and the effects on soil microorganisms in the rhizosphere. Beijing: PhD thesis of Chinese Academy of Agricultural Sciences.[in Chinese]) http://cdmd.cnki.com.cn/Article/CDMD-82101-2010170784.htm |
刘辉, 吴小芹, 任嘉红, 等. 2012. 荧光假单胞菌及红绒盖牛肝菌接种对NL-895杨生长和光合特征的影响. 西部林业科学, 41(1): 53-59. (Liu H, Wu X Q, Ren J H, et al. 2012. Effect of inoculating Pesudomonas fluorenscens and Xerocomus chrysenteron on growth and photosynthetic characteristics of NL-895 poplar. Journal of West China Forestry Science, 41(1): 53-59. DOI:10.3969/j.issn.1672-8246.2012.01.008 [in Chinese]) |
罗希茜, 郝晓晖, 陈涛, 等. 2009. 长期不同施肥对稻田土壤微生物群落功能多样性的影响. 生态学报, 29(2): 740-748. (Luo X Q, Hao X H, Chen T, et al. 2009. Effects of long-term different fertilization on microbial community functional diversity in paddy soil. Acta Ecologica Sinica, 29(2): 740-748. DOI:10.3321/j.issn:1000-0933.2009.02.024 [in Chinese]) |
潘超美, 郭庆荣, 邱桥姐, 等. 2000. VA菌根真菌对玉米生长及根际土壤微生态环境的影响. 土壤与环境, 9(4): 304-306. (Pang C M, Guo Q R, Qü Q J, et al. 2000. Effect of VAM fungus on the growth of core and micro-ecological environment of core rhizosphere. Soil and Environmental Sciences, 9(4): 304-306. DOI:10.3969/j.issn.1674-5906.2000.04.014 [in Chinese]) |
任嘉红, 李浩, 刘辉, 等. 2016. 吡咯伯克霍尔德氏菌JK-SH007对杨树根际微生物数量及功能多样性的影响. 林业科学, 52(5): 126-133. (Ren J H, Li H, Liu H, et al. 2016. Influence of Burkholderia pyrrocinia JK-SH007 on the microbial population and functional diversity of microbial communities in the rhizosphere soil of poplar. Scientia Silvae Sinicae, 52(5): 126-133. [in Chinese]) |
盛江梅, 吴小芹, 侯亮亮. 2014. 黑松-黄色须腹菌共生体根际菌根辅助细菌的筛选及鉴定. 东北林业大学学报, 42(5): 110-114. (Sheng J M, Wu X Q, Hou L L. 2014. Isolating and identifying mycorrhiza helper bacteria from the rhizosphere soil of Pinus thunbergii inoculated with Rhizipogen luteous. Journal of Northeast Forestry University, 42(5): 110-114. DOI:10.3969/j.issn.1000-5382.2014.05.027 [in Chinese]) |
田雅楠, 王红旗. 2011. Biolog法在环境微生物功能多样性研究中的应用. 环境科学与技术, 34(3): 50-57. (Tian Y N, Wang H Q. 2011. Application of Biolog to study of environmental microbial function diversity. Environmental Science and Technology, 34(3): 50-57. DOI:10.3969/j.issn.1003-6504.2011.03.012 [in Chinese]) |
武晓森, 周晓琳, 曹凤明, 等. 2015. 不同施肥处理对玉米产量及土壤酶活性的影响. 中国土壤与肥料, (1): 44-49. (Wu X S, Zhou X L, Cao F M, et al. 2015. Effects of different fertilization on the corn yield and soil enzyme activity in corn growth period. Soil and Fertilizer Sciences in China, (1): 44-49. [in Chinese]) |
徐万里, 唐光木, 葛春辉, 等. 2015. 长期施肥对新疆灰漠土土壤微生物群落结构与功能多样性的影响. 生态学报, 35(2): 468-477. (Xu W L, Tang G M, Ge C H, et al. 2015. Effects of long-term fertilization on diversities of soil microbial community structure and function in grey desert soil of Xinjiang. Acta Ecologica Sinica, 35(2): 468-477. [in Chinese]) |
姚如斌, 吴小芹. 2012. 高效解磷细菌与菌根真菌菌剂交互作用对杨树的促生效应. 南京林业大学学报:自然科学版, 36(5): 170-173. (Yao R B, Wu X Q. 2012. Interaction between high effective phosphate-solubilizing bacteria and mycorrhizal fungi and its effects on poplar growth. Journal of Nanjing Forestry University:Natural Science Edition, 36(5): 170-173. [in Chinese]) |
余贤美, 安淼, 王海荣, 等. 2014. 枯草芽孢杆菌Bs-15对板栗土壤微生物种群数量及功能多样性的影响. 生态环境学报, 23(4): 598-602. (Yu X M, An M, Wang H R, et al. 2014. Influence of Bacillus subtilis Bs-15 on the microbial population and functional diversity of microbial communities in the chestnut soil. Ecology and Environmental Sciences, 23(4): 598-602. DOI:10.3969/j.issn.1674-5906.2014.04.009 [in Chinese]) |
曾丽琼. 2010.几种优良外生菌根菌的应用和胶丸菌剂的制备.南京: 南京林业大学硕士学位论文. (Zeng L Q. 2010. Field application of ectomcorrhizal fungi and study on the process of capsules microbial agent. Nanjing: MS thesis of Nanjing Forestry University.[in Chinese]) http://cdmd.cnki.com.cn/Article/CDMD-10298-2010253705.htm |
张昕, 张炳欣, 喻景权, 等. 2005. 生防菌ZJY-1及ZJY-116的GFP标记及其在黄瓜根围的生态适应性. 应用生态学报, 16(11): 2144-2148. DOI:10.3321/j.issn:1001-9332.2005.11.027 |
Zhang X, Zhang B X, Yu J Q, et al. 2002. Labeling of biocontrol agents ZJY-1 and ZJY-116 gfp gene and its ecological adaptability in cucumber rhizosphere. Chinese Journal of Applied Ecology, 16(11): 2144-2148. |
郑华, 陈法霖, 欧阳志云, 等. 2007. 不同森林土壤微生物群落对Biolog-GN板碳源的利用. 环境科学, 28(5): 1126-1130. (Zheng H, Chen F L, Ouyang Z Y, et al. 2007. Utilization of different carbon sources types in Biolog-GN microplates by soil microbial communities from four forest types. Environmental Science, 28(5): 1126-1130. DOI:10.3321/j.issn:0250-3301.2007.05.034 [in Chinese]) |
中国科学院南京土壤研究所微生物室. 1985. 土壤微生物研究法. 北京: 科学出版社. (Nanjing Soil Research Institute of Chinese Academy of Sciences. 1985. Methods for soil microorganism. Beijing: cience Press. [in Chinese]) |
Abbasi M K, Sharif S, Kazmi M, et al. 2011. Isolation of plant growth promoting rhizobacteria from wheat rhizosphere and their effect on improving growth, yield and nutrient uptake of plants. Plant Biosystems, 145(1): 159-168. DOI:10.1080/11263504.2010.542318 |
Bouhraoua D, Aarab S, Laglaout A, et al. 2015. Phosphate solubilizing bacteria efficiency on mycorrhization and growth of peanut in the northwest of Morocco. American Journal of Microbiological Research, 3(5): 176-180. |
Duponnois R, Plenchette C. 2003. A mycorrhiza helper bacterium enhances ectomycorrhizal and endomycorrhizal symbiosis of Australian Acacia species. Mycorrhiza, 13(2): 85-91. DOI:10.1007/s00572-002-0204-7 |
Garland J L. 1997. Analysis and interpretation of community-level physiological profiles in microbial ecology. FEMS Microbiology Ecology, 24(4): 289-300. DOI:10.1111/j.1574-6941.1997.tb00446.x |
Graham M H, Haynes R J. 2005. Catabolic diversity of soil microbial communities under sugarcane and other land uses estimated by Biolog and substrate-induced respiration methods. Applied Soil Ecology, 29(2): 155-164. DOI:10.1016/j.apsoil.2004.11.002 |
Kelly J J, Tate R L. 1998. Use of BIOLOG for the analysis of microbial communities from zinc-contaminated soils. Journal of Environmental Quality, 27(3): 600-608. |
Kim K Y, Jordan D, McDonald G A. 1998. Effect of phosphate-solubilizing bacteria and vesicular-arbuscular mycorrhizae on tomato growth and soil microbial activity. Biology and Fertility of Soils, 26(2): 79-87. |
Moscatelli M C, Fonck M, De Angelis P, et al. 2001. Mediterranean natural forest living at elevated carbon dioxide:soil biological properties and plant biomass growth. Soil Use and Management, 17(3): 195-202. DOI:10.1079/SUM200176 |
Tabatabai M A, Bremner J M. 1969. Use of p-nitrophenyl phosphate for assay of soil phosphatase activity. Soil Biology and Biochemistry, 1(4): 301-307. DOI:10.1016/0038-0717(69)90012-1 |
Zaidi A, Khan M S. 2007. Stimulatory effects of dual inoculation with phosphate-solubilizing microorganisms and arbuscular mycorrhizal fungus on chickpea. Australian Journal of Experimental Agriculture, 47(8): 1016-1022. DOI:10.1071/EA06046 |
Zhang H H, Tang M, Chen H, et al. 2010. Effects of inoculation with ectomycorrhizal fungi on microbial biomass and bacterial functional diversity in the rhizosphere of Pinus tabulaeformis seedlings. European Journal of Soil Biology, 46(1): 55-61. DOI:10.1016/j.ejsobi.2009.10.005 |
 2019, Vol. 55
2019, Vol. 55

