文章信息
- 曹丹丹, 魏建荣, 王伟超, 王丽平, 赵正萍, 刘曙雯, 嵇保中.
- Cao Dandan, Wei Jianrong, Wang Weichao, Wang Liping, Zhao Zhengping, Liu Shuwen, Ji Baozhong.
- 松材线虫病死木皮下的南京隐翅虫(鞘翅目:隐翅虫科)
- Homalota nanjingensis(Coleoptera: Staphylinidae: Aleocharinae) Under Bark of Dead Pine Trees Infected by Bursaphelenchus xylophilus
- 林业科学, 2019, 55(1): 157-162.
- Scientia Silvae Sinicae, 2019, 55(1): 157-162.
- DOI: 10.11707/j.1001-7488.20190118
-
文章历史
- 收稿日期:2018-06-07
- 修回日期:2018-08-29
-
作者相关文章
2. 福建省长汀县林业局 长汀 366300;
3. 湖南省林业科学院 长沙 410007;
4. 南京中山陵园管理局 南京 210014;
5. 南方现代林业协同创新中心 南京林业大学林学院 南京 210037
2. Changting County Forestry Bureau of Fujian Province Changting 366300;
3. Hunan Academy of Forestry Changsha 410007;
4. Administration Bureau of Dr Sun Yat-sen's Mausoleum Nanjing 210014;
5. Co-Innovation Center for Sustainable Forestry in Southern China College of Forestry, Nanjing Forestry University Nanjing 210037
由松材线虫(Bursaphelenchus xylophilus)引起的松树萎蔫病(Pine wilt disease)是世界性的毁灭性松树病害(叶建仁等,2012),其主要借助媒介昆虫——松褐天牛(Monochamus alternatus)成虫传播危害,防治松褐天牛是控制松材线虫病的重要途径(宁眺等,2005)。为探索松材线虫病的有效防控措施,笔者于2012—2013年对松材线虫病导致的南京紫金山马尾松(Pinus massoniana)枯立木、病死木及伐倒原木皮下节肢动物类群进行调查(曹丹丹等,2013a),发现南京隐翅虫(Homalota nanjingensis)(Cao et al., 2018)与共栖的蛀干害虫——天牛、小蠹等在时间、空间生态位重叠指数及生态位相似性比例指数上均高于其他种类,跟随现象最为明显(曹丹丹等,2013a)。利用与害虫共栖的生物作为载体,携带害虫的病原微生物开展生物防治,是近年来发展较快的生物防治新方法。陈晓明(2013)利用南京隐翅虫成虫携带白僵菌菌株B13孢子防治松墨天牛幼虫,取得了一定的效果,说明该隐翅虫具有作为病原生物的载体昆虫、携带病原生物防治蛀干害虫的潜能。进一步研究南京隐翅虫的形态特征和生物学、生态学习性,对于其作为生物防治载体昆虫进行研究开发具有一定的科学和应用意义。
Homalota属隐翅虫全世界记录有72种,其生境多在树皮下(Kim et al., 2014)。由于其特殊的隐蔽性生境,且对树木无害,一直以来鲜有关注,目前尚未见Homalota属隐翅虫食性及活动节律的相关报道。本文报道南京隐翅虫不同虫态的形态特征、成虫的食性以及昼夜活动节律,以期为今后的开发利用打下基础。
1 材料与方法 1.1 供试虫源供试的南京隐翅虫于2012年3—11月采集于南京中山陵园管理局园林处储料场的松材线虫病死木(马尾松)皮下。用小毛笔将成虫、幼虫、蛹连同生境中的基质一起刷至牙签盒内,带回实验室,分别置于玻璃培养皿(直径9 cm)中,培养皿底部铺放2层湿润滤纸,滤纸湿度以潮湿不滴水为宜。滤纸上覆1~2 cm厚取自病死木树皮下的湿润碎屑,进行室内饲养。
1.2 南京隐翅虫形态特征观察将野外采回的南京隐翅虫幼虫、蛹和成虫置于双目连续变倍体视显微镜(JSZ6S和Leica M205 A)下,观察不同发育阶段个体的外部形态,并进行拍照和测量分析。口器解剖形态观察参照Hanley等(2003)的方法,在体视显微镜下解剖,将口器不同部分置于Phenom-World Phenom Pro扫描电镜下进行拍照。
1.3 南京隐翅虫成虫食性研究食料种类:南京隐翅虫成、幼虫均生活在松材线虫病病死木的树皮下,推测其食物来源可能为生境中的共栖生物。故选取病死木皮下动物作为试验食料,包括螨类(Mites)成虫、跳虫科(Poduridae)成虫、隐翅虫科(Staphylinidae)成幼虫、寄甲科(Bothrideridae)幼虫、象甲科(Curculionidae)幼虫、露尾甲科(Nitidulidae)幼虫、阎甲科(Histeridae)幼虫、郭公虫科(Cleridae)幼虫、蝇科(Muscidae)幼虫、天牛科(Cerambycidae)低龄幼虫、小蠹科(Scolytidae)幼虫、叩甲科(Elateridae)幼虫、蚁科(Formicidae)幼虫、蠼螋科(Labiduridae)幼虫、肿腿蜂科(Bethylidae)和茧蜂科(Braconidae)幼虫。以上每种食料分别设置活体及人为杀死的新鲜虫尸处理,每处理重复3次。
取食试验设计:南京隐翅虫成虫30头为1组,饥饿处理24 h后,接入玻璃培养皿(直径9 cm, 高2 cm),培养皿底部放置2~3层湿滤纸,每隔2天滴入0.5 mL蒸馏水以保持皿内湿度。将培养皿置于培养箱中黑暗条件下,温度22~24 ℃、相对湿度75%饲养。在培养皿中间放置上述食料种类中的单种单头食料,观察成虫对不同食料的取食情况。
对不同食料喜食程度的衡量标准:参照李鸿昌等(1983)的标准,略修改。将南京隐翅虫成虫的取食喜嗜程度划分为5级。当取食食料的成虫个体数量为0时,为拒食,以“-”表示;取食食料的成虫个体数量 < 25%时,认为取食现象发生,以“+”表示;取食食料的成虫个体数量在25%~50%时,为少量取食,以“++”表示;取食食料的成虫个体数量达到50%~75%时,为喜食,以“+++”表示;取食食料的成虫个体数量> 75%时,为嗜食,以“++++”表示。
1.4 南京隐翅虫昼夜活动节律研究在磨砂玻璃板上(长60 cm,宽60 cm)制作成虫活动观察区。磨砂玻璃上铺3 cm厚病死木树皮下湿润碎屑作为基质,将10个圆形的塑料培养皿(直径3.5 cm,高1 cm)对称排列成2行嵌入基质内构成捕猎陷阱。整个试验观察区域置于窗前,保持室内通风良好,以模拟外界环境条件。观察时间为2013年6月4日至6月7日,温度21~31 ℃,空气相对湿度68%。
2013年6月4日晚22:00将南京隐翅虫成虫接入观察区内,适应8 h后,6月5日早6:30开始观察试验。设置2个条件一致的观察区,每观察区放入30头南京隐翅虫成虫,尽量减少对观察试虫的干扰。观察区1的观察时间点为6:30、9:30、12:30、15:30、18:30、21:30、0:30、3:30、6:30;观察区2的观察时间点为8:00、11:00、14:00、17:00、20:00、23:00、2:00、5:00、8:00。观察结束后将2组数据整合为一天内南京隐翅虫成虫的活动节律,连续观察3天。夜间观察使用柔弱红光以减少对成虫的影响。统计陷阱捕获的成虫数量,并按下式计算期望捕获量,进而转化为特定时段的成虫活动能力。
| $ r = n\sum\limits_{i = 0}^{k - 1} {\frac{1}{{n - i}}。} $ |
式中,r 为期望值,k为在3 h时间段内实际捕捉的数量,n为试验总头数(Ottesen,1985)。
由于每个观察区在3 h间隔内新捕捉的南京隐翅虫成虫数量会越来越少,故陷阱捕获的实际隐翅虫数经以上公式计算为理论期望值。南京隐翅虫昼夜活动节律以3 h内活动能力(Activity=r/n)衡量。简单来说,就是将捕获规模(catch size)转换为活动能力值(Activity)。试验数据采用Excel 2003进行统计分析。
2 结果与分析 2.1 南京隐翅虫不同发育阶段个体的外部形态特征南京隐翅虫林间成虫活动期较长,在南京地区4—11月均有发生,其典型生境和活动场所为松树皮下潮湿基质,潮湿基质包括其他节肢动物排泄物及木屑等。
南京隐翅虫幼虫为寡足型(步甲型),前口式,口器为咀嚼式。胸足发达,行动较迅速。初孵幼虫乳白色,以后体色逐渐加深呈红褐色(图 1a)。蛹为裸蛹,长约2.5 mm,初蛹为乳白色(图 1b),后渐变为黄褐色(图 1c),室内蛹期约为9~14天。成虫(图 1 d)体狭长平行,体长1.5~2.0 mm。头、中后胸、腹部6~8节色较深,身体其他部分浅黄色。头近正方形,复眼微凸,触角位于复眼前端。中足基节窝分离,但紧紧相邻,跗式4-4-5。由于野外采样过程中未采集到南京隐翅虫的卵,室内饲喂成虫,只发现雌雄成虫呈“一字型”交配,未观察到产卵,卵的形态特征及成虫产卵习性等尚不了解。

|
图 1 南京隐翅虫外部形态特征 Fig. 1 External morphological characters of Homalota nanjingensis a.老龄幼虫Last instar larva;b.蜕及蛹Exuvium and pupa;c.蛹Pupa;d.成虫Adult. |
昆虫口器结构与取食方式、取食习性、食物性质等密切相关。解剖表明,相对于一般的咀嚼式口器,南京隐翅虫成虫上颚切齿消失或近消失,上颚切区与磨区分化不特别明显,但是仍保留明显的咀嚼式口器特征。上颚(图 2a)坚硬,切齿叶前部具小齿,臼齿叶后部粗糙。上唇覆盖在上颚的前面(图 2b),内唇膜质,具多数感器。下颚(图 2c)的轴节、茎节、下颚须正常,外颚叶退化,内颚叶端部细而具齿。下颚须(图 2d)和下唇须发达。
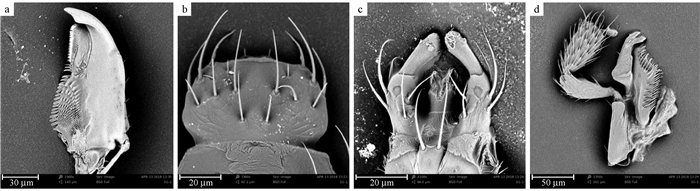
|
图 2 南京隐翅虫的口器构造(腹面观) Fig. 2 Mouthparts structures of Homalota nanjingensis(ventral view) a右上颚Right mandibles;b上唇Labrum;c下唇Labium;d下颚Maxilla. |
试验过程中分别投喂南京隐翅虫生境中共栖动物的活体及新鲜虫尸,并未观察到南京隐翅虫成虫捕食共栖动物活体的现象,但对所投新鲜虫尸则表现出不同程度的嗜食性(表 1)。其中,南京隐翅虫成虫拒食螨类成虫以及寄甲科、露尾甲科、阎甲科、郭公虫科、肿腿蜂科及茧蜂科的幼虫;取食小蠹科、象甲科、叩甲科、蚁科、蠼螋科幼虫,取食以上食料的南京隐翅虫成虫个体数量均 < 8头;少量取食天牛幼虫的成虫个体数量8~15头;喜食蝇科幼虫的成虫个体数量为15~23头;嗜食跳虫科成虫的成虫个体数量>23头。试验中还发现南京隐翅虫成虫会将死亡的隐翅虫幼虫尸体大部分取食干净,取食后尸体只剩下坚硬的外骨骼。
|
|
室内试验期间,未发生南京隐翅虫成虫死亡情况,说明所提供的试验条件比较适合成虫。由图 3可以看出,南京隐翅虫成虫昼夜活动有2个高峰期,分别为8:00—11:00和20:00—22:00,晚上的峰值稍低于上午。这种现象的成因可能与树皮下温度等条件有关,9:30后气温升高,活动力逐渐下降,傍晚17:00后活动力逐渐回升,直至夜晚21:30后达到峰值。此后,活动力下降可能与温度逐渐降低有关,直至凌晨5:00又开始回升,并于9:00后达到峰值。上述结果表明,南京隐翅虫成虫对温度等环境条件比较敏感。

|
图 3 南京隐翅虫成虫昼夜活动节律 Fig. 3 Circadian rhythm of Homalota nanjingensis adults activity |
南京隐翅虫隶属的前角隐翅虫亚科(Aleocharinae)是隐翅虫科的最大类群,食性复杂,多为捕食性和菌食性(曹丹丹等,2013b)。而室内取食选择行为试验表明,南京隐翅虫成虫能取食人为杀死的5目9科节肢动物的尸体,却并未对共栖动物活体表现出攻击并捕食的行为。Jałoszyński(2012)通过室内观察Scydmaenus hellwigii[隐翅虫总科(Staphylinidae):苔甲亚科(Scydmaeninae)]取食行为,表明相较于软体的壁虱Acari和粉螨科Acaridae的生物活体,S.hellwigii更倾向于取食新鲜的弹尾目昆虫尸体及体积较大的跳虫虫体的碎片。以上结果说明,这些隐翅虫的取食策略符合行为生态学中的“最优觅食理论”(尚玉昌,2001),即为了获得最大的觅食效率,会优先选择较易获得的食物种类,而不是主动搜寻和追逐的食物,以节省自身能量、利于种群的生存和繁衍生息。
在鞘翅目甲虫中,腐食性和菌食性被认为起源较早。具有咀嚼式口器的昆虫,口器各部分的构造随虫态、食性、习性等略有变化。南京隐翅虫成虫口器构造与印红等(2005)报道的腐食性粪堆粪金龟(Geotrupes sterlorarius)、大瘤皮金龟[Trox (Trox) cadareinus]、雅蜉金龟(Aphodius elegans)、驼金龟属(Phaeochrous sp.)、臭蜣螂(Copris ochus)和绣红金龟(Ochodaeus serrugineus)成虫口器有相似性,即:上唇膜质,唇根发达,内唇着生浓密的感觉毛;下颚轴节为三角形,茎节3个骨片均明显;下颚须4节,内颚叶发达,端部钩状或具栉齿,外颚叶相对退化;成虫常常成群取食尸体,取食时不需要内或外颚叶辅助切割食物,故外颚叶呈现退化趋势。由此推测,咀嚼式口器的昆虫长期取食松软的动物尸体或者捕食软体动物,将会导致口器各部分构造和功能产生适应性变化。此外,南京隐翅虫成虫上颚有发达的上颚切区和磨区,表明其取食的食物相对有一定的韧性或坚硬度,但是否取食植物类或菌丝等尚待进一步研究。
动物的昼夜活动节律是一种复杂的生物学现象,是动物对各种环境条件变化的综合适应,如光照、温度、湿度等非生物条件和食物条件、种内社群关系和种间关系等生物因素(肖春印等,2009)。准确把握昆虫的各种行为活动规律,可以为昆虫寄主、配偶、产卵场所定位等行为生态学研究提供准确的研究时间段,使行为学研究更加准确可靠(吕飞等,2015)。根据本研究推测影响南京隐翅虫成虫“双峰型”昼夜活动节律的主要环境因素为温度。但本研究只在6月初进行了室内试验观察,野外及不同季节种群的活动节律、其栖息场所伴生动物对活动节律影响、觅食和搜寻配偶等与活动节律的关系等,还有待进一步研究。
与目标害虫共栖或重叠生态位中具有关系紧密的昆虫,具有作为载体昆虫传递目标害虫的病原物的潜力,是开展目标害虫生物防治的一种方法(赵正萍等,2015)。这种方法能使病原物或天敌生物达到人工措施难以到达的微生境或特殊隐蔽场所,从而提高防治效果。载体昆虫种类的选择与室内繁殖饲养,是实施这种方法的前提。前期研究表明南京隐翅虫具有作为载体昆虫防治共栖蛀干害虫的潜力,如防治松材线虫病媒介松褐天牛等松树蛀干害虫的幼虫。但南京隐翅虫生物、生态学特性和室内繁育技术等,还需要开展更多的研究工作,才能实现其作为载体昆虫的应用价值。
4 结论南京隐翅虫幼虫为寡足型(步甲型),蛹为裸蛹,成虫体狭长平行,体长1.5~2.0 mm,头、中后胸和腹部第6~8节色较深,身体其他部分浅黄色,外部形态描述可为南京隐翅虫的野外识别提供参考。南京隐翅虫成虫具有明显的咀嚼式口器特征,但上颚切齿消失或近消失,上颚切区与磨区分化不特别明显,该结构的变化应与其长期取食刚刚死亡的节肢动物尸体密切相关。南京隐翅虫昼夜活动节律的高峰期为8:00—11:00和20:00—22:00。本研究的结论为南京隐翅虫的室内饲养和可能的进一步利用提供了基础资料。
曹丹丹, 嵇保中, 刘曙雯, 等. 2013a. 松材线虫病死木皮下节肢动物生态位及跟随性评价. 生态学杂志, 32(11): 3015-3021. (Cao D D, Ji B Z, Liu S W, et al. 2013a. Niches and following performance evaluation of arthropod populations under the barks of dead pine trees caused by Bursaphelenchus xylophilus.. Chin J Ecol, 32(11): 3015-3021. [in Chinese]) |
曹丹丹, 嵇保中, 刘曙雯, 等. 2013b. 隐翅虫成虫取食、防御和生殖行为. 环境昆虫学报, 35(6): 815-826. (Cao D D, Ji B Z, Liu S W, et al. 2013b. The feeding, defensive and reproductive behavior of adult staphlinids (Insecta:Coleoptera:Staphylinidae). J Enviro Entomol, 35(6): 815-826. [in Chinese]) |
陈晓明. 2013.利用隐翅虫携带病原菌防治松墨天牛技术研究.南京: 南京林业大学硕士学位论文. (Chen X M. 2013. Researches on the control technology of Monochamus alternatus by use of entomopathogenic fungi carried by rove beetle. Nanjing: MS thesis of Nanjing Forestry University.[in Chinese]) http://cdmd.cnki.com.cn/Article/CDMD-10298-1013046236.htm |
李鸿昌, 席瑞华, 陈永林. 1983. 内蒙古典型草原蝗虫食性的研究Ⅰ. 罩笼供食下的取食特性.生态学报, 3(3): 214-228. (Li H C, Xi R H, Chen Y L. 1983. Studies on the feeding behaviour acridoids in the typical steppe subzone of the Nei Mongol autonomous region Ⅰ. Characteristics of food selection within the artificial cages. Acta Ecologica Sinica, 3(3): 214-228. [in Chinese]) |
吕飞, 海小霞, 王志刚, 等. 2015. 人工光暗条件下花绒寄甲成虫活动行为节律. 昆虫学报, 58(6): 658-664. (Lü F, Hai X X, Wang Z G, et al. 2015. Circadian behaviors of the parasitic beetles, Dastarcus helophoroides (Fairmaire) (Coleoptera:Bothrideridae) under artificial light/dark conditions. Acta Entomologica Sinica, 58(6): 658-664. [in Chinese]) |
宁眺, 方宇凌, 汤坚, 等. 2005. 松材线虫及其传媒松墨天牛的监测和防治现状. 昆虫知识, 42(3): 264-269. (Ning T, Fang Y L, Tang J, et al. 2005. Current status of monitoring strategies and control techniques for Bursaphelenchus xylophilus and its vector Monochamus alternatus.. Chinese Bulletin of Entomology, 42(3): 264-269. DOI:10.3969/j.issn.0452-8255.2005.03.008 [in Chinese]) |
尚玉昌. 2001. 行为生态学. 北京: 北京大学出版社. (Shang Y C. 2001. Behavioural Ecology. Beijing: Peking University Press. [in Chinese]) |
肖春印, 丛晓娜, 刘小侠, 等. 2009. 黑腹果蝇昼夜活动节律及行为时间分配. 昆虫知识, 46(2): 298-301. (Xiao C Y, Cong X N, Liu X X, et al. 2009. Circadian rhythms and diurnal time allocation in Drosophila melanogaster adults. Chinese Bulletin of Entomology, 46(2): 298-301. DOI:10.3969/j.issn.0452-8255.2009.02.023 [in Chinese]) |
叶建仁, 黄麟. 2012. 松材线虫病病原学研究的几个问题. 中国森林病虫, 31(5): 13-21, 44. (Ye J R, Huang L. 2012. Some aspects of the pathogen of the pine wilt disease. Forest Pest and Disease, 31(5): 13-21, 44. DOI:10.3969/j.issn.1671-0886.2012.05.004 [in Chinese]) |
印红, 任国栋. 2005. 腐食性金龟甲成虫口器形态学研究. 昆虫分类学报, 27(2): 103-110. (Yin H, Ren G D. 2005. Morphological study on the mouthparts of adult saprophagous scarab beetles (Coleoptera:Scarabaeoidea). Entomotaxonomia, 27(2): 103-110. DOI:10.3969/j.issn.1000-7482.2005.02.004 [in Chinese]) |
赵正萍, 嵇保中, 刘曙雯, 等. 2015. 利用昆虫携带病原物实施生物防治的研究进展. 南京林业大学学报:自然科学版, 39(2): 155-162. (Zhao Z P, Ji B Z, Liu S W, et al. 2015. Research progress of biological control by use of insects to deliver pathogens. Journal of Nanjing Forestry University:Natural Sciences Edition, 39(2): 155-162. [in Chinese]) |
Cao D D, Wei J R, Liu S W, et al. 2018. A new species of Homalota Mannerheim, 1830 (Coleoptera:Staphylinidae:Aleocharinae) from Nanjing, China. Zootaxa, 4444(3): 327-332. DOI:10.11646/zootaxa.4444.3 |
Hanley R S, Ashe J S. 2003. Techniques for dissecting adult Aleocharine beetles (Coleoptera:Staphylinidae). Bulletin of Entomological Research, 93(1): 11-18. |
Jałoszyński P. 2012. Adults of European ant-like stone beetles (Coleoptera:Staphylinidae:Scydmaeninae) Scydmaenus tarsatus Müller & Kunze and Scydmaenus hellwigii (Herbst) prey on soft-bodied arthropods. Entomol Sci, 15(1): 35-41. |
Kim Y H, Ahn K J. 2014. Taxonomy of the genus Homalota Mannerheim in Korea (Coleoptera, Staphylinidae, Aleocharinae). ZooKeys, 447: 109-123. DOI:10.3897/zookeys.447.7728 |
Ottesen P S. 1985. Diel activity patterns of South Scandinavian high mountain ground beetles(Coleoptera, Carabidae). Ecography, 8(3): 191-203. DOI:10.1111/eco.1985.8.issue-3 |
 2019, Vol. 55
2019, Vol. 55

