文章信息
- 张扬, 杜琳, 唐贤丰, 刘唤唤, 周功克, 柴国华.
- Zhang Yang, Du Lin, Tang Xianfeng, Liu Huanhuan, Zhou Gongke, Chai Guohua.
- 杨树BAG基因的鉴定及表达模式分析
- Identification and Expression Pattern Analyses of Populus BAG Genes
- 林业科学, 2019, 55(1): 138-145.
- Scientia Silvae Sinicae, 2019, 55(1): 138-145.
- DOI: 10.11707/j.1001-7488.20190116
-
文章历史
- 收稿日期:2018-02-22
- 修回日期:2018-03-23
-
作者相关文章
2. 中国科学院大学 北京 100049
2. University of Chinese Academy of Sciences Beijing 100049
杨树(Populus)生长快、易繁殖、成材早、产量高、适应性强,是世界上分布最广的树种之一,也是我国北方地区主要的造林树种。而且,杨树基因组已测序,并有较为成熟的遗传转化体系,因而已成为林木功能基因组学研究的模式树种(尹吴等, 2017)。
BAG(Bcl-2-associated athanogene)蛋白是动、植物中较为保守的一类蛋白,它们的C端均含有该蛋白家族特有的结构域——BAG结构域(BAG domain)。BAG蛋白最早在动物中被发现,它的C端结合Hsp70,N端与多种分子伴侣绑定,形成三元复合体,发挥分子伴侣的“桥梁作用”。功能研究表明,动物BAG蛋白通过调控蛋白激酶、受体信号转导以及转录因子的活性,影响分裂、迁移、分化和死亡等多种细胞活动,因其与人类癌症等重大疾病相关,因而一直是该领域研究的热点(Cheung et al., 2000; Brive et al., 2001; Frydman, 2001)。近些年,随着生物信息学技术的发展,BAG蛋白陆续在拟南芥(Arabidopsis thaliana)、小麦(Triticum aestivum)、水稻(Oryza sativa)、大豆(Glycine max)、二倍体雷蒙德氏棉(Gossypium raimondii)、番茄(Solanum lycopersicum)和葡萄(Vitis vinifera)中被鉴定出来(Yan et al., 2003)。大多数植物BAG蛋白参与抗逆,也有一小部分BAG蛋白涉及到生长发育。例如,拟南芥AtBAG5不仅能够调节ROS生成,还可以调节SAGs(senescence-associated genes)表达调控叶片衰老(Liet al.,2016a)。AtBAG6能够与BAGP1(BAG-Associated GRAM Protein)、APCB1(Aspartyl Protease Cleaving BAG)分别互作,形成复合体,共同参与抵御真菌感染(Liet al.,2016b)。水稻OsBAG4和EBR1组成蛋白复合体,使得EBR1通过泛素化BAG4来控制其蛋白稳定水平参与抗病,而且也抑制生长发育,导致植株矮小(You et al., 2016)。葡萄HSG1在正常情况下不表达,但在热胁迫条件下,叶片和果实中的表达量急剧升高,促进CONSTANS表达,抗热性增强,植物提前开花(Kobayashi et al., 2012)。大量的证据证明植物BAG蛋白的作用机理与动物BAGs类似,可以与其他蛋白互作,在逆境和生长发育中扮演分子桥梁的作用。但是截至目前,尚未发现杨树BAG基因的功能报道。
本文通过生物信息学在毛果杨中鉴定了14个PtrBAG家族成员,对其进化和表达模式进行了系统分析,同时也鉴定了多个可能参与杨树木材形成和抗热的BAG基因。这些结果为解析PtrBAG基因在杨树中的生物学功能奠定了基础。
1 材料与方法 1.1 鉴定杨树(毛果杨)及水稻、小立碗藓的BAG蛋白在TAIR网站(https://www.arabidopsis.org)下载拟南芥BAG蛋白家族7个成员的蛋白序列,将其输入Phytozome (https://phytozome.jgi.doe.gov)搜索与之同源的杨树、水稻和小立碗藓(Physcomitrella patens)BAG蛋白。
1.2 杨树BAG蛋白聚类分析和功能域预测将4个代表性物种(杨树、拟南芥、水稻和小立碗藓)的BAG蛋白放入Clustal X进行多序列比对分析。聚类分析结果放入MEGA5.0软件中,采用邻接法(Neighbor-Joining)构建进化树(Tamura et al., 2011),bootstrap值设置为1 000。另外,应用在线软件CDD-search(https://www.ncbi.nlm.nih.gov/cdd)对杨树BAG蛋白功能域进行预测。
1.3 杨树BAG基因抗旱表达模式分析基于在线数据库eFP (http://bar.utoronto.ca)中杨树芯片数据(GSE15242),检测杨树14个BAG基因在2个品种(DN34,P. deltoides×P. nigra;NM6,P. nigra×P. maximowiczii)中不同时段(黎明、正午、傍晚和午夜)经干旱处理不同时间的表达谱(Wilkins et al., 2009),应用Genesis(v1.8.1)软件(Sturn et al., 2002)对其抗旱表达模式进行热图分析。杨树干旱处理的大体过程为:温室培养6周的杨树品种DN34连续控水12天,NM6连续控水14天。
1.4 杨树BAG基因的抗热表达模式分析以温室培养1个月的‘南林895’杨(Populus deltoides×P. euramericana ‘Nanlin895’)为材料,参照中国林业科学研究院张进等(2013)的方法,在45 ℃下处理3 h,按照本文作者Chai等(2014)的方法提取RNA并反转录成第1链cDNA。利用Takara公司的2×SYBR Green Realtime PCR Master Mix在罗氏480上进行qRT-PCR分析。引物见表 1。扩增条件为95 ℃ 2 min;95 ℃ 10 s, 55 ℃ 15 s, 72 ℃ 10 s, 循环40次;95 ℃ 1 min, 60 ℃ 30 s, 95 ℃ 30 s。
|
|
将杨树BAG基因探针号输入在线软件eFP (http://bar.utoronto.ca)检测这些基因在北美香脂杨(Populus balsamifera)不同组织的相对表达量(芯片数据,GSE13990),应用Genesis(v1.8.1)软件进行热图分析。在此基础上,选取温室培养2个月的‘南林895’杨的根、叶、芽、上部茎(第10节)、中部茎(第25节)和基部茎(第40节),按照上述方法利用qRT-PCR分析BAG 2和BAG 12基因的组织表达模式。
2 结果与分析 2.1 杨树BAG蛋白的生化特性以拟南芥7个BAG蛋白的氨基酸序列为诱饵,利用在线软件Phytozome在毛果杨中找到14个BAG蛋白。这些蛋白的C端都包含1个由70~80个氨基酸组成的BAG结构域,基于其在染色体上的位置,按照国际命名法将其命名为PtrBAG1 —PtrBAG14(表 2)。大多数PtrBAG基因包含3~4个外显子,编码的蛋白由300~400个氨基酸组成,等电点在8~10之间。
|
|
为了深入了解杨树BAG家族成员的特性,利用NJ方法构建了杨树、拟南芥、水稻和小立碗藓BAG蛋白的进化树。如图 1所示,BAG家族大体能被分为2个亚家族:第1个亚家族的蛋白N端大都含有UBL(ubiquitin-like,类泛素化)结构域,这类蛋白主要包括杨树、水稻和拟南芥BAG,只有2个小立碗藓的BAG蛋白(Pp3c423970V3.1和Pp3c2611200V3.1)在这个亚家族;第2个亚家族的蛋白在BAG结构域的N端含有植物特有的IQ(calmodulin-binding motif,钙调蛋白结合模块)结构域,这类蛋白包含大量的小立碗藓的BAG蛋白成员,只有3个杨树BAG蛋白(PtrBAG4、PtrBAG6和PtrBAG13)落在这个亚家族中。
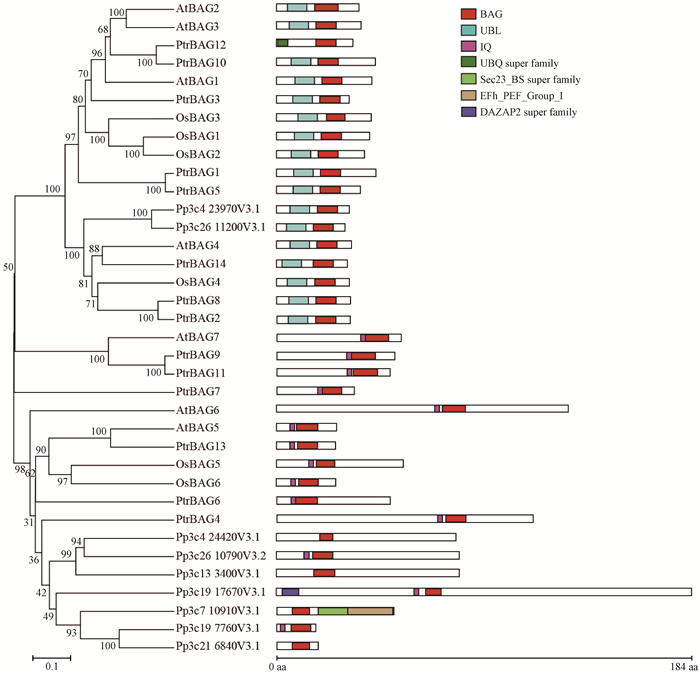
|
图 1 杨树(Ptr)、拟南芥(At)、水稻(Os)和小立碗藓(Pp)BAG蛋白的结构及聚类分析 Fig. 1 Protein structure and phylogeny analysis of BAG family members from Populus (Ptr), Arabidopsis (At), rice (Os) and moss (Pp) 杨树(毛果杨)、拟南芥、水稻和小立碗藓全长BAG蛋白利用Clustal X软件进行比对,MEGA5.0软件聚类分析,采用邻接法(Neighbor-Joining)构建进化树,bootstrap值设置为1 000。利用在线软件CDD-search(https://www.ncbi.nlm.nih.gov/cdd)预测蛋白结构域。 Full-length BAG proteins from poplar (Populus trichocarpa), Arabidopsis thaliana, rice (Oryza sativa) and moss (Physcomitrella patens) were aligned and clustered using Clustal X and MEGA5.0, respectively. Phylogeny tree was constructed with the Neighbor-Joining method. Bootstrap value, 1 000. Domains of these poplar PtrBAG proteins were predicted using online CDD-search software (https://www.ncbi.nlm.nih.gov/cdd). |
植物BAG基因普遍认为与抗逆性相关(Doukhanina et al., 2006)。利用已有的杨树芯片数据(GSE15242)(Wilkins et al., 2009)分析杨树14个BAG基因应对干旱胁迫的时空表达模式。结果表明只有极少数BAG基因在2个杂交种(DN34,P. deltoides × P. nigra;NM6,P. nigra×P. maximowiczii)不同时段(黎明、正午、傍晚和午夜)经干旱处理时表达量发生显著变化(图 2)。BAG 14 在黎明和正午干旱处理时诱导表达,而BAG 1 在午夜干旱处理时抑制表达。这些结果表明大部分杨树BAG基因可能在抗旱胁迫中不起作用。

|
图 2 杨树BAG基因在干旱处理下的表达谱 Fig. 2 Expression profiles of poplar BAG genes under drought treatment 杨树不同品种(DN34:P. deltoides×P. nigra; NM6:P. nigra×P. maximowiczii)在不同时间段(黎明、正午、傍晚、午夜)进行干旱处理时BAG基因相对表达量(芯片数据,GSE15242)。利用Genesis(v1.8.1)软件对其进行热图分析。 Expression data of Populus BAG genes were obtained from microarray data (GSE15242), which was generated on two untreated or drought-treated hybrid poplars (DN34, P. deltoides×P. nigra; NM6, P. nigra ×P. maximowiczii) at different time points (predawn, midday, later day, midnight). Heat map was generated using the Genesis (v1.8.1) software. |
按照已报道的研究方法(张进等, 2013),利用qRT-PCR检测杨树14个BAG基因是否在抗热性中发挥作用。结果如图 3所示,在热胁迫条件下,所有基因的表达量都发生明显变化。其中,BAG1、BAG4、BAG6、BAG7和BAG 8表达被激活,而且BAG 4和BAG 6被上调超过90倍;而另9个BAG基因表达在热胁迫下出现不同程度地下降。这些结果说明杨树BAG基因不同成员在抗热过程中可能发挥相反作用。
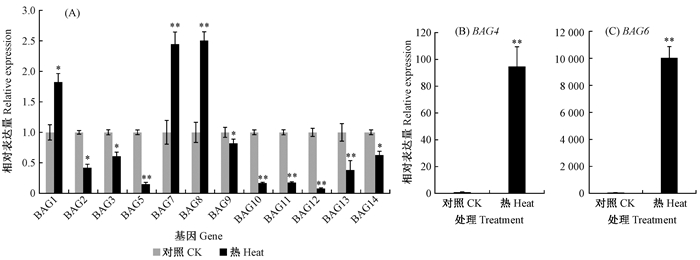
|
图 3 杨树BAG基因在高温处理下的表达模式 Fig. 3 Expression patterns of Populus BAG genes under heat treatment 温室培养1个月的‘南林895’杨42 ℃处理3 h,提取RNA并反转录成第1链cDNA,利用qRT-PCR检测BAG基因的表达量。设置3个生物学重复。应用SPSS软件进行显著性分析:n=3,t-test,*P < 0.05,差异显著;**P < 0.01,差异极显著。 Total RNA isolation and cDNA synthesis were performed from one-month-old poplar (Populus deltoides×P. euramericana 'Nanlin895') treated at 42 ℃ for 3 h. Expression of PtrBAG genes was detected by qRT-PCR. Three biological repeats were conducted. The SPSS software was used for the significance analysis of n=3, t-test, *P < 0.05, significant; **P < 0.01, extremely significant. |
首先利用已有的杨树芯片数据(GSE13990)(Wilkins et al., 2008)分析杨树BAG基因在北美香脂杨不同组织(根、叶、芽、雌花序、雄花序和木质部)中的相对表达量。结果如图 4所示,BAG 2 和BAG 12 在茎干木质部中大量表达,而其他BAG基因在被检测各个组织中表达量均较低。进一步利用qRT-PCR检测BAG 2 和BAG 12 在‘南林895’杨6个组织(根、叶、芽、上部茎、中部茎和下部茎)中的表达模式。与芯片数据类似,这2个基因在叶片中的表达量最低,而在木质部分化旺盛的中部茎表达量最高(图 5)。
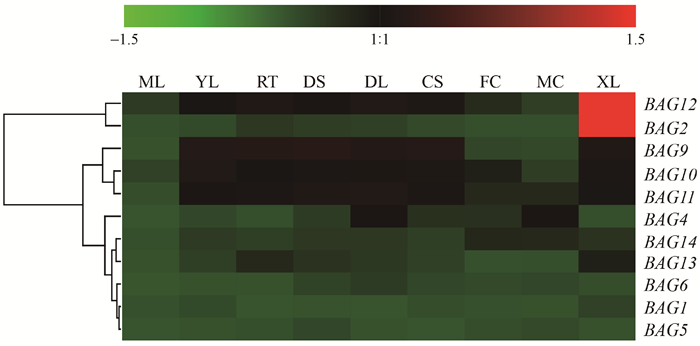
|
图 4 杨树BAG基因的组织表达谱 Fig. 4 Tissue expression profiles of Populus BAG genes 杨树BAG基因在北美香脂杨不同组织中的表达量(芯片数据,GSE13990)输入Genesis(v1.8.1)软件进行热图分析。ML:成熟叶;YL:幼叶;RT:根;DS:暗培养幼苗,黄化;DL:暗培养幼苗,黄化,光照3 h;CS:持续光照幼苗;FC:雌花序;MC:雄花序;XL:木质部。 Heatmap was generated with Genesis (v1.8.1) based on microarray data (GSE13990) of BAGs expression in different tissues of Populus balsamifera. ML: Mature leaf; YL: Young leaf; RT: Root; DS: Dark-grown seedling, etiolated; DL: Dark-grown seedling, etiolated, exposed to light for 3 h; CS: Continuous light-grown seedling; FC: Female catkins; MC: Male catkins; XL: Xylem. |
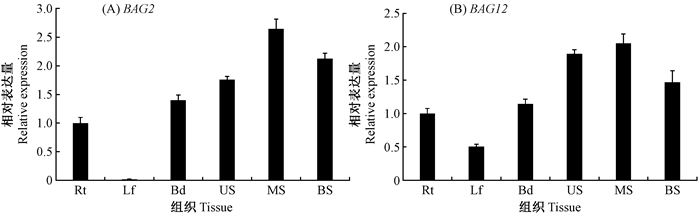
|
图 5 杨树BAG 2 和BAG 12 基因的组织表达模式 Fig. 5 Expression patterns of BAG 2 and BAG 12 in six tissues 选取温室培养2个月的‘南林895’杨的根、叶、芽、上部茎(第10节)、中部茎(第25节)和基部茎(第40节),提取RNA后反转录进行qRT-PCR分析。设置3个生物学重复。Rt:根;Lf:叶片;Bd:芽;US:上部茎;MS:中部茎;BS:下部茎。 Total RNA isolation and qRT-PCR analysis were performed on roots (Rt), leaves (Lf), bud (Bd), upper stems (US, section 10th), middle stems (MS, section 25th), and basal stems (BS, section 40th) of two-month-old 'Nanlin895' poplar. |
杨树是我国重要的速生用材树种,鉴定木材形成和抗逆相关的基因并利用基因工程对其进行遗传操控具有重要意义。已有一些研究表明,植物BAG基因在生长发育和逆境胁迫等过程中发挥作用(Gonzalez-Arzola et al., 2015; Kang et al., 2006),因而有必要在杨树中鉴定BAG基因,并鉴定其生物学功能。本研究通过生物信息学在毛果杨中首次鉴定了14个PtrBAG基因,并分析了它们与拟南芥、水稻和小立碗藓中BAG基因的进化关系。这些基因编码的蛋白被分为2个亚家族,差别主要在它们的N端。第1个亚家族包括大部分的杨树、拟南芥和水稻BAG蛋白。这类蛋白除了包含BAG结构域之外还有UBL(ubiquition-like)结构域,而UBL结构域被证明参与降解目标蛋白。例如,在酵母中,BAG6通过UBL结构域与26S蛋白酶体的Rpn10亚基(PSMD4)互作,作为桥梁将一些蛋白质聚脲基化使其降解(Payapilly et al., 2014)。这个亚家族的杨树PtrBAG蛋白包含高保守的UBL结构域,意味着它们也可能作为分子桥梁参与降解某些蛋白。第2个亚家族包含大部分的小立碗藓BAG蛋白。这个亚家族的蛋白除了包含BAG结构域之外还有植物特有的IQ结构域,而IQ结构域能够结合钙调蛋白CaM(Calmodulin),依赖Ca2+浓度调控下游通路。例如,在拟南芥中,低Ca2+水平诱导AtBAG5的BAG结构域与Hsc70结合,激活ROS的合成和SAG的表达,导致叶片发生早衰;高Ca2+水平时,BAG结构域不能与Hsc70结合,切断了该通路的后续步骤(Li et al., 2016a)。本研究通过进化分析发现杨树PtrBAG4和PtrBAG6处于第2亚家族,包含IQ结构域,意味着它们的生物学功能可能与Ca2+信号相关。
已有多项研究表明植物BAG基因参与逆境胁迫(Doukhanina et al., 2006)。本研究的qRT-PCR结果表明大部分杨树BAG基因可能与干旱胁迫无关,而参与调控抗热性。特别是,杨树BAG 4 和BAG 6 的表达量在热处理条件下急剧增加,达到上百倍。在拟南芥中,AtBAG7被证实通过不同途径参与热胁迫。AtBAG7作为协调ER和核信号的载体,通过结合BiP3和bZIP28作为UPR通路中的一环来减弱热胁迫带来的损伤(Li et al., 2017)。最近研究表明AtBAG7受高温诱导在ER上被苏素化(类泛素化,sumoylate),转移到细胞核中与WRKY29互作,进而激活抗热相关基因表达。而且WRKY29能够结合AtBAG 7 启动子中的W-box元件,反馈正调控AtBAG 7 表达(Williams et al., 2010)。本文发现AtBAG 7 在杨树中的同源基因BAG 7 和BAG 11 在热胁迫条件下分别被诱导和抑制,意味着这2个基因可能在应答热胁迫中发挥相反的作用。通过组织表达谱和qRT-PCR分析表明杨树BAG 2 和BAG 12 在茎干木质部中大量表达,而在其他组织中的表达量较低,说明这2个基因可能参与木材形成。以前研究表明,大多数拟南芥BAG基因在茎、种子、花瓣、幼苗及未开放的花蕾等生长发育旺盛的组织中高表达(Schmid et al., 2005)。这说明木本植物和草本植物在进化过程中某些BAG基因发生功能异化。
4 结论杨树PtrBAG蛋白家族包含14个成员,按照蛋白结构和聚类分析可以分为2个亚家族,第1亚家族包含大部分成员。大部分杨树BAG基因可能与抗旱无关,但参与调控抗热性,而且某些成员在热胁迫中起相反作用。特别需要强调的是,杨树BAG 4 和BAG 6 表达能够被热胁迫剧烈诱导,意味着这2个基因在热胁迫中起重要作用。另外发现杨树BAG 2 和BAG 12 也可能在木材形成过程中发挥作用。
尹吴, 孙伟博, 周燕, 等. 2017. 毛果杨Rubisco活化酶基因的克隆与功能分析. 林业科学, 53(4): 83-95. (Yin W, Sun W B, Zhou Y, et al. 2017. Cloning and functional analysis of Rubisco activase gene from Populus trichocarpa.. Scientia Silvae Sinicae, 53(4): 83-95. [in Chinese]) |
张进, 李建波, 刘伯斌, 等. 2013.杨树Hsp90基因家族亚细胞定位及胁迫响应分析.中国林学会林木遗传育种分会第七届全国林木遗传育种学术大会. (Zhang J, Li J B, Liu B B, et al. 2013. Subcellular localization and stress response analysis of poplar Hsp90 gene family. National Tree Genetics and Breeding Academic Conference, Tree Genetics and Breeding Branch, Chinese Society of Forestry.[in Chinese]) |
Brive L, Takayama S, Briknarova K, et al. 2001. The carboxyl-terminal lobe of Hsc70 ATPase domain is sufficient for binding to BAG1. Biochemical and Biophysical Research Communications, 289(5): 1099-1105. DOI:10.1006/bbrc.2001.6087 |
Chai G H, Qi G, Cao Y P, et al. 2014. Poplar PdC3H17 and PdC3H18 are direct targets of PdMYB3 and PdMYB21, and positively regulate secondary wall formation in Arabidopsis and poplar. New Phytologist, 203(2): 520-534. DOI:10.1111/nph.12825 |
Cheung J, Smith D F. 2000. Molecular chaperone interactions with steroid receptors:an update. Molecular Endocrinology, 14(7): 939-946. DOI:10.1210/mend.14.7.0489 |
Doukhanina E V, Chen S, van der Zalm E, et al. 2006. Identification and functional characterization of the BAG protein family in Arabidopsis thaliana.. Journal of Biological Chemistry, 281(27): 18793-18801. DOI:10.1074/jbc.M511794200 |
Frydman J. 2001. Folding of newly translated proteins in vivo:The role of molecular chaperones. Annual Review of Biochemistry, 70: 603-647. DOI:10.1146/annurev.biochem.70.1.603 |
Gonzalez-Arzola K, Moreno-Beltran B, Martinez-Fabregas J, et al. 2015. A common role for cytochrome c in programmed cell death in humans and plants. Protein Science, 24(1): 259-260. |
Kang C H, Jung W Y, Kang Y H, et al. 2006. AtBAG6, a novel calmodulin-binding protein, induces programmed cell death in yeast and plants. Cell Death and Differentiation, 13(1): 84-95. DOI:10.1038/sj.cdd.4401712 |
Kobayashi M, Takato H, Fujita K, et al. 2012. HSG1, a grape Bcl-2-associated athanogene, promotes floral transition by activating CONSTANS expression in transgenic Arabidopsis plant. Molecular Biology Reports, 39(4): 4367-4374. DOI:10.1007/s11033-011-1224-1 |
Li L, Xing Y, Chang D, et al. 2016a. CaM/BAG5/Hsc70 signaling complex dynamically regulates leaf senescence. Scientific Reports, 6: 31889. DOI:10.1038/srep31889 |
Li Y, Kabbage M, Liu W, et al. 2016b. Aspartyl protease-mediated cleavage of BAG6 is necessary for autophagy and fungal resistance in plants. Plant Cell, 28(1): 233-247. |
Li Y R, Williams B, Dickman M. 2017. Arabidopsis B-cell lymphoma2 (Bcl-2)-associated athanogene 7 (BAG7)-mediated heat tolerance requires translocation, sumoylation and binding to WRKY29. New Phytologist, 214(2): 695-705. DOI:10.1111/nph.14388 |
Payapilly A, High S. 2014. BAG6 regulates the quality control of a polytopic ERAD substrate. Journal of Cell Science, 127(13): 2898-2909. DOI:10.1242/jcs.145565 |
Schmid M, Davison T S, Henz S R. 2005. A gene expression map of Arabidopsis thaliana development. Nature Genetics, 37(5): 501-506. DOI:10.1038/ng1543 |
Sturn A, Quackenbush J, Trajanoski Z. 2002. Genesis:cluster analysis of microarray data. Bioinformatics, 18(1): 207-208. DOI:10.1093/bioinformatics/18.1.207 |
Tamura K, Peterson D, Peterson N, et al. 2011. MEGA5:molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods. Molecular Biology and Evolution, 28(10): 2731-2739. DOI:10.1093/molbev/msr121 |
Wilkins O, Nahal H, Foong J, et al. 2008. Expansion and diversification of the Populus R2R3-MYB family of transcription factors. Plant Physiol, 149(2): 981-993. DOI:10.1104/pp.108.132795 |
Wilkins O, Waldron L, Nahal H, et al. 2009. Genotype and time of day shape the Populus drought response. Plant Journal, 60(4): 703-715. DOI:10.1111/tpj.2009.60.issue-4 |
Williams B, Kabbage M, Britt R, et al. 2010. AtBAG7, an Arabidopsis Bcl-2-associated athanogene, resides in the endoplasmic reticulum and is involved in the unfolded protein response. Proceedings of the National Academy of Sciences of the United States of America, 107(13): 6088-6093. DOI:10.1073/pnas.0912670107 |
Yan J Q, He C X, Zhang H. 2003. The BAG-family proteins in Arabidopsis thaliana.. Plant Science, 165(1): 1-7. |
You Q, Zhai K, Yang D, et al. 2016. An E3 ubiquitin ligase-BAG protein module controls plant innate immunity and broad-spectrum disease resistance. Cell Host Microbe, 20(6): 758-769. DOI:10.1016/j.chom.2016.10.023 |
 2019, Vol. 55
2019, Vol. 55

