文章信息
- 解卫海, 王仲礼, 朱建军
- Xie Weihai, Wang Zhongli, Zhu Jianjun
- 常绿园林植物顶花板凳果叶片低温条件下的结冰模式分析
- On the Freezing Mode of Leaves of an Evergreen Ornamental Plant Pachysandra terminalis under Low Temperatures
- 林业科学, 2018, 54(9): 38-43.
- Scientia Silvae Sinicae, 2018, 54(9): 38-43.
- DOI: 10.11707/j.1001-7488.20180905
-
文章历史
- 收稿日期:2017-08-09
- 修回日期:2017-09-28
-
作者相关文章
低温冰冻是植物越冬面临的主要环境胁迫因素。植物的抗冻能力受多因素控制(Sklenáǎa et al., 2012; Briceñoa et al., 2014)主要由植物的遗传特性决定(Gusta et al., 2013),其他因素如生育时期(Martin et al., 2010; Koehler et al., 2012)、生理状态(Sakai et al., 1987; Miura et al., 2013)、组织器官含水量(Levis et al., 2012)以及经受低温锻炼时间长短(Taiz et al., 2010; 文彬, 2011)等影响植物低抗冰冻伤害的机制也因植物种类的不同而有一定差别。有的通过大幅度降低结冰温度来阻止组织结冰(Anderson et al., 1993; Shen et al., 1998; Wisniewski et al., 1999; Hacker et al., 2011),有的通过提高细胞的抗脱水能力以避免结冰阻断水分输导或者结冰导致的水分胁迫(Levis et al., 2012; Wisniewski et al., 2014),有些则通过降低细胞膜脂的饱和程度来保持膜脂的流动性(Los et al., 2013; Shahandashti et al., 2013),还可以通过积累小分子化合物(如葡萄糖、果糖、蔗糖等可溶性糖,山梨醇、甘露醇与乙二醇等)降低冰点和增强吸水保水的能力(Levitt, 1980; Li, 2012; Riikonen et al., 2013)等,而所有这些抗冻策略均涉及组织在低温下的结冰。低温下植物组织的结冰一般分为胞外结冰(Asahina, 1956; Pearce, 1988; 2001)与胞内结冰(Asahina, 1956; Diller, 1975; Zhu et al., 1991)2种模式,其中细胞内结冰会导致植物细胞的死亡(Asahina, 1956; 文彬, 2011),而细胞外结冰会导致细胞脱水伤害。(Zhu et al., 1991;Rajashekar et al., 1996)。因此,研究植物组织的结冰模式和机制,对于了解植物的抗冻性和冰冻伤害机制有重要意义。
一般认为在自然降温过程中植物组织是胞外首先结冰,主要是质外体溶液在膨压不为零时的渗透浓度总是低于细胞浆,冰点温度更高,在低温条件下更容易结冰,但要确认组织的胞外结冰在试验观察方面存在很多技术上的困难,目前只有极少数的研究用显微镜观察到细胞外结冰(Asahina, 1956; Pearce, 1988; 2001)。尚无植物组织胞外结冰的详细可靠的热力学证据。理论上,由于植物组织结冰时放出大量的融解热,可以通过差热分析研究植物的结冰过程。然而,经典的差热分析分辨率较低,仅用于分析膜脂的相变温度或膜脂的不饱和度,还没有用于分析植物组织的结冰过程的研究报道。顶花板凳果(Pachysandra terminalis)是一种耐寒的常绿草本园林植物,广泛用于城市绿化。Zhu等(1991)用热敏电阻检测到了顶花板凳果叶片活叶片和死叶片的冷却结冰曲线有差别。在寒冷的冬季,其叶片要经历反复的结冰-融冰过程,了解其叶片的结冰模式,有助于理解植物细胞的抗冻机制。本研究用高精密差热扫描分析结合水势测定和显微观察,研究常绿的顶花板凳果叶片在冷却结冰过程中的放热特征和叶片组织的显微观察结果,以了解这种植物的结冰模式,为阐明常绿植物抗冻机制提供理论依据。
1 材料与方法 1.1 试验材料以自然条件下生长的常绿园林植物顶花板凳果的健康成熟叶片(茎中部介于上部幼嫩叶片和下部老叶之间)为材料。叶片从植株上取下后立即装入塑料薄膜袋内密封防止水分散发。将新鲜活叶片密封在薄膜保鲜袋中,用液氮冰冻后在室温条件下(24~28 ℃)迅速融冰得到冰冻杀死的对照叶片。另外用顶花板凳果叶片的组织提取液浸润滤纸(多余的溶液以上下叠加的滤纸吸收)作为与叶片可比的细胞溶液模拟参照物。
1.2 试验方法 1.2.1 样品的固定和冷却冷却和测定过程开始前,先将热电偶结点通过一层约5 mm厚的橡胶海绵作为温度缓冲物固定在植物叶片上,然后将带有热电偶的叶片固定在一块15 cm×12 cm,厚3 mm的硬质泡沫塑料板上,装入双层聚乙烯塑料袋中,放入以异丙醇作为冷却介质,可控制降温速度,控温精度为0.01 ℃的低温恒温水浴中。从0~-20 ℃的平均降温速度为(0.66±0.2) ℃ ·min-1。
1.2.2 水势测定和差热分析叶片水势和组织溶液的渗透势均采用美国Wescor公司的L-51探头连接该公司的HR-33T微伏计组成的水势仪测定。数据采集记录使用NI-6009数据采集卡(美国National Instruments)和EasyDaq 2.1版记录软件(泛华测控)连接电脑进行。其中HR-33T微伏计表盘上的的模拟信号输出(满量程输出为10 V)连接到NI-6009数据采集卡的模拟信号输入端,数据采集频率为10赫兹。为了保证整个水势测定过程可控,所有水势和渗透势测定全部采用湿度测定模式而非通常的露点测定模式。
差热分析用TC-08 USB型8通道热电偶数据记录仪(Pico Technology, 英国)和PicoLog Recorder记录软件,连接到电脑进行记录和分析。以降温过程中水浴槽中干叶片的背景温度为对照。为了保证温度测定的高灵敏度和高反应速度,将热电偶结点对本试验选用直径0.127 mm (OMEGA TT-T-36-SLE,美国OMEGA公司)的特制热电偶,整个系统分辨率为0.00 025 ℃。样品的过冷度以根据样品的水势值计算出的理论冰点温度和实际测定的结冰温度之差表示。所有差热扫描和水势测定试验重复3次。
1.2.3 叶片结冰过程的显微观察事先将显微镜置于一个低温人工气候箱内,然后将叶片背部局部撕去表皮并用中性红染色后,切下约0.5 cm × 0.5 cm的叶片样品,在载玻片上用凡士林围成一个高于1 mm的方框,将切下约0.5 cm ×0.5 cm的叶片样品放入方框并盖上盖玻片密封后降温,在-10 ℃时观察组织结冰情况并拍照。冰冻杀死的对照叶片进行同样处理和观察,用LED软管冷光源从显微镜物镜侧面照射打在叶片样品上辅助照明。
2 结果与分析 2.1 顶花板凳果离体活叶片和冰冻杀死叶片的降温曲线图 1为顶花板凳果离体活叶片(A)和冰冻杀死叶片(B)在降温过程中的冷却曲线。从图 1中可知,活叶片(图 1A)在降温过程中呈现双放热峰,结冰放热出现有分隔的双相特征,即一个体积很小的第一区和相对较大的第二区结冰放热特征。相反,杀死叶片(图 1B)只有一个急速上升的单放热峰。活叶片的主放热峰代表的是一个缓慢的有物理阻滞的放热过程,而杀死叶片的放热峰代表的是一个快速的单相放热过程。
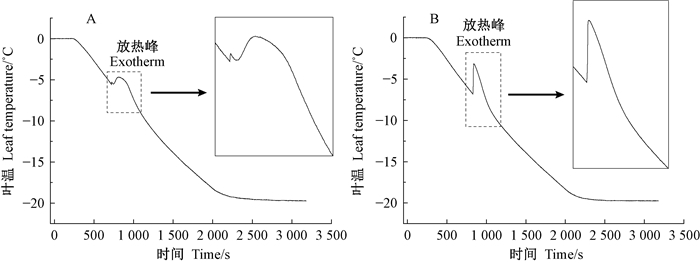
|
图 1 顶花板凳果离体活叶片(A)和冰冻杀死叶片(B)在降温过程中的冷却曲线 Figure 1 The exotherms of the living (A) and freeze killed P. terminalis leaves (B) during cooling and freezing 方框内为放热峰(exotherm)附近曲线的局部放大。下同。 The insets are the local magnification of the exotherms. The same below. |
图 2为顶花板凳果离体活叶片(A)和冰冻杀死叶片(B)在降温过程和结冰放热过程中的差热扫描曲线。从开始结冰放热到到达放热峰顶点所需要的平均时间,离体活叶片为(184±11)s,冰冻杀死叶片仅为(14±3)s,两者差别显著;根据结冰放热量积分得到的体内总水分结冰一半的平均结冰弛豫时间,活叶片为(195±15)s,冰冻杀死叶片为(73±5)s,活叶片约为冰冻杀死叶片的3倍(表 1)。由图 2可知,活叶片冷却过程中在-5.76 ℃开始结冰,第1个放热峰的温差仅仅为0.33 ℃,主放热峰为2.41 ℃,叶温最高升至-3.35 ℃(图 2 A中的-5.76 ℃加2.41 ℃);杀死叶片在(-6.71 ℃开始结冰并出现单一的高达3.72 ℃的主放热峰,叶温最高升至-2.99 ℃。
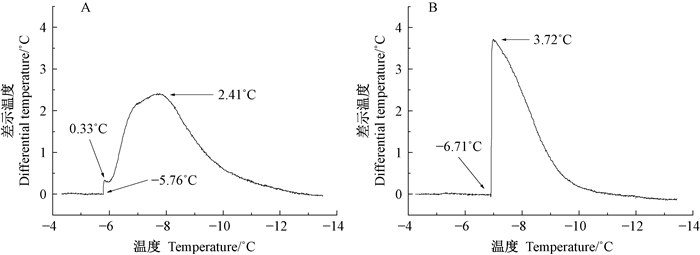
|
图 2 顶花板凳果离体活叶片(A)和冰冻杀死叶片(B)在降温过程中的差热扫描曲线 Figure 2 Differential scanning calorimetric graphs of the living (A) and freeze killed P. terminalis leaves (B) during cooling and freezing |
|
|
根据水势测定和图 2所示的结果表明,顶花板凳果离体活叶片水势为(0.94±0.073) MPa,对应的质外体冰点温度为-0.71 ℃,过冷度为5.05 ℃。冰冻杀死叶片的渗透势为(1.66±0.15) MPa,对应的冰点温度为-1.26 ℃,过冷度为5.45 ℃。
2.3 顶花板凳果叶片的组织抽提液在降温过程中的冷却曲线和差热分析曲线为了解冰冻杀死叶片的结冰放热过程是否与单相的均一溶液相似,本试验以浸润顶花板凳果叶片的组织提提液的滤纸作为参照物,与叶片相同的条件进行了冷却和差热分析,结果如图 3所示。顶花板凳果叶片抽提液的湿润滤纸在降温过程中只有一个急速上升的单放热峰,这与冰冻杀死叶片的快速的放热过程非常相似而与活叶片的放热峰明显不同(图 3A)。叶片抽提液的湿润滤纸的结冰温度为-7.48 ℃,最高升至-2.78 ℃,由于顶花板凳果叶片抽提液的冰点温度为-1.26 ℃,因此有5.92 ℃的过冷度;从开始结冰放热到放热峰顶点所需要的时间为6 s,结冰弛豫时间为36 s(图 3B)。

|
图 3 顶花板凳果叶片抽提液的湿润滤纸在降温过程中的冷却曲线和差热扫描曲线 Figure 3 The exotherms of filter paper drenched with the sap from P. terminalis leaves during cooling and freezing (A) and the differential thermal analysis graph (B) |
组织结冰后,由于细胞内溶质的存在,并不是所有液态水都变成冰,而有更多的液态水从细胞流出变成冰晶,细胞溶液进一步浓缩。如图 4 A,B所示,对于活组织来说,如果发生细胞外结冰,胞外冰晶将随温度下降不断从细胞吸水扩大,同时造成细胞浆溶液的进一步浓缩。对比叶片组织结冰前(图 4A)和结冰后(图 4B)的情况,可以看到无色的胞外冰晶而不是红紫色的细胞浆泄漏物,表明板凳果活叶片组织在低温条件下发生的是胞外结冰,这也验证了差热分析的结果。对于死亡组织来说,由于细胞膜已经破坏,细胞内外溶液一致,组织的结冰将是单相结冰,比较先杀死叶片的组织结冰前(图 4C)和结冰后(图 4D)的情况,可以看到有色冰晶在细胞内外同时出现, 呈现出典型的单相结冰的特征,这也同样验证了差热分析显示的死亡组织单相结冰的结果。
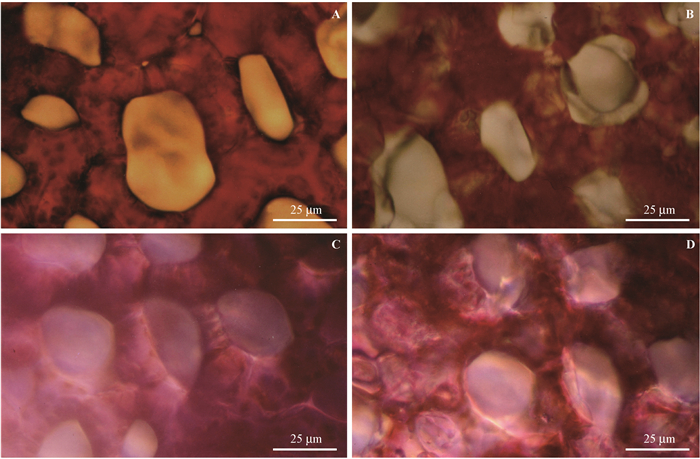
|
图 4 顶花板凳果活叶片和液氮杀死叶片海绵组织在降温过程中的结冰状况 Figure 4 The freezing pattern of spongy tissues in P. terminalis leaves during cooling and freezing A.活体叶片结冰前;B.活体叶片结冰后;C.液氮杀死叶片结冰前;D.液氮杀死叶片结冰后。结冰后的活叶片组织(B)中可以看到细胞间隙大量的无色冰晶,杀死叶片结冰后的组织(D)中可以看到含有色素的冰晶同时出现在细胞内外。 A. Living tissues before freezing; B. Living tissues after freezing; C. Killed tissues before freezing; D. Killed tissues after freezing. Colourless ice crystals was visible in the intercellular spaces, stained ice crystals could be seen both inside and outside cells. |
一般认为,植物在低温下的结冰过程和模式,即细胞外结冰还是内外同时结冰与植物细胞的抗冻性有着紧密的关系(Asahina, 1965; Li, 2012)。然而,由于胞外结冰的验证在试验上有较多的困难,目前的直接证据还不多,特别是缺乏热力学的证据。笔者的高分辨率差热分析结果从热力学角度提供了植物在低温条件下首先发生胞外结冰的新证据。首先,本试验结果显示,顶花板凳果的活叶片在热力学上和解剖上都呈现出与冰冻杀死叶片明显不同的结冰特征(图 1,图 2和图 4)。差热分析曲线(图 2)表明,活叶片的第1个小放热峰温度上升仅有0.33 ℃,放热量很小,表明结冰的水的量很小,代表的是细胞间隙的少量水的结冰;其次,紧随的缓慢大放热峰不是一个陡然上升的放热峰,因此不代表细胞内溶液的突然结冰,而是符合细胞内水分透过细胞膜逐渐流出再结冰的缓慢过程。另外,显微分析的结果显示,结冰后的活叶片组织细胞间隙出现大量的无色冰晶,也进一步证明活叶片组织首先发生胞外结冰的特点,这与Pearce(1998)的扫描电镜观察结果一致。对于杀死组织的显微分析其在降温过程中是突然的细胞内外同时结冰,也从另一个角度验证了活叶片组织在降温过程中首先发生是胞外结冰的看法。
从顶花板凳果叶片的结冰动力学来看,杀死叶片在过冷条件下一旦结冰,就有极快速的温度上升,从开始结冰至到达放热峰值仅有14 s,并且只有一个尖锐的单峰,与叶片抽提液这一单相均一液体的结冰特征一致,表明叶片组织内已经不存在溶液分隔,即细胞膜已经被彻底破坏,这与Zhu等(1991)和Wisniewski等(1999)显微镜下观察到的研究结果一致。而活叶片开始结冰至到达放热峰则需要184 s左右,并且开始都有1个很小的放热峰,随后连接着1个缓慢的大放热峰,即活组织的双放热峰比死组织的单放热峰有高出约10倍以上的放热时间拖滞现象。这一现象的产生可能有下以原因:1)由于细胞外的质外体溶液的渗透浓度在细胞膨压不为零时总是小于胞浆的渗透浓度,冰点更高,所以首先结冰,这也在其他的研究中得到证实(Asahina, 1956; Pearce, 1988; 2001)。2)由于质外体体积很小,因此活叶片结冰开始首先出现的小放热峰放热量也很小。此外,本试验中所有样品都不同程度地呈现出过冷现象,样品的实际结冰温度比样品的冰点普遍低6~8 ℃。这一点和其他人研究结果也是一致的(Anderson et al., 1993; Shen et al., 1998;Wisniewski et al., 1999;Hacker et al., 2011)。因此差热分析也能够提供组织在降温过程中的过冷度分析。
4 结论本试验从热力学角度阐明常绿抗冻植物顶花板凳果叶片在低温下的结冰过程是细胞外首先结冰的差热分析证据,并用显微观测验证差热分析的结果。从理论上,提供了差热分析用于植物组织的结冰放热过程和结冰模式的分析方法,为从热力学角度进一步深入了解植物体内结冰的细节和冰冻伤害机制提供了新途径。
文彬. 2011. 植物种质资源超低温保存概述[J]. 植物分类与资源学报, 33(3): 311-329. (Wen B. 2011. An introduction to cryopreservation of plant germplasm[J]. Plant Diversity and Resources, 33(3): 311-329. [in Chinese]) |
Anderson J A, Whitworth J. 1993. Supercooling strawberry plants inoculated with ice-nucleation-active bacteria and treated with frostgard[J]. HortScience, 28(8): 828-830. |
Asahina E. 1956. The freezing process of plant cell. contributions from the institute of low temperature[J]. Science, 10(3): 83-126. |
Briceñoa V F, Harris-Pascala D, Nicotraa A B, et al. 2014. The biology of plant cold hardiness, adaptive strategies variation in snow cover drives differences in frost resistance in seedlings of the alpine herb Aciphylla glacialis[J]. Environmental and Experimental Botany, 106(2): 174-181. |
Diller K R. 1975. Intracellular freezing, effect of extracellular supercooling[J]. Cryobiology, 12(5): 480-485. DOI:10.1016/0011-2240(75)90029-2 |
Gusta L V, Wisniewski M. 2013. Understanding plant cold hardiness, an opinion[J]. Physiologia Plantarum, 147(1): 4-14. DOI:10.1111/ppl.2013.147.issue-1 |
Hacker J, Ladinig U, Wagner J, et al. 2011. Inflorescences of alpine cushion plants freeze autonomously and may survive subzero temperatures by supercooling[J]. Plant Science, 1: 149-156. |
Koehler K, Center A, Cavender-Bares J. 2012. Evidence for a freezing tolerance growth rate trade off in the live oaks (Quercus series Virentes) across the tropical temperate divide[J]. New Phytologist, 193(3): 730-744. DOI:10.1111/j.1469-8137.2011.03992.x |
Levis N A, Yi S X, Lee Jr R E. 2012. Mild desiccation rapidly increases freeze tolerance of the goldenrod gall fly, Eurosta solidaginis, evidence for drought-induced rapid cold-hardening[J]. Journal of Experimental Biology, 221(12): 3768-3773. |
Levitt J. 1980. Responses of plants to environmental stresses, chilling, freezing and high temperature stresses (2nd edition)[M]. New York: Academic Press Inc.
|
Li P H. 2012. Plant cold hardiness and freezing stress, mechanisms and crop implications[J]. Elsevier Science, the Netherlands. |
Los D A, Mironov K S, Allakhverdiev S I. 2013. Regulatory role of membrane fluidity in gene expression and physiological functions[J]. Photosynthesis Research, 116(2/3): 489-509. |
Martin M, Gavazov K, Körner C, et al. 2010. Reduced early growin:g season freezing resistance in alpine treeline plants under elevated atmospheric CO2[J]. Global Change Biology, 16(3): 10 57-1070. DOI:10.1111/gcb.2010.16.issue-3 |
Miura K, Furumoto T. 2013. Cold signaling and cold response in plants[J]. International Journal of Molecular Science, (14): 5312-5337. |
Pearce R S. 1988. Extracellular ice and cell shape in frost-stressed cereal leaves, a low-temperature scanning-electron-microscopy study[J]. Planta, 175(3): 313-24. DOI:10.1007/BF00396336 |
Pearce R S. 2001. Plant freezing and damage[J]. Annals of Botany, 87(4): 417-424. DOI:10.1006/anbo.2000.1352 |
Rajashekar C B, Burke M J. 1996. Freezing characteristics of rigid plant tissues, development of cell tension during extracellular freezing[J]. Plant Physiology, 111(2): 597-603. DOI:10.1104/pp.111.2.597 |
Riikonen J, Kontunen-Soppela S, Vapaavuori E, et al. 2013. Carbohydrate concentrations and freezing stress resistance of silver birch buds grown under elevated temperature and ozone[J]. Tree Physiology, 33(3): 311-319. DOI:10.1093/treephys/tpt001 |
Sakai A, Larcher W. 1987. Frost Survival of Plants. Responses and adaptation to freezing stress. Springer-Verlag, Berlin, Heidelburg.
|
Shahandashti S S K, Amiri R M, Zeinali H, et al. 2013. Change in membrane fatty acid compositions and cold-induced responses in chickpea[J]. Molecular Biology Reports, 40(2): 893-903. DOI:10.1007/s11033-012-2130-x |
Shen F Y, Gao R F, Liu W J, et al. 1998. A preliminary approach to the mechanisms of the formation of deep supercooling of water in some frost hardy plants[J]. Acta Biophysica Sinica, 14(6): 791-794. |
Sklenáǎ P, Ku Dč erováb A, Macekbc P, et al. 2012. The frost-resistance mechanism in páramo plants is related to geographic origin[J]. New Zealand Journal of Botany, 50(4): 391-400. DOI:10.1080/0028825X.2012.706225 |
Taiz L, Zeiger E. 2010. Plant physiology (5th ed). Sinauer Associates, Inc., New York.
|
Wisniewski M, Fuller M. 1999. Ice nucleation and deep supercooling in plants, new insights using infrared thermography//Margesin R, Schinner F.Cold-adapted organisms. Berlin, 105-118. https://link.springer.com/chapter/10.1007%2F978-3-662-06285-2_6
|
Wisniewski M, Gustab L, Neunerc G. 2014. Adaptive mechanisms of freeze avoidance in plants, A brief update[J]. Environmental and Experimental Botany, 99(2): 133-140. |
Zhu J J, Beck E. 1991. Water relations of Pachysandra leaves during freezing and thawing[J]. Plant Physiology, 97(3): 1146-1153. DOI:10.1104/pp.97.3.1146 |
 2018, Vol. 54
2018, Vol. 54

