文章信息
- 陈鸿鹏, 彭彦, 刘果, 李慧, 高丽琼, 詹妮, 谢耀坚
- Chen Hongpeng, Peng Yan, Liu Guo, Li Hui, Gao Liqiong, Zhan Ni, Xie Yaojian
- 印加果种子发育过程中挥发性物质的特性分析
- Dynamic Changes of Volatile Components from Developing Seeds of Plukenetia volubilis
- 林业科学, 2018, 54(9): 157-168.
- Scientia Silvae Sinicae, 2018, 54(9): 157-168.
- DOI: 10.11707/j.1001-7488.20180918
-
文章历史
- 收稿日期:2017-08-25
- 修回日期:2018-01-25
-
作者相关文章
挥发性物质是植物在生长发育过程中所释放的一类主要次生代谢物,可以从花、果实、叶片等组织器官合成并释放出来,主要分为酯类、醇类、醛类、酮类、烯烃类、烷烃类、苯环类以及一些含氮、硫化合物等多种物质,一般具有一定的香气(Pulu et al., 2016)。植物释放挥发性物质在调控生长发育(Shelly et al., 2016)、适应生态环境(Wouter et al., 2010;Patricia et al., 2013)、抵御天敌(Andrea et al., 2012)、增强抗病能力(Katrin et al., 2012;Gerard et al., 2016)等方面具有重要的生物学功能,同时,一些食用植物释放的挥发性物质还具有舒适的风味口感(Jessica et al., 2015),可以进一步调节人体的生理和心理状态(何念鹏等,2005;王荣等,2015)。目前,对于植物挥发性物质的提取方法主要采用顶空固相微萃取法(head space solid phase micro-extraction,HS-SPME),与其他常用的挥发性物质获取技术相比,HS-SPME具有简便、快速、选择性好且灵敏度高等优点(Spietelun et al., 2013;rica et al., 2017),对样品纯化、富集后,可直接与气相色谱-质谱(gas chromatograph mass spectrometry,GC-MS)、高效液相色谱(high performance liquid chromatography, HPLC)、毛细管电泳仪(capillary electrophoresis,CE)等仪器联用,被广泛应用于食品、医药、化工等多个行业领域的分析与检测(刘亚琼等, 2006;宋永等, 2008;陈旭等, 2013)。
印加果(Plukenetia volubilis)是一种原产于南美洲安第斯山脉地区的大戟科(Plukenetia)多年生木质藤本植物,其种子中含有大量的多元不饱和脂肪酸,具有特有的香气风味(Guillén et al., 2003;Follegatti et al., 2009;Fanali et al., 2011)。印加果籽油凭借优良的感官和品质分别于2004、2006年和2010年在巴黎世界食用油博览会上获得金质奖章,引起了世界油料产品开发商的高度关注。然而,目前尚未对印加果籽油的挥发性物质及其特性开展研究。本研究利用HS-SPME和GC-MS技术对印加果种子发育过程中的挥发性物质进行解析,为快速判定印加果种子成熟度,建立印加果籽油的感官评定指标以及深入开发和利用印加果籽油香气成分提供重要理论依据。
1 材料与方法 1.1 试验材料分别于印加果种子形成初期(7月份)至种子成熟期(同年9月份),即花后18~90天(day after flowering, DAF)5个不同发育时期,在南方国家种苗基地印加果种质资源圃采摘印加果优良无性系种子。
1.2 仪器设备粉碎机:900 N(飞马,台湾);PLUS萃取头:65 μm PDMS/DVB (Supelco,USA);气相色谱-质谱联用仪:7890 A-5975C (Agilent,USA)。
1.3 试验方法1) 样品处理 不同发育时期印加果的果实各自切开后,去除果皮和种皮,剥出种仁,迅速置于用液氮预冷的粉碎机中打磨成为细粉,期间不断加入液氮以保持低温。
2) 挥发性物质的萃取 250 ℃的条件下,将SPME的萃取纤维头在气相色谱的进样口老化15 min,气相色谱载气体积流量为1.0 mL·min-1。用10 mL的样品瓶分别收集已粉碎处理的印加果种子2.0 g,盖上盖子,插入65 μm PDMS-DVB萃取纤维头,于60 ℃的萃取30 min后,取出后立即插入色谱仪进样口在温度250 ℃脱附2 min (陈鸿鹏等,2015;周萍萍等,2012)。
3) 气相色谱的分析条件 HP-5MS石英弹性毛细管柱(0.25 μm×30.0 m×250 μm),载气为高纯氦气(99.999%),流速1.0 mL·min-1,进样口温度250 ℃;色谱柱初始温度50 ℃(保持2.0 min),以4 ℃·min-1升温至120 ℃(保持2 min),最后以6 ℃·min-1升温至230 ℃(保持5 min)。分流进样的分流比为10:1 (陈鸿鹏等,2015;周萍萍等,2012)。
4) 质谱的分析条件 电离方式:EI源电离能量70 eV;离子源温度为230 ℃;四极杆温度150 ℃;传输线温度为280 ℃;电子倍增器电压1 588 V。质量扫描范围(m/z)30~400,谱图检索采用Nist08.L进行检索(陈鸿鹏等,2015;周萍萍等,2012)。
2 结果与分析 2.1 印加果种子整个发育过程的挥发性物质成分特征利用HS-SPME和GC-MS分析了印加果近成熟种子中的挥发性物质,通过面积归一法计算出各成分的相对含量。在HS-SPME的萃取下,印加果种子中的挥发性物质能够充分的收集起来,并能够通过灵敏的GC-MS逐一分离。
5个不同发育时期的印加果种子共分离鉴定出230种挥发性物质构成印加果种子的主体风味,大致可以分成8大类,其中包括35种酯类化合物(42.70%),37种醇类化合物(24.02%),18种烯烃类化合物(15.32%),17种醛类化合物(2.72%),60种烷烃类化合物(4.50%),28种苯环类化合物(4.15%),8种酮类化合物(0.17%)以及27种其他化合物(6.42%)(表 1)。印加果种子中的挥发性气味物质主要由酯类、醇类和烯烃类物质组成,二者合计占挥发性物质总含量的82.04%。
|
|
18 DAF~90 DAF的印加果种子分别鉴定出107、94、102、76、28种挥发性物质。其中,18 DAF的印加果种子中主要以邻苯二甲酸二乙酯、邻苯二甲酸二甲酯、α-甲基-β-氧基-2-吡啶丙酸乙酯、邻苯二甲酸二丁脂及邻苯二甲酸二异丁酯等酯类,1, 8-桉叶油素、3-甲基丁醇、α-雪松醇、氯乙醇、4-庚醇以及松蕈醇等醇类,四氘代乙烯、4-蒈烯以及柠檬烯等烯类和对异丙基甲苯为主。36 DAF的印加果种子中主要以邻苯二甲酸二乙酯、邻苯二甲酸二甲酯、邻苯二甲酸二丁脂及邻苯二甲酸二异丁酯等酯类,1, 8-桉叶油素、3-甲基丁醇、松蕈醇以及2-甲基丁醇等醇类,四氘代乙烯、4-蒈烯、β-月桂烯以及柠檬烯等烯类和对异丙基甲苯为主。54 DAF的印加果种子中主要以邻苯二甲酸二乙酯、邻苯二甲酸二甲酯、α-甲基-β-氧基-2-吡啶丙酸乙酯及邻苯二甲酸二丁脂等酯类,1, 8-桉叶油素、3-甲基丁醇、松蕈醇、2-甲基丁醇以及乙醇等醇类,4-蒈烯、柠檬烯以及β-月桂烯等烯类,壬醛和3-甲基丁醛等醛类和对异丙基甲苯为主。72 DAF的印加果种子中以邻苯二甲酸二乙酯、邻苯二甲酸二甲酯、α-甲基-β-氧基-2-吡啶丙酸乙酯等酯类,柠檬烯等烯类,1, 8-桉叶油素、3-甲基丁醇、松蕈醇、2-甲基丁醇等醇类,3-甲基丁醛等醛类和对异丙基甲苯物质为主。90 DAF的印加果种子中以邻苯二甲酸二乙酯、邻苯二甲酸二甲酯等酯类,4-蒈烯、柠檬烯、β-月桂烯以及水芹烯等烯类,1, 8-桉叶油素等醇类,3-甲基丁醛等醛类和1-甲基-2-(1-甲基乙基)苯物质为主(表 2和图 1)。
|
|
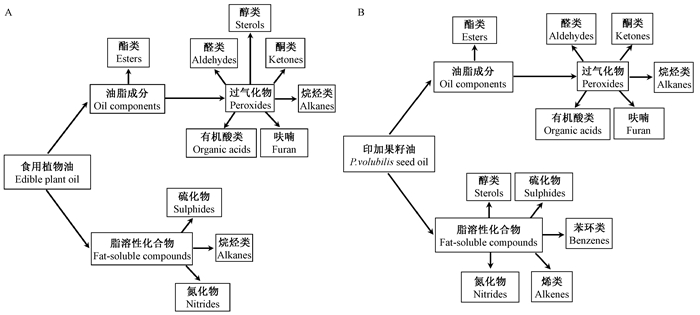
|
图 1 食用植物油与印加果籽油中相关挥发性物质的形成 Figure 1 The formation principle of main volatile components in edible plant oil and P. volubilis seed oil |
在印加果种子5个不同发育时期,共有邻苯二甲酸二乙酯、邻苯二甲酸二甲酯、邻苯二甲酸二丁酯、1, 8-桉叶油素、柠檬烯、4-蒈烯、壬醛、β-月桂烯、2, 6-二羟基苯甲酸以及水芹烯、2, 3, 4, 4-四丙基-1-(三甲基硅基)-1-(三甲基硅烷氧基)-1, 3-二叠氮-2, 4-二硼化丁烷等10种挥发性物质均有不同程度的出现(表 3)。随着成熟度增加,邻苯二甲酸二乙酯、邻苯二甲酸二甲酯、邻苯二甲酸二丁酯以及2, 6-二羟基苯甲酸等物质逐渐减少,1, 8-桉叶油素、柠檬烯、β-月桂烯以及水芹烯等物质逐渐增加。
|
|
此外,α-甲基-β-氧基-2-吡啶丙酸乙酯、3-甲基丁醇、松蕈醇、对异丙基甲苯、2-己醇、3-己醇、1-戊烯-3-醇、癸醛、己醛、2-己烯醛、苯乙醛、庚醛、2, 6, 10, 14-四甲基十五烷、二十四甲基环十三硅氧烷、2, 6, 10-三甲基十五烷、十六甲基七硅氧烷、十八烷、2, 3, 4, 4-四丙基-1-(三甲基硅基)-1-(三甲基硅烷氧基)、八甲基环四硅氧烷、十四烷、六甲基环三硅氧烷、癸醛、2-己醇、1-甲基-4-(1-甲基乙烯基)苯、己醛、3, 4-二乙基联苯、2-己烯醛、苯乙醛、庚醛、3-己醇、1-戊烯-3-醇等31种物质在18 DAF~72 DAF的时期均有所生成,但是,在90DAF的印加果种子中没有出现。由此表明,印加果种子完全成熟后,α-甲基-β-氧基-2-吡啶丙酸乙酯、3-甲基丁醇、松蕈醇、对异丙基甲苯等主要物质(相对含量>1.00%)消失,酯类、烯类物质含量相对降低,醇类、苯环类物质含量相对升高,而烷烃类、酮类以及其他物质含量出现不同程度的波动,挥发性物质逐渐从以酯类物质为主转变为以醇类物质和萜烯类物质为主。因此,印加果种子逐渐从浓郁的果香味转变成类似柠檬或者薄荷的清香味。
食用植物油中的酯类物质主要由油脂成分分解而来,继而分解出醛类、酮类、醇类等其他挥发性物质(求海强, 2009)。随着种子成熟度的增加,油脂逐渐积累,挥发性物质中的酯类物质逐渐减少(图 1A)(Moreda et al., 2001;Maria et al., 2008;Tommaso et al., 2008)。印加果籽油中,各类挥发性物质的形成基本符合食用植物油挥发性物质产生的原理,说明解析出的挥发性物质成分的可靠性。但是,根据印加果籽油中各类物质之间的相关性分析,推测油脂成分分解出酯类物质后,进一步氧化形成醛类、酮类及烷烃类等物质;同时,脂溶性氧化物逐步分解出醇类、苯环类及烯类等物质(图 1B),因此,印加果籽油的挥发性物质形成特性,基本符合食用植物油挥发性物质特性,但是又存在一定程度的差异(Beaulieu et al., 2001; Luna et al., 2006; Yang et al., 2008; Nauman et al., 2017),有待通过后续的深入研究来考证。
由表 4可以看出,印加果种子中的酯类物质与烷烃类、醛类以及酮类物质呈正相关性,相关分数分别为0.581 4、0.568 5和0.332 0,与醇类、苯环类以及烯类物质成负相关性,相关系数分别为-0.899 4、-0.856 5和-0.717 4;烷烃类与醛类和酮类物质成正相关性,相关系数分别为0.199 7和0.018 5,与醇类、烯类以及苯环类物质成负相关性,相关系数分别为-0.348 3、-0.062 4和-0.136 2;醛类物质与酮类物质的相关系数为0.544 5,与醇类、烯类以及苯环类物质成负相关性,相关系数分别为-0.239 4、-0.810 1和-0.584 0;苯环类物质与烯类和醇类物质呈正相关性,相关系数分别为0.913 6和0.846 3;烯类物质与醇类物质的相关系数为0.572 4。由此,印加果种子中的酯类、烷烃类、醛类以及酮类物质之间具有正相关性,苯环类、醇类和烯类物质之间具有正相关性,这两组物质间存在负相关性。
|
|
本研究采用HS-SPME和GC-MS方法对印加果不同发育时期种子中的挥发性物质进行解析,主要分离鉴定出230种挥发性物质,包括35种酯类化合物、37种醇类化合物、18种烯烃类化合物、17种醛类化合物、60种烷烃类化合物、28种苯环类化合物、8种酮类化合物以及27种其他化合物。其中,酯类物质使印加果籽油一定的芳香气味,滞留时间长久(周琦等, 2016;朱永清等, 2016);醇类物质让印加果籽油具有柔和的花香气味(钟海雁等, 2006;周瑞宝, 2006);醛类物质对印加果籽油贡献了类似坚果的脂肪香气味;萜烯类物质具有一定浓郁的清凉芳香性气味,有助于提高印加果籽油的整体香味(徐萌等, 2016;郭艳峰等, 2017);盐酸氨基脲及其他物质对于香味物质形成气体状态可能有一定的内在关系(Yurchenko et al., 2006;高智席等, 2007;余星等, 2016)。研究发现,精制菜籽油挥发性物质中9种醛类物质占43%(杨湄等, 2010;谢婧等, 2013),大豆油挥发性风味成分中5种醛类物质的相对百分含量为21.0%(杨春英等, 2015),高低温压榨的花生油中己醛含量分别达13.8%和13.6%(刘晓君等, 2008)。同时,根据印加果种子挥发性物质的特性,结合大豆油(张丽等, 2014)、花生油(刘晓君等, 2008)、菜籽油(张谦益等, 2017)、玉米油(龙正海, 2012)等其他食用植物油的特性,可以研制不同风味和适合不同消费者的调和油。此外,也可作为高档化妆品精油加以开发和利用。
4 结论在印加果种子发育过程中,酯类物质和萜烯类物质可能主要通过印加果籽油中的脂溶性成分转化而来。同时,印加果籽油既具有常见食用油的芳香气味,又具有一定的花香和坚果香气,适宜作为色拉油和营养胶囊食用。本研究初步揭示了印加果种子发育过程中各类挥发性物质组成特性和形成规律,为快速判定印加果种子成熟度,建立印加果籽油的感官评定指标以及后续的印加果良种选育提供重要理论依据。
陈鸿鹏, 彭彦, 林彦, 等. 2015. HS-SPME & GC-MS分析印加果种子的挥发性物质[J]. 亚热带植物科学, 44(3): 199-203. (Chen H P, Peng Y, Lin Y, et al. 2015. Analysis of volatile components from Sacha inchi Seed by HS-SPME&GC-MS[J]. Subtropical Plant Science, 44(3): 199-203. DOI:10.3969/j.issn.1009-7791.2015.03.004 [in Chinese]) |
陈旭, 王胜威, 母应春, 等. 2013. 顶空固相微萃取气质联用研究贵州常用卤味料挥发性成分[J]. 食品与机械, 29(4): 24-28. (Chen X, Wang S W, Mu Y C., et al. 2013. Study on volatile compounds in common braised food materials of Guizhou by SPME and GC-MS determination[J]. Food & machinary, 29(4): 24-28. DOI:10.3969/j.issn.1003-5788.2013.04.007 [in Chinese]) |
高智席, 周光明, 唐国风, 等. 2007. 高效液相色谱柱后化学发光检测技术对杉科植物中羟基酸的分析应用[J]. 药物分析杂志, 32(7): 1081-1085. (Gao Z X, Zhou G M, Tang G F, et al. 2007. Application of HPLC with post-column chemiluminscence detection to alcoholic acid in Taxodium ascendens and Taxodiu distichum[J]. Chinese Journal of Pharmaceutical Analysis, 32(4): 551-557. [in Chinese]) |
郭艳峰, 吴惠婵, 夏雨, 等. 2017. 百香果不同发育阶段果汁挥发性成分研究[J]. 福建农业学报, 32(3): 299-304. (Guo Y F, Wu H C, Xia Y, et al. 2017. Volatiles in juice of passion fruitsat different developmental stages[J]. Fujian Journal of Agricultural Sciences, 32(3): 299-304. [in Chinese]) |
何念鹏, 韩兴国, 潘庆民. 2005. 植物源VOCs及其对陆地生态系统碳循环的贡献[J]. 生态学报, 25(8): 2041-2048. (He N P, Han X G, Pan Q M. 2005. Volatile organic compounds emitted from vegetation and their contribution to the terrestrial carbon cyclle[J]. Acta Ecologica Sinica, 25(8): 2041-2048. DOI:10.3321/j.issn:1000-0933.2005.08.030 [in Chinese]) |
刘晓君, 金青哲, 刘元法, 等. 2008. 花生油挥发性风味成分的鉴定[J]. 中国油脂, 33(8): 40-42. (Liu X J, Jin Q Z, Liu Y F, et al. 2008. Identification of volatile flavour compounds of sunflower oil[J]. China Oils and Fats, 33(8): 40-42. DOI:10.3321/j.issn:1003-7969.2008.08.011 [in Chinese]) |
刘亚琼, 朱运平, 乔支红. 2006. 食品风味物质分离技术研究进展[J]. 食品研究与开发, 27(6): 181-184. (Liu Y Q, Zhu Y P, Qiao Z H. 2006. Research progress of technique for extracting flavor substances in food[J]. Food research and development, 27(6): 181-183. DOI:10.3969/j.issn.1005-6521.2006.06.067 [in Chinese]) |
龙正海. 2012. 玉米油化学成分及其抗氧化性能研究[J]. 中国粮油学报, 27(2): 68-70. (Long Z H. 2012. Study on chemical constituents and antioxidation capability of corn Oil[J]. Journal of the Chinese Cereals and Oil Associaton, 27(2): 68-70. DOI:10.3969/j.issn.1003-0174.2012.02.015 [in Chinese]) |
求海强. 2009. 食用植物油挥发性风味成分的研究[J]. 浙江工业大学: 8-30. (Qiu H Q. 2009. Study on volatile flavor components of vegetable oil[J]. Zhejiang University of Technology: 8-30. [in Chinese]) |
宋永, 张军, 李冲伟. 2008. 食品挥发性风味物质的提取方法[J]. 中国调味品, 33(6): 77-78. (Song Y, Zhang J, Li C W. 2008. Extracting method of volatile compounds from food[J]. China condiment, 33(6): 77-78. DOI:10.3969/j.issn.1000-9973.2008.06.017 [in Chinese]) |
唐贵敏, 于喜艳, 赵登超, 等. 2007. 不同品种厚皮甜瓜果实成熟过程中挥发性物质成分分析[J]. 中国蔬菜, 1(4): 7-11. (Tang G M, Yu X Y, Zhao D C, et al. 2007. GC-MS analysis of volative components in different cultivars of muskmelon during fruit development[J]. Chinese Vegetables, 1(4): 7-11. DOI:10.3969/j.issn.1000-6346.2007.04.003 [in Chinese]) |
杨春英, 刘学铭, 王思远, 等. 2015. SPME-GC/MS分析植物油挥发性风味成分[J]. 中国粮油学报, 32(10): 127-134. (Yang C Y, Liu X M, Wang S Y, et al. 2015. Volatile flavor compouds in vegetable oils using GC chromatography-mass spectrometry combined with solid-phase microtract[J]. Journal of Chinese Cereals and oils Association, 32(4): 551-557. [in Chinese]) |
杨湄, 刘昌盛, 周琦, 等. 2010. 加工工艺对菜籽油主要挥发性风味成分的影响[J]. 中国油料作物学报, 32(4): 551-557. (Yang M, Liu C S, Zhou Q, et al. 2010. Processing effects on volatile flavor composition of rapeseed oil[J]. Chinese Journal of Oil Crop Sciences, 32(4): 551-557. [in Chinese]) |
余星, 朱苗苗, 赵丽, 等. 2016. 新型脱氢枞胺1, 2, 3-噻二唑衍生物的合成及表征[J]. 林产化学与工业, 36(1): 141-146. (Yu X, Zhu M M, Zhao L, et al. 2016. Synthesis and structural characterization of novel dehydroabietylamine 1, 2, 3-thiadiazole derivatives[J]. Chemistry and Industry of Forestry Products, 36(1): 141-146. DOI:10.3969/j.issn.0253-2417.2016.01.020 [in Chinese]) |
谢婧, 徐俐, 张秋红, 等. 2013. 顶空固相微萃取法提取菜籽油挥发性风味成分[J]. 食品科学, 34(12): 281-285. (Xie J, Xu L, Zhang Q H, et al. 2013. Headspace solid phase microextraction of volatile components from rapeseed oil[J]. Food Science, 34(12): 281-285. DOI:10.7506/spkx1002-6630-201312058 [in Chinese]) |
徐萌, 张经纬, 吴令上, 等. 2016. HS-SPME-GC-MS联用测定蜡梅属植物花的挥发性成分[J]. 林业科学, 52(12): 58-65. (Xu M, Zhang J W, Wu L S, et al. 2016. Determination of Volatile components from Chimonanthus[J]. Scientia Silvae Sinicae, 52(12): 58-65. DOI:10.11707/j.1001-7488.20161207 [in Chinese]) |
张丽, 李刚, 炳伟. 2014. 大豆油中挥发性醛类物质的检测与鉴别[J]. 农产品加工, 7(13): 39-41. (Zhang L, Li G, Bing W. 2014. Detection and identification of volatile aldehydes substances in soybean oil[J]. Academic Periodical of Farming Products Processing, 7(7): 39-41. DOI:10.3969/j.issn.1671-9646.2014.07.021 [in Chinese]) |
张谦益, 包李林, 熊巍林, 等. 2017. 浓香菜籽油挥发性风味成分的鉴定[J]. 粮食与油脂, 30(3): 78-80. (Zhang Q Y, Bao L L, Xiong W L, et al. 2017. Identification of volatile flavor components of fragrant rapeseed oil[J]. Cereals & Oils, 30(3): 78-80. DOI:10.3969/j.issn.1008-9578.2017.03.021 [in Chinese]) |
钟海雁, 黄永辉, 刘宁露, 等. 2006. 油脂气味的研究进展[J]. 中国油脂, 31(7): 12-15. (Zhong H Y, Huang Y H, Liu N L, et al. 2006. Study advance in odor oils[J]. China Oils and Fats, 31(7): 12-15. DOI:10.3321/j.issn:1003-7969.2006.07.002 [in Chinese]) |
周萍萍, 黄健花, 宋志华, 等. 2012. 浓香葵花籽油挥发性风味成分的鉴定[J]. 食品工业科技, 33(14): 128-131. (Zhou P P, Huang J H, Song Z H, et al. 2012. Identification of volatile flavour compounds of sunflower oil[J]. Science and Technology of Food Industry, 33(14): 128-131. [in Chinese]) |
周琦, 黄凤洪, 杨湄, 等. 2016. 番茄籽油的挥发性成分分析[J]. 中国油脂, 41(9): 46-50. (Zhou Q, Huang F H, Yang M, et al. 2016. Volatile components of tomato seed oil[J]. China Oils and Fats, 41(9): 46-50. DOI:10.3969/j.issn.1003-7969.2016.09.010 [in Chinese]) |
周瑞宝. 2006. 芝麻油香气成分研究[J]. 中国油脂, 31(7): 7-11. (Zhou R B. 2006. Study on the flavor components of sesame oil[J]. China Oils and Fats, 31(7): 7-11. DOI:10.3321/j.issn:1003-7969.2006.07.001 [in Chinese]) |
朱永清, 李可, 袁怀瑜, 等. 2016. "巴山红"香椿不同发育时期挥发性物质分析[J]. 食品科学, 52(24): 118-123. (Zhu Y Q, Li K, Yuan H Y, et al. 2016. Analysis of volatile compounds in developing leaves of "Bashanhong" Toona sinensis[J]. Food Science, 52(12): 58-65. [in Chinese]) |
Andrea C M, Sybille B U, Jonathan G. 2012. The specificity of herbivore-induced plant volatiles in attracting herbivore enemies[J]. Trends in Plant Science, 17(5): 303-310. DOI:10.1016/j.tplants.2012.03.012 |
Beaulieu J C, Grimm C C. 2001. Identification of volatile compounds in cantaloupe at various developmental stages using solid phase microextraction[J]. Journal of Agriculture and Food Chemistry, 49(3): 1345-1352. DOI:10.1021/jf0005768 |
Érica A S S, Giovanni S, Nina C J, et al. 2017. Development of a HS-SPME-GC/MS protocol assisted by chemometric tools to study herbivore-induced volatiles in Myrcia splendens[J]. Talanta, 175(1): 9-20. |
Fanali C, Dugo L, Cacciola F, et al. 2011. Chemical characterization of Sacha Inchi (Plukenetia volubilis L.) Oil[J]. Journal of Agricultural and Food Chemistry, 59(24): 13043-13049. DOI:10.1021/jf203184y |
Follegatti RL A, Piantino C R, Grimaldi R, et al. 2009. Supercritical CO2 extraction of omega-3 rich oil from Sacha Inchi[J]. The Journal of supercritical Fluids, 49(3): 323-329. DOI:10.1016/j.supflu.2009.03.010 |
Gerard F A, Iolanda F, Joan L, et al. 2016. Bidirectional interaction between phyllospheric microbiotas and plant volatile emissions[J]. Trends in Plant Science, 21(10): 854-860. DOI:10.1016/j.tplants.2016.06.005 |
Guillén M D, Ruiz A, Cabo N, et al. 2003. Characterization of Sacha inchi (Plukenetia volubilis L.) oil by FTIR spectroscopy and HNMR comparison with linseed oil[J]. Journal of the American Oil Chemists' Society, 80(8): 755-762. DOI:10.1007/s11746-003-0768-z |
Jessica L G, Matthew J G, Salvador A G, et al. 2015. Identifying breeding priorities for blueberry flavor using biochemical, sensory, and genotype by environment analyses[J]. PLoS One, 10(9): 1-21. |
Katrin W, Dierk W, Joachim K, et al. 2012. Volatiles of two growth-inhibiting rhizobacteria commonly engage AtWRKY18 function[J]. The Plant Journal, 70(3): 445-459. DOI:10.1111/tpj.2012.70.issue-3 |
Luna G, Morales M T, Aparicio R. 2006. Characterisation of 39 varietal virgin olive oils by their volatile compositions[J]. Food Chemistry, 98(6): 243-252. |
Maria D G, Encarnacion G. 2008. Formation of oxygenated α, β-unsaturated aldehydes and other toxic compounds in sunflower oil oxidation at room temperature in closed receptacles[J]. Food Chemistry, 111(1): 157-164. DOI:10.1016/j.foodchem.2008.03.052 |
Moreda W, Pérez-Camino M C, Cert A. 2001. Gas and liquid chromatography of hydrocarbons in edible vegetable oils[J]. Journal of Chromatography A, 936(1-2): 159. DOI:10.1016/S0021-9673(01)01222-5 |
Nauman K, Nauman K, Rao S M. 2017. A comprehensive characterisation of safflower oil for its potential applications as a bioactive food ingredient[J]. Trends in Food Science & Technology, 66: 176-186. |
Patricia Y O, Manuel T L. 2013. Catabolism of volatile organic compounds influences plant survival[J]. Trends in Plant Science, 18(12): 695-703. DOI:10.1016/j.tplants.2013.08.011 |
Pulu S, Robert C S, Jean-Claude C, et al. 2016. My way: noncanonical biosynthesis pathways for plant volatiles[J]. Trends in Plant Science, 21(10): 884-894. DOI:10.1016/j.tplants.2016.07.007 |
Shelly H A, Orna S, Radu C R, et al. 2016. A metabolic gene cluster in the wheat W1 and the barley cer-cqu Loci determines β-diketone biosynthesis and glaucousness[J]. Plant Cell, 28(6): 1440-1460. DOI:10.1105/tpc.16.00197 |
Spietelun A, Marcinkowski T, de la Guardia M, et al. 2013. Recent developments and future trends in solid phase microextraction techniques towards green analytical chemistry[J]. Journal of Chromatography A, 1321(20): 1-13. |
Tommaso G, Debora D, Vito M P. 2008. Pro-oxidant action of polar triglyceride oligopolymers in edible vegetable oils[J]. European Food Research and Technology, 226(6): 1409-1414. DOI:10.1007/s00217-007-0671-3 |
Wouter K, Ronald P. 2010. Biogenic volatile organic compounds and plant competition[J]. Trends in Plant Science, 15(3): 126-132. DOI:10.1016/j.tplants.2009.11.007 |
Yang D S, Shewfelt R L, Lee K S, et al. 2008. Comparison of odor-active compounds from six distinctly different rice flavor types[J]. Journal of Agriculture and Food Chemistry, 56(8): 2780-2787. DOI:10.1021/jf072685t |
Yurchenko S, Molder U. 2006. Volatile N-nitrosaminesin various fish products[J]. Food Chemistry, 98(2): 325-333. |
 2018, Vol. 54
2018, Vol. 54

