文章信息
- 付冰, 叶霞, 王会鱼, 陈鹏, 李继东, 郑先波, 谭彬, 冯建灿
- Fu Bing, Ye Xia, Wang Huiyu, Chen Peng, Li Jidong, Zheng Xianbo, Tan Bin, Feng Jiancan
- 枣WRKY转录因子的鉴定及其对枣疯病植原体和激素处理的应答
- Identification of WRKY Transcription Factors in Jujube and Their Responses to 'Candidatus Phytoplasma ziziphi' and Salicylic Acid or Methyl Jasmonate Treatments
- 林业科学, 2018, 54(8): 65-78.
- Scientia Silvae Sinicae, 2018, 54(8): 65-78.
- DOI: 10.11707/j.1001-7488.20180808
-
文章历史
- 收稿日期:2017-10-23
- 修回日期:2017-11-02
-
作者相关文章
枣(Ziziphus jujuba)是我国重要的干果和特色经济树种之一。枣疯病(jujube witches’ broom,JWB)是一种典型的致死性枣疯病植原体(‘Candidatus Phytoplasma ziziphi’)病害,是枣树生产中发生最普遍、危害最严重的毁灭性传染病害,枣树受感染后,主要表现为叶片黄化、枝丛生、果实畸形等症状,一般发病3~5年会整株死亡,严重影响枣产业发展。建立枣的高效离体再生体系,通过稳定的遗传转化体系导入外源基因,快速培育优良品种是今后研究的重点(冯建灿等,2009)。
转录调控是植物在生长发育及代谢过程中调控细胞或组织中基因表达的重要机制(Zhang et al., 2005)。转录因子(transcription factor,TF)又称反式作用因子,是一种调控蛋白,它可以直接或间接作用于启动子来激活或抑制下游目标基因的转录,通过调控靶基因转录效率使植物对各种因素产生及时的反应,从而调节植物体的正常生长发育和应对外界胁迫(Eulgem et al., 2000;Porto et al., 2014)。WRKY转录因子是植物中广泛存在、最大的转录家族之一。Ishiguro等(1994)在甘薯(Dioscorea esculenta)中克隆得到第1个WRKY转录因子编码基因SPF1,继而在越来越多的植物基因组中克隆得到WRKY基因。WRKY转录因子名称来源于其N末端高度保守的WRKYGQK氨基酸序列(Agarwal et al., 2011),在对靶标基因进行调控时,WRKY可以通过此保守序列特异性识别并启动下游基因启动子区域的W-Box(Wang et al., 2013),从而调节植物对病原体的防卫作用、非生物胁迫抗性、生长发育以及激素信号的转导等。如在拟南芥(Arabidopsis thaliana)中过表达AtWRKY7可以提高植物对丁香假单孢菌(Pseudomonas syringae)的抗性水平,而AtWRKY7的突变体对丁香假单孢菌的抗病能力却显著降低,说明AtWRKY7在防御丁香假单孢菌的过程中发挥正向调控作用(Kim et al., 2006);相反,AtWRKY48在丁香假单胞菌有毒生理小种的侵染过程中发挥负向调控的功能(Xing et al., 2008)。而AtWRKY33受病原菌的诱导表达后,能增强拟南芥对黑斑病菌(Alternaria brassicicola)和灰葡萄孢菌(Botrytis cinerea)的防御能力(Zheng et al., 2006)。在水稻(Oryza sativa)中,OsWRKY45-1和OsWRKY45-2是1对等位基因,2个基因过表达之后均能够提高水稻对稻瘟病菌(Magnaporthe oryzae)的抗性;但在白叶枯病病菌(Xanthomonas oryzae pv. oryzae)的侵染过程中,二者却发挥完全相反的作用,其中OsWRKY45-2作为正调控因子,而OsWRKY45-1则发挥负调控作用(Tao et al., 2009; Shimono et al., 2012)。葡萄(Vitis vinifera) VvWRKY33在霜霉病病原菌(Plasmopara viticola)的侵染过程中表达量明显上调,同时伴随着VvPR10.1的积累,将该基因在葡萄叶片中过表达后,可以增强植株对霜霉病的抗性(Merz et al., 2014)。
在植物的防御信号途径中,植物激素是重要的组成部分,其中水杨酸(salicylic acid,SA)和茉莉酸(jasmonic acid,JA)的积累是植物抵抗其他生物入侵的重要反应。病原菌入侵可诱导SA的积累,常常会导致活性氧(ROS)的活性水平增加和一些特定病程相关蛋白(PRs)的表达(Baker et al., 1995; Chen et al., 1993; Klessing et al., 2000; Lamb et al., 1997; Loake et al., 2007)。在SA诱导的病原防御中,AtWRKY70可以增强对白粉病菌(Blumeria graminis)的抗性,但是却降低了对黑斑病菌的抗性(杨建,2010)。拟南芥受到霜霉病菌侵染或外源施加SA处理后,可以诱导49个AtWRKY转录因子基因的表达水平发生变化。PDF1.2经常作为JA防御通路中的标记基因,在植物受到丁香假单胞菌侵染后,与JA响应相关的基因,如LOX2、PDF1.2以及VSP的表达量都明显上调。SA诱导的疾病防御基因AtPR1在突变体atwrky38和atwrky62中的表达量明显升高,而在双突变体中表达量更高;过表达AtWRKY38或AtWRKY62降低植株对疾病的抗性,同时AtPR1的表达量降低,这说明AtWRKY38或AtWRKY62在病原菌防御过程中发挥负向调节作用(Kim et al., 2008)。
枣基因组测序的完成(Liu et al., 2014),为全面研究枣WRKY转录因子家族提供了可能。本研究利用生物信息学的方法,鉴定出枣的相关WRKY转录因子,对枣疯病发生过程中部分WRKY转录因子的转录水平进行分析和qPCR验证,并对SA和MeJA处理后WRKY基因的表达量进行了分析,探讨WRKY基因在枣疯病发病过程中的作用,为进一步研究枣WRKY转录因子的生物学功能及枣与植原体相互作用机制奠定基础。
1 材料和方法 1.1 枣疯病植原体转染与枣转录组测序为将枣疯病植原体转染到健康枣苗,从感病枣苗上切取接芽,采用“T”型芽接法,将带有植原体的芽嫁接于健康1年生灰枣(Z. jujuba ‘Huizao’)上,枣苗定植于河南农业大学园艺学院试验站防虫网室内。为观察研究一年中完整的枣疯病发病过程,转染在秋季进行,于每周采集叶片进行植原体PCR检测和表形观察。转录组样品采集时间为嫁接后0周(2014-08-13)、嫁接后2周(2014-08-23,叶片PCR检测初次检测到植原体)、37周(2015-05-27,翌年枣苗萌芽后初次检测到植原体)、39周(2015-06-10,枣苗开始出现可视枣疯病症状)、48周(2015-08-19,枣苗出现丛枝、黄化等典型症状)和52周(2015-09-01,丛枝、黄化加剧,叶片开始脱落)。每次取样均选取健康对照枣苗和感病枣苗各3株,采集叶片,迅速放入液氮,并-80 ℃保存。枣叶片的RNA提取采用试剂盒法(上海生工生物工程有限公司,上海)。将提取的RNA样品送往北京源泉宜科生物科技有限公司进行测序以及文库构建,使用Illumina HiSeq 2000高通量测序平台进行转录组测序。
1.2 枣WRKY转录家族生物信息学分析 1.2.1 枣假定WRKY转录因子的识别从NCBI (http://www.ncbi.nlm.nih.gov/)中,应用Blast命令,得到87个假定WRKY转录因子核苷酸及氨基酸序列,从枣转录组测序数据得到49个假定WRKY转录因子序列。将2部分假定WRKY转录因子的下载结果在PlantTFDB (http://planttfdb.cbi.pku.edu.cn/)进行比对,利用SMART在线对得到的假定WRKY蛋白进行功能结构的预测,去除重复序列和不含WRKY保守结构域的蛋白,并重新命名为ZjWRKYs。同时利用ExPASy Proteomics Server (http://expasy.org/)对所有WRKY蛋白的分子量(MW)和等电点(pI)进行预测。
1.2.2 WRKY家族的进化树分析及染色体定位从拟南芥数据库TAIR(http://www.arabidopsis.org/)下载得到拟南芥72个WRKY家族转录因子的氨基酸序列,根据拟南芥WRKY家族的分类方法,利用MEGA6.0软件,通过MUSCLE进行序列比对,采用邻接法(Neighbor-Joining,NJ),采用默认参数,校验参数Bootstrap重复1 000次,构建系统进化树。通过MapInspect软件将得到的枣WRKY家族基因进行染色体定位,并绘制位置图。
1.2.3 WRKY的保守区域比对及基序分析利用DNA MAN软件对枣WRKY蛋白的保守结构域进行比对,参数采用系统默认数值。MEME(http://meme.nbcr.net/meme/)用来搜索枣假定WRKY蛋白的保守基序,设置最大基序数量为10,其余均采用默认参数。
1.3 枣WRKY转录因子家族基因在枣疯病发病过程中的差异表达与qPCR验证对转染枣疯病植原体后不同时期转录组分析结果中的WRKY转录因子表达水平进行分析,采用pheatmap软件绘制WRKY基因表达热图。选取枣疯病发病过程中表达量变化较大的6个上调基因,设计定量引物(表 1),RNA模板为转录组测序样品RNA,使用Takara反转录试剂盒(宝生物工程有限公司,大连)执行cDNA第1条链的合成,利用实时荧光定量PCR技术检测其在枣疯病发病过程中的表达量。试验所用的荧光颜料SYBR Select Master Mix(Applied Biosystems by Life Technologies)。所选内参为Actin,上游引物:5′-agccttcctgccaacgagt-3′,下游引物:5′-ttgcttctcaccctt gatgc-3′。
|
|
选择大小生长一致的枣‘蜂蜜罐’(Z. jujuba ‘Fengmiguan’)胚培苗,在三角培养瓶中分别喷施0.1 mmol·L-1水杨酸和0.1 mmol·L-1茉莉酸甲酯,每个处理重复3次,处理后0,4,8,16,24 h采叶片,每个时间段重复3次取样,将样品迅速放入液氮中保存。以处理后0 h为对照,利用实时荧光定量PCR技术(参照1.3)检测其处理后不同时期的表达量。RNA提取及cDNA第1条链的合成参照1.1、1.3。
2 结果与分析 2.1 枣WRKY转录家族的鉴定在植物转录因子数据库中已有枣WRKY转录因子55个,从枣转录组数据库中又鉴定出14个枣WRKY假定蛋白(已上传NCBI,并获得相应登录号,表 2),枣WRKY蛋白家族成员为69个。依照它们在染色体上的位置信息,将69个WRKY蛋白重新命名为ZjWRKY1-ZjWRKY69。
|
|
对69个ZjWRKY转录蛋白进行理化性质分析(表 2),氨基酸含量在145 (ZjWRKY40)~758 (ZjWRKY2)不等,枣WRKY蛋白的分子量介于16 087.2 (ZjWRKY40)~82 009.1 (ZjWRKY2)之间,这也与它们的氨基酸含量成正比。另外,ZjWRKY1等电点最小(5.12),而ZjWRKY59最大(9.84)。不同WRKY蛋白之间氨基酸数量差别较大,理化性质变化明显,这种差异可能与它们具有不同生物学功能和参与不同生理过程密切相关。
2.2 枣WRKY转录家族成员的系统进化依据枣WRKY蛋白与拟南芥WRKY蛋白的相似性进行聚类分析,将69个WRKY蛋白分为3个组Group Ⅰ、Group Ⅱ和Group Ⅲ,且与拟南芥的分组相对应。Group Ⅰ成员含有2个WRKY保守结构域,C末端锌指蛋白结构类型为C2H2,而Group Ⅱ和Group Ⅲ只含有1个保守结构域,其C末端锌指蛋白结构类型分别为C2H2和C2HC。根据枣与拟南芥的同源进化树(图 1)可以看出,有17个ZjWRKY属于Group Ⅰ;Group Ⅱ中含有41个WRKY成员,可细分为Ⅱa、Ⅱb、Ⅱc、Ⅱd、Ⅱe 5个亚组,所含WRKY成员分别为3个、11个、15个、3个、9个;GroupⅢ含有11个ZjWRKY成员。
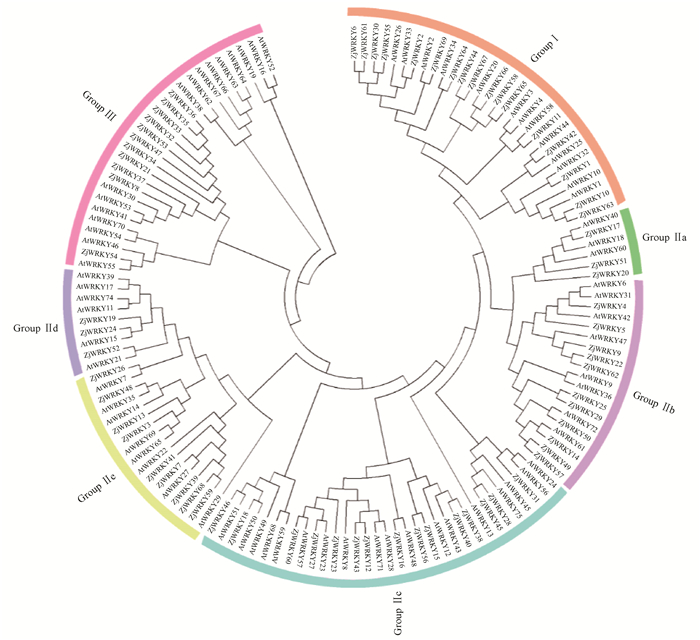
|
图 1 枣与拟南芥WRKY转录因子的系统进化树 Figure 1 The phylogenetic tree of WRKY transcription factors in jujube and Arabidopsis thaliana |
由图 1发现,在每个组中均包含有AtWRKYs和ZjWRKYs,如GroupⅠ中有17个枣WRKY转录因子、13个拟南芥WRKY转录因子,这说明2个物种的WRKY转录因子存在一定保守性。同一个分组内,AtWRKYs和ZjWRKYs在进化树上单独位于一簇分支上,如在GroupⅠ中的ZjWRKY6和61、30和55单独在一个小分组,而AtWRKY3和4在一个分组;GroupⅡ的ZjWRKY68和59、AtWRKY3和4;GroupⅢ中这种现象尤为明显,ZjWRKY8、21、32、33、34、35、36、37、47和53存在成簇现象,AtWRKY18、19、38、52、62、63、64、66和67成簇存在,表明WRKY转录因子在不同物种之间存在一定差异。
2.3 枣WRKY基因的染色体定位利用Mapinspect软件对ZjWRKY基因进行染色体定位,结果如图 2(图左侧cM为基因图距单位),43个WRKY基因可以定位在枣的11条染色体上,26个WRKY基因无匹配的染色体定位信息。在枣的12条染色体上,7号染色体上无WRKY基因,其余11条染色体上都分布有不同数量的ZjWRKY基因。11号染色体上分布最多,含有8个ZjWRKY基因(ZjWRKY30-ZjWRKY37),占11.60%,其次是1号染色体,含有6个ZjWRKY基因,而2号和8号染色体最少,只有1个WRKY基因(分别为ZjWRKY6和ZjWRKY21)。从图 2中还可以看出,枣中的WRKY基因在12条染色体上的分布并不是均匀的,在6、9、11和12号染色体上WRKY基因成簇存在。

|
图 2 枣WRKY基因的染色体定位 Figure 2 The chromosome location of jujube WRKY genes |
利用MEME在线工具对枣WRKY蛋白的保守基序进行预测分析,得到10个保守基序,并将其命名为motif 1-motif 10(图 3)。motif 1和motif 2包含有WRKY蛋白标志性的WRKYGQK结构域。motif 1结构最为保守,ZjWRKY40(GroupⅡc)和ZjWRKY49(GroupⅡb)以外的67个枣WRKY蛋白均含有该结构。10个WRKY转录因子不含有motif 2结构,分别为GroupⅠ的ZjWRKY1、11、49,GroupⅡa的ZjWRKY48,GroupⅡb的ZjWRKY40、54,GroupⅡe的ZjWRKY42以及GroupⅢ中的ZjWRKY3、13、26。其次motif 3、4、5也较为保守,在每个分组几乎都占有一定比例。21个WRKY蛋白含有motif 9结构,其中GroupⅡa和GroupⅡd完全不含有该结构。同样,21个WRKY转录因子含有motif 10,该结构在每个分组都有分布。GroupⅠ中ZjWRKY44、58、66、67,GroupⅡd的ZjWRKY52以及GroupⅢ中ZjWRKY33、34、35、36、47等都含有最多的保守基序(10个);GroupⅡc的ZjWRKY18和ZjWRKY46含有最少的保守基序(2个)。
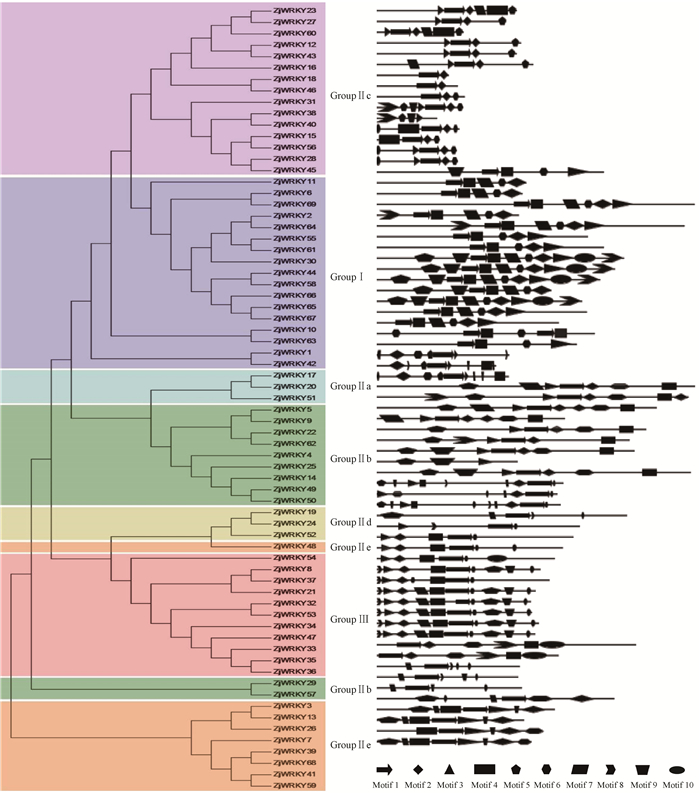
|
图 3 ZjWRKY蛋白的保守基序分析 Figure 3 Analysis of conseved motifs of ZjWRKY proteins |
本试验从枣疯病发生过程中的枣叶片的转录组数据中检测到了28个ZjWRKY转录因子基因,其表达水平变化如图 4。与对照健康枣苗相比28个ZjWRKY基因在嫁接后0周表达量无显著变化,第2、37周多为下调表达,这些时期能检测到植原体存在,稍有症状出现;39~48周显著上调表达,此时期为发病盛期,丛枝、黄化、小叶等症状显著;嫁接后52周下调表达,这时枣苗受植原体危害严重,处于凋亡状态。
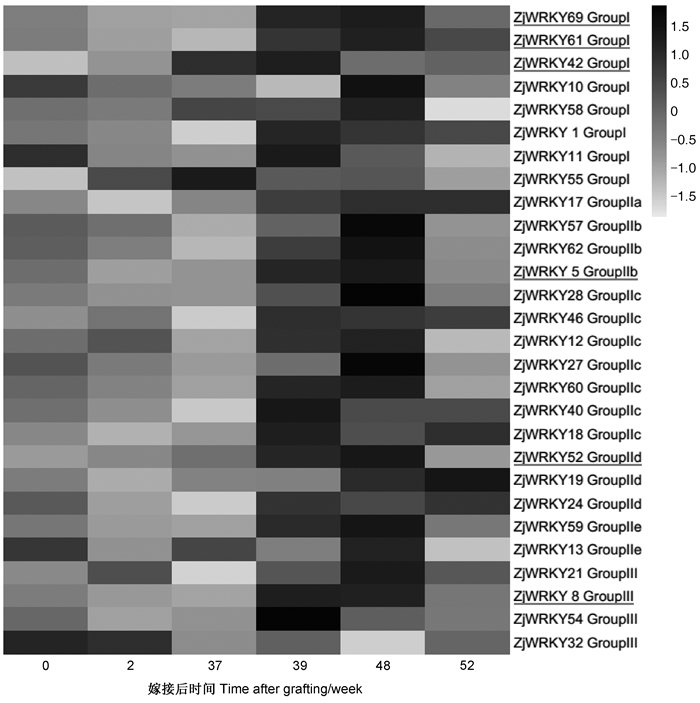
|
图 4 ZjWRKY基因在嫁接后不同时期的表达水平 Figure 4 Expression levels of ZjWRKY genes in different periods after grafting |
枣WRKY基因差异表达主要集中在嫁接后38~52周。GroupⅠ中差异表达的基因有8个,ZjWRKY1、61、69在嫁接后39~48周表达量上调;ZjWRKY42在37~39周2个时期表达量显著升高;ZjWRKY55、58的表达量分别只在37周和48周时期有明显变化;ZjWRKY10、11随着嫁接周数增加,表达量呈现先下降后升高的趋势。GroupⅡ中共检测到16个基因差异表达,其中GroupⅡa的ZjWRKY17以及GroupⅡc的ZjWRKY46在嫁接后39~52周表达量升高;GroupⅡb中的3个基因在52周变化最为明显;GroupⅡd的2个基因在48~52周表达量差异相对比较突出。GroupⅢ中除了ZjWRKY8在39~48周表达量明显上调外,ZjWRKY21和ZjWRKY54都只在1个时期上调明显,分别为48周和39周;而ZjWRKY32在嫁接前期(第2周)表达量显著升高。
根据枣与拟南芥的进化树(图 1)可以知道,ZjWRKY8(GroupⅢ)与AtWRKY30同源关系比较近,研究表明,AtWRKY30参与了植物激素类信号调节路径。在ABA和MeJA处理下,AtWRKY30RNAi植株的种子萌发率明显低于野生型;将正常生长1周的幼苗移栽到含有ABA和MeJA的平板上继续生长2周,AtWRKY30RNAi植株未表现出敏感表型,表明AtWRKY30参与了种子萌发阶段植物激素类信号调节途径(Scarpeci et al., 2013)。ZjWRKY5(GroupⅡb)与AtWRKY6的同源性较高,而AtWRKY6参与了植物的衰老和防御进程,在防御过程中可以对PR1做出正向调节作用。SIPK可以编码一种受体蛋白激酶,在植物的衰老过程中表达量显著升高,而SIPK的转录激活依赖于AtWRKY6,将AtWRKY6基因敲除之后,SIPK的表达量明显下调(Robatzek et al., 2002)。与ZjWRKY61(GroupⅠ)同源关系较近的是AtWRKY26和AtWRKY33,它们与多种非生物胁迫(低温、高盐、脱落酸等)有关,其中低温和高盐对AtWRKY26和AtWRKY33的诱导尤为明显,表明这2个WRKY基因可能在响应环境信号方面起着一定的作用(付乾堂等,2010)。ZjWRKY69(GroupⅠ)与AtWRKY2在进化树上属于一个分组,AtWRKY2的表达受NaCl及甘露醇的诱导,表明AtWRKY2可能在NaCl和甘露醇引起的渗透胁迫反应中起一定的作用(江文波等,2009)。根据ZjWRKYs与AtWRKYs的进化树,认为这些WRKY转录因子基因之间可能功能类似,参与了一些非生物胁迫或者响应激素处理。而ZjWRKYs在枣疯病发病过程中表达量显著升高,说明植原体侵染后诱导了这些基因的表达,表明它们与枣疯病的发生发展有密切关系。
2.6 枣疯病发病过程中ZjWRKY基因的qPCR分析以测序样品RNA反转录后的cDNA为模板,采用实时荧光定量PCR,对ZjWRKY5、ZjWRKY8、ZjWRKY42、ZjWRKY52、ZjWRKY61和ZjWRKY69的表达量进行了检测。由图 5可以看出,ZjWRKY5、ZjWRKY52、ZjWRKY61 3个基因在嫁接后2周、37周、39周的表达量都呈上调趋势,且高于同时期的健康对照,与基因表达热图趋势基本一致。而ZjWRKY8、ZjWRKY69在嫁接后第2周和第39周时表达量最高,在嫁接后37周时表达量较低。ZjWRKY42在嫁接后37周、39周表达量都呈现明显上调趋势,且显著高于同时期的健康对照,与热图变化保持一致。植原体嫁接后2周、37周、39周是嫁接后初次检测到植原体DNA、出现发病症状,到枣树表现出丛枝症状的整个过程,属于植原体侵染前期。结合定量结果,ZjWRKY8、ZjWRKY52、ZjWRKY61、ZjWRKY69均在该时期显著表达。由此可以认为枣疯病植原体侵入引起了枣中WRKY转录因子基因家族中ZjWRKY8、ZjWRKY52、ZjWRKY61、ZjWRKY69表达量的变化(上调)。
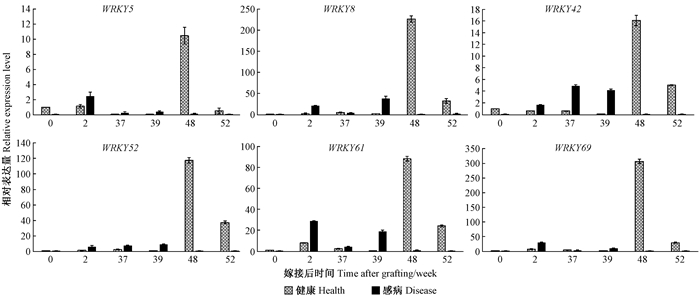
|
图 5 植原体侵染过程中枣WRKY基因的表达量分析 Figure 5 Analysis of ZjWRKY gene expression during phytoplasma infecting process |
SA处理对枣6个WRKY转录因子基因的表达量影响如图 6。从图中可以看出,6个WRKY转录因子基因在0.1 mmol·L-1SA处理后,表达量发生了显著的变化,不同的基因在不同的时期表达量也有极大的差异。ZjWRKY52对SA处理的反应最为强烈,处理后0~8 h表达量变化不大,在处理8 h以后表达量升高,16 h表达量最高,是处理0 h表达量的将近120倍。ZjWRKY42在处理后8 h时表达量最高,相对0 h表达量增加34倍。ZjWRKY5和ZjWRKY61表达量在8 h时达到峰值,分别为处理0 h的6倍和10倍。ZjWRKY8在处理16 h时表达量最高,约为0 h的7倍。ZjWRKY69的表达量并没有较大变化。结果表明,SA处理后诱导了ZjWRKY5、ZjWRKY8、ZjWRKY42、ZjWRKY52和ZjWRKY61的表达。

|
图 6 水杨酸处理后枣WRKY基因的表达量分析 Figure 6 Analysis of ZjWRKY gene expression after SA treatment |
MeJA处理后只有少数基因变化量比较大(图 7)。ZjWRKY5、ZjWRKY8、ZjWRKY52、ZjWRKY69的表达量在处理后虽然呈现先下降再升高的变化趋势,但整个过程表达量并没有比较明显的变化(变化量2倍以内)。而ZjWRKY42、ZjWRKY61在处理前期变化一直不明显,只在24 h表达量最高,分别为处理0 h的4.3倍和6.7倍。结果表明,MeJA的积累诱导了ZjWRKY42和ZjWRKY61的表达量明显升高。

|
图 7 茉莉酸甲酯处理后枣WRKY基因的表达量分析 Figure 7 Analysis of WRKY gene expression after MeJA treatment |
拟南芥(AG Initiative et al., 2000)和水稻(Yu et al., 2002)基因组测序完成使在全基因组水平上对WRKY转录因子家族进行研究成为可能,此后,大量的WRKY家族成员在各种植物中被相继发现,拟南芥含有72个,水稻中有大于100个,大豆中则多至197个(Eulgem et al., 2007; Song et al., 2010; Schmutz et al., 2010),苹果(Malus domestica)鉴定出128个(许瑞瑞等,2012)。本研究共鉴定出69个枣WRKY转录因子,其中有14个ZjWRKYs是根据转录组测序新鉴定发现的。相对于其他植物所鉴定的WRKY转录因子数量而言,枣WRKY转录因子的数量相对较少,是否还有尚未发现的,仍需进一步研究。已发现的枣WRKY转录因子在各组中的数量分布与拟南芥较为类似,拟南芥含有72个WRKY转录因子,在GroupⅠ,GroupⅡa、b、c、d、e以及GroupⅢ中分别含有13、4、7、18、7、9、14个家族成员,枣中分别含有17、3、11、15、3、9、11个成员。从进化树上可以看出ZjWRKY转录因子的3个分组中GroupⅡa与GroupⅠ靠得最近,这表明它们之间有更近的进化关系。对枣WRKY转录因子的保守序列进行比对时发现,有2个转录因子ZjWRKY23和ZjWRKY46变异为WRKYGKK结构,这2个转录因子都属于GroupⅡc亚组,而这种变化在其他植物中也有报道,如拟南芥WRKY家族成员中的AtWRKY50、AtWRKY51和AtWRKY59;研究发现有些植物中存在WRKYGEK组成的核心结构域(Qiu et al., 2004),暗示WRKY转录因子家族可能具有更加广泛的生物学功能,这也表明植物WRKY基因家族在进化过程中出现了多样性。枣WRKY蛋白的保守基序预测结果表明GroupⅠ中的WRKY转录因子含有较多的基序数量(10个),结构更加完整;且同一个分组内WRKY蛋白的保守基序类型及个数相似,与它们之间的进化关系一致。ZjWRKYs基因在枣12条染色体上分布不均匀,7号染色体上并没有匹配上相应的ZjWRKY基因,目前在其他物种上没有发现类似情况,可能还未发现7号染色体上的ZjWRKY基因,也可能是7号染色体上根本没有ZjWRKY基因的存在,这还有待进一步研究。在6、9、11和12号染色体上发现有基因簇存在,表明ZjWRKY基因家族的进化很大程度上跟串联重复事件有关。
3.2 枣疯病发病过程中WRKY转录因子基因的差异表达大量研究表明,WRKY转录因子在植物抗病过程中发挥重要作用,然而其具体抗病机制目前尚不明确。枣受枣疯病植原体侵染后6个时期转录组分析和qPCR结果发现ZjWRKY5、ZjWRKY8、ZjWRKY42、ZjWRKY52、ZjWRKY61和ZjWRKY69等基因在植原体侵染后表达量有明显上调,说明植原体的侵染诱导了这些基因的表达,这些WRKY转录因子基因的表达可能与抗病有关。棉花(Gossypium spp.) GhWRKY39-1和GhWRKY40在烟草(Nicotiana tabacum)中过量表达后,均能够影响植株对青枯雷尔氏菌(Ralstonia solanacearum)的敏感性,GhWRKY40还能提高植株对伤害的耐受性(Shi et al., 2014;Wang et al., 2014)。毛果杨(Populus trichocarpa)PtrWRKY73,在拟南芥中过表达可以增强植株对活体营养型病原菌丁香假单胞菌的抗性,而在野生型中抗性降低;将其在拟南芥中过表达之后对死体营养型病原菌灰霉病菌(Botrytis cinerea)的敏感性增强,这说明WRKY转录因子在对不同病原菌的防御过程中发挥不同的作用(Duan et al., 2015)。本研究中枣疯病发病后期(嫁接后52周)6个基因的表达量明显下调,可能与枣疯病发病末期,枣树防御功能完全被破坏、新陈代谢紊乱有关。
3.3 外源施加SA、MeJA后WRKY基因的表达量差异SA通路、JA通路是植物抗病反应中2种重要的信号通路,生物胁迫的发生会迅速激活SA、JA等激素信号通路,造成相关基因的转录水平发生变化。SA处理后,ZjWRKY42和ZjWRKY52 2个基因表达量变化最为明显,MeJA处理后,ZjWRKY42、ZjWRKY61表达量变化较大,表明这几个转录因子基因的表达分别受SA和JA调控。用SA诱导水稻叶片后,OsWRKY45和OsWRKY62在12 h后表达量增加;外源喷施MeJA后,OsWRKY10、OsWRKY82和OsWRKY85在处理后4~12 h表达量增加;SA和MeJA均可以诱导OsWRKY30和OsWRKY83基因的表达(Ryu et al., 2006)。OsWRKY3在SA、MeJA处理后的前6 h内,表达量上调(Liu et al., 2005)。水杨酸被认为是一种重要的病原信号分子,SA的积累可以激活SAR(系统获得抗性),参与多种病原防御过程。如烟草的突变体不能正常积累SA,对病原菌的抗性减弱(Delaney et al., 1995)。NahG水解酶可以将SA水解成没有活性的邻苯二酚,将该基因转入烟草或拟南芥后,植株对病原菌的入侵变得更加敏感(Kachroo et al., 2000)。在抗烟草花叶病毒(tobacco mosaic virus,TMV)的烟草栽培品种中,内源SA水平在接种TMV的叶片内能增加40倍左右,同一植株的其他未感染叶片内增加10倍左右,但在易感品种中没有这种规律,说明SA在激活植物防御反应抵御病原菌侵染过程中起着重要作用(谢鑫等,2011)。大量研究表明植物防御寄生型病源菌常常激活SA介导的抗病信号途径,而防御半寄生和腐生型病源菌常常激活JA介导的抗病信号途径(Spoel et al., 2007),这可能是植物-病原菌共进化的结果(Mcdowell et al., 2000)。
病原相关分子激发的抗性反应即PTI (pathogen associated molecular pattern triggered immunity),植物主要通过识别病原物特异相关分子,并激活下游的激酶级联反应以及相关防御基因表达而产生抗病(Eulgem et al., 2007;Jones et al., 2006),这种抗病形式与由激素(如SA、JA)介导的免疫系统有关。MAP激酶会受到病原菌及植物激素SA的诱导,触发的级联反应往往通过特定的磷酸化反应作用于相关的WRKY蛋白,激活的WRKY基因又可以作为其他基因的抑制剂或者激活剂,在植物对病原菌的防御过程中发挥相关功能(Asai et al., 2002; Gómez-Gómez et al., 2000; Petersen et al., 2000; Yang et al., 2001)。在SA介导的防御信号通路中,一些特定的PR表达量升高,从而引起植株对病原菌的抗性增加。辣椒(Capsicum annuum) CaWRKY27通过参与SA、JA信号通路来调控转基因烟草对茄科雷尔氏菌的敏感性,将该基因过表达之后能够明显增强烟草对茄科雷尔氏菌的抵抗力(Dang et al., 2014)。OsWRKY45在SA引起的病原防御反应中起重要作用,敲除OsWRKY45后,植株对SA介导的病菌抵抗力显著降低,相反,将该基因过表达则可以提高植株的防御能力(Matsushita et al., 2013; Nakayama et al., 2013)。
4 结论通过基因组分析确定了枣中69个WRKY转录因子,可以分为3个组GroupⅠ、GroupⅡ和GroupⅢ,其中有43个ZjWRKY转录因子基因可以匹配到枣的11条染色体上,并呈不均匀随机分布,在7号染色体上还没有发现枣WRKY基因的存在。枣疯病植原体侵染枣树后,诱导了ZjWRKY8、ZjWRKY52、ZjWRKY61和ZjWRKY69基因的表达。水杨酸处理后同样使ZjWRKY42和ZjWRKY52的表达量显著升高;茉莉酸甲酯处理则引起了ZjWRKY42和ZjWRKY61基因的表达量升高,说明这几个转录因子基因的表达可能在SA和JA激素通路中发挥作用。
冯建灿, 喻晓敏, 尚霄丽, 等. 2009. 枣叶片离体再生体系研究进展[J]. 经济林研究, 27(1): 98-101. (Feng J C, Yu X M, Shang X L, et al. 2009. Advances in regenaration system for jujube leaves in vitro[J]. Nonwood Forest Research, 27(1): 98-101. [in Chinese]) |
付乾堂, 余迪求. 2010. 拟南芥AtWRKY25、AtWRKY26和AtWRKY33在非生物胁迫条件下的表达分析[J]. 遗传, 32(8): 848-856. (Fu Q T, Yu D Q. 2010. Expression profiles of AtWRKY25, AtWRKY26 and AtWRKY33 under abiotic stresses[J]. Hereditas, 32(8): 848-856. [in Chinese]) |
江文波, 余迪求. 2009. 拟南芥WRKY2转录调控因子可能参与调控渗透胁迫反应[J]. 植物分类与资源学报, 31(5): 427-432. (Jiang W B, Yu D Q. 2009. Arabidopsis WRKY2 transcription factors may be involved in osmotic stress response[J]. Acta Botanica Yunnanica, 31(5): 427-432. [in Chinese]) |
谢鑫, 桑维钧, 张新强, 等. 2011. 水杨酸诱导烟草抗TMV作用的研究[J]. 江苏农业科学, 39(2): 151-153. (Xie X, Sang W J, Zhang X Q, et al. 2011. Research on the effect of salicylic acid induced resistance to TMV in tobacco[J]. Jiangsu Agricultural Sciences, 39(2): 151-153. [in Chinese]) |
许瑞瑞, 张世忠, 曹慧, 等. 2012. 苹果WRKY转录因子家族基因生物信息学分析[J]. 园艺学报, 39(10): 2049-2060. (Xu R R, Zhang S Z, Cao H, et al. 2012. Bioinformatics analysis of WRKY transcription factors genes family in apple[J]. Acta Horticulture Sinica, 39(10): 2049-2060. [in Chinese]) |
杨建. 2010. LURP1诱导型启动子驱动下AtWRKY70表达载体构建及对水稻的遗传转化. 福州: 福建农林大学硕士学位论文. (Yang J. 2010. Construction of expression vector of AtWRKY70 driven by LURP1 inducible promoter and its genetic transformation to rice. Fuzhou: MS thesis of Fujian Agriculture and Forest University. [in Chinese]) |
AG Initiative. 2000. Analysis of the genome sequence of the flowering plant Arabidopsis thaliana[J]. Nature, 408(6814): 796-815. DOI:10.1038/35048692 |
Agarwal P, Reddy M P, Chikara J. 2011. WRKY:its structure, evolutionary relationship, DNA-binding selectivity, role in stress tolerance and development of plants[J]. Molecular Biology Reports, 38(6): 3883-3896. DOI:10.1007/s11033-010-0504-5 |
Asai T, Tena G, Plotnikova J, et al. 2002. MAP kinase signaling cascade in Arabidopsis innate immunity[J]. Nature, 415(6875): 977-983. DOI:10.1038/415977a |
Baker C J, Orlandi E W. 1995. Active oxygen in plant pathogenesis[J]. Ann Rev Phytopathol, 33(1): 299-321. DOI:10.1146/annurev.py.33.090195.001503 |
Chen Z, Silva H, Klessig D F. 1993. Active oxygen species in the induction of plant systemic acquired resistance by salicylic acid[J]. Science, 262(5141): 1883-1886. DOI:10.1126/science.8266079 |
Dang F, Wang Y, She J, et al. 2014. Overexpression of CaWRKY27, a subgroup Ⅱe WRKY transcription factor of Capsicum annuum, positively regulates tobacco resistance to Ralstonia solanacearum infection[J]. Physiol Plant, 150(3): 397-411. DOI:10.1111/ppl.2014.150.issue-3 |
Delaney T P, Friedrich L, Ryals J A. 1995. Arabidopsis signal transduction mutant defective in chemically and biologically induced disease resistance[J]. Proceedings of the National Academy of Sciences of the United States of America, 92(14): 6602-6606. DOI:10.1073/pnas.92.14.6602 |
Duan Y, Jiang Y, Ye S, et al. 2015. PtrWRKY73, a salicylic acid-inducible poplar WRKY transcription factor, is involved in disease resistance in Arabidopsis thaliana[J]. Plant Cell Reports, 34(5): 831-841. DOI:10.1007/s00299-015-1745-5 |
Eulgem T, Rushton P J, Robatzek S, et al. 2000. The WRKY superfamily of plant transcription factors[J]. Trends Plant Sci, 5(5): 199-206. DOI:10.1016/S1360-1385(00)01600-9 |
Eulgem T, Somssich I E. 2007. Networks of WRKY transcription factors in defense signaling[J]. Curr Opin Plant Biol, 10(4): 366-371. DOI:10.1016/j.pbi.2007.04.020 |
Gómez-Gómez L, Boller T. 2000. FLS2:a LRR receptor-like kinase involved in recognition of the flagellin elicitor in Arabidopsis[J]. Mol Cell, 5(6): 1003-1011. DOI:10.1016/S1097-2765(00)80265-8 |
Ishiguro S, Nakamura K. 1994. Characterization of a cDNA encoding a novel DNA-binding protein, SPF1, that recognizes SP8 sequences in the 5'upstream regions of genes coding for sporamin and β-amylase from sweet potato[J]. Mol Gen Genet, 244(6): 563-571. |
Jones J D, Dang J L. 2006. The plant immune system[J]. Nature, 444(7117): 323-329. DOI:10.1038/nature05286 |
Kachroo P, Yoshioka K, Shah J, et al. 2000. Resistance to turnip crinkle virus in Arabidopsis is regulated by two host genes and is salicylic acid dependent but NPR1, ethylene, and jasmonate independent[J]. Plant Cell, 12(5): 677-691. DOI:10.1105/tpc.12.5.677 |
Kim K C, Fan B, Chen Z X. 2006. Pathogen-induced Arabidopsis thaliana WRKY7 is a transcriptional repressor and enhances plant susceptibility to Pseudomonas syringae[J]. Plant Physiol, 142(3): 1180-1192. DOI:10.1104/pp.106.082487 |
Kim K C, Lai Z, Fan B, et al. 2008. Arabidopsis WRKY38 and WRKY62 transcription factors interact with histone deacetylase 19 in basal defense[J]. Plant Cell, 20(9): 2357-2371. DOI:10.1105/tpc.107.055566 |
Klessig D F, Durner J, Noad R, et al. 2000. Nitric oxide and salicylic acid signaling in plant defense[J]. Proc Natl Acad Sci USA, 97(16): 8849-8855. DOI:10.1073/pnas.97.16.8849 |
Lamb C, Dixon R A. 1997. The oxidative burst in plant disease resistance[J]. Ann Rev Plant Physiol Mol Biol, 48(1): 251-275. DOI:10.1146/annurev.arplant.48.1.251 |
Liu M J, Zhao J, Cai Q L, et al. 2014. The complex jujube genome provides insights into fruit tree biology[J]. Nature Communications, 5: 5315. DOI:10.1038/ncomms6315 |
Liu X Q, Bai X Q, Qian Q, et al. 2005. OsWRKY03, a rice transcriptional activator that functions in defense signaling pathway upstream of OsNPR1[J]. Cell Research, 15(8): 593-603. DOI:10.1038/sj.cr.7290329 |
Loake G, Grant M. 2007. Salicylic acid in plant defence—the players and protagonists[J]. Curr Opin Plant Biol, 10(5): 466-472. DOI:10.1016/j.pbi.2007.08.008 |
Matsushita A, Inoue H, Goto S, et al. 2013. The nuclear ubiquitin proteasome degradation affects WRKY45 function in the rice defense program[J]. Plant, 73(2): 302-313. |
Mcdowell J M, Dangl J L. 2000. Signal transduction in the plant immune response[J]. Trends in Biochemical Sciences, 25(2): 79-82. DOI:10.1016/S0968-0004(99)01532-7 |
Merz P R, Moser T, Höll J, et al. 2014. The transcription factor VvWRKY33 is involved in the regulation of grapevine (Vitis vinifera)defense against the oomycete pathogen Plasmopara viticola[J]. Physiologia Plantarum, 153(3): 365. |
Nakayama A, Fukushima S, Goto S, et al. 2013. Genome-wide identification of WRKY45-regulated genes that mediate benzothiadiazole-induced defense responses in rice[J]. BMC Plant Biol, 13(1): 150. DOI:10.1186/1471-2229-13-150 |
Petersen M, Brodersen P, Naested H, et al. 2000. Arabidopsis map kinase 4 negatively regulates systemic acquired resistance[J]. Cell, 103(7): 1111-1120. DOI:10.1016/S0092-8674(00)00213-0 |
Porto M S, Batista V G L, Santos R C D, et al. 2014. Plant promoters:An approach of structure and function[J]. Molecular Biotechnology, 56(1): 38. DOI:10.1007/s12033-013-9713-1 |
Qiu Y, Jing S, Jian F U, et al. 2004. Cloning and analysis of expression profile of 13 WRKY genes in rice[J]. Chinese Science Bulletin, 49(20): 2159-2168. |
Robatzek S, Somssich I E. 2002. Targets of AtWRKY6 regulation during plant senescence and pathogen defense[J]. Genes & Development, 16(9): 1139-1149. |
Ryu H S, Han M H, Lee S K, et al. 2006. A comprehensive expression analysis of the WRKY gene super family in rice plants during defense response[J]. Plant Cell Reporter, 25: 836-847. DOI:10.1007/s00299-006-0138-1 |
Scarpeci T E, Zanor M I, Mueller-Roeber B, et al. 2013. Overexpression of AtWRKY30 enhances abiotic stress tolerance during early growth stages in Arabidopsis thaliana[J]. Plant Molecular Biology, 83(3): 265-277. DOI:10.1007/s11103-013-0090-8 |
Schmutz J, Cannon S B, Schlueter J, et al. 2010. Genome sequence of the palaeo polyploid soybean[J]. Nature, 463(7278): 178-183. DOI:10.1038/nature08670 |
Shi W, Hao L, Li J, et al. 2014. The Gossypium hirsutum WRKY gene GhWRKY39-1 promotes pathogen infection defense responses and mediates salt stress tolerance in transgenic Nicotiana benthamiana[J]. Plant Cell Rep, 33(3): 483-498. DOI:10.1007/s00299-013-1548-5 |
Shimono M, Koga H, Akagi A, et al. 2012. Rice WRKY45 plays important roles in fungal and bacterial disease resistance[J]. Mol Plant Pathol, 13(1): 83-94. DOI:10.1111/mpp.2012.13.issue-1 |
Song Y, Ai C R, Jing S J, et al. 2010. Research progress on functional analysis of rice WRKY genes[J]. Rice Sci, 17(1): 60-72. DOI:10.1016/S1672-6308(08)60105-5 |
Spoel S H, Johnson J S, Dong X. 2007. Regulation of trade-offs between plant defenses against pathogens with different lifestyle[J]. Proceedings of the National Academy of Sciences of the United States of America, 104(47): 18842-18847. DOI:10.1073/pnas.0708139104 |
Tao Z, Liu H, Qiu D, et al. 2009. A pair of allelic WRKY genes play opposite roles in rice-bacteria interactions[J]. Plant Physiol, 151(2): 936-948. DOI:10.1104/pp.109.145623 |
Wang C, Deng P, Chen L, et al. 2013. A wheat WRKY transcription factor TaWRKY10 confers tolerance to multiple abiotic stresses in transgenic tobacco[J]. PLoS One, 8(6): 65120. DOI:10.1371/journal.pone.0065120 |
Wang X, Yan Y, Li Y, et al. 2014. GhWRKY40, a multiple stress-responsive cotton WRKY gene, plays an important role in the wounding response and enhances susceptibility to Ralstonia solanacearum infection in transgenic Nicotiana benthamiana[J]. PLoS One, 9(4): 93577. DOI:10.1371/journal.pone.0093577 |
Xing D H, Lai Z B, Zheng Z Y, et al. 2008. Stress-and pathogen-induced Arabidopsis WRKY48 is a transcriptional activator that represses plant basal defense[J]. Mol Plant, 1(3): 459-470. DOI:10.1093/mp/ssn020 |
Yang K Y, Liu Y, Zhang S. 2001. Activation of a mitogen-activated protein kinase pathway is involved in disease resistance in tobacco[J]. Proc Natl Acad Sci USA, 98(2): 741-746. DOI:10.1073/pnas.98.2.741 |
Yu J, Hu S, Wang J, et al. 2002. A draft sequence of the rice genome(Oryza sativa L[J]. ssp. indica). Science, 296(5565): 79-92. |
Zhang Y J, Wang L J. 2005. The WRKY transcription factor superfamily:its origin eukaryotes and expansion in plants[J]. BMC Evol Biol, 5: 1. DOI:10.1186/1471-2148-5-1 |
Zheng Z, Qamar S A, Chen Z, et al. 2006. Arabidopsis WRKY33 transcription factor is required for resistance to necrotrophic fungal pathogens[J]. Plant J, 48(4): 592-605. DOI:10.1111/tpj.2006.48.issue-4 |
 2018, Vol. 54
2018, Vol. 54

