文章信息
- 姜晓旭, 李国雷, 史文辉, 赵凯芬, 李成
- Jiang Xiaoxu, Li Guolei, Shi Wenhui, Zhao Kaifen, Li Cheng
- 子叶丢失强度和时间对栓皮栎幼苗生长状况和营养物质转移的影响
- Effects of Cotyledon Loss Intensity and Time on Seedling Growth Status and Reserves Translocation in Quercus variabilis
- 林业科学, 2018, 54(8): 56-64.
- Scientia Silvae Sinicae, 2018, 54(8): 56-64.
- DOI: 10.11707/j.1001-7488.20180807
-
文章历史
- 收稿日期:2017-07-26
- 修回日期:2018-01-27
-
作者相关文章
2. 城乡生态环境北京实验室 北京 100083;
3. 北京市大东流苗圃 北京 102211
2. Laboratory of Urban and Rural Ecological Environment Beijing 100083;
3. Beijing Dadongliu Nursery Beijing 102211
栎属(Quercus spp.)作为大粒种子树种的典型代表广泛分布于北半球,具有重要的生态和经济价值(Harper et al., 1970)。栎属的繁殖与更新主要依赖于种子,成熟的橡实较大,为幼苗的萌发以及快速生长提供大量的代谢储备(Milberg et al., 1997; Merouani et al. 2001; Villar-Salvador et al., 2010; Yi et al., 2012; 2015; Jha et al., 2014),但同时也更容易吸引鸟类、啮齿类动物等传播媒介(Miyaki et al., 1988)。橡实在受动物携带传播的过程中难免被取食子叶(Bossema 1979; Muñoz et al., 2007; Perea et al., 2011; Chang et al., 2014; Zhang et al., 2016),子叶的丢失直接影响其存活和幼苗建成。因此,幼苗存活和建成所需种子投入与种子扩散和传播过程中所损失能量大小之间的关系是栎属繁殖与更新策略的研究热点。
动物对栎属种子的取食有2个高峰期。第1个高峰期为秋季种子成熟脱落后,由于含有胚根的近端子叶单宁含量高比较苦涩(Steele et al., 1993)动物不喜食,在传播埋藏的过程中取食子叶远端,这也使得被取食的种子有萌发和幼苗建成的可能(Mellanby 1968; Branco et al., 2002; Hou et al., 2010; Giertych et al., 2011; Yang et al., 2012; Mancilla-Leytón et al., 2013)。Hou等(2010)通过模拟不同程度的子叶取食对栓皮栎(Quercus variabilis)种子萌发和幼苗存活的影响,揭示子叶缺失程度对幼苗生长的影响(Hou et al., 2010);Shi等(2017)通过模拟不同程度子叶丢失发现中度子叶切除会促进种子的萌发率和萌发速率。子叶丢失的第2个高峰期为翌年春季,由于春季自然库中可供动物取食的食物相对较少,为了满足生存需求,动物不得不寻找取食地表下潜藏的种子来源,尤其在上胚轴刚刚出土到叶子完全展开之前,动物更容易找到并取食子叶(Pyare et al., 2000)。García-Cebrián等(2003)通过模拟不同时间子叶移除对夏栎(Quercus robur)苗木早期生长的影响,揭示了夏栎种子养分转移规律(García-Cebrián et al., 2003)。以往对动物秋季子叶取食强度和翌年春季取食时间的研究都是独立开展的,而自然界中这2种现象并不独立,种子还存在第3种被取食现象,即动物在翌年春季以萌发的幼苗作为信号寻找并取食子叶,萌发的种子中既包括秋季未被取食的完整种子,也包括子叶被部分取食的种子(Rossell, 1988; Iida, 1996)。种子子叶丢失强度和丢失时间均会导致种子向苗木养分供应的差异,进而影响苗木建成与生长,因此开展子叶丢失强度与丢失时间对苗木生长状况影响的试验,对于深入了解栎属树种更新机制具有重要意义。本研究模拟自然界栓皮栎(Q. variabilis)种子萌发前子叶丢失强度和萌发后不同时间子叶丢失,探究两者对种子养分和碳水化合物转移规律及苗木生长状况的影响,分析种子养分、碳水化合物转移与苗木存活、生长、养分积累和非结构性碳水化合物的关系,揭示动物取食对栓皮栎幼苗更新的作用机制。
1 材料与方法 1.1 试验材料试验地在北京市昌平区大东流苗圃温室内(40°10′03″N, 116°28′21″E)。种子于2015年9月初采于河南伏牛山支脉老君山天然林(111°39′5″E, 33°45′54″N),经50 ℃温水浸泡1 h以杀死潜藏在种子内的幼虫及虫卵,并摒弃漂浮在水面上的劣种,剩余种子沥水后平铺于吸水纸上置于阴凉地方阴干12 h,选出无病虫害且未萌发的种子装入带有透气孔的塑料自封袋中,于2 ℃冷藏柜中保存待用(Li et al., 2014)。育苗容器选用体积为1 050 mL,口径10 cm×深度20 cm的国产塑料营养钵。育苗基质采用泥炭(丹麦PindstrupMosebrug A/S公司)、珍珠岩按3:1(V/V)均匀混合,用多菌灵消毒后,装入容器中,浇透水等待播种。播种前每个容器施精准奥绿肥(美国Scotts) 0.833 g,约每株125 mg N。试验用种千粒质量4.54 kg,每粒干质量3.1 g,种子氮、可溶性糖、淀粉含量为27.75、251.04、444.61 mg。
1.2 试验设计试验采用秋季子叶丢失强度与翌年春季子叶丢失时间相结合的双因素裂区试验设计。主因素A:秋季子叶丢失强度,2016年4月7日将贮藏种子取出平均分成3份,设置1/3、2/3 2个丢失强度(分别模拟动物轻度和重度取食强度,按照种子长度切除子叶远端),同时设置对照0/3 (模拟秋季未被取食的完整种子);然后将种子播于容器中,覆盖基质1~2 cm,进行常规育苗(Li et al., 2014),待出苗后动态移除子叶,模拟翌年春季子叶丢失时间即副因素B。出苗后4、8、12、16、20、25、30天7个时间点移除全部子叶(模拟春季种子萌发后子叶的取食时间),同时设置对照CK (模拟春季种子未被取食)。试验共24个处理,4个重复,每个重复20株苗,共计1 920株苗。
1.3 苗期管理用JL-18空气温湿光记录仪(上海华嵒仪器设备有限公司生产)监测苗木生长环境,每隔15 min记录温度和湿度。本研究采取自然光照,温室湿度控制在70%~85%之间。从4月7日播种开始,温室温度为26 ℃/18 ℃ (日/夜),当基质含水量达到65%以下时,进行灌溉;于10月10日开始将苗木移到炼苗场加速苗木木质化,直至11月中旬(叶子全部枯落),室外温度为15 ℃/8 ℃(日/夜);每2周用50%多菌灵可湿性粉剂600倍液喷雾防治病虫害;培育过程中所有苗木每周轮换位置1次,以减少边缘效应。
1.4 试验方法将切除子叶的种子与完整种子分别取20粒测定初始生物量与内含物本底;每个移除的子叶用清水冲洗干净并用蒸馏水润洗后装入信封,在65 ℃下烘至恒质量,密封保存。2016年11月中旬,每个处理随机抽取16株苗木进行测定。单株重复测定苗高及地径后,进行破坏取样。用清水小心冲洗掉根系周围的基质,再用蒸馏水润洗2次。然后将苗木在地径处剪开,根茎分别装入信封中于75 ℃下烘72 h至恒质量,测定生物量。之后将苗木、种子粉碎,过0.25 mm细筛,四分法取0.1 g用蒽酮~硫酸法提取可溶性糖和淀粉;四分法取0.2 g用浓H2SO4-H2O2法消煮至清液后,测定全氮、全磷、全钾。采用凯氏定氮法(UDK-152,美国VelpScientifica公司)测定氮浓度;紫外分外光度计法(Model 722-分光光度计; 德国Agilent公司)测定磷浓度及可溶性糖和淀粉浓度;原子吸收法(Spectra AA Varian 220原子吸收光谱仪;美国Varian公司)测定钾浓度(鲍士旦,2005)。
氮(可溶性糖、淀粉)的累计转移率(accumulated translocation rate, ACT)和绝对转移率(absolute translocation rate, ABT),计算公式分别为(1)和(2):
| $ {\rm{AC}}{{\rm{T}}_i}\left(\% \right) = \frac{{m - {M_i}}}{m} \times 100; $ | (1) |
| $ {\rm{AB}}{{\rm{T}}_i}\left(\% \right) = {\rm{AC}}{{\rm{T}}_i} - {\rm{AC}}{{\rm{T}}_{i-1}}。$ | (2) |
式中:i为1、2、3、4、5、6、7,分别对应苗木萌发后4、8、12、16、20、25、30天7个子叶移除时间点;m为播种时的子叶初始氮(可溶性糖、淀粉)含量(mg);Mi为7个时间点移除的子叶氮(可溶性糖、淀粉)含量(mg)。
1.5 数据分析采用SPSS18.0(IBM,USA)软件进行数据分析。采用双因素方差分析法(two-way ANOVA)分析子叶丢失强度与子叶丢失时间及二者的交互效应对苗木生长状况的影响。如果存在交互效应,探究24个处理组合对该指标的影响;若不存在交互效应,则分析主效应。若处理间差异显著,用Ducan法进行多重比较。利用Excel 2010和SigmaPlot 12.0软件对数据进行归纳与绘图。
2 结果与分析 2.1 不同子叶丢失强度下栓皮栎种子养分和碳水化合物的转移规律从氮、可溶性糖、淀粉累计转移率来看,种子中的淀粉向苗木转移最多(72.4%~89.36%),可溶性糖次之(66.61%~72.72%),氮最小(30.64%~59.45%)。不同丢失程度下,种子淀粉和氮的转移规律一致,均表现为完整种子>丢失1/3子叶种子>丢失2/3子叶种子;而可溶性糖的转移则表现为丢失1/3子叶种子>丢失2/3子叶种子>完整种子(表 1)。
|
|
从氮、可溶性糖、淀粉的绝对转移率来看,完整种子向苗木的转移时间为淀粉(30天)>氮(25天)>可溶性糖(20天);丢失1/3子叶的种子为可溶性糖(30天)>淀粉(20天)>氮(8天);丢失2/3子叶为淀粉(25天)>可溶性糖(20天)>氮(8天)。对于完整的种子,氮转移在出苗25天后基本完成;而丢失1/3和2/3子叶的种子氮转移在出苗8天后基本结束。完整种子可溶性糖转移在出苗后20天已基本完成,而丢失1/3子叶会延长可溶性糖向苗木的转移时间(30天),子叶丢失2/3与完整种子的转移时间一致;完整种子淀粉转移持续时间最长(30天),而丢失1/3和2/3子叶会缩短淀粉向苗木的转移时间,分别为20天和25天。
2.2 子叶丢失强度和丢失时间对栓皮栎容器苗成活和生长的影响秋季种子丢失程度与翌年春季种子丢失时间对苗木成活率具有交互影响(P<0.001)。秋季未被动物取食的完整种子翌年春季萌发后子叶未丢失(0/3+CK),生长季末成活率达到86.3%,而萌发后动物取食会显著降低苗木的成活率,尤其是在出苗后4天取食子叶成活率仅为36.3%(图 1)。秋季被动物取食1/3子叶的种子春季萌发后子叶未被取食(1/3+CK),生长季末成活率达到87.5%,与0/3+CK没有显著差异,出苗12天之前取食子叶会显著降低苗木成活率,而出苗25天后取食子叶会显著提高苗木的成活率。秋季被动物取食2/3子叶的种子,翌年春季萌发后,无论子叶取食与否都会显著降低苗木成活率(P<0.05)。
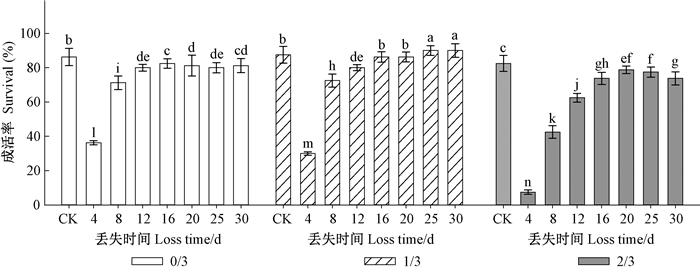
|
图 1 子叶丢失强度和丢失时间对栓皮栎容器苗成活率的影响 Figure 1 Interactions of loss intensity and loss time on seedling survival percent of Q. variabilis at the end of growing season. 不同字母表示处理组合间存在显著差异(α=0. 05)。下同。Different letter in the different interactions indicates signifcance difference at 0.05 level.The same below. |
秋季种子丢失强度的主效应与翌年春季种子丢失时间的副效应对苗高、地径、高茎比的影响极显著(P<0.001)。相对于秋季未被取食的完整种子,子叶丢失2/3会显著降低苗高、地径和高茎比,苗高和地径分别降低30%、18%;出苗16天后子叶丢失对苗高没有影响,出苗20天后子叶丢失对地径没有影响,8天后子叶丢失对高茎比没有影响(P>0.05)(图 2)。
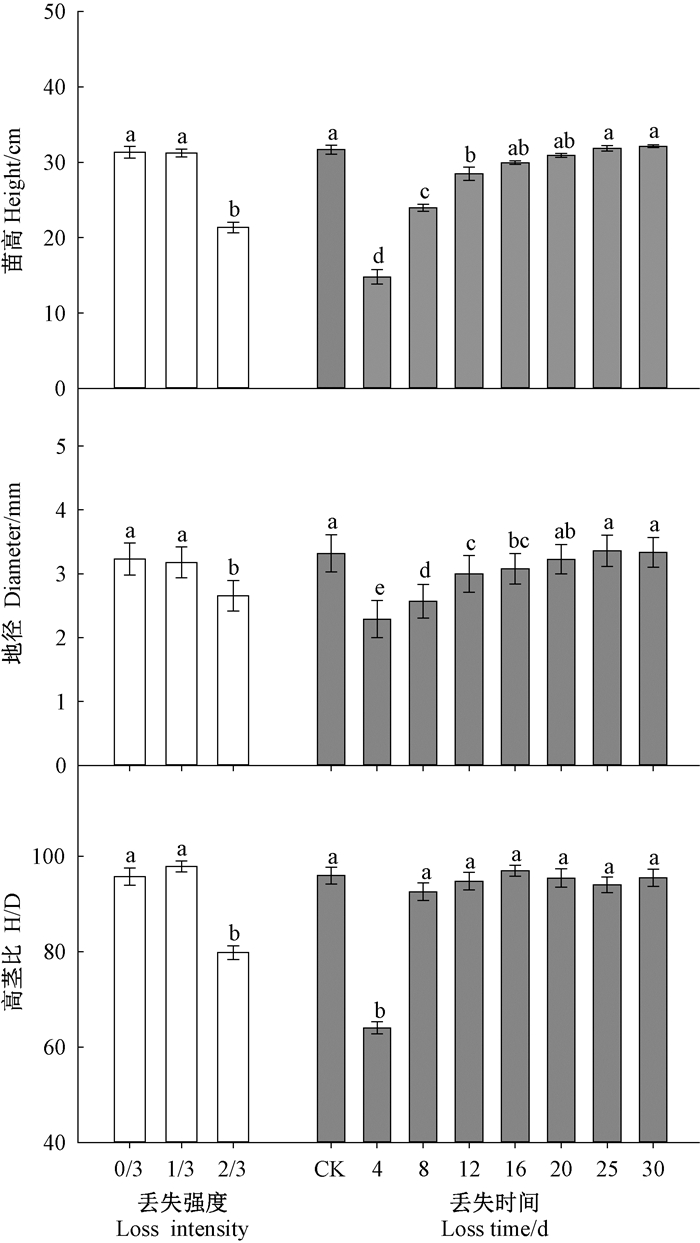
|
图 2 子叶丢失强度和丢失时间的主效应对栓皮栎容器苗苗高、地径和高茎比的影响 Figure 2 Main effects of loss intensity and loss time on height (H), diameter(D) and H/D of Q. variabilis at the end of growing season |
秋季种子丢失强度与翌年春季种子丢失时间对苗木的根茎生物量具有交互影响(P<0.001)。秋季未被动物取食的完整种子,翌年春季出苗25天之前子叶丢失会显著降低根、茎的生物量(图 3)。对于秋季被动物取食1/3子叶的种子,翌年春季萌发后子叶未丢失或者出苗16天前丢失都会显著降低茎生物量;种子萌发后无论子叶丢失与否都会显著降低根生物量。对于秋季被动物取食2/3子叶的种子,根、茎生物量受到严重影响,分别降低57.6%~88.5%和56.9%~88.8%。
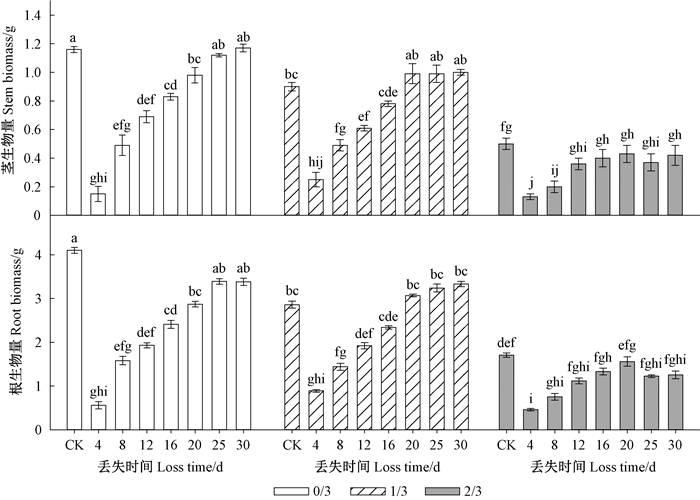
|
图 3 子叶丢失强度和丢失时间对栓皮栎容器苗根茎生物量的影响 Figure 3 Interactions of loss intensity and loss time on seedling root and stem dry mass of Q. variabilis at the end of growing season |
秋季种子丢失程度与翌年春季种子丢失时间对生长季末苗木N、P、K均具有交互影响(P < 0.005)。对于秋季未丢失子叶的完整种子,翌年春天出苗16天前丢失子叶会显著降低茎N含量,出苗12天前丢失子叶显著降低茎P含量,出苗25天前丢失子叶显著降低茎K含量(图 4)。对于秋季丢失1/3子叶的种子,翌年春季出苗4~16天丢失子叶均会显著抑制茎N、K积累,出苗4~16天丢失子叶显著降低茎P含量,但出苗25天后子叶丢失则会促进茎P积累。对于秋季丢失2/3子叶的种子,茎N、K含量均显著降低;春季子叶丢失会降低P含量,春季未丢失子叶茎P含量则不受影响。
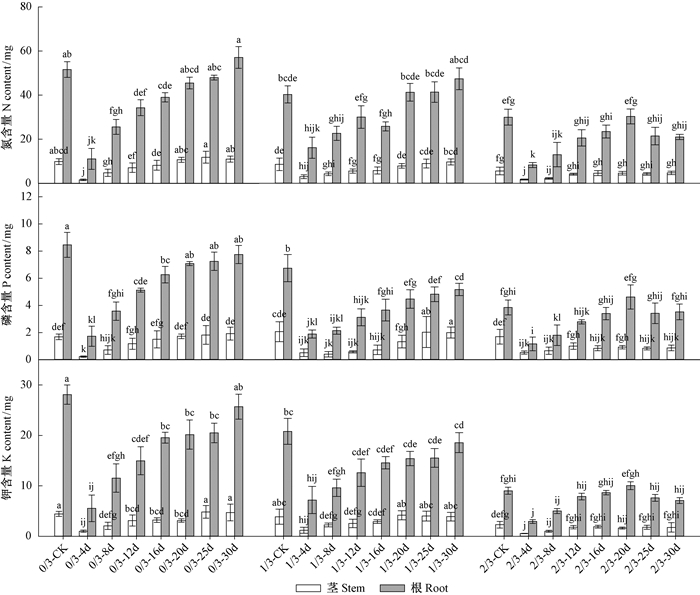
|
图 4 子叶丢失强度和丢失时间对栓皮栎容器苗根、茎氮、磷和钾含量的影响 Figure 4 Interactions of loss intensity and loss time on root, stem N, P and K content of Q. variabilis at the end of growing season |
对于秋季未丢失子叶的完整种子,翌年春天出苗20天前丢失子叶会显著降低根N、P含量,出苗30天前丢失子叶会降低根K含量(图 4)。对于秋季丢失1/3子叶的种子,翌年春季出苗4~16天丢失子叶均会显著抑制根N积累,春季无论子叶丢失与否,均会显著降低根P、K含量。对于秋季丢失2/3子叶的种子,春季无论子叶丢失与否,均会显著降低根N、P、K含量(P < 0.05)。
2.3 子叶丢失强度和丢失时间对栓皮栎容器苗非结构性碳水化合物含量的影响秋季种子丢失程度与翌年春季种子丢失时间对苗木可溶性糖和淀粉均具有交互影响(P < 0.005)。对于秋季未丢失子叶的完整种子,翌年春天出苗12天前丢失子叶显著降低茎可溶性糖含量,出苗30天丢失子叶会促进茎可溶性糖积累(图 5)。对于秋季丢失1/3子叶的种子,翌年春天出苗4~16天丢失子叶显著降低茎可溶性糖含量。对于秋季丢失2/3子叶的种子,无论春季子叶何时丢失,茎可溶性糖含量均会显著降低。对于秋季未丢失子叶的完整种子,翌年春天出苗16天前丢失子叶显著降低根可溶性糖含量。对于秋季丢失1/3子叶的种子,翌年春天出苗4~16天丢失子叶显著降低根可溶性糖含量,出苗后20天丢失子叶会促进根可溶性糖积累。对于秋季丢失2/3子叶的种子,无论春季何时丢失,根可溶性糖含量均显著降低。
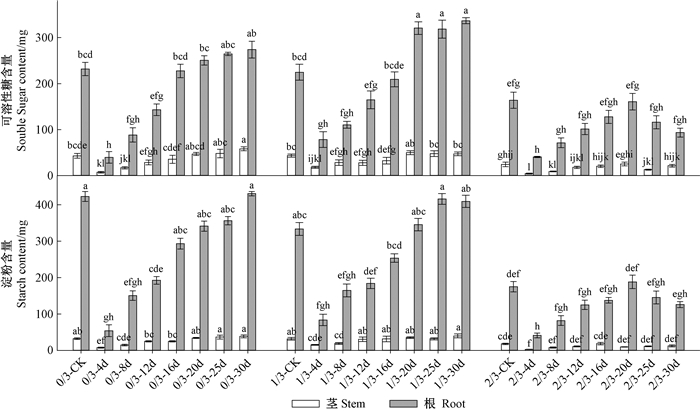
|
图 5 子叶丢失强度和丢失时间对栓皮栎容器苗根、茎可溶性糖和淀粉含量的影响 Figure 5 Interactions of loss intensity and loss time on root, stem soluble sugar (SS) and starch(S) content of Q. variabilis at the end of growing season |
对于秋季未丢失子叶的完整种子,翌年春天出苗12天前丢失子叶显著降低茎淀粉含量(图 5)。对于秋季丢失1/3子叶的种子,翌年春季出苗4~12天丢失子叶显著降低茎淀粉含量。对于秋季丢失2/3子叶的种子,无论何时丢失子叶茎淀粉含量均显著降低。对于秋季未丢失子叶的完整种子,翌年春天出苗16天前丢失子叶显著降低根淀粉含量。对于秋季丢失1/3子叶的种子,翌年春季出苗4~12天丢失子叶显著降低根淀粉含量。对于秋季丢失2/3子叶的种子,无论春季何时丢失,根淀粉含量均显著降低。
3 讨论本研究发现,秋季子叶丢失强度导致翌年春季种子向苗木的物质转移具有非同步性、非线性和非时效性。非同步性既表现在不同物质转移之间,种子淀粉转移率最大,可溶性糖次之,氮最小;又表现在不同子叶丢失强度之间,出苗30天后,种子氮和淀粉的累计转移率均表现为完整种子>丢失1/3子叶种子>丢失2/3子叶种子;种子可溶性糖累计转移率为丢失1/3子叶种子>丢失2/3子叶种子>完整种子。非线性表现在同一物质在不同子叶丢失强度下的转移情况,出苗30天后,完整种子氮、可溶性糖、淀粉转移量分别为15.19、149.24、296.15 mg;丢失1/3子叶的种子理论转移量(实际转移量)为10.13 (10.47)、99.49 (75.02)、197.43 (227.65) mg;丢失2/3子叶的种子为5.06 (3.13)、49.75 (24.28)、98.72 (52.18) mg。非时效性表现为种子向苗木物质转移完成时间的早晚,完整种子较缺失子叶的种子转移慢,缺失子叶的种子转移快,因为子叶丢失,营养物质减少,快速转移养分可弥补子叶缺失带来的影响;这与Yang等(2012)在动物取食部分橡实对蒙古栎(Q. mongolica)更新影响的研究中结果一致。此外,种子向苗木的物质转移基本呈现前期转移较快后期转移逐渐减少的趋势。种子萌发1个周左右,幼苗的2片真叶展开,这个阶段被Kozlowski (1971)和Landis (1989)定义为苗木的建成期;建成期栓皮栎苗木地上和根系部分生长较快,但此时根系不能吸收外界养分,叶片光合能力较差难以合成自身代谢所需的碳水化合物,因此建成期苗木对种子能量依赖性较大,种子养分和碳水化合物转移最多。栓皮栎形成真叶后,苗木开始进入速生期,根系吸收外界养分和叶片合成碳水化合物能力逐渐增强,尽管此时苗木生长仍依赖种子的贮藏物质,但种子养分和碳水化合物向苗木转移逐渐减少(Johnson et al., 2009)。本研究结果表明,栓皮栎种子向苗木的物质转移在出苗25天左右基本完成,这与在夏栎种子物质转移的研究结果基本一致(García-Cebrián et al. 2003),这也证明苗木对种子贮藏物质依赖性在降低。虽然此时苗木对种子营养物质的依赖性降低,但是前期的子叶丢失已对苗木的生长造成影响,导致苗木叶面积与叶片数量不一,间接影响苗木生长。本试验未在子叶丢失后测定苗木的光合速率和叶面积等指标,因此不能直接解释苗木进行自养后,子叶的养分是否还会对苗木的生长、存活等造成影响。
秋季丢失1/3子叶的种子翌年春季萌发后对苗木生长状况的影响,主要取决于子叶丢失时间的早晚。出苗20天前丢失子叶会显著抑制苗木生长,这里因为子叶养分向苗木的转移需要一个过程,过早的丢失子叶导致苗木养分亏缺,从而降低苗木生长状况(Armstrong et al., 1993; Hanley et al., 2006)。出苗20天后丢失子叶对苗木的影响不显著,Giertych等(2011)的研究中也发现类似的规律。出苗25天后丢失子叶则能提高苗木生长状况,成活率、茎P含量和根可溶性糖含量均有增加。子叶丢失的叠加效应促进茎P和根可溶性糖的积累,原因可能在于萌发前子叶丢失导致种子内部代谢物质的不均衡分布(Steele et al., 1993),萌发后子叶丢失导致养分转移发生变化(Timmer et al. 1987; Fenner et al., 1989;Tsakaldimi et al., 2005; Millard et al., 2010; Nilsson et al., 2011);子叶移除后会将碳水化合物的储存核心放在主根和茎上,以促进新叶的形成(Castro-Diez et al., 1998)。以往子叶丢失对苗木养分和碳水化合物积累的影响研究较少,本试验发现的规律仍需在其他树种中得到验证。种子在秋季被动物轻度(1/3)取食后,翌年春季如果被动物发现较晚(出苗25天后),能够满足动物不同季节取食需求,苗木生长状况同时得以提升,充分反映了动物捕食与栓皮栎更新的互惠关系。
秋季重度丢失子叶会导致翌年春季种子向苗木供应的物质量锐减,会抑制栓皮栎苗木的成活和生长,这一现象在Shi等(2017)的研究中也有同样结论;本研究同时发现,春季无论何时被动物取食子叶均会降低当年生苗木生长状况。这种负面影响可能会持续多年,这是因为苗木成活后将面临杂草、干旱和养分胁迫等(LF et al., 2005;张文辉等. 2004; Villar-Salvador et al., 2010),这些不利环境条件均会影响栓皮栎的建成。因此,秋季重度丢失强度和翌年春季再度丢失子叶的叠加效应对栓皮栎更新的影响尚需持续观测。需要指出的是,尽管动物过度取食子叶会引起苗木生长状况下降,但大粒种子栓皮栎仍在动物搬运、埋藏和取食中得到了扩散传播。
4 结论1) 秋季子叶丢失会降低翌年春季种子氮和淀粉的转移率,提高可溶性糖的转移率;种子氮和碳水化合物向苗木的转移率淀粉>可溶性糖>氮。
2) 秋季未丢失子叶的完整种子,翌年春季种子向苗木的氮转移在出苗25天后完成,而秋季丢失子叶的种子春季向苗木转移氮的时间大幅缩短(8天)。
3) 秋季末丢失子叶的完整种子,翌年春季出苗25天前丢失子叶会降低苗木生长状况。秋季丢失1/3子叶的种子,翌年春季出苗20天前丢失子叶降低苗木生长状况。秋季丢失2/3子叶会严重抑制苗木存活与生长。
4) 秋季被动物轻度取食子叶的种子,翌年春季出苗25天后被动物取食子叶对苗木生长状况有一定促进作用,此时种子既能满足动物取食需求又能促进栓皮栎更新,阐释了栓皮栎种群扩散与捕食者间的互惠机制。
鲍士旦. 2005. 土壤农化分析[M]. 北京: 中国农业出版社. (Bao S D. 2005. Soil agricultural chemistry analysis[M]. Beijing: China Agriculture Press. [in Chinese]) |
张文辉, 段宝丽, 周建云. 2004. 不同种源栓皮栎幼苗叶片水分关系和保护酶活性对干旱胁迫的响应[J]. 植物生态学报, 28(4): 483-490. (Zhang W H, Duan B L, Zhou J Y. 2004. Water relations and activity of cell defense enzymes to water stress in seeding leaves of different provences of Quercus variabilis[J]. Acta Phytoecologica Sinica, 28(4): 483-490. DOI:10.17521/cjpe.2004.0066 [in Chinese]) |
Armstrong D P, Westoby M. 1993. Seedlings from large seeds tolerated defoliation better:a test using phylogenetically independent contrasts[J]. Ecology, 74(4): 1092-1100. DOI:10.2307/1940479 |
Bossema I. 1979. Jays and oaks:an eco-ethological study of a symbiosis[J]. Behaviour, 70(1): 1-117. DOI:10.1163/156853979X00016 |
Branco M, Branco C, Merouani H. 2002. Germination success, survival and seedling vigour of Quercus suber acorns in relation to insect damage[J]. Forest Ecol Manage, 166(3): 159-164. |
Castro-diez P, Puyravaud J P, Cornelissen J H C. 1998. Stem anatomy and relative growth rate in seedlings of a wide range of woody plant species and types[J]. Oecologia, 116(2): 57-66. |
Chang G, Zhang Z. 2014. Functional traits determine formation of mutualism and predation interactions in seed-rodent dispersal system of a subtropical forest[J]. Acta Oecologica, 55: 43-50. DOI:10.1016/j.actao.2013.11.004 |
Fenner M, Lee W G. 1989. Growth of seedlings of pasture grasses, and legumes deprived of single mineral nutrients[J]. Journal of Applied Ecology, 26(1): 223-232. DOI:10.2307/2403663 |
Giertych M J, Suszka J. 2011. Consequences of cutting off distal ends of cotyledons of Quercus robur acorns before sowing[J]. Annals of Forest Science, 68(2): 433-442. DOI:10.1007/s13595-011-0038-6 |
García-Cebrián F, Esteso-Martínez J, Gil-Pelegrín E. 2003. Influence of cotyledon removal on early seedling growth in Quercus robur L[J]. Annals of Forest Science, 60: 69-73. DOI:10.1051/forest:2002075 |
Hanley M E, May O C. 2006. Cotyledon damage at the seedling stage affects growth and flowering potential in mature plants[J]. New Phytologist, 169(2): 243-250. DOI:10.1111/nph.2006.169.issue-2 |
Harper J L, Lovell P H, Moore K G. 1970. The shapes and sizes of seeds[J]. Annual Review of Ecology, Evolution and Systematics, 1: 327-356. DOI:10.1146/annurev.es.01.110170.001551 |
Hou X G, Yi X F, Yang Y Q. 2010. Acorn germination and seedling survival of Quercus variabilis: effects of cotyledon excision[J]. Annals of Forest Science, 67(7): 711-711. DOI:10.1051/forest/2010036 |
Iida S. 1996. Quantitative analysis of acorn transportation by rodents using magnetic locator[J]. Vegetatio, 124(1): 39-43. DOI:10.1007/BF00045142 |
Jha A, kamalvanshi M, Kumar A. 2014. The effects of arbuscular mycorrhizal inoculations and cotyledon removal on early seedling growth of Pongamia pinnata[J]. Turkish Journal of Botany, 38(2): 526-535. |
Johnson P S, Shifley S R, Rogers R. 2009. The ecology and silviculture of oaks, 2nd ed. MPG Books Group, Bodmin, UK, 92-102.
|
Kozlowski T. 1971. Seed germination, ontogeny, and shoot growth//Growth and Development of Trees. Academic Press, 41-45.
|
Landis T D. 1989. Mineral nutrients and fertilization in the container tree nursery manual[J]. Agriculture Handbook: 4-674. |
Li G, Zhu Y, Liu Y. 2014. Combined effects of prehardening and fall fertilization on nitrogen translocation and storage in Quercus variabilis seedlings[J]. European Journal of Futures Research, 133(6): 983-992. |
LÖF M, Welander N T. 2004. Influence of herbaceous competitors on early growth in direct seeded Fagus sylvatica L. and Quercus robur L[J]. Annals of forest science, 61: 781-788. DOI:10.1051/forest:2004075 |
Mancilla-Leytón J M, Cambrollé J, Figueroa M E. 2013. Growth and survival of cork oak (Quercus suber) seedlings after simulated partial cotyledon consumption under different soil nutrient contents[J]. Plant Soil, 370(1): 381-392. |
Mellanby K. 1968. The effect of some mammals and birds on the regeneration of oaks[J]. Journal of Applied Ecology, 5(2): 359-366. DOI:10.2307/2401566 |
Merouani H, Branco C, Almeida M H. 2001. Effects of acorn srorage duration and parental tree on emergence and physiological status of Cork oak (Quercus suber L.)seedlings[J]. Annals of Forest Science, 58: 543-554. DOI:10.1051/forest:2001144 |
Milberg P, Lamont B B. 1997. Seed/cotyledon size and nutrient content play a major role in early performance of species on nutrient-poor soils[J]. New Phytologist, 137(4): 665-672. DOI:10.1046/j.1469-8137.1997.00870.x |
Millard P, Grelet G A. 2010. Nitrogen storage and remobilization by trees:ecophysiological relevance in a changing world[J]. Tree Physiology, 30(9): 1083-1095. DOI:10.1093/treephys/tpq042 |
Miyaki M, Kikuzawa K. 1988. Dispersal of Quercus mongolica acorns in a broad-leaved deciduous forest[J]. Forest Ecology and Management, 25(1): 1-8. DOI:10.1016/0378-1127(88)90129-6 |
Muñoz A, Bonal R. 2007. Rodents change acorn dispersal behavior in response to ungulate presence[J]. Oikos, 116(10): 1631-1638. DOI:10.1111/oik.2007.116.issue-10 |
Nilsson U, Luoranen J, Kolström T. 2010. Reforestation with planting in northern Europe[J]. Scandinavian Journal of Forest Research, 25(4): 283-294. DOI:10.1080/02827581.2010.498384 |
Perea R, Miguel A S, Gil L. 2011. Acorn dispersal by rodents:The importance of re-dispersal and distance to shelter[J]. Basic and Applied Ecology, 125(8): 1203-1210. |
Pyare S, Longland W S. 2000. Seedling-aided cache detection by heteromyid rodents[J]. Oecologia, 122(1): 66-71. DOI:10.1007/PL00008837 |
Rossell C. 1988. La poblaci6 de senglar al Montseny. Introducci6 a la biologia de l'especie. Diputaci6 de Barcelona, Barcelona.
|
Shi W H, Bloomberg M, Li G L. 2017. Combined effects of cotyledon excision and nursery fertilization on root growth, nutrient status and outplanting performance of Quercus variabilis container seedlings[J]. PLoS One, 12(5): e0177002. DOI:10.1371/journal.pone.0177002 |
Steele M A, Knowles T, Bridle K. 1993. Tannins and partial consumption of acorns implications for dispersal of oaks by seed predators[J]. Am Midl Nat, 130(2): 229-238. DOI:10.2307/2426123 |
Timmer V R, Armstrong G. 1989. Growth and nutrition of containerized Pinus resinosa seedlings at varying moisture regimes[J]. New Forests, 3(2): 171-180. DOI:10.1007/BF00021580 |
Tsakaldimi M, Zagas T, Tsitsoni T. 2005. Root morphology, stem growth and field performance of seedlings of two Mediterranean evergreen oak species raised in different container types[J]. Plant Soil, 278(1/2): 85-93. |
Villar-Salvador P, Heredia-Guerrero N, Millard P. 2010. Remobilization of acorn nitrogen for seedling growth in holm oak(Quercus ilex), cultivated with contrasting nutrient availability[J]. Tree Physiology, 30(2): 257-263. DOI:10.1093/treephys/tpp115 |
Yang Y Q, Yi X F. 2012. Partial acorn consumption by small rodents:implication for regeneration of white oak, Quercus mongolica[J]. Plant Ecology, 213(2): 197-205. DOI:10.1007/s11258-011-0016-y |
Yi X, Yang Y, Curtis R. 2012. Alternative strategies of seed predator escape by early-germinating oaks in Asia and North America[J]. Ecology and Evolution, 2(3): 487-492. DOI:10.1002/ece3.209 |
Yi X F, Wang Z Y, Liu C Q. 2015. Acorn cotyledons are larger than their seedlings' need:evidence from artificial cutting experiments[J]. Scientific Reports, 5: 8112. DOI:10.1038/srep08112 |
Zhang Z, Wang Z, Chang Z. 2016. Trade-off between seed defensive traits and impacts on relationship between seeds and rodents in forest ecosystems[J]. Plant Ecology, 217(3): 253-265. DOI:10.1007/s11258-016-0566-0 |
 2018, Vol. 54
2018, Vol. 54

