文章信息
- 李伟成, 盛海燕, 蒋跃平, 温星
- Li Weicheng, Sheng Haiyan, Jiang Yueping, Wen Xing
- 基塘系统不同竹林土壤CO2通量特征及其影响因子
- Soil CO2 Flux and Its Influence Factors of Different Bamboo Plantations in the Dike-Pond Ecosystem
- 林业科学, 2018, 54(8): 13-22.
- Scientia Silvae Sinicae, 2018, 54(8): 13-22.
- DOI: 10.11707/j.1001-7488.20180802
-
文章历史
- 收稿日期:2016-11-09
- 修回日期:2018-06-28
-
作者相关文章
2. 西南林业大学生命科学学院 昆明 650224;
3. 杭州环境保护科学研究院 杭州 310005;
4. 杭州西溪国家湿地公园生态研究中心 杭州 310030
2. College of Life Sciences, Southwest Forestry University Kunming 650224;
3. Hangzhou Environmental Protection Science Institute Hangzhou 310005;
4. Hangzhou Xixi National Wetland Park Research Center for Ecological Science Hangzhou 310030
CO2是大气中最主要的温室气体。土壤中储存15 800亿t碳,为大气总碳量的3倍多,是陆地生态系统最大的碳库(Schlesinger et al., 2000)。土壤呼吸是土壤碳库的主要输出途径和大气CO2的重要源,全球每年土壤呼吸释放的碳高达500亿~750亿t(Falk et al., 2005)。湿地生态系统在温室气体减排中“汇”的作用巨大,且CO2在参与湿地生态系统土壤-大气物质交换过程中具有关键作用(栾军伟等,2012;Hatala et al., 2012),因此湿地CO2排放的观测研究日益增多,但与森林、草地等自然生态系统相比,城市湿地CO2排放规律的研究仍相对薄弱。
土壤CO2通量在很大程度上依赖土壤有机质的矿化速率及土壤中各类有机化合物的转化强度(Peng et al., 2015)。土壤水溶性碳氮(WSOC和WSON)和土壤微生物生物量碳氮(MBC和MBN)是陆地生态系统中最活跃的有机碳氮组分,可在水体或土壤中转化为其他组分,控制了一系列土壤物理、化学和生物过程(陈安强等,2015;Curtin et al., 2015);同时,WSOC、WSON、MBC和MBN相互依存、密切相关(Blair et al., 2006),在土壤活性碳氮储存库中不断处于源和汇转换。以往研究多注重施肥等人为干扰对土壤不同形式碳氮的影响(Wang et al., 2003),有关土壤不同形式碳氮与土壤呼吸之间的关系尚未形成一致结论。
长江三角洲是我国工业化和城镇化发展最快的地区之一,其密集的平原河网湖泊形成了城市边缘湿地,常具有典型的基塘系统。随着长江三角洲城市化进程加快,原有基塘湿地生态系统结构和周边景观环境逐渐改变,对土壤CO2通量及土壤环境产生了诸多影响。温室气体排放监测是全球变化研究的重要领域(Hatala et al., 2012),但对湿地生态系统土壤CO2通量特征及其土壤因素的研究有限。为了解长江三角洲自然状态下典型基塘系统土壤CO2通量特征,本研究以杭州西溪国家湿地公园毛竹(Phyllostachys edulis)林和早竹(P. violascens)林为研究对象,采用静态密闭箱-气相色谱法测定土壤CO2通量,解析其动态特征,同时,结合WSOC、WSON、MBC和MBN含量数据,分析基塘土壤CO2通量与其影响因子的关系,以期为城市湿地温室气体排放和管理提供基础资料,为长江三角洲基塘湿地生态系统温室气体估算和碳氮循环研究提供科学依据。
1 研究区概况研究区位于杭州市西郊西溪国家湿地公园(120°03′E,30°15′N),总面积16.15 km2。试验点选在西溪湿地费家塘保护区毛竹林和塘基早竹林。西溪湿地是由浙江省的苕溪和钱塘江两大水系发育而成的河成湖滨湿地,总面积10.08 km2, 其核心区域是间歇性沼泽地,亦是罕见的城中次生湿地。在古河滩遗存的基础上,湿地在千余年农渔耕作活动影响下形成了典型城市边缘次生湿地(李伟成等,2007)。湿地基塘系统以鱼塘为主,河港、湖漾、沼泽和基渚相间。
西溪湿地属亚热带北缘季风气候,四季分明,年均气温16.4 ℃,全年无霜期240天,年降水量1 100~1 600 mm,10月至翌年2月相对干旱(降水量只占全年的20%~27%)。根据气候观测数据,西溪湿地3—5月日均温、日均湿度和降水量开始上升,6—8月日均温、日均湿度和降水量达到最高,9—10月开始降温、降水量减少,同时大气湿度下降,12月至翌年2月出现全年低温和偏干旱的气候环境。土壤主要为水稻土,核心区域平均下挖60~ 100 cm可见泥炭层,水稻耕作层15~25 cm,pH6.5~7.2,有机质含量1.7%~2.1%(李伟成等,2007)。毛竹林约700 m2,成林时间较长(50~70年),在建立保护区以前,原住民曾经有过经营。毛竹林下伴生种较少,偶见麦冬(Ophiopogon japonicus)、碎米荠(Cardamine hirsuta)和井栏边草(Pteris multifida)等。早竹林塘基宽3~6 m,长48 m,面积约220 m2。林下伴生有麦冬、碎米荠、窃衣(Torilis scabra)、通泉草(Mazus japonicus)、蚊母草(Veronica peregrina)、海金沙(Lygodium japonicum)、井栏边草、酢浆草(Oxalis corniculata)和紫马唐(Digitaria violascens)等。2种竹林概况见表 1。
|
|
土壤CO2通量测定采用静态密闭箱-气相色谱法(Wickland,2001)进行。分别在毛竹林和早竹林中沿塘基直线每隔5 m设置1个CO2采集箱,每种竹林设置3~5个采集箱,采集箱由有机玻璃(0.4 cm厚)制作,体积均为50 cm×50 cm×50 cm,底座体积为50 cm×50 cm×10 cm,上端设计成密闭水槽,清除底座内凋落物。采集箱外贴一层锡箔纸,以减小因太阳辐射引起的箱内温度变化,箱内装有小风扇和温度传感器。为防止安插底座对样地土壤的扰动,取样前30天将底座插入土中10 cm,并留置于样地中,以便长期采样观测。
2014年4月—2015年6月进行CO2采样,每隔25~40天采集1次,采样时间为8:30—15:00,早竹林和毛竹林同时采集气体。使用一次性注射器(60 mL)在40 min内每10 min抽取1次静态密闭箱内气体,如此每次在0、10、20和、30和40 min获得5个气体样品;同时,使用插入式温度传感器原位同步测定10 cm处土壤温度(李伟成等,2013)。样品采集后注射到100 mL铝塑复合气袋(大连德霖气体包装有限公司)中储存,带回实验室,3~5天内使用气相色谱仪(Agilent 6820)分析各气体样品CO2(离子火焰化FID检测器),根据5次气体浓度差值分别计算排放通量,并通过加权平均计算累积排放量。
利用下式计算CO2通量(Drewitt et al., 2002):
| $ F = M/{V_0} \times P/{P_0} \times {T_0}/T{\rm{ }} \times H \times {d_{\rm{c}}}/{d_{\rm{t}}}。$ | (1) |
式中:F为CO2通量(g·m-2h-1);M为CO2摩尔质量(g·mol-1);P0和T0为理想气体在标准状态下的空气压力和气温(分别为1 013.25 hPa和273.15 K);V0为CO2在标准状态下的摩尔体积;H为箱室高度(m);P和T为测定时箱内的实际气压和气温;dc和dt为箱内CO2浓度随时间变化的回归曲线斜率。
2.2 土壤碳氮参数测定测量土壤CO2通量的同时,每间隔1个月采集1次土样,随机选择距静态密闭箱观测点20~50 cm且没有植被生长的3~5个地点,去除表面凋落物,采集0~20 cm土层混合土样3~5份带回实验室。去杂并过2 mm筛,鲜样于4 ℃以下保存3~ 5 h,用于测定土壤水溶性有机碳含量(WSOC)和土壤水溶性有机氮含量(WSON):称鲜土20.00 g,水土比为2:1,用蒸馏水浸提,在25 ℃下振荡0.5 h,再在高速离心机中(8 000 r·min-1)离心10 min后,抽滤过0.45 μm滤膜。抽滤液分成3份:第1份直接在岛津TOC-VcpH有机碳分析仪上测定WSOC,取平均值;第2份直接用岛津TOC-VcpH的总氮单位(TN)测定土壤水溶性总氮含量(WSN);第3份用离子色谱法测定NH4+和NO3-含量(即无机氮含量WIN),WSON=WSN-WIN。采用烘干法测量土壤含水量。
土壤微生物生物量碳氮(MBC和MBN)采用氯仿熏蒸-K2SO4提取法测定。土壤微生物生物量碳的计算公式(Joergensen,1996)为:
| $ {\rm{MBC = (FOC - UOC)/0}}{\rm{.45}}{\rm{。}} $ | (2) |
式中:FOC为熏蒸的有机碳含量;UOC为未熏蒸的有机碳含量。
土壤微生物生物量氮的计算公式(Joergensen et al., 1996)为:
| $ {\rm{MBN = }}\left( {{\rm{FON - UON}}} \right){\rm{/0}}{\rm{.54}}{\rm{。}} $ | (3) |
式中:FON为熏蒸的有机氮含量;UON为未熏蒸的有机氮含量。
2.3 数据处理采用Microsoft Excel 2007和SPSS15软件对数据进行统计分析,LSD法进行多重比较。
3 结果与分析 3.1 2种竹林土壤CO2通量的年动态西溪湿地毛竹林土壤CO2通量最小值出现在1月(图 1)(127.4±24.1 mg·m-2h-1),然后波动上升,最大值出现在9月(537.2±41.1 mg·m-2h-1),随后开始下降,10月至翌年1月,土壤CO2通量出现波动;早竹林土壤CO2通量最小值出现在12月(2.1±0.6 mg·m-2h-1),呼吸极弱,最大值出现在8月(120.0±22.9 mg·m-2h-1)。毛竹林土壤CO2通量最大和最小平均值分别是早竹林的4.5和59.5倍,在同一测定时间内,毛竹林土壤CO2通量显著(P<0.05)大于早竹林。

|
图 1 2种竹林土壤CO2通量的年动态 Figure 1 Annual dynamics of soil CO2 flux under two bamboo plantations |
2种竹林土壤CO2通量在春夏季和秋冬季转化期间波动上升或下降,均在夏季(8—9月)达到高峰,在冬季(12月至翌年1月)出现最低点,具有明显的季节性差异,与多数湿地土壤CO2通量年动态相仿。2种竹林土壤CO2通量差异较大,全年毛竹林土壤CO2累积排放量为3 366.3 g·m-2a-1,早竹林土壤CO2累计排放量为558.4 g·m-2a-1,毛竹林土壤CO2累积排放量约是早竹林的6倍。
3.2 2种竹林土壤CO2通量与土壤温度、土壤含水量的关系图 2表明,2种竹林土壤CO2通量均与10 cm深处土壤温度呈极显著线性正相关(P<0.01)、与0~20 cm深处土壤含水量呈显著线性正相关(P<0.05)。
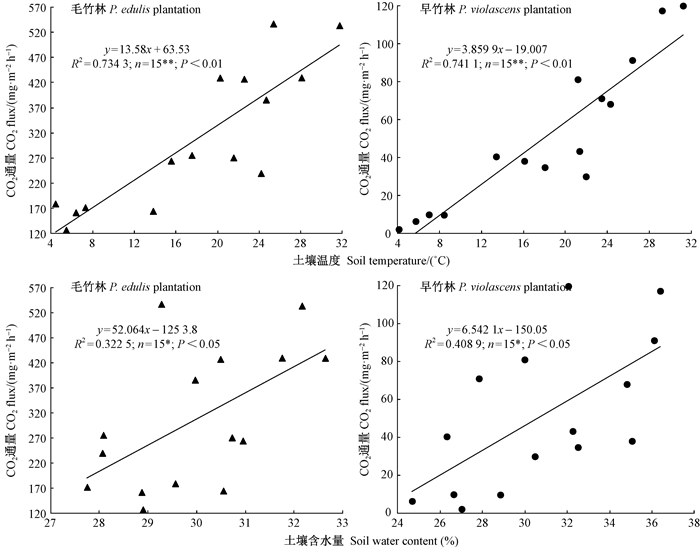
|
图 2 2种竹林土壤CO2通量与土壤温度、土壤含水量的关系 Figure 2 Relationships between soil CO2 flux and soil temperature, soil water content of two bamboo plantations |
2种竹林土壤WSOC含量在8月达到最大(图 3),分别为(348.0±25.5)和(146.1±9.9) mg·kg-1,然后开始下降,毛竹林与早竹林分别在10和12月出现最低值,分别为(202.5±28.4)和(54.9±13.8)mg·kg-1,毛竹林土壤WSOC含量在12月再次上升,而早竹林的这种趋势出现在翌年2月,随后2种竹林土壤WSOC含量逐渐上升。

|
图 3 2种竹林土壤水溶性碳氮和土壤微生物生物量碳氮含量的年动态 Figure 3 Annual dynamics of water soluble C and N, and microbial biomass C and N contents in the soils of two bamboo plantations |
土壤WSON含量在2种竹林中没有表现出特殊规律,年度波动较大,毛竹林土壤WSON含量峰值出现在6月, (7.6±0.3) mg·kg-1,早竹林土壤WSON含量没有明显的峰值,最大值出现在8月, (2.7±0.3) mg·kg-1。
毛竹林与早竹林土壤MBC含量峰值均出现在6月(图 3),分别为(279.0±17.6)和(313.9±38.6)mg·kg-1。之后2种竹林土壤MBC含量都开始下降,直至翌年2—4月出现最低值,分别为(219.7±13.8)和(198.6±12.7)mg·kg-1,然后二者含量再次上升。
2种竹林土壤MBN含量最大值出现的时间相比土壤MBC含量有差异,毛竹林与早竹林分别于6月和8月以后下降,至翌年4月,毛竹林土壤MBN含量年度波动范围为(21.4±3.8)~(43.7±4.2)mg·kg-1,早竹林土壤MBN含量年度波动范围比毛竹林大,为(13.9±1.4)~(57.0±10.8)mg·kg-1。西溪湿地10月以后气候干燥,温度偏低,凋落物和地下部根系尚处于分解状态,土壤中有机碳积累较少,因此土壤MBC含量较低;进入多雨季节后,凋落物分解也基本结束,有机物分解物大量进入土壤中,被微生物利用或被淋溶,此时土壤MBC和MBN含量迅速增加。
总体而言,毛竹林土壤WSOC和WSON含量波动范围比早竹林大。2种竹林土壤WSOC和WSON含量差异明显(图 3),土壤WSOC、WSON、MBC和MBN含量在夏季6—8月较高或出现峰值。土壤WSOC和WSON含量在12月至翌年2月同时有上升的波动,而且早竹林土壤MBC和MBN含量在12月也有上升的波动,可能是冬季死亡的微生物残体释放WSOC和WSON造成的。
3.4 2种竹林土壤CO2通量与土壤水溶性碳氮含量、土壤微生物生物量碳氮含量之间的关系毛竹林土壤CO2通量与土壤WSOC含量呈显著正相关(表 2)(r=0.790,P<0.05),与其他参数没有相关性(P>0.05)。毛竹林土壤MBC含量与土壤MBN含量呈显著正相关(r=0.789,P<0.05)。早竹林与毛竹林类似(表 2),其土壤CO2通量与土壤WSOC含量呈显著正相关(r=0.774,P<0.05),MBC与MBN含量达到极显著正相关水平(r=0.938,P<0.01)。
|
|
2种竹林土壤CO2通量差异明显,毛竹林土壤CO2通量明显大于早竹林,其原因可能是:1)渚上毛竹林成林时间较长,且属于大型散生竹,以前有原住民粗犷经营,群落生物量积累多、根系发达及其生物量较高,故由根系构成的自养呼吸可能较大;2)渚上毛竹林受湿地水系和雨水冲刷的影响比塘基早竹林小,故其土壤微生物与土壤动物的异养呼吸较为稳定;3)土壤水分影响土壤的通气性和营养的有效性(Bowles et al., 2014),塘基早竹林土壤含水量较高,部分土壤孔隙被水分占据,限制CO2扩散,进而影响了土壤呼吸(张睿等,2015)。
人类活动和全球气候变化的大背景下,湿地生态系统的碳源/汇功能变化显著(Vasin et al., 2006;Hatala et al., 2012;Bowles et al., 2014)。本研究发现,渚上毛竹林土壤CO2年累积排放量较大(33.66 t·hm-2a-1),大于广州市无积水红树林湿地秋茄(Kandelia candel)+桐花树(Aegiceras corniculatum)群落类型的在土壤CO2排放量(12.26 t·hm-2a-1)和滩涂湿地茳芏(Cyperus malaccensis)+芦苇(Phragmites cornmunis)+卡开芦(Phragmites karka)等群落类型的年土壤CO2排放量(5.88 t·hm-2a-1)(康文星等,2008),亦大于洞庭湖白沙洲湿地湖潮土(土层深度100 cm以上)的杨树(Populus tomentosa)人工林(9.88 t·hm-2a-1)(谭三清等,2010),而小于浙江省临安市三口镇葱坑村毛竹林年土壤CO2总排放量(37.25 t·hm-2a-1)(杨文佳等,2015)和浙江省安吉县山川乡毛竹林年土壤CO2总排放量(40.10 t·hm-2a-1)(张敏霞等,2016),西溪湿地渚上毛竹林土壤CO2排放特征更类似于亚热带丘陵地带的毛竹林土壤呼吸。在整个生长季节(4—10月),渚上毛竹林平均土壤CO2通量(0.41 g·m-2h-1)低于浙江省临安市青山镇集约经营毛竹林、粗犷经营毛竹林和苦槠(Costanopsis sclerophylla)+石栎(Lithocarpus glabe)常绿阔叶林(1.01、0.79和0.72 g·m-2h-1)(叶耿平等,2011),这与集约经营措施促进毛竹林土壤有机质矿化、加剧土壤呼吸有关。多数研究表明,施肥会增加土壤呼吸(Schlesinger et al., 2000;李伟成等,2013),且人为干扰如挖笋和砍材亦是造成土壤呼吸速率升高的原因(Liu et al., 2010)。而塘基早竹林CO2年累计排放量较小(5.58 t·hm-2a-1)。
4.2 土壤CO2通量与土壤温度、土壤含水量的关系研究表明,土壤CO2通量变化受温度和水分共同调控(Davidson et al., 1998;初小静等,2015),土壤CO2年动态与气候相关(Keith et al., 1997)。本研究结果与康文星等(2008)和谭三清等(2010)的湿地土壤CO2通量动态变化类似,2种竹林土壤CO2通量均与土壤温度和土壤含水量呈显著正相关,且总体表现为夏季高于冬季。西溪湿地春季温度回升,土壤微生物和土壤酶的活性增强,特别是进入生长季后植物开始萌发,夏季是植物生长旺盛和水热条件达到最佳时期(Yi et al., 2007),土壤呼吸亦达到最大值(Sheng et al., 2010;李伟成等,2013)。之后,随着水热条件降低,土壤CO2通量也随之下降,进入非生长季节时水热条件最低,土壤CO2通量出现最低值。
土壤温度和土壤含水量可以解释土壤CO2通量67.50%~97.00%的变异(Kang et al., 2003;李伟成等,2013)。本研究发现,无论是毛竹林(土壤含水率27.74%~32.63%)还是早竹林(土壤含水率24.67%~36.37%),土壤CO2通量与土壤含水率均呈正相关,表明土壤水分含量是限制土壤CO2通量的主要因子。而张睿等(2015)对亚热带天然阔叶林和杉木(Cunninghamia lanceolata)人工林的研究表明,两种林地土壤CO2通量与土壤含水量没有显著相关性,这说明在某些条件下土壤CO2排放与土壤含水量的关系复杂(Freeman et al., 2008)。
4.3 土壤CO2通量与土壤水溶性碳氮含量的关系WSOC和WSON主要来源于植物凋落物、土壤腐殖质、微生物和根系及其分泌物等,其含量与植被种类有很大关系(Peng et al., 2015)。本研究表明,毛竹林土壤WSOC和WSON含量显著高于早竹林,造成这种情况的原因可能是:1)塘基微环境使得WSOC和WSON更易被淋溶和冲刷(Uselman et al., 2009),故其含量更低;2)长期施肥显著提高了土壤WSOC和WSON含量,毛竹林土壤有机质含量高,而土壤有机碳氮是WSOC和WSON的主要来源。
本研究发现,2种竹林土壤CO2通量与土壤WSON含量没有显著相关性,与李永夫等(2010)对亚热带毛竹林的施肥试验结果一致,其原因可能与土地利用类型不同导致土壤酶系统破坏(Xing et al., 2010)进而造成土壤WSON含量明显波动(Cui et al., 2014)有关。同时,2种竹林土壤CO2通量与土壤WSOC含量呈显著正相关(P < 0.05),与一些常绿阔叶林、毛竹林和经济林的研究结果类似(Rochette et al., 1998;Iqbal et al., 2008;张剑等,2009;李伟成等,2013;杨文佳等,2015)。
本研究2种竹林土壤WSOC含量峰值出现在6—8月,春、夏季大气温度升高,植物根系分泌物增多,进而增大了土壤水溶性碳含量(Sheng et al., 2010),同时,微生物活性增高,加快土壤有机质的矿化(张剑等,2009;杨文佳等,2015),提高了土壤活性有机碳含量。而在对亚热带天然阔叶林的研究中发现,土壤CO2通量与WSOC含量之间并没有相关性(Liu et al., 2010;张睿等,2015)。因此,WSOC含量受到的影响因素是多方面的,WSOC与土壤总有机质碳常处于动态平衡中,在一定条件下又可以相互转化,WSOC含量变化规律也可能随着微环境的变化而转变。而Kane等(2006)则倾向于生长期或水热条件较适宜时期WSOC与土壤呼吸、气候的关系较为明显,而进入非生长期或水热条件较差时关系不明显。
4.4 土壤CO2通量与土壤微生物生物量碳氮之间的关系2种竹林土壤MBC和MBN含量均呈显著正相关(P < 0.05),与Piotrowsk等(2012)对波兰西北部欧洲油菜(Brassica napus)和冬小麦(Triticum aestivum)轮作土壤微生物生物量碳氮的研究结果一致,也与陈安强(2015)在云南省洱源县的有机物料试验结果相符。
Zak等(2003)认为,植物多样性对土壤微生物代谢活性及其多样性均会产生影响,随着植物多样性增加,土壤微生物生物量明显增加。本研究发现,在6—8月,塘基早竹林土壤MBC和MBN含量比毛竹林上升幅度大,除了水热条件上升使微生物更适宜繁殖以外,早竹林下草本层多样性和生物量较大可能也是造成这一现象的原因。2种竹林土壤MBC和MBN含量在6—8月的上升趋势与WSOC含量变化类似,WSOC可为微生物生长提供充足的营养(Uselman et al., 2009),使微生物繁殖加快,活性提高,进而促进微生物呼吸(Rochette et al., 1998;Zak et al., 2003)。
2种竹林土壤MBC含量与土壤CO2通量虽然没有显著相关性,但从整年度分析,其具有类似的变化趋势,与葛高飞等(2011)对湖南祁阳红壤栽培玉米(Zea mays)的研究结果一致。Fernandes(2005)对贫铁砖红壤施加污泥的试验亦表明,土壤呼吸速率与土壤MBC和MBN含量同时增加,但不存在相关性;Wang等(2003)的720天长期室内土壤培养试验表明,土壤MBC含量与土壤呼吸没有相关性,认为土壤MBC含量仅与微生物呼吸有关而不是土壤呼吸底物的替代物;Iqbal等(2008)在中亚热带山地土壤CO2通量的研究亦认为土壤MBC含量与土壤CO2通量没有相关性。这可能是因为土壤MBC含量占土壤有机碳的份额较小,土壤CO2排放主要依赖水热条件和呼吸底物WSOC,土壤MBC的影响程度可能被屏蔽,而土壤MBN含量对于土壤CO2通量而言,更多的是以植物根系吸收的方式存在(Xing et al., 2010)。因此,湿地土壤CO2通量是在土地利用方式(Wagai et al., 1998;Iqbal et al., 2008;Piotrowsk et al., 2009)、群落结构(Uselman et al., 2009)、土壤微生物活性与生物量(Schimel et al., 1996;Cui et al., 2014)、降雨冲刷和湿地水位(初小静等,2015)等多层次多方面的综合影响下动态变化。
5 结论杭州西溪湿地基塘系统2种竹林土壤CO2通量具有强烈的时空变异性,受降雨、湿地水文条件和植物群落的影响,毛竹林土壤CO2通量年动态和年累积排放量明显大于塘基早竹林。2种竹林土壤CO2通量动态变化受温度和水分共同调控,与10 cm深处土壤温度、土壤含水量呈线性相关性;而主导因子是水热条件变化导致的土壤呼吸底物WSOC含量的变化。2种竹林土壤CO2通量与土壤WSON、MBC和MBN含量相关性不显著。
建议西溪湿地保护区内仅进行小规模灌草清理,如此可减少施肥、翻耕、挖笋和砍材等人为干扰,降低湿地竹林土壤CO2通量,亦使土壤WSON含量下降,可减轻西溪湿地水质富营养化程度。
陈安强, 付斌, 鲁耀, 等. 2015. 有机物料输入稻田提高土壤微生物碳氮及可溶性有机碳氮[J]. 农业工程学报, 31(21): 160-167. (Chen A Q, Fu B, Lu Y, et al. 2015. Exogenous organic materials applied to paddy field improving soil microbial biomass C, N and dissolved organic C, N[J]. Transactions of the Chinese Society of Agricultural Engineering, 31(21): 160-167. DOI:10.11975/j.issn.1002-6819.2015.21.021 [in Chinese]) |
初小静, 韩广轩. 2015. 气温和降雨量对中国湿地生态系统CO2交换的影响[J]. 应用生态学报, 26(10): 2978-2990. (Chu X J, Han G X. 2015. Effect of air temperature and rainfall on wetland ecosystem CO2 exchange in China[J]. Chinese Journal of Applied Ecology, 26(10): 2978-2990. [in Chinese]) |
葛高飞, 梁永超. 2011. 玉米生长过程中施肥对土壤呼吸和微生物量碳的影响[J]. 中国农学通报, 27(18): 73-78. (Ge G F, Liang Y C. 2011. Effect of fertilization on soil respiration and microbial biomass carbon during maize growth period[J]. Chinese Agricultural Science Bulletin, 27(18): 73-78. [in Chinese]) |
康文星, 赵仲辉, 田大伦, 等. 2008. 广州市红树林和滩涂湿地生态系统与大气二氧化碳交换[J]. 应用生态学报, 19(12): 2605-2610. (Kang W X, Zhao Z H, Tian D L, et al. 2008. CO2 exchanges between mangrove-and shoal wetland ecosystems and atmosphere in Guangzhou[J]. Chinese Journal of Applied Ecology, 19(12): 2605-2610. [in Chinese]) |
李伟成, 盛海燕, 钟哲科, 等. 2007. 杭州西溪湿地中不同土地利用类型的种子库特征[J]. 林业科学, 43(11): 163-169. (Li W C, Sheng H Y, Zhong Z K, et al. 2007. Seed banks characteristics according to different land use type of Xixi Wetlands in Hangzhou[J]. Scientia Silvae Sinicae, 43(11): 163-169. [in Chinese]) |
李伟成, 王曙光, 盛海燕, 等. 2013. 酒竹人工林土壤呼吸对氮输入的响应及其因子分析[J]. 浙江大学学报:农业与生命科学版, 39(3): 299-308. (Li W C, Wang S G, Sheng H Y, et al. 2013. Effects of nitrogen levels on soil respiration of sympodial bamboo plantation and factor analysis[J]. Journal of Zhejiang University:Agriculture and Life Science, 39(3): 299-308. [in Chinese]) |
李永夫, 姜培坤, 刘娟, 等. 2010. 施肥对毛竹林土壤水溶性有机碳氮与温室气体排放的影响[J]. 林业科学, 46(12): 166-170. (Li Y F, Jiang P K, Liu J, et al. 2010. Effect of fertilization on water-soluble organic C, N, and emission of greenhouse gases in the soil of Phyllostachys edulis stands[J]. Scientia Silvae Sinicae, 46(12): 166-170. [in Chinese]) |
栾军伟, 崔丽娟, 宋洪涛, 等. 2012. 国外湿地生态系统碳循环研究进展[J]. 湿地科学, 10(2): 235-243. (Luan J W, Cui L J, Song H T, et al. 2012. Foreign research progress on carbon cycle in wetland ecosystems[J]. Wetland Science, 10(2): 235-243. [in Chinese]) |
谭三清, 康文星, 何介南, 等. 2010. 洞庭湖白沙洲4种植被系统与大气中碳素交换[J]. 生态学报, 30(13): 3441-3448. (Tan S Q, Kang W X, He J N, et al. 2010. The exchange between four types of vegetation system of Baishazhou in Dongting Lake and carbon of atmosphere[J]. Acta Ecologica Sinica, 30(13): 3441-3448. [in Chinese]) |
杨文佳, 李永夫, 姜培坤, 等. 2015. 亚热带毛竹人工林土壤呼吸组分动态变化及其影响因素[J]. 应用生态学报, 26(10): 2937-294. (Yang W J, Li Y F, Jiang P K, et al. 2015. Dynamic changes in soil respiration components and their regulating factors in the moso bamboo plantation in subtropical China[J]. Chinese Journal of Applied Ecology, 26(10): 2937-2945. [in Chinese]) |
叶耿平, 刘娟, 姜培坤, 等. 2011. 集约经营措施对毛竹林生长季土壤呼吸的影响[J]. 浙江农林大学学报, 28(1): 18-25. (Ye G P, Liu J, Jiang P K, et al. 2011. Soil respiration during the growing season with intensive management of Phyllostachys pubescens[J]. Journal of Zhejiang Agriculture and Forestry University, 28(1): 18-25. DOI:10.11833/j.issn.2095-0756.2011.01.004 [in Chinese]) |
张睿, 白杨, 刘娟, 等. 2015. 亚热带天然阔叶林转换为杉木人工林对土壤呼吸的影响[J]. 应用生态学报, 26(10): 2946-2952. (Zhang R, Bai Y, Liu J, et al. 2015. Effects of conversion of natural broad 1eaved forest to Chinese fir plantation on soil respiration in subtropical China[J]. Chinese Journal of Applied Ecology, 26(10): 2946-2952. [in Chinese]) |
张敏霞, 江洪, 陈晓峰, 等. 2016. 亚热带毛竹林生态系统碳通量与土壤呼吸研究[J]. 东北农业大学学报, 47(6): 41-50. (Zhang M X, Jiang H, Chen X F, et al. 2016. Study on the carbon flux and soil respiration of Phyllostachys edulis forest ecosystem in subtropic China[J]. Journal of Northeast A cultural University, 47(6): 41-50. [in Chinese]) |
张剑, 汪思龙, 王清奎, 等. 2009. 不同森林植被下土壤活性有机碳含量及其季节变化[J]. 中国生态农业学报, 17(1): 41-47. (Zhang J, Wang S L, Wang Q K, et al. 2009. Content and seasonal change in soil labile organic carbon under different forest covers[J]. Chinese Journal of Eco-Agriculture, 17(1): 41-47. [in Chinese]) |
Blair N, Faulkner R D, Till A R, et al. 2006. Long-term management impacts on soil C, N and physical fertility:part Ⅰ:broad balk experiment[J]. Soil and Tillage Research, 91(1/2): 30-38. |
Bowles T M, Acosta M V, Calderon F, et al. 2014. Soil enzyme activities, microbial communities, and carbon and nitrogen availability in organic agroecosystems across an intensively managed agricultural landscape[J]. Soil Biology and Biochemistry, 68(1): 252-262. |
Cui J F, Holden N M. 2014. The relationship between soil microbial activity and microbial biomass, soil structure and grassland management[J]. Soil and Tillage Research, 146(Part A): 32-38. |
Curtin D, Beare M H, Qiu W W, et al. 2015. Temperature dependence of organic matter solubility:influence of biodegradation during soil-water extraction[J]. Soil Science Society of America Journal, 79(3): 858-863. DOI:10.2136/sssaj2015.02.0068 |
Davidson E A, Belk E, Boone R D. 1998. Soil water content and temperature as independent or confounded factors controlling soil respiration in a temperate mixed hardwood forest[J]. Global Change Biology, 4(2): 217-227. |
Drewitt G B, Black T A, Nesic Z, et al. 2002. Measuring forest floor CO2 fluxes in a Douglas-fir forest[J]. Agriculture and Forest Meteorology, 110(4): 299-317. DOI:10.1016/S0168-1923(01)00294-5 |
Falk M, Paw U K T, Wharton S, et al. 2005. Is soil respiration a major contributor to the carbon budget within a Pacific Northwest old growth forest?[J]. Agricultural and Forest Meteorology, 135(1/4): 269-283. |
Fernandes S A P, Bettiol W, Cerri C C. 2005. Effect of sewage sludge on microbial biomass, basal respiration, metabolic quotient and soil enzymatic activity[J]. Applied Soil Ecology, 30(1): 65-77. DOI:10.1016/j.apsoil.2004.03.008 |
Freeman J, Valerie A O. 2008. Relationships between soil respiration and soil moisture[J]. Soil Biology and Biochemistry, 40(5): 1013-1018. DOI:10.1016/j.soilbio.2007.12.012 |
Hatala J A, Detto M, Sonnentag O, et al. 2012. Greenhouse gas (CO2, CH4, N2O) fluxes from drained and flooded agricultural peatlands in the Sacramento-San Joaquin Delta[J]. Agriculture, Ecosystems and Environment, 150(6): 1-18. |
Iqbal J, Hu R G, Du L J, et al. 2008. Differences in soil CO2 flux between different land use types in mid-subtropical China[J]. Soil Biology and Biochemistry, 40(9): 2324-2333. DOI:10.1016/j.soilbio.2008.05.010 |
Joergensen R G. 1996. The fumigation-extraction method to estimate soil microbial biomass:calibration of the kEC value[J]. Soil Biology and Biochemistry, 28(1): 25-31. DOI:10.1016/0038-0717(95)00102-6 |
Joergensen R G, Mueller T. 1996. The fumigation-extraction method to estimate soil microbial biomass:calibration of the kEN value[J]. Soil Biology and Biochemistry, 28(1): 33-37. DOI:10.1016/0038-0717(95)00101-8 |
Kane E S, Valentine D W, Michaelson G J., et al. 2006. Controls over pathways of carbon efflux from soils along climate and black spruce productivity gradients in interior Alaska[J]. Soil Biology and Biochemistry, 38(6): 1438-1450. DOI:10.1016/j.soilbio.2005.11.004 |
Kang S S, Doh D, Lee V L, et al. 2003. Topographic and climatic controls on soil respiration in six temperate mixed-hardwood forest slopes[J]. Global Change Biology, 9(10): 1427-1437. DOI:10.1046/j.1365-2486.2003.00668.x |
Keith H, Jacobsen K L, Raison R J. 1997. Effects of soil phosphorus availability, temperature and moisture oil soil respiration in Eucalyptus Pauciflora forest[J]. Plant and Soil, 190(1): 127-141. DOI:10.1023/A:1004279300622 |
Liu J X, Zhou G Y, Zhang D, et al. 2010. Carbon dynamics in subtropical forest soil:effects of atmospheric carbon dioxide enrichment and nitrogen addition[J]. Journal of Soils and Sediments, 10(4): 730-738. DOI:10.1007/s11368-009-0178-6 |
Peng Q A, Shaaban M, Hu R G, et al. 2015. Effects of soluble organic carbon addition on CH4 and CO2 emissions from paddy soils regulated by iron reduction processes[J]. Soil Research, 53(3): 316-324. DOI:10.1071/SR14287 |
Piotrowsk A, Dlugosz J. 2012. Spati-temporal variability of microbial biomass content and activities related to some physicochemical properties of Luvisols[J]. Geoderma, 173-174(2): 199-208. |
Rochette P, Gregorich E G. 1998. Dynamics of soil microbial biomass C, soluble organic C and CO2 evolution after three years of manure application[J]. Canadian Journal of Soil Science, 78(2): 283-290. DOI:10.4141/S97-066 |
Schimel J P, Clein J S. 1996. Microbial response to freeze-thaw cycles in tundra and taiga soils[J]. Soil Biology and Biochemistry, 28(8): 1061-1066. DOI:10.1016/0038-0717(96)00083-1 |
Schlesinger W H, Andrews J A. 2000. Soil respiration and the global carbon cycle[J]. Biogeochemistry, 48(1): 7-20. DOI:10.1023/A:1006247623877 |
Sheng H, Yang Y S, Yang Z J, et al. 2010. The dynamic response of soil respiration to land-use changes in subtropical China[J]. Global Change Biology, 16(3): 1107-1121. DOI:10.1111/gcb.2010.16.issue-3 |
Uselman S M, Qualls R G, Lilienfein J. 2009. Production of total potentially soluble organic C, N, and P across an ecosystem chronosequence:root versus leaf litter[J]. Ecosysytem, 12(2): 240-260. DOI:10.1007/s10021-008-9220-6 |
Vasin Y, Boyd C E. 2006. Physical and chemical changes in aquaculture pond bottom soil resulting from sediment removal[J]. Aquacultural Engineering, 35: 199-205. DOI:10.1016/j.aquaeng.2006.02.001 |
Wagai R, Brye K R, Gower S T, et al. 1998. Land use and environmental factors influencing soil surface CO2 flux and microbial biomass in natural and managed ecosystems in Southern Wisconsin[J]. Soil Biology and Biochemistry, 30(12): 1501-1509. DOI:10.1016/S0038-0717(98)00041-8 |
Wang W J, Dalal R C, Moody P W, et al. 2003. Relationships of soil respiration to microbial biomass, substrate availability and clay content[J]. Soil Biology and Biochemistry, 35(2): 273-284. DOI:10.1016/S0038-0717(02)00274-2 |
Wickland K P. 2001. Carbon gas exchange at a southern Rocky Mountain wetland. 1996-1998[J]. Global Biogeochemical Cycles, 15(2): 321-335. DOI:10.1029/2000GB001325 |
Xing S H, Chen C G, Zhou B Q, et al. 2010. Soil soluble organic nitrogen and active microbial characteristics under adjacent coniferous and broadleaf plantation forests[J]. Journal of Soils Sediments, 10(4): 748-757. DOI:10.1007/s11368-009-0159-9 |
Yi Z, Fu S, Yi W, et al. 2007. Partitioning soil respiration of subtropical forests with different successional stages in south China[J]. Forest Ecology and Management, 243(2): 178-186. |
Zak D R, Holmes W E, White D C, et al. 2003. Plant diversity, soil microbial communities, and ecosystem function:are there any links?[J]. Ecology, 84(8): 2042-2050. DOI:10.1890/02-0433 |
 2018, Vol. 54
2018, Vol. 54
