文章信息
- 卞方圆, 钟哲科, 张小平, 杨传宝, 苏文会
- Bian Fangyuan, Zhong Zheke, Zhang Xiaoping, Yang Chuanbao, Su Wenhui
- 毛竹和伴矿景天对重金属污染土壤的修复作用和对微生物群落的影响
- Remediation of Heavy Metal Contaminated Soil by Moso Bamboo (Phyllostachys edulis) Intercropping with Sedum plumbizincicola and the Impact on Microbial Community Structure
- 林业科学, 2018, 54(8): 106-116.
- Scientia Silvae Sinicae, 2018, 54(8): 106-116.
- DOI: 10.11707/j.1001-7488.20180812
-
文章历史
- 收稿日期:2017-04-27
- 修回日期:2018-05-20
-
作者相关文章
2. 国际竹藤中心 国家林业局竹藤科学与技术重点实验室 北京 100102
2. Key Laboratoryof Science and Technology of Bamboo and Rattan of State Forestry Administration International Centre for Bamboo and Rattan Beijing 100102
重金属排放并扩散进入土壤系统已带来日益严重的污染问题,据统计,我国现有0.1亿hm2重金属污染土地,每年因重金属污染造成的农作物直接损失就达200余亿元(周建军等, 2014)。土壤重金属通过食物链在生物体内聚集,从而对食品安全以及人体健康造成威胁(Khan et al., 2013; 胡春华等, 2012)。植物修复是利用植物和相关的土壤微生物的吸收、转化和贮存等功能来减少污染物在环境中的浓度或毒性作用(Ali et al., 2013),从而达到清洁土壤的目的。与物理、化学和工程等传统修复技术相比,植物修复具有原位修复、投资和维护成本低、环境友好、无二次污染、美化景观等优点(Haque et al., 2009; Henry et al., 2013; 王亚男等, 2016)。
植物修复土壤重金属污染需要经历一个长期的过程,而大部分修复物种不具备利用价值。因此,具有较大生物量和一定经济价值的植物在修复土壤重金属污染的应用中受到广泛关注(杨洋等, 2016)。毛竹(Phyllostachys edulis)是我国南方分布最广泛的且最有价值的巨型竹种之一(Yen, 2015),它具有生物质能高、栽培方便、竞争力强、用途广泛等特点,如作为竹材应用于家具、建筑材料和装饰,被认为是最有前途的固碳物种(Chen et al., 2016; Zhou et al., 2011; 漆良华等, 2009)。毛竹可以作为植物修复的潜在物种,具有很高的生物量积累能力和对重金属污染土壤的高耐久性(Chen et al., 2015; Liu et al., 2015; 周国模等, 2011)。但是现有对毛竹修复重金属研究主要集中于竹子幼苗的水培试验和盆栽试验,而对成竹的野外田间修复试验研究较少。伴矿景天(Sedum plumbizincicola)已被证实为耐荫性强的Cd/Zn超累积植物(Hu et al., 2015),具有多年生、生物量大、生长速度快等特点(Wu et al., 2013)。
土壤微生物是土壤生态系统的重要组成部分,其参与土壤有机质的分解和腐殖质的形成,是土壤养分转化、循环和有机碳代谢的主要驱动力(Dick, 1997)。土壤微生物种类丰富,数量庞大,同时代谢活动旺盛,在降解及净化有毒物质等方面起着重要作用(Khan et al., 2013; 张雪晴等, 2016)。随着现代生物技术的发展和分子生物学技术的提高,环境污染对微生物的影响研究日愈增多,分析方法也多种多样,如聚合酶链反应-变性凝胶电泳(PCR-DGGE)(Deng et al., 2015)、荧光原位杂交(FISH) (Egli et al., 2003)、构建克隆文库(Figuerola et al., 2007)和末端限制性长度多态性(T-RFLP) (Wang et al., 2011)等方法。然而,由于这些方法存在固有的局限性,比如使用克隆文库方法可以生成序列,但耗时、昂贵且数量非常有限(DeSantis et al., 2007)。PCR-DGGE的限制性是一个条带可能包含多个物种(Muyzer et al., 1998)。它们不能完全反映整个微生物群落信息。高通量测序方法因成本低、简单、快速等优点已被广泛用于评价土壤微生物群落多样性以及群落结构研究中(Hong et al., 2015; 江玉梅等, 2016; 庄林杰等, 2017)。
本试验采用野外原位修复污染土壤技术,设置毛竹纯林、毛竹与伴矿景天间作林2种修复模式,结合土壤重金属(Cu、Zn和Cd)污染的研究背景,利用Illumina高通量测序技术分析土壤微生物群落结构,旨在探讨不同种植模式下重金属污染地区的微生物群落的变化特征。以毛竹与伴矿景天作为植物修复物种,为重金属污染土壤的植物修复技术的应用提供科学依据。
1 研究地概况试验样地位于浙江省杭州市富阳区(119°53′E, 29°52′N),该地区为亚热带季风气候,年均气温16.2 ℃,年均降水量1 452.0 mm,年均日照时间1 709.4 h。
研究地附近有电子厂和热镀锌厂,由于10年前工厂长期污水排放灌溉农田,从而造成土壤受重金属严重污染。本试验是在由多种重金属复合污染(Cu、Zn和Cd)的土壤上进行。土壤重金属污染情况见表 2,根据土壤环境质量标准(GB 15618—1995),本试验地Cd和Zn大大超过了国家Ⅲ级土壤污染标准,Cu超过国家Ⅱ级污染标准,其他金属均在正常范围内。
|
|
清理地上杂草,对造林地进行翻土至30 cm深。本试验设置3块样地,分别随机分布毛竹纯林(SM)、间作毛竹与伴矿景天(IMS)和无栽培空白对照(CK)。这3个地块紧密相邻,每块样地为10 m×20 m。毛竹株行距为2 m×2.5 m,按长方形配置种植点进行挖栽植穴,穴大小为60 cm×60 cm× 60 cm。毛竹林用生长健壮、枝叶繁茂、无病虫害、须根发达的2年生母竹移栽造林。为提高毛竹成活率和促进母竹发笋成竹,对竹林定期进行灌溉,除草松土和保护等抚育管理。供试伴矿景天采用种子育苗,先在蛭石、珍珠岩为主的复合育苗基质中培育小苗,待小苗长出6片真叶后再移栽到毛竹林下,高为3~5 cm,冠幅为4~7 cm,在毛竹林下套种密度约为3 000株·(667 m2)-1。毛竹于2012年10月种植,伴矿景天于2013年3月种植。
2.2 样品采集2016年8月从试验区采集土壤样品。试验地幼竹由母竹发笋成竹,试验竹林为异龄林,竹龄分布情况为:除初次种植的母竹[6年生,密度133株·(667 m2)-1]外,其余为近3年竹林生长的竹子,其中1年、2年和3年生毛竹密度分别为70、90和60株·(667 m2)-1。在每个样地,按照“S”形随机地选取5个土壤剖面,然后取上层的0~20 cm土壤样品,装入塑料袋中后密封。回到实验室后,从新鲜土壤中拣出石砾和植物残体,将土样分为2份保存,一份立即装入灭菌自封袋冷冻保存,用于提取土壤微生物DNA,供土壤微生物群落结构分析使用,另一份土样铺平到牛皮纸上自然风干。充分混匀后用四分法依次将样品连续筛分出 < 2和0.149 mm的组分,研磨成细粉末,分别装入新的自封袋,编号,室温下储存,备用。
2.3 土壤理化性质及重金属分析土壤pH值用电极电位法及在土-水悬液(水土比为2.5:1)中通过酸度计测定(NY/T 1377—2007),用通过2 mm筛的土壤;土壤有机质、有机碳含量用重铬酸钾-外加热法测定(LY/T 1237—1999),用通过0.149 mm筛的土壤;有效重金属用DTPA浸提法(LY/T 1260—1999; LY/T 1261—1999)测定,用通过2 mm筛的土壤;重金属全量用王水-高氯酸法测定(鲁如坤, 2000),使用通过0.149 mm筛的土壤;土壤有效态及全量重金属含量用原子吸收分光光度计(AAS)(AAnalyst800,Perkin Elmer,USA)测定。每个试验重复3次。
2.4 土壤DNA提取、PCR扩增以及Illumina Miseq测序将保存于-80 ℃超低温冰箱中的土壤样品取出,所有样品的DNA提取采用TIANamp Soil DNA Kit(货号:DP336-02)试剂盒。采经试剂盒提取后的土样微生物DNA使用NanoDrop 2000超微量分光光度计进行DNA的初步定量质检。
对微生物基因组16S rDNAV3-V4高变区域进行PCR扩增,以土壤微生物中总提取的DNA为模板,采用细菌通用型引物,上游引物为CCTACG GGNGGCWGCAG,下游引物为GACTACHVGGGT ATCTAATCC。PCR扩增反应体系(50 μL):25 μL 2× Phanta Max Master Mix,2 μL DNA模板,2 μL上游引物和下游引物(10 μmol·L-1),ddH2O加至50 μL。PCR反应条件:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火40 s,72 ℃延伸30 s,反应25个循环;72 ℃延伸5 min结束;4 ℃保存。利用AMPure XP beads对PCR产物进行纯化。
对纯化后产物样本添加特异性标签序列,采用以下PCR反应体系:25 μL 2× Phanta Max Master Mix,5 μL DNA模板,2 μL Nextera XT Index Primer 1及Nextera XT Index Primer 2(10 mol·L-1),16 μL ddH2O。PCR反应条件:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火40 s,72 ℃延伸30 s,反应8个循环;最后72 ℃终延伸5 min结束;4 ℃保存。将PCR产物再次用AMPure XP beads进行纯化,所得产物即为16S文库。每个样品的PCR产物割胶回收后用UV-Vis spectrophotometer (NanoDrop ND2000, USA)测量浓度。
利用qubit定量计和Agilent Technologies 2100 Bioanalyzer分别对文库进行浓度与片段的质检,参照Illumina文库构建试剂盒(16S Metagenomic Sequencing Library Preparation)指南进行文库的构建,将构建好的DNA文库均一化至4 nmol·L-1后等体积混合,将混合好的文库加入等体积的0.2 mol·L-1 NaOH进行变性,在Illumina MiSeq(Illumina Inc., San Diego CA)平台进行2×300循环的测序模式。
2.5 数据分析原始数据用Excel 2010和SPSS 19.0进行数据处理分析,不同模式下土壤pH值、土壤理化性质和土壤重金属含量的差异使用One-way analysis of variance (ANOVA)分析,LSD进行方差分析,土壤微生物丰度与有效态重金属、全量重金属以及土壤性质的相关性分析采用Pearson相关分析。
测序后的DNA序列用PANDAseq软件拼接(Masella et al., 2012),拼接后的序列用USEARCH软件除去嵌合体(Edgar, 2010),然后用QIIME平台(Caporaso et al., 2010)中“add_qiime_labels.py”命令将所有样品序列整合。一个微生物可操作单元(OUT)为序列相似度大于97%的DNA序列。利用“pick_open_reference_otus.py”命令基于Greengenes v13_08数据库提取OTU及进行种属分类。去掉占所有序列数目的比例小于0.005%的OTU,进行后续分析(Bokulich et al., 2013)。用QIIME软件的“alpha_rarefaction.py”计算多样性指数(Faith’ PD, Shannon, Chao1, observed species和Good’s coverage)。“beta_diversity_through_plots.py script”模块用于比较不同样品原核生物群落的差异(UniFrac significance test)。
3 结果与分析 3.1 土壤基本理化性质及重金属含量不同模式下的土壤pH值呈弱碱性(表 1),IMS的土壤pH值(>8.0)显著高于SM和CK(P < 0.05),但SM与CK没有明显差异。CK的平均SOM含量在3种模式中为最高,显著高于其他2种种植模式,分别是SM和IMS的近1.5倍(P < 0.01)和1.4倍(P < 0.01)。3种模式下的SOC含量变化情况与SOM一致。全氮含量在CK中最高,显著高于SM和IMS(P < 0.05),SM和IMS之间无显著差异。
|
|
从3种模式下的土壤全量重金属和有效态重金属含量情况(表 2)可知,全量和有效态Cu、Zn和Cd含量在IMS土壤中为最低,其次为SM,在CK中最高。在IMS土壤中,全Cu、全Zn和全Cd含量分别低于CK的47.8%、21.6%和23.6%(P < 0.01)。全Cu含量在SM中比在IMS中高14.4%(P < 0.01),全Zn和全Cd含量在SM和IMS之间无显著性差异。在IMS土壤中,有效Cu含量分别低于SM和CK的26.0%和65.0%(P < 0.01);有效Zn含量分别低于SM和CK的5.2%和28.7%,其与SM差异不显著,与CK之间的差异较明显(P < 0.01);全Cd含量明显低于SM和CK,分别为5.3%和48.5% (P < 0.01)。
3.2 土壤微生物组成如图 1所示,在门的分类水平上,对于所有土壤样品,有10个门的相对丰度>1%,包括变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、芽单胞菌门(Gemmatimonadetes)、浮霉菌门(Planctomycetes)、疣微菌门(Verrucomicrobia)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、硝化螺旋菌门(Nitrospira)、绿弯菌门(Chloroflexi)和WS3,其中变形菌门(Proteobacteria)是最优势的菌,占30%以上。
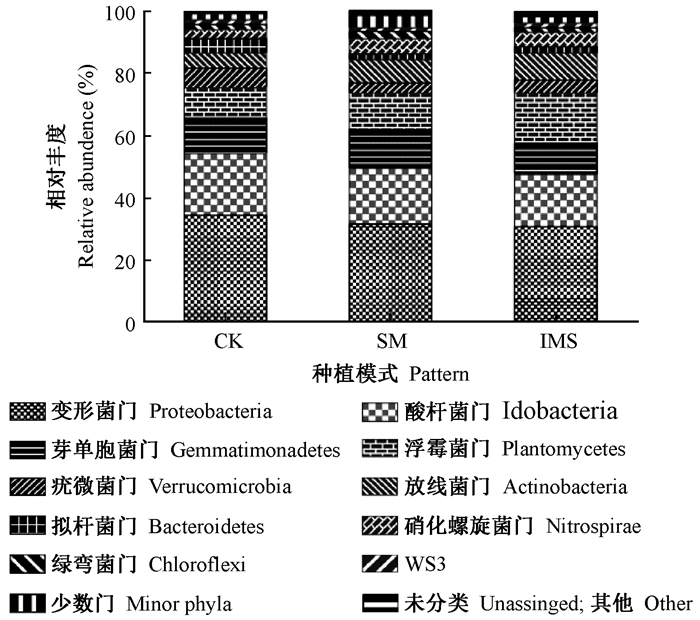
|
图 1 不同模式下微生物在门水平上的相对丰度 Figure 1 Relative abundance of the microorganism at phylum level in the different patterns |
对微生物相对丰度>1%的门进行LSD统计分析,发现3种模式中不存在变形菌门丰度的显著性差异,但存在放线菌门、硝化螺旋菌门、拟杆菌门和绿弯菌门的显著差异(P < 0.05)(图 2)。放线菌门在土壤中相对丰度依次为IMS>SM>CK,且IMS和SM显著高于CK(P < 0.05)。同样,对硝化螺旋菌门,IMS和SM均显著高于CK(P < 0.05)。而对拟杆菌门,IMS和SM显著低于CK(P < 0.05),SM和IMS中的拟杆菌门相对丰度约为CK的1/2。放线菌门、硝化螺旋菌门、拟杆菌门这3类门在SM和IMS间差异不显著。绿弯菌门在SM中相对丰度最高,显著高于CK和IMS(P < 0.05),但CK和IMS差异不显著。
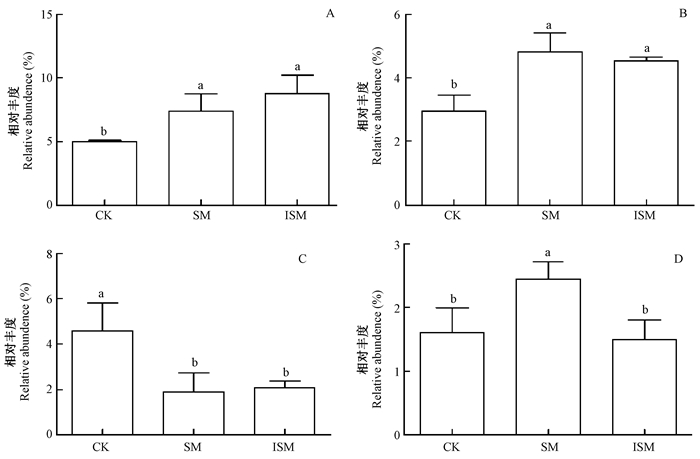
|
图 2 土壤微生物的相对丰度在门水平上的差异 Figure 2 Relative abundence of soil microbes exist differences at phylum level A.放线菌门Actinobacteria; B.硝化螺旋菌门Nitrospira; C.拟杆菌门Bacteroidetes; C.绿弯菌门Chloroflexi.下同The same below.小写字母(a, b和c)表示不同模式之间的显著性差异(P < 0.05)Lowercase letters (a, b and c) indicate significant differences (P < 0.05) among different patterns. |
LEfSe (LDA Effect Size)是一种用于发现高维生物标识和揭示基因组特征的软件分析,能够在组与组之间寻找具有统计学差异的生物标识(Biomarker),即组间差异显著的物种,该算法强调的是统计意义和生物相关性(Segata et al., 2011)。通过LEfSe进一步分析发现(图 3),在各个组别中得分超过3 (lg)以上的物种,CK有8个,SM有11个,IMS有5个,其中Candidatus Koribacter和绿颤菌属(Oscillochloris)可作为CK属的水平上的生物标识,SM中有Fimbriimonas可作为SM属的水平上的生物标识,硝化螺旋菌属(Nitrospira)可作为IMS属的水平上的生物标识。
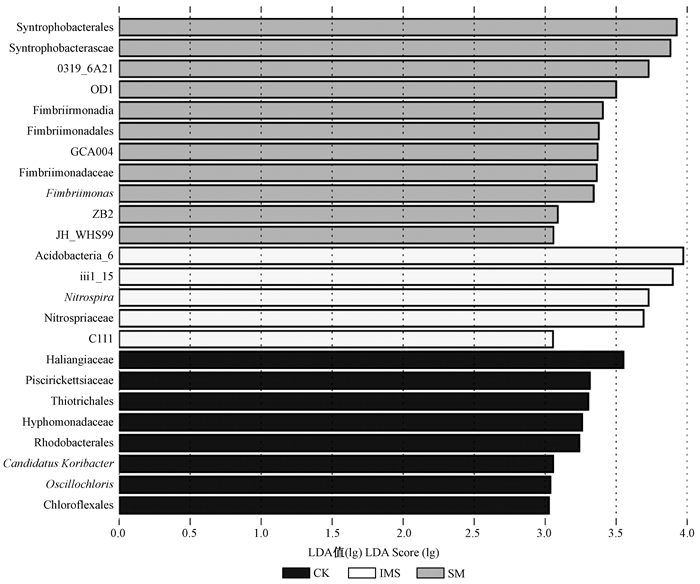
|
图 3 不同模式下土壤菌落的LEfSe分析① Figure 3 LEfSe analysis of soil bacterial colonies in the different patterns |
从土壤微生物与土壤重金属含量、理化性质的相关性分析(表 3)看出,在存在差异的门的水平上,硝化螺旋菌门的丰度与所有试验的有效态及全量重金属含量、土壤有机碳和全氮含量均呈极显著负相关(P < 0.01);而拟杆菌门与之相反,其与3种重金属有效态和全量含量、土壤有机碳含量呈极显著正相关(P < 0.01);放线菌门与有效态及全量重金属(有效Zn除外)含量呈极显著负相关(P < 0.01),与土壤有机碳含量呈显著负相关(P < 0.05),与pH值呈显著正相关(P < 0.05);绿弯菌门与重金属含量、土壤理化性质相关性不明显。在生物标识属的水平,对照土壤的Candidatus Koribacter与有效Zn、全氮含量呈显著正相关(P < 0.05),与全Zn、有效及全Cu和Cd含量呈极显著正相关(P < 0.01),与pH值呈显著负相关(P < 0.05);对照土壤的绿颤菌属只与pH值呈显著负相关(P < 0.05);SM的生物标识属Fimbriimonas与有效Cd、全Zn、全Cd、土壤有机碳含量呈显著负相关(P < 0.05);IMS的生物标识属硝化螺旋菌属与土壤有效态及全量重金属含量均呈极显著负相关(P < 0.01),与土壤有机碳含量呈显著负相关(P < 0.05),与土壤pH值呈显著正相关(P < 0.05)。
|
|
所有样品中最小的序列条数为23 153,因此,对每个样品选取24 153条序列进行后续α-和β-多样性分析。由图 4可知,在香侬指数和菌种丰富度指数中,SM样品略高,其次为IMS,CK为最低。在谱性多样性和物种指数中,SM为最高,CK略高于IMS。经统计分析发现,所有样品中的α-多样性指数(香侬菌种丰富度、谱性多样性和物种指数)无显著性差异(P>0.05)。

|
图 4 不同模式下土壤微生物α-多样性分析 Figure 4 Analysis of soil microbial α-diversity in the different patterns |
从β-多样性分析之UniFrac分析得到的距离矩阵可用于多种分析方法,可通过多变量统计学方法PCoA分析,直观显示不同环境样品中微生物进化上的相似性及差异性。非加权UniFrac只考虑物种的有无而不考虑其丰度,非加权UniFrac考虑物种的丰度。对3类土壤进行主成分分析,得到了3个主成分PC1、PC2和PC3。基于非加权UniFrac,PC1、PC2和PC3分别解释了总变异的53.98%、14.42%和8.92%。基于加权UniFrac,它们分别解释了总变异的54.76%、20.42%和12.67%。基于2种方法的UniFrac距离的主坐标分析表明(图 5),在以3个主成分为坐标轴构建的三维坐标系中,3种土样CK、SM和IMS出现了明显的空间分异,它们之间存在显著性差异(ANOSIM, P < 0.05)。
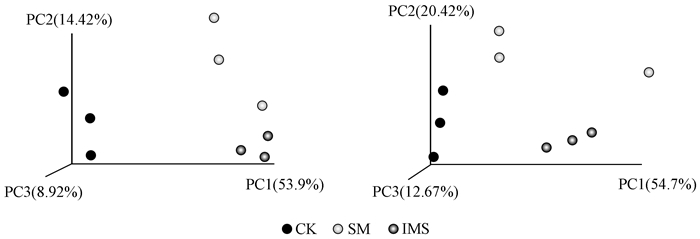
|
图 5 基于非加权(左)和加权(右)UnFric的PcoA分析 Figure 5 PcoA analysis based on unweighted(Left) and weighted(Right) UnFric in the different planting patterns |
细菌群落以极快的速度响应环境和污染的变化,从而来反映其微环境状况。因此,在原位修复条件下,细菌丰度的估算及其遗传多样性是土壤微生物的重要目标(Harichová et al., 2012)。变形菌门、酸杆菌门、疣微菌门、拟杆菌门、绿弯菌门都能在厌氧环境中生存(江玉梅等, 2016)。在重金属污染土壤中使用连续搅拌釜式反应器(CSTR)研究发现,在厌氧消化过程中微生物代谢保持平衡,可溶性重金属含量降低(Lee et al., 2017)。本试验土壤中的芽单胞菌门、浮霉菌门、放线菌门、硝化螺旋菌门以及绿弯菌门在SM土壤中的丰度均高于在CK土壤中的丰度,其中芽单胞菌门、硝化螺旋菌门和绿弯菌门在SM土壤中的丰度为最高,浮霉菌门、放线菌门和WS3在IMS土壤中的丰度最高,其余的变形菌门、酸杆菌门、疣微菌门以及拟杆菌门4类门在CK土壤高于经植物修复的土壤(SM和IMS)。由此可见,SM和IMS种植模式均有利于土壤细菌多样性的增加。
变形菌门是一大类细菌群落,在不同施肥处理下的设施菜地(曾希柏等, 2013)、长期施肥条件下的稻田(袁红朝等, 2015)以及在重金属污染(Bourceret et al., 2016)等多种土壤类型中具有最高的相对丰度。有研究表明,变形菌门对重金属的耐受能力最强(Feris et al., 2003; Gillan et al., 2005)。本研究结果显示在CK、SM以及IMS 3种模式的土壤中,变形菌门的相对丰度均为最高,占30%以上,这表明变形菌门在重金属土壤中是一个庞大的细菌群体并且可以耐受高Zn以及高Cd的土壤污染环境。近年来,有益放线菌辅助植物修复已被广泛用于清理重金属污染土壤。放线菌门在IMS土壤中含量最高,且IMS和SM显著高于CK,同时IMS和SM土壤中重金属含量也显著低于CK,表明放线菌在重金属污染土壤修复中发挥了作用,这与放线菌在植物生长,重金属和营养物获取,解毒重金属和减轻生物和非生物胁迫中起重要作用有关(Taj et al., 2016)。由于对重金属的抗性,放线菌经常被发现在重金属污染的土壤中,这个菌群可以取代更为敏感的真菌作为土壤中的主要分解者(Cáliz et al., 2013)。硝化螺旋菌门在SM及IMS的丰度相对较高,其主要参与亚硝酸盐的氧化和N循环细菌的活动。在种植复垦植被刺槐的土壤中,硝化螺旋菌等属的细菌相对丰度随复垦年限延长而变大,更有利于矿区污染土壤的生态修复和土壤肥力的恢复(贺龙等, 2017)。本研究中硝化螺旋菌为IMS的生物标识,这表明N循环在植物修复土壤生态功能中可能占有重要地位。绿弯菌门是一类以CO2为碳源通过光合作用产生能量的细菌(Klatt et al., 2013)。在本研究中,绿弯菌门与SOC呈负相关性,这与王鹏等(2017)研究结果相一致,具光合特性的绿弯菌门可能使其在SOC含量较低的SM和IMS土壤中具有竞争优势。
Cu具有广谱作用,会改变古细菌、细菌和真菌群落的结构(Macdonald et al., 2011; Wakelin et al., 2010a),对酸杆菌门有较强的消极作用(Macdonald et al., 2011; Wakelin et al., 2010b),而对放线菌门有积极作用(Lejon et al., 2008)。这与本研究结果相反,酸杆菌门在CK中丰度最高,在IMS中丰度最低,而放线菌门在CK中丰度最低,在IMS中丰度最高,且放线菌门与有效态及全Cu含量呈极显著负相关,这可能与土壤受重金属污染程度不同有关,本试验土壤为Cu、Zn和Cd复合污染,且土壤中Zn和Cd含量较高,从而导致细菌群落对重金属的响应不相同。同时,土壤微生物群落组成、植物群落组成、对重金属污染的适应性、土壤理化性质等与土壤微生物对环境干扰的响应密切相关(Griffiths et al., 2013)。
从本研究结果可发现,不同模式对重金属污染土壤微生物的组成产生了明显影响,土壤微生物群落结构发生了显著差异。Müller等(2002)研究表明,重金属污染土壤的抗性降低是因为微生物多样性降低。但是重金属含量与微生物多样性不是简单随着污染程度的增大而降低的线性关系(谢学辉等, 2012; 赵祥伟等, 2005)。重金属有效态和全量含量均为CK>SM>IMS,SM土壤重金属含量在3种模式土壤中虽处于中等水平,但是α-多样性分析显示其微生物多样性相对较为丰富,β-多样性unweighted和weighted UnFric的PcoA分析显示3种模式之间存在显著性差异,其中SM模式下物种的存在以及丰度均为最优。同时在LEfSe分析中,SM得分超过3以上(lg)的物种数量最多。赵祥伟等(2005)研究表明,最大的多样性指数出现在中等污染程度土壤中,这与本研究结果相一致。
微观及野外试验已经证明大多数土壤微生物对重金属的抵抗性和恢复力较弱(Deng et al., 2009; Griffiths et al., 2013)。在重金属高度污染的土壤中,微生物为解毒和损伤修复而分配大量能量,从而导致资源量减少(Griffiths et al., 2013)。土壤中的重金属能够明显改变土壤微生物群落的结构和功能(Suhadolc et al., 2004),这与土壤中重金属的生物有效性密切相关(程东祥等, 2009)。本试验中,有效态及全量重金属均与放线菌门、硝化螺旋菌门与拟杆菌门呈极显著相关性,这说明重金属对这3类门存在较大的影响。同时,硝化螺旋菌门与重金属含量的相关系数的绝对值普遍高于放线菌门与拟杆菌门,由此可见,重金属对硝化螺旋菌门的影响更大。与重金属含量成正相关的菌群被定义为耐受菌群,与重金属含量呈负相关的菌群被定义为敏感菌群(江玉梅等, 2016)。由此可知,本试验中放线菌门、硝化螺旋菌门和绿弯菌门为敏感菌群,拟杆菌门为耐受菌群。从属的水平上,Candidatus Koribacter和绿颤菌属具有耐受性,Fimbriimonas和硝化螺旋菌属具有敏感性。所以,本试验具有耐受性的菌主要存在于重金属含量最高的CK土壤中,敏感性菌主要存在于重金属含量相对较低的SM和IMS修复土壤中。对于同一重金属,不同种类的微生物表现出不同程度的敏感性。
5 结论毛竹-伴矿景天间作林及毛竹纯林种植模式均能定植于重金属污染土壤,并且毛竹与伴矿景天能够吸收和转运Cu、Zn和Cd,从而使土壤中的重金属含量大幅减少。其中,毛竹-伴矿景天间作林降低土壤中的全量和有效态重金属含量效果更为明显。同时,不同种植模式对重金属污染土壤微生物的组成产生了明显影响,土壤的群落结构发生了显著差异。毛竹-伴矿景天间作林和毛竹纯林均有利于增加土壤微生物的多样性,毛竹纯林土壤中的微生物多样性相对较为丰富。重金属污染土壤中存在丰富的微生物,在相对丰度>1%的10个门中,变形菌门为最优势菌。土壤微生物在修复重金属污染土壤中起着重要作用,其中耐受菌群和敏感菌群是修复和指示土壤重金属污染的重要种质资源。
程东祥, 张玉川, 马小凡, 等. 2009. 长春市土壤重金属化学形态与土壤微生物群落结构的关系[J]. 生态环境学报, 18(4): 1279-1285. (Cheng D X, Zhang Y C, Ma X F, et al. 2009. Relationship between chemical forms of some heavy metals and the microbial community structure in soil in Changchun urban[J]. Ecology and Environmental Sciences, 18(4): 1279-1285. [in Chinese]) |
贺龙, 李艳琴, 李彬春, 等. 2017. 矿区不同植被复垦模式对土壤细菌群落结构的影响[J]. 环境科学, 38(2): 752-759. (He L, Li Y Q, Li B C, et al. 2017. Effects of different vegetation types and reclamation years on soil bacterial community structure in reclaimed mine areas[J]. Environmental Science, 38(2): 752-759. [in Chinese]) |
胡春华, 蒋建华, 周文斌. 2012. 环鄱阳湖区农家菜地土壤重金属风险评价及来源分析[J]. 地理科学, 32(6): 771-776. (Hu C H, Jiang J H, Zhou W B. 2012. Risk evaluation and sources analysis of heavy metals in vegetable field soil of rural area around Poyang Lake[J]. Scientia Geographica Sinica, 32(6): 771-776. [in Chinese]) |
江玉梅, 张晨, 黄小兰, 等. 2016. 重金属污染对鄱阳湖底泥微生物群落结构的影响[J]. 中国环境科学, 36(11): 3475-3486. (Jiang Y M, Zhang C, Huang X L, et al. 2016. Effect of heavy metals in the sediment of Poyang Lake estuary on microbial communities structure base on Mi-seq sequencing[J]. China Environmental Science, 36(11): 3475-3486. DOI:10.3969/j.issn.1000-6923.2016.11.034 [in Chinese]) |
鲁如坤. 2000. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社. (Lu R K. 2000. Analysis methods of soil agricultural chemistry[M]. Beijing: China Agricultural Science and Technology Publishing House. [in Chinese]) |
漆良华, 刘广路, 范少辉, 等. 2009. 不同抚育措施对闽西毛竹林碳密度、碳贮量与碳格局的影响[J]. 生态学杂志, 28(8): 1482-1488. (Qi L H, Liu G L, Fan S H, et al. 2009. Effect of different tending measures on carbon density, storage, and allocation pattern of Phyllostachys edulis forests in western Fujian Province[J]. Chinese Journal of Ecology, 28(8): 1482-1488. [in Chinese]) |
王鹏, 陈波, 张华. 2017. 基于高通量测序的鄱阳湖典型湿地土壤细菌群落特征分析[J]. 生态学报, 37(5): 1-9. (Wang P, Chen B, Zhang H. 2017. High throughput sequencing analysis of bacterial communities in soils of a typical Poyang Lake wetland[J]. Acta Ecololgica Sinica, 37(5): 1-9. [in Chinese]) |
王亚男, 程立娟, 周启星. 2016. 萱草修复石油烃污染土壤的根际机制和根系代谢组学分析[J]. 环境科学, 37(5): 1978-1985. (Wang Y N, Cheng L J, Zhou Q X. 2016. Rhizospheric mechanisms of Hemerocallis middendorfii Trautv[J]. et Mey. remediating petroleum-contaminated soil and metabonomic analyses of the root systems. Environmental Science, 37(5): 1978-1985. [in Chinese]) |
谢学辉, 范凤霞, 袁学武, 等. 2012. 德兴铜矿尾矿重金属污染对土壤中微生物多样性的影响[J]. 微生物学通报, 39(5): 624-637. (Xie X H, Fan F X, Yuan X W, et al. 2012. Impact on microbial diversity of heavy metal pollution in soils near Dexing copper mine tailings[J]. Microbiology China, 39(5): 624-637. [in Chinese]) |
杨洋, 陈志鹏, 黎红亮, 等. 2016. 两种农业种植模式对重金属土壤的修复潜力[J]. 生态学报, 36(3): 688-695. (Yang Y, Chen Z P, Li H L, et al. 2016. The potential of two agricultural cropping patterns for remediating heavy metals from soils[J]. Acta Ecologica Sinica, 36(3): 688-695. [in Chinese]) |
袁红朝, 吴昊, 葛体达, 等. 2015. 长期施肥对稻田土壤细菌、古菌多样性和群落结构的影响[J]. 应用生态学报, 26(6): 1807-1813. (Yuan H C, Wu H, Ge T D, et al. 2015. Effects of long-term fertilization on bacterial and archaeal diversity and community structure within subtropical red paddy soils[J]. Chinese Journal of Applied Ecology, 26(6): 1807-1813. [in Chinese]) |
曾希柏, 王亚男, 王玉忠, 等. 2013. 不同施肥模式对设施菜地细菌群落结构及丰度的影响[J]. 中国农业科学, 46(1): 69-79. (Zeng X B, Wang Y N, Wang Y Z, et al. 2013. Effects of different fertilization regimes on abundance and composition of the bacterial community in greenhouse vegetable soils[J]. Scientia Agricultura Sinica, 46(1): 69-79. [in Chinese]) |
张雪晴, 张琴, 程园园, 等. 2016. 铜矿重金属污染对土壤微生物群落多样性和酶活力的影响[J]. 生态环境学报, 25(3): 517-522. (Zhang X Q, Zhang Q, Cheng Y Y, et al. 2016. The impact of heavy metal contamination on soil microbial diversity and enzyme activities in a copper mine[J]. Ecology and Environmental Sciences, 25(3): 517-522. [in Chinese]) |
赵祥伟, 骆永明, 滕应, 等. 2005. 重金属复合污染农田土壤的微生物群落遗传多样性研究[J]. 环境科学学报, 25(2): 186-191. (Zhao X W, Luo Y M, Teng Y, et al. 2005. Genetic diversity of microbial communities in farmland soils contaminated with mixed heavy metals[J]. Acta Scientiae Circumstantiae, 25(2): 186-191. [in Chinese]) |
周国模, 刘恩斌, 施拥军, 等. 2011. 基于最小尺度的浙江省毛竹生物量精确估算[J]. 林业科学, 47(1): 1-5. (Zhou G M, Liu E B, Shi Y J, et al. 2011. Accurate estimation for moso bamboo (Phyllostachys edulis) biomass in Zhejiang Province based on the lowest scale technique[J]. Scientia Silvae Sinicae, 47(1): 1-5. DOI:10.11707/j.1001-7488.20110101 [in Chinese]) |
周建军, 周桔, 冯仁国. 2014. 我国土壤重金属污染现状及治理战略[J]. 中国科学院院刊, 29(3): 315-320. (Zhou J J, Zhou J, Feng R G. 2014. Status of China's heavy metal contamination in soil and its remediation strategy[J]. China Academic Journal Electronic Publishing House, 29(3): 315-320. [in Chinese]) |
庄林杰, 夏超, 田晴, 等. 2017. 高通量测序技术研究典型湖泊岸边陆向深层土壤中厌氧氨氧化细菌的群落结构[J]. 环境科学学报, 37(1): 261-271. (Zhuang L J, Xia C, Tian Q, et al. 2017. Community structure of anaerobic ammonia oxidation bacteria in subsurface soil from riparian zone to land in Baiyangdian Lake using high-throughput sequencing technology[J]. Acta Scientiae Circumstantiae, 37(1): 261-271. [in Chinese]) |
Ali H, Khan E, Sajad M A. 2013. Phytoremediation of heavy metals-Concepts and applications[J]. Chemosphere, 91(7): 869-881. DOI:10.1016/j.chemosphere.2013.01.075 |
Bokulich N A, Subramanian S, Faith J J, et al. 2013. Quality-filtering vastly improves diversity estimates from Illumina amplicon sequencing[J]. Nat Methods, 10: 57-59. DOI:10.1038/nmeth.2276 |
Bourceret A, Cébron A, Tisserant E, et al. 2016. The bacterial and fungal diversity of an aged PAH-and heavy metal-contaminated soil is affected by plant cover and edaphic parameters[J]. Microbial Ecology, 71(3): 711-724. DOI:10.1007/s00248-015-0682-8 |
Cáliz J, Montserrat G, Martí E, et al. 2013. Emerging resistant microbiota from an acidic soil exposed to toxicity of Cr, Cd and Pb is mainly influenced by the bioavailability of these metals[J]. Journal of Soils and Sediments, 13(2): 413-428. DOI:10.1007/s11368-012-0609-7 |
Caporaso J G, Kuczynski J, Stombaugh J, et al. 2010. QⅡME allows analysis of high-throughput community sequencing data[J]. Nature Methods, 7(5): 335-336. DOI:10.1038/nmeth.f.303 |
Chen J, Shafi M, Li S, et al. 2015. Copper induced oxidative stresses, antioxidant responses and phytoremediation potential of Moso bamboo (Phyllostachys pubescens)[J]. Scientific Reports, 5: 13554. DOI:10.1038/srep13554 |
Chen J, Shafi M, Wang Y, et al. 2016. Organic acid compounds in root exudation of Moso Bamboo (Phyllostachys pubescens) and its bioactivity as affected by heavy metals[J]. Environmental Science and Pollution Research, 23(20): 20977-20984. DOI:10.1007/s11356-016-7323-8 |
Deng H, Li X F, Cheng W D, et al. 2009. Resistance and resilience of Cu-polluted soil after Cu perturbation, tested by a wide range of soil microbial parameters[J]. FEMS Microbiology Ecology, 70(2): 293-304. DOI:10.1111/fem.2009.70.issue-2 |
Deng L, Zeng G, Fan C, et al. 2015. Response of rhizosphere microbial community structure and diversity to heavy metal co-pollution in arable soil[J]. Applied Microbiology and Biotechnology, 99(19): 8259-8269. DOI:10.1007/s00253-015-6662-6 |
DeSantis T Z, Brodie E L, Moberg J P, et al. 2007. High-density universal 16S rRNA microarray analysis reveals broader diversity than typical clone library when sampling the environment[J]. Microbial Ecology, 53(3): 371-383. DOI:10.1007/s00248-006-9134-9 |
Dick R P. 1997. Soil enzyme activities as integrative indicators of soil health. Biological Indicators of Soil Health, 121-156.
|
Edgar R C. 2010. Search and clustering orders of magnitude faster than BLAST[J]. Bioinformatics, 26(19): 2460-2461. DOI:10.1093/bioinformatics/btq461 |
Egli K, Langer C, Siegrist H R, et al. 2003. Community analysis of ammonia and nitrite oxidizers during start-up of nitritation reactors[J]. Applied and Environmental Microbiology, 69(6): 3213-3222. DOI:10.1128/AEM.69.6.3213-3222.2003 |
Feris K, Ramsey P, Frazar C, et al. 2003. Differences in hyporheic-zone microbial community structure along a heavy-metal contamination gradient[J]. Applied and Environmental Microbiology, 69(9): 5563-5573. DOI:10.1128/AEM.69.9.5563-5573.2003 |
Figuerola E L M, Erijman L. 2007. Bacterial taxa abundance pattern in an industrial wastewater treatment system determined by the full rRNA cycle approach[J]. Environmental Microbiology, 9(7): 1780-1789. DOI:10.1111/j.1462-2920.2007.01298.x |
Gillan D C, Danis B, Pernet P, et al. 2005. Structure of sediment-associated microbial communities along a heavy-metal contamination gradient in the marine environment[J]. Applied and Environmental Microbiology, 71(2): 679-690. DOI:10.1128/AEM.71.2.679-690.2005 |
Griffiths B S, Philippot L. 2013. Insights into the resistance and resilience of the soil microbial community[J]. FEMS Microbiology Reviews, 37(2): 112-129. DOI:10.1111/j.1574-6976.2012.00343.x |
Haque N, Peralta-Videa J R, Duarte-Gardea M, et al. 2009. Differential effect of metals/metalloids on the growth and element uptake of mesquite plants obtained from plants grown at a copper mine tailing and commercial seeds[J]. Bioresource Technology, 100(24): 6177-6182. DOI:10.1016/j.biortech.2009.06.090 |
Harichová J, Karelová E, Pangallo D, et al. 2012. Structure analysis of bacterial community and their heavy-metal resistance determinants in the heavy-metal-contaminated soil sample[J]. Biologia, 67(6): 1038-1048. |
Henry H F, Burken J G, Maier R M, et al. 2013. Phytotechnologies-preventing exposures, improving public health[J]. International Journal of Phytoremediation, 15(9): 889-899. DOI:10.1080/15226514.2012.760521 |
Hong C, Si Y, Xing Y, et al. 2015. Illumina MiSeq sequencing investigation on the contrasting soil bacterial community structures in different iron mining areas[J]. Environmental Science and Pollution Research, 22(14): 10788-10799. DOI:10.1007/s11356-015-4186-3 |
Hu P J, Wang Y D, Przybyłowicz W J, et al. 2015. Elemental distribution by cryo-micro-PIXE in the zinc and cadmium hyperaccumulator Sedum plumbizincicola grown naturally[J]. Plant and Soil, 388(1-2): 267-282. DOI:10.1007/s11104-014-2321-4 |
Khan M U, Malik R N, Muhammad S. 2013. Human health risk from heavy metal via food crops consumption with wastewater irrigation practices in Pakistan[J]. Chemosphere, 93(10): 2230-2238. DOI:10.1016/j.chemosphere.2013.07.067 |
Klatt C G, Liu Z T, M L, et al. 2013. Temporal metatranscriptomic patterning in phototrophic Chloroflexi inhabiting a microbial mat in a geothermal spring[J]. The ISME Journal, 7(9): 1775-1789. DOI:10.1038/ismej.2013.52 |
Lee J, Kim J R, Jeong S, et al. 2017. Long-term performance of anaerobic digestion for crop residues containing heavy metals and response of microbial communities[J]. Waste Management, 59: 498-507. DOI:10.1016/j.wasman.2016.10.005 |
Lejon D P H, Martins J M F, Lévêque J, et al. 2008. Copper dynamics and impact on microbial communities in soils of variable organic status[J]. Environmental Science & Technology, 42(8): 2819-2825. |
Liu D, Li S, Islam E, et al. 2015. Lead accumulation and tolerance of Moso bamboo (Phyllostachys pubescens) seedlings:applications of phytoremediation[J]. Journal of Zhejiang University, Science B, 16(2): 123-130. DOI:10.1631/jzus.B1400107 |
Müller A K, Westergaard K, Christensen S, et al. 2002. The diversity and function of soil microbial communities exposed to different disturbances[J]. Microbial Ecology, 44(1): 49-58. DOI:10.1007/s00248-001-0042-8 |
Macdonald C A, Clark I M, Zhao F J, et al. 2011. Long-term impacts of zinc and copper enriched sewage sludge additions on bacterial, archaeal and fungal communities in arable and grassland soils[J]. Soil Biology and Biochemistry, 43(5): 932-941. DOI:10.1016/j.soilbio.2011.01.004 |
Masella A P, Bartram A K, Truszkowski J M, et al. 2012. PANDAseq:paired-end assembler for illumina sequences[J]. BMC Bioinformatics, 13(1): 31. DOI:10.1186/1471-2105-13-31 |
Muyzer G, Smalla K. 1998. Application of denaturing gradient gel electrophoresis (DGGE) and temperature gradient gel electrophoresis (TGGE) in microbial ecology[J]. Antonie Van Leeuwenhoek, 73(1): 127-141. DOI:10.1023/A:1000669317571 |
Segata N, Izard J, Waldron L, et al. 2011. Metagenomic biomarker discovery and explanation[J]. Genome Biology, 12(6): R60. DOI:10.1186/gb-2011-12-6-r60 |
Suhadolc M, Schroll R, Gattinger A, et al. 2004. Effects of modified Pb-, Zn-, and Cd-availability on the microbial communities and on the degradation of isoproturon in a heavy metal contaminated soil[J]. Soil Biology and Biochemistry, 36(12): 1943-1954. DOI:10.1016/j.soilbio.2004.05.015 |
Taj Z Z, Rajkumar M. 2016. Perspectives of plant growth-promoting actinomycetes in heavy metal phytoremediation. Springer Singapore.
|
Wakelin S A, Chu G, Broos K, et al. 2010a. Structural and functional response of soil microbiota to addition of plant substrate are moderated by soil Cu levels[J]. Biology and Fertility of Soils, 46(4): 333-342. DOI:10.1007/s00374-009-0436-1 |
Wakelin S A, Chu G, Lardner R, et al. 2010b. A single application of Cu to field soil has long-term effects on bacterial community structure, diversity, and soil processes[J]. Pedobiologia, 53(2): 149-158. DOI:10.1016/j.pedobi.2009.09.002 |
Wang X H, Wen X H, Yan H J, et al. 2011. Community dynamics of ammonia oxidizing bacteria in a full-scale wastewater treatment system with nitrification stability[J]. Frontiers of Environmental Science & Engineering in China, 5(1): 92-98. |
Wu L H, Liu Y J, Zhou S B, et al. 2013. Sedum plumbizincicola X H Guo et S B Zhou ex L H Wu (Crassulaceae):a new species from Zhejiang Province, China[J]. Plant Systematics and Evolution, 299(3): 487-498. DOI:10.1007/s00606-012-0738-x |
Yen T M. 2015. Comparing aboveground structure and aboveground carbon storage of an age series of moso bamboo forests subjected to different management strategies[J]. Journal of Forest Research, 20(1): 1-8. DOI:10.1007/s10310-014-0455-0 |
Zhou G, Meng C, Jiang P, et al. 2011. Review of carbon fixation in bamboo forests in China[J]. The Botanical Review, 77: 262-270. DOI:10.1007/s12229-011-9082-z |
 2018, Vol. 54
2018, Vol. 54

