文章信息
- 姚虹宇, 刘亚敏, 张盛楠, 刘玉民, 周文颖, 王针针
- Yao Hongyu, Liu Yamin, Zhang Shengnan, Liu Yumin, Zhou Wenying, Wang Zhenzhen
- 外源柠檬酸对铝胁迫下马尾松生理特性的影响
- Effects of Exogenous Citric Acid on Physiological Characteristics of Pinus massoniana under Aluminum Stress
- 林业科学, 2018, 54(7): 155-164.
- Scientia Silvae Sinicae, 2018, 54(7): 155-164.
- DOI: 10.11707/j.1001-7488.20180717
-
文章历史
- 收稿日期:2017-04-21
- 修回日期:2017-09-25
-
作者相关文章
铝是地壳中含量最多的金属元素,常以无毒性硅酸盐等形式存在,但在pH<5的酸性条件下会转变为对植物有毒害作用的离子态Al3+,抑制植物生长,降低作物产量(Maejima et al., 2017;吴道铭等,2014)。铝毒诱导植物根系分泌和积累有机酸被认为是植物耐铝的一种普遍适应机制。研究表明,耐铝型菜豆(Phaseolus vulgaris)受铝胁迫下所分泌的柠檬酸是无铝胁迫的70倍,是铝敏感型的10倍(Miyasaka et al., 1991);在对21个大麦(Horoleum vulgare)品种耐铝研究中也发现,柠檬酸的分泌量与耐铝性成正比(Zhao et al., 2003),进一步证实了柠檬酸的分泌是植物耐铝的一种机制。具有螯合性的低分子量有机酸如柠檬酸(金婷婷等,2009;Wenzl et al., 2002)、草酸(Peng et al., 2017)、苹果酸(杨野等,2010)等能与细胞外Al3+形成稳定系数较大且无毒的螯合物,从而有效降低进入植物细胞质内Al3+的活性。不同有机酸与Al3+形成的螯合物稳定性差异较大,具有三价阴离子的柠檬酸被认为是缓解铝毒最有效的有机酸(Ma et al., 1998),因此,柠檬酸作为植物抗毒反应的信号分子(覃蔡清等,2015),对植物铝毒害有一定缓解作用。
马尾松(Pinus massomiana)是我国南方主要的乡土树种和荒山造林先锋树种(封晓辉等,2013),也是重要的用材树种之一(罗应华等,2013)。但近年来出现马尾松林大面积生长衰退甚至死亡的现象,其主要原因是土壤酸化加剧,导致土壤中活性铝溶出,使马尾松受铝毒所致(刘厚田等,1992;张盛楠等,2016)。关于铝毒对植物生长以及植物耐铝性已有报道(Choudhary et al., 2011;Xu et al., 2015),但如何有效缓解马尾松铝毒害,提高马尾松的耐铝能力是目前急需解决的科学问题。因此,本试验采用水培法研究外源柠檬酸对耐铝型FJ5、铝敏感型GD20马尾松家系的铝毒缓解作用及差异,探究外源柠檬酸缓解马尾松铝毒过程中起关键作用的生理指标,揭示柠檬酸缓解马尾松铝毒的生理机制,旨在为马尾松在酸性环境中的生长提供理论依据。
1 材料与方法 1.1 试验材料由福建省漳平五一国有林场提供。试验前课题组已通过聚类分析将来自福建、广东、广西等6个种源的29个优质马尾松家系分为耐铝型和铝敏感型2类,其中福建5号(FJ5)耐铝性最强,广东20号(GD20)对铝毒最敏感(纪雨薇,2016)。2016年4月,筛选出耐铝型福建5号(FJ5)和铝敏感型广东20号(GD20)2家系大小一致、圆润饱满的马尾松种子,经2%H2O2消毒10 min后,蒸馏水反复冲洗20 min,于25 ℃浸种24 h,均匀放置盛有珍珠岩的育苗盘中,恒温培养箱中25 ℃下催芽至露白,置于光照培养室(控制室温25 ℃,空气湿度60%,光照强度100 μmol·m-2s-1)进行培养,光照时间6: 00—18: 00,定期浇等量蒸馏水。待其幼苗针叶完全展开,选择长势一致的幼苗用纱布包裹马尾松茎部,移栽固定于盖上有小孔的玻璃杯(200 mL)中,每杯放置3株幼苗,用1/5Hoagland完全营养液培养,7天更换1次培养液,培养半年后即得供试幼苗。
1.2 试验设计为消除土壤中本底铝及有机酸对研究结果的影响,本研究采用水培试验。选取长势一致的FJ5号和GD20号供试幼苗,分别将其移入盛有培养液的试验玻璃杯中。2种马尾松家系分别设置7个处理组,其中空白对照组为不加Al3+和柠檬酸(以下记为CK),C0处理组只加Al3+不加柠檬酸,C1~C5处理组为加入0.8 mmol·L-1Al3+和不同浓度的柠檬酸(CA)(具体试验设计如表 1)。每个处理组设置3个重复,每个重复6杯,每杯3株。供试有机酸选用天然柠檬酸,Al3+以AlCl3(分析纯)形式加入,培养液用HCl和NaOH溶液将pH调节至4.00±0.05,每7天更换1次营养液,处理60天后进行各项指标的测定。
|
|
1) 生长指标测定 分别于铝胁迫前、铝胁迫60天后对马尾松株高进行人工测量,各处理随机选取30株幼苗(每组10株,共3组),计算铝胁迫60天马尾松株高增长量。用加拿大WinRHIZO根系分析系统测量根系指标,计算马尾松根系增长量。
2) 生理特性指标测定 铝处理60天后随机选择各浓度处理下的马尾松针叶进行相应生理指标测定,各指标均进行3次重复。称取马尾松针叶时,均匀摘取马尾松上、中、下3个部位的针叶进行测定。丙二醛(MDA)含量测定采用硫代巴比妥酸法(王丹等,2011);脯氨酸(Pro)含量采用茚三酮比色法(蒋时姣等,2015);可溶性糖含量采用蒽酮比色法(王学奎,2006)测定;可溶性蛋白含量采用考马斯亮蓝G250染色法(王学奎,2006)测定;谷胱甘肽还原酶(GR)的测定参照侯福林等(2015)方法;抗坏血酸过氧化酶(APX)活性的测定和
由于各指标间纲量不同,在分析前先对数据进行标准化,再对无纲量新指标矩阵进行统计分析,计算主成分特征根、方差贡献率和各指标相关系数矩阵。分析结果以特征值>1,累积方差贡献率>80%为提取标准,确定主成分数量,再根据主成分中各指标方差贡献率的大小,分析外源柠檬酸缓解马尾松铝毒的关键生理指标(Gillard, 2015)。
各指标标准化处理公式为:
| $ {X_{ij}} = \frac{{{y_{ij}} - {{\overline y }_j}}}{{{S_j}}}。$ | (1) |
式中:
利用Excel2003软件对数据进行处理和作图,运用SPSS19.0软件进行统计分析及主成分分析,其中采用One-WayANOVA进行单因素方差分析,LSD分析法进行多重比较。
2 结果与分析 2.1 外源柠檬酸对马尾松幼苗根系形态的影响铝胁迫对马尾松根系总长、表面积、体积及直径均会产生抑制作用,适当浓度的柠檬酸对马尾松根系铝毒害具有一定的缓解作用,随着外源柠檬酸浓度的增大,根系总长、表面积、体积及直径均呈现先升后降的趋势(表 2)。外源柠檬酸浓度为0.02 mmol·L-1时,对马尾松根系的缓解效果最好,在此浓度下FJ5根系总长比C0组高26.4%,根体积和直径显著高于C0组72.7%、35.3%(P<0.05);GD20根系总长比C0组高11.9%,根表面积为C0组的19.4%,根体积和直径显著高于C0组(P<0.05)。当柠檬酸的浓度>0.08 mmol·L-1时,对马尾松根系的生长产生一定的抑制作用。
|
|
如图 1所示:铝胁迫下FJ5和GD20株高增量均显著低于CK组(P<0.05),降幅分别为32.7%、58.0%,表明铝胁迫对马尾松株高增长具有显著抑制作用。加入柠檬酸后,铝毒对马尾松株高的抑制均得到一定的缓解,其中FJ5随柠檬酸浓度增加呈先上升后下降的趋势;GD20经各浓度柠檬酸处理后其株高增量均高于C0组,增量范围为40.0%~115%。柠檬酸浓度为0.02 mmol·L-1时,FJ5和GD20株高增量均最大,分别较相应的C0组上升30.4%、115%。可见,外源柠檬酸对铝敏感型马尾松家系GD20的缓解效果好于耐铝型马尾松家系FJ5。
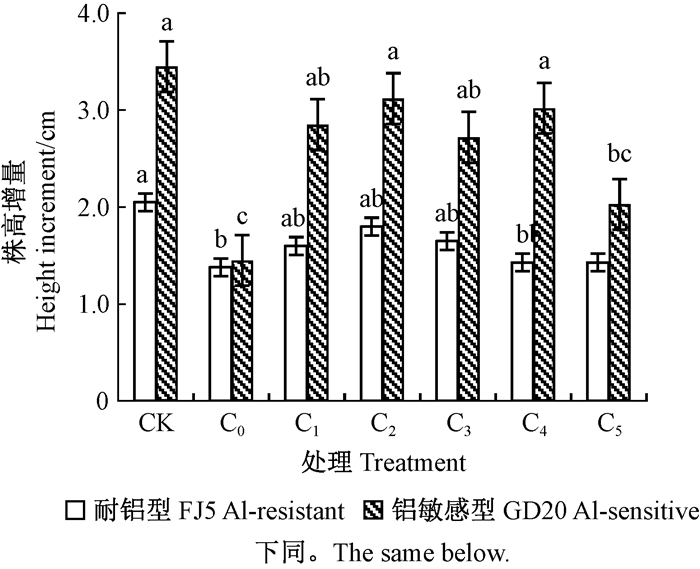
|
图 1 铝胁迫下外源柠檬酸对2种家系马尾松幼苗株高的影响 Figure 1 The effects of exogenous citric acids on height increment of P. massomiana under aluminum stress |
铝处理可以显著增加马尾松针叶内H2O2含量(P<0.05),铝处理后FJ5和GD20的H2O2含量分别增加86.8%、116%。柠檬酸的施加抑制了H2O2在马尾松体内的产生,且随柠檬酸浓度增大,2种马尾松家系H2O2含量均呈现先下降后上升的趋势。其中FJ5在柠檬酸浓度为0.02 mmol·L-1时H2O2含量最低,较C0组显著下降58.3% (P<0.05),而GD20则在柠檬酸浓度为0.04 mmol·L-1时H2O2含量最低,较C0组显著下降55.2%(P<0.05)。当柠檬酸浓度≥0.16 mmol·L-1时,2种马尾松家系的H2O2含量均与相应C0组的差异性不显著(P<0.05),此时外源柠檬酸对H2O2缓解作用不明显(图 2A)。

|
图 2 铝胁迫下外源柠檬酸对2种家系马尾松幼苗叶片活性氧(ROS)含量的影响 Figure 2 The effects of exogenous citric acids on ROS contents of P. massomiana under aluminum stress |
铝处理可以显著增加马尾松针叶内
外源柠檬酸的施加增强了马尾松针叶内过氧化物酶(POD)活性,且POD活性随柠檬酸浓度加大呈先上升后下降的变化趋势,当柠檬酸浓度为0.02 mmol·L-1时马尾松针叶内POD活性均有最高值,分别显著高于相应C0组的53.5%、63.2%(P<0.05),其中各柠檬酸浓度处理下的FJ5较C0组的差异性均显著(P<0.05)(图 3A)。
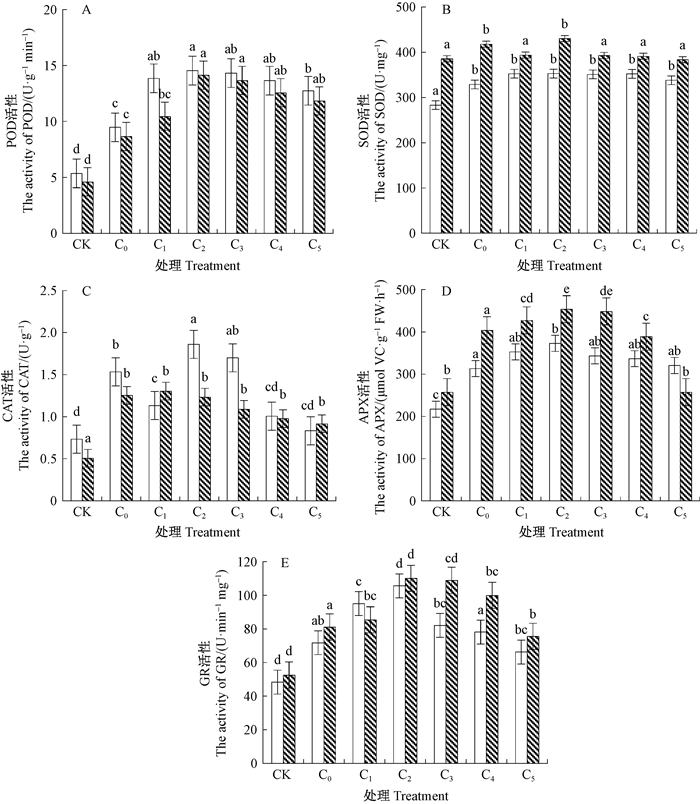
|
图 3 铝胁迫下外源柠檬酸对马尾松幼苗叶片抗氧化酶的影响 Figure 3 The effects of exogenous citric acids on antioxidant enzymes of P. massomiana under aluminum stress |
经不同浓度的外源柠檬酸处理后,FJ5针叶内超氧化物歧化酶(SOD)活性较C0组均有所提高,但变化不显著,0.02 mmol·L-1柠檬酸处理时SOD活性最大,为C0组11.5%。而GD20针叶SOD活性随柠檬酸浓度增大呈现先上升后下降的趋势,只有柠檬酸浓度为0.02 mmol·L-1时,SOD活性较C0组才有所提高,但差异性不显著,其余各柠檬酸处理组SOD活性均低于C0组(图 3B)。
施加柠檬酸后,铝胁迫下FJ5针叶过氧化氢酶(CAT)活性随柠檬酸浓度的增大呈现出先上升后下降的趋势,其中浓度在0.02 mmol·L-1时有活性最大,较C0组显著增大21.6%(P<0.05)。GD20针叶中CAT活性则随柠檬酸浓度增大而持续降低,仅在柠檬酸浓度为0.01 mmol·L-1时高于C0组4.0%,各柠檬酸处理下其针叶中CAT活性均与C0组差异性不显著(图 3C)。
加入外源柠檬酸使铝胁迫下马尾松针叶内抗坏血酸过氧化酶(APX)活性均呈现先上升后下降的趋势(图 3D),FJ5和GD20针叶中APX活性均在柠檬酸浓度为0.02 mmol·L-1时达到最大值,分别比C0组高19.0%和18.8%(P<0.05)。GD20针叶APX活性在各处理组下均与C0组有显著性差异(P<0.05),其中当柠檬酸浓度≥0.08 mmol·L-1时,APX活性低于C0组,表明该浓度范围下,柠檬酸的缓解作用受到抑制。
柠檬酸处理后,马尾松针叶谷胱甘肽还原酶(GR)活性均呈现先增大后减小的变化趋势(图 3E)。其中在柠檬酸浓度为0.02 mmol·L-1时2种家系马尾松针叶GR活性均为最大,分别显著高于相应C0组46.4%、35.7%(P<0.05)。但在浓度0.16 mmol·L-1时FJ5和GD20的GR活性均低于相应C0组7.6%、6.9%。
2.5 外源柠檬酸对马尾松幼苗渗透调节物质的影响受铝毒的FJ5和GD20针叶内可溶性糖含量较CK分别增加54.9%、18.9%。在柠檬酸处理后马尾松针叶内可溶性糖含量均呈现先下降后上升的趋势,均在柠檬酸浓度为0.02 mmol·L-1时出现最低值,分别比C0组降低50.3%、59.4%,且2种家系在各个浓度处理下可溶性糖含量较相应C0组的差异均显著(P<0.05) (图 4A)。

|
图 4 铝胁迫下外源柠檬酸对2种家系马尾松幼苗叶片渗透调节物质的影响 Figure 4 The effects of exogenous citric acids on osmotic adjustment substances of P. massomiana under aluminum stress |
马尾松在铝胁迫下其针叶可溶性蛋白含量分别显著增加(P<0.05)。柠檬酸处理使2种家系马尾松针叶可溶性蛋白均呈现先下降后上升的趋势,其中0.02 mmol·L-1的柠檬酸处理使2种家系其含量均有最低值,较相应C0组下降50.0%、32.5%。但FJ5在柠檬酸浓度>0.08 mmol·L-1时可溶性蛋白含量显著增加(P<0.05);GD20则在浓度>0.02 mmol·L-1时大幅度上升,为C0组45.5%(图 4B)。可见GD20较FJ5对柠檬酸处理的响应更强。
加入适量的铝可以刺激马尾松针叶内脯氨酸含量显著升高(P<0.05)。施加外源柠檬酸使铝胁迫下的FJ5针叶内脯氨酸含量呈现先降低后升高的趋势,且与C0组差异性显著(P<0.05);GD20脯氨酸含量在柠檬酸浓度为0.02 mmol·L-1时有最低值,但在浓度为0.16 mmol·L-1时出现大幅度增长,高于C0组21.7%(图 4C),表明该浓度下柠檬酸对于GD20的缓解作用受到抑制。
2.6 外源柠檬酸对马尾松幼苗膜脂过氧化的影响丙二醛(MDA)是膜脂过氧化最重要的产物之一。由图 5可知,铝处理后马尾松针叶内MDA含量大幅度上升,铝对马尾松针叶膜系统伤害严重。添加外源柠檬酸后,马尾松针叶内MDA含量较C0组均有所降低,且随柠檬酸浓度增大呈下降后上升的趋势。其中FJ5和GD20针叶内MDA含量均在浓度为0.02 mmol·L-1时最低,分别较相应C0组显著降低了37.3%、45.0%(P<0.05);且GD20针叶内MDA含量在各个柠檬酸浓度处理下均与C0组有显著性差异(P<0.05)。
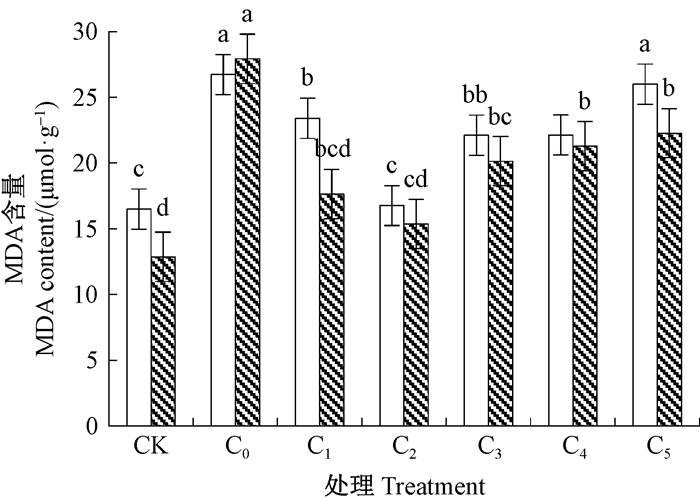
|
图 5 铝胁迫下外源柠檬酸对2种家系马尾松幼苗叶片MDA含量的影响 Figure 5 The effects of exogenous citric acids on MDA contents of P. massomiana under aluminum stress |
对不同浓度柠檬酸缓解受铝毒马尾松幼苗的11项生理指标进行主成分方差贡献率分析,得出指标因子的特征值、贡献率及因子载荷矩阵。依据因子特征值大于1的要求提取主成分,由表 3可知,前3个主因子特征值大于1,包含了11个指标中80.049%的信息量,具有较高的代表性,故本试验选取前3个因子作为主成分进行分析。成分1由MDA、H2O2、脯氨酸及GR所决定,这4个指标在成分1中有较高载荷;CAT、
|
|
|
|
在成分因子载荷矩阵中(表 4),检测值绝对值反映了对主成分贡献率的大小,绝对值越大,则贡献率也越大。比较第一主成分中贡献率大小排序为:MDA>H2O2>脯氨酸>GR;第二主成分中贡献率大小排序为:O2->SOD>CAT。由此看出,MDA、H2O2可能是本试验所研究的11项指标中具较高代表性的指标,可作为外源柠檬酸对马尾松铝毒的缓解作用的关键指标。
3 讨论铝对植物的毒害作用首先出现在植物根尖部分,主侧根变短而坚硬,根尖受损膨大,根伸长生长减缓甚至停止(Daniel et al., 2013;蒋琪等,2016),在研究根系生长的试验中,发现各浓度柠檬酸均可以缓解铝毒害对FJ5根系体积和直径的抑制作用,但柠檬酸对其根系总长和表面积的缓解作用却受到浓度的限制。柠檬酸对GD20铝毒缓解的趋势整体与FJ5相似,在柠檬酸浓度为0.02 mmol·L-1时对根系形态各指标的缓解效果最佳。虽然柠檬酸在一定浓度范围内可以缓解2种家系马尾松的铝毒害,但高浓度(≥0.08 mmol·L-1)柠檬酸处理马尾松后,个别根系形态指标会出现比铝毒胁迫下更严重的抑制作用。因而,一定浓度外源柠檬酸能够起到较为理想的缓解铝毒作用,但浓度过高则会使缓解作用减弱,甚至对植物产生更严重的毒害(Martins et al., 2012)。这可能是因为高浓度有机酸会加剧根际环境的酸化,刺激可溶性铝的活性增大,反而加重植物根际铝的毒害。
植株矮小是铝毒对植物最直观的危害表现(Silva et al., 2001)。通过测定外源柠檬酸对铝胁迫下马尾松株高的影响,可以探究柠檬酸对不同家系马尾松铝毒缓解作用的差异。在本试验中,各浓度柠檬酸处理后,铝毒下的耐铝和铝敏感马尾松株高增量均大于铝处理组,表明柠檬酸有效缓解了马尾松的铝毒害,使其生长活动恢复正常。不同浓度柠檬酸的缓解效果不同,其中柠檬酸浓度为0.16 mmol·L-1时,马尾松株高增量较其他柠檬酸处理组有所降低,可见高浓度柠檬酸的缓解作用受到抑制(Silva et al., 2001);在柠檬酸浓度为0.02 mmol·L-1时不同家系马尾松均呈现最佳效果,并对铝敏感型马尾松的影响更为显著,这与前人研究结果一致,外源有机酸对植物铝毒害的缓解作用在铝敏感品种上表现得更明显(孙远秀等,2016)。
在正常生长环境下,植物体内的活性氧物质的产生和清除处于一种动态平衡状态,但在逆境中,这种平衡被打破(曹林等,2015),细胞自身的活性氧清除系统遭受破坏,不能清除体内过量的活性氧自由基(相昆等,2016),因而H2O2和
逆境胁迫对植物细胞膜有强烈的过氧化作用,膜脂过氧化终产物MDA含量会相应增加,因此MDA含量反映了植物质膜受伤害的程度(Campos et al., 2003;杜润峰等,2012)。本试验显示,铝毒会造成不同家系马尾松针叶MDA的显著增加,说明马尾松细胞膜系统遭到铝毒破坏。加入柠檬酸后,MDA含量降低,这表明柠檬酸使铝胁迫下马尾松针叶细胞膜受铝毒的程度得到缓解,细胞膜系统逐渐得到恢复,这与李朝苏等(2006)对荞麦(Fagopyrum esculentum)的研究结果一致。随着柠檬酸浓度的增加,MDA含量有所增加,这可能是因为高浓度有机酸使细胞内多种代谢机制受到影响,进而导致细胞膜结构恢复受到抑制。2种家系马尾松针叶内MDA含量均在柠檬酸浓度为0.02 mmol·L-1有最低值,且GD20降幅更明显,说明铝敏感型品种更易接受有机酸的缓解作用。
植物细胞的渗透调节物质(可溶性糖、可溶性蛋白、脯氨酸等)对维持细胞渗透平衡起重要作用。可溶性糖能为细胞提供能量,保持细胞渗透势,减缓由胁迫造成的植物生理代谢不平衡问题(李力等,2014)。可溶性蛋白含量越高,细胞的保水能力和结构稳定性越强,能更有效地抵御毒害(Shahnaz et al., 2011)。脯氨酸作为重要的渗透调节物质,在消除ROS、提高抗氧化能力、稳定大分子结构等方面也具有重要作用(Hayat et al., 2012)。本试验中,铝胁迫使马尾松体内的可溶性糖、可溶性蛋白和脯氨酸的含量均明显增加,可见逆境使马尾松启动了自身保护机制,其体内渗透调节物质大量合成与积累。且试验中FJ5的增幅更为明显,说明耐铝型品种能产生更多渗透调节物质以适应逆境,与前人得出的植物抗逆性与其含量呈正相关的结果一致(Shahnaz et al., 2011)。低浓度柠檬酸使铝毒下的马尾松可溶性糖、可溶性蛋白和脯氨酸含量均低于铝处理组,表明低浓度有机酸使植物细胞的渗透调节功能得以恢复,渗透调节物质含量相应减少。而在高浓度柠檬酸条件下3种渗透调节物质含量显著增加,说明高浓度有机酸能改变植物体内的物质代谢途径,从而提高渗透调节物质含量。另外,柠檬酸最佳缓解效果浓度皆为0.02 mmol·L-1,且该浓度下GD20效果更好。通过对可溶性糖、可溶性蛋白和脯氨酸含量变化的综合分析,还发现马尾松施加有机酸后,可溶性糖含量较C0组降幅远远大于可溶性蛋白和脯氨酸,这可能是因为有机酸缓解马尾松铝毒,提高其生长活力进而消耗更多的糖。
4 结论活性铝抑制马尾松的生长;适宜浓度的外源柠檬酸可使马尾松铝毒得到相应缓解,其缓解效果因浓度不同而存在差异,其中0.02 mmol·L-1的柠檬酸解毒效果最佳;柠檬酸对铝敏感型马尾松的缓解效果好于耐铝型;MDA和H2O2可能是外源柠檬酸缓解铝毒作用的关键指标。
曹林, 吴玉环, 章艺, 等. 2015. 外源水杨酸对铝胁迫下菊芋光合特性及耐铝性的影响[J]. 水土保持学报, 29(4): 260-266. (Cao L, Wu Y H, Zhang Y, et al. 2015. Effects of exogenous salicylic acid on photosynthetic characteristics and aluminum tolerance of Helianthus tuberosus under aluminum stress[J]. Journal of Soil and Water Conservation, 29(4): 260-266. [in Chinese]) |
杜润峰, 郝文芳, 王龙飞. 2012. 达乌里胡枝子抗氧化保护系统及膜脂过氧化对干旱胁迫及复水的动态响应[J]. 草业学报, 21(2): 51-61. (Du R F, Hao W F, Wang L F. 2012. Dynamicresponses onanti-oxidative defense system and lipidperoxidation of Lespedeza davurica to droughtstress and re-watering[J]. Acta Prataculturae Sinica, 21(2): 51-61. DOI:10.11686/cyxb20120207 [in Chinese]) |
封晓辉, 程瑞梅, 肖文发, 等. 2013. 基于lpj-guess模型的鸡公山马尾松林生产力和碳动态[J]. 林业科学, 49(4): 7-15. (Feng X H, Cheng R M, Xiao W F, et al. 2013. Productivity and carbon dynamic of the masson pine stands in Jigongshan region based on lpj-guess model[J]. Scientia Silvae Sinicae, 49(4): 7-15. DOI:10.11707/j.1001-7488.20130402 [in Chinese]) |
高俊凤. 2006. 植物生理学实验指导[M]. 北京: 高等教育出版社: 218-219. (Gao J F. 2006. Plant physiology experimental guidance[M]. Beijing: Higher Education Press: 218-219. [in Chinese]) |
侯福林. 2015. 植物生理学实验教程[M]. 北京: 科学出版社: 105-106. (Hou F L. 2015. Plant physiology experiment cours[M]. Beijing: Science Press: 105-106. [in Chinese]) |
纪雨薇. 2016. 马尾松铝胁迫生理响应机制. 重庆: 西南大学硕士论文. (Ji Y W. 2016. Study on physiological response mechanism of Pinus massoniana Lamb. to aluminum stress. Chongding: MS thesis of Southwest University. [in Chinese]) http://cdmd.cnki.com.cn/Article/CDMD-10635-1016767186.htm |
贾新平, 邓衍明, 孙晓波, 等. 2015. 盐胁迫对海滨雀稗生长和生理特性的影响[J]. 草业学报, 24(12): 204-212. (Jia X P, Deng Y M, Sun X B, et al. 2015. Impacts of salt stress on the growth and physiological characteristics of Paspalum vaginatum[J]. Acta Prataculturae sinica, 24(12): 204-212. DOI:10.11686/cyxb2015028 [in Chinese]) |
蒋琪, 高智席, 吕朝燕, 等. 2016. 植物耐铝毒作用机制研究进展[J]. 南方农业, 10(18): 211-213. (Jiang Q, Gao Z X, Lü Z Y, et al. 2016. Progress in the mechanism of plant aluminum toxicity[J]. South China Agriculture, 10(18): 211-213. [in Chinese]) |
蒋时姣, 钟宇, 刘海鹰, 等. 2015. 铝胁迫对柳杉组培苗生长及生理特性的影响[J]. 植物生理学报, 1(2): 227-232. (Jiang S J, Zhong Y, Liu H Y, et al. 2015. Effects of aluminum stress on growth and some physiological characteristics in Cryptomeria fortunei tissue culture seedlings[J]. Plant Physiology Communications, 1(2): 227-232. [in Chinese]) |
金婷婷, 刘鹏, 张志祥, 等. 2009. 外源柠檬酸缓解大豆根系短期铝胁迫的FTIR特征分析[J]. 光谱学与光谱分析, 29(2): 367-371. (Jin T T, Liu P, Zhang Z X, et al. 2009. Analysis of soybean (Glycine max Merrill)treated with exogenous citric acid pluss short time aluminum stress by direct determination of FTIR spectrum[J]. Spectroscopy and Spectral Analysis, 29(2): 367-371. [in Chinese]) |
李力, 刘玉民, 王敏, 等. 2014. 3种北美红枫对持续高温干旱胁迫的生理响应机制[J]. 生态学报, 34(22): 6471-6480. (Li L, Liu Y M, Wang M, et al. 2014. Physiological response mechanism of three kinds of Acer rubrum L. under continuous high temperature and drought stress[J]. Acta Ecologica Sinica, 34(22): 6471-6480. [in Chinese]) |
李璇, 王升, 岳红, 等. 2011. 不同pH值和酶提取体系对丹参抗氧化酶活性的影响[J]. 中国现代中药, 13(12): 46-49. (Li X, Wang S, Yue H, et al. 2011. Effects of different pH value and enzyme extraction system on antioxidant enzyme activities in Salvia miltiorrhiza[J]. Modern Chinese Medicine, 13(12): 46-49. DOI:10.3969/j.issn.1673-4890.2011.12.013 [in Chinese]) |
李朝苏, 刘鹏, 徐根娣, 等. 2006. 外源有机酸对荞麦幼苗铝毒害的缓解效应[J]. 作物学报, 32(4): 532-539. (Li Z S, Liu P, Xu G D, et al. 2006. Effects of exogenous organic acids on aluminum toxicity in buckwheat seedlings[J]. Acta Agronomica Sinica, 32(4): 532-539. [in Chinese]) |
刘厚田, 田仁生. 1992. 重庆南山马尾松衰亡与土壤铝活化的关系[J]. 环境科学学报, 12(3): 297-305. (Liu H T, Tian R S. 1992. Effects of Pinus massoniana decay and soil aluminum activation in Nanshan mountain, Chongqing[J]. Acta Scientiae Circumstantiae, 12(3): 297-305. [in Chinese]) |
罗应华, 孙冬婧, 林建勇, 等. 2013. 马尾松人工林近自然化改造对植物自然更新及物种多样性的影响[J]. 生态学报, 33(19): 6154-6162. (Luo Y H, Sun D J, Lin J Y, et al. 2013. Effect of close-to-nature management on the natural regeneration and species diversity in a masson pine plantation[J]. Acta Ecologica Sinica, 33(19): 6154-6162. [in Chinese]) |
覃蔡清, 梁丽, 游蕊, 等. 2015. 柠檬酸对三峡水库消落区土壤中汞活化及甲基化的影响[J]. 环境科学, (12): 4494-4500. (Qin C Q, Liang L, You R, et al. 2015. Effects of citric acid on activation and methylation of mercury in soil of the Three Gorges Reservoir[J]. Environmental Science, (12): 4494-4500. [in Chinese]) |
孙远秀, 邱爽, 张伟伟, 等. 2016. 柠檬酸对西瓜幼苗铝毒害的缓解作用[J]. 核农学报, 30(10): 2072-2079. (Sun Y X, Qiu S, Zhang W W, et al. 2016. Ecological effects of citric acid on aluminum toxicity in watermelon seedlings[J]. Acta Agriculturae Nucleatae Sinica, 30(10): 2072-2079. DOI:10.11869/j.issn.100-8551.2016.10.2072 [in Chinese]) |
王丹, 宣继萍, 郭海林, 等. 2011. 结缕草的抗寒性与体内碳水化合物、脯氨酸、可溶性蛋白季节动态变化的关系[J]. 草业学报, 20(4): 98-107. (Wang D, Xuan J P, Guo H L, et al. 2011. Seasonal changes of freezing tolerance and its relationship to the contents of carbohydrate, proline, and soluble protein of Zoysia[J]. Acta Prataculturae sinica, 20(4): 98-107. DOI:10.11686/cyxb20110412 [in Chinese]) |
王学奎. 2006. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社: 134-136, 118-119, 190-191. (Wang X K. 2006. Principles and techniques of plant physiological and biochemical experiments[M]. Beijing: Higher Education Press: 134-136, 118-119, 190-191. [in Chinese]) |
吴道铭, 曹华苹, 沈宏. 2014. 生长素及其运输蛋白对植物铝胁迫的响应[J]. 植物生理学报, 12(08): 1135-1143. (Wu D M, Cao H P, Shen H. 2014. Response of auxin and its transporterto aluminumstress in plants[J]. Plant Physiology Journal, 12(8): 1135-1143. [in Chinese]) |
夏钦, 何丙辉, 刘玉民, 等. 2010. 高温胁迫对粉带扦插苗形态和生理特征的影响[J]. 生态学报, 30(19): 5217-5224. (Xia Q, He B H, Liu Y M, et al. 2010. Effects of high temperature stress on morphological and physiological characteristics in Scaerolaalb ida cutting seedlings[J]. Acta Ecologica Sinica, 30(19): 5217-5224. [in Chinese]) |
相昆, 徐颖, 李国田, 等. 2016. 外源NO对低温胁迫下核桃幼苗活性氧代谢的影响[J]. 林业科学, 52(1): 143-149. (Xiang K, Xu Y, Li G T, et al. 2016. Effects of exogenous nitric oxide on reactire oxygen metabolism of walnut seedlings under low temperature stress[J]. Scientia Silvae Sinicae, 52(1): 143-149. [in Chinese]) |
萧浪涛, 王三根. 2005. 植物生理实验技术[M]. 北京: 中国农业出版社. (Xiao L T, Wang S G. 2005. Plant physiological experiment technology[M]. Beijing: China Agricultural Publishing House. [in Chinese]) |
徐圆圆, 陆明英, 蒋维昕, 等. 2016. 铝胁迫下不同耐铝型桉树无性系根和叶抗氧化特征的差异[J]. 浙江农林大学学报, 33(6): 1009-1016. (Xu Y Y, Lu M Y, Jiang W X, et al. 2016. Al stress withlipid peroxidation and antioxidantenzyme activitiesin eucalyptus roots and leaves[J]. Journal of Zhejiang A & F University, 33(6): 1009-1016. DOI:10.11833/j.issn.2095-0756.2016.06.012 [in Chinese]) |
杨野, 王巧兰, 耿明建, 等. 2010. 生长素对铝胁迫下不同耐铝性小麦根苹果酸分泌的影响[J]. 中国农业科学, 43(10): 2016-2022. (Yang Y, Wang Q L, Geng M J, et al. 2010. Effect of auxinonAl-inducedmalic acid effluxin wheatwithdifferentialAltolerance[J]. Scientia Agricultura Sinica, 43(10): 2016-2022. DOI:10.3864/j.issn.0578-1752.2010.10.006 [in Chinese]) |
张盛楠, 刘亚敏, 刘玉民, 等. 2016. 马尾松幼苗生长及生理特性对铝胁迫的响应[J]. 西北植物学报, 36(10): 2022-2029. (Zhang S N, Liu Y M, Liu Y M, et al. 2016. Response of growth and physiological characteristics of Pinus massoniana seedlings to aluminum stress[J]. Acta Botanica Boreali-Occidentalia Sinica, 36(10): 2022-2029. DOI:10.7606/j.issn.1000-4025.2016.10.2022 [in Chinese]) |
张蜀秋. 2011. 植物生理学实验技术教程[M]. 北京: 科学出版社: 197-198. (Zhang S Q. 2011. Plant physiology experiment technology course[M]. Beijing: Science Press: 197-198. [in Chinese]) |
Campos P S, Quartin V, Ramalho J C, et al. 2003. Electrolyte leakage and lipid degradation account for cold sensitivity in leaves of Coffea sp[J]. Plants. Journal of Plant Physiology, 160(3): 283-292. DOI:10.1078/0176-1617-00833 |
Choudhary A K., Singh D, Iquebal M A. 2011. Selection of pigeonpea genotypes for tolerance to aluminium toxicity[J]. Plant Breeding, 130(4): 492-495. DOI:10.1111/pbr.2011.130.issue-4 |
Daniel da S de J, Andre D de A N. 2013. Aluminum tolerance in Sunflower plants is associated with phosphorus content in the roots[J]. Communications in Soil Science and Plant Analysis, 44(22): 3423-3430. DOI:10.1080/00103624.2013.847453 |
Gillard J. 2015. Constrained principal component analysis and related techniques[J]. Journal of Applied Statistics, 42(4): 916-916. |
Hartwell B L, Pember F R. 1918. The presence of aluminium as a reason for the difference in the effect of so-called acid soil on barley and rye[J]. Soil Sci, 6(4): 259-280. DOI:10.1097/00010694-191810000-00001 |
Hayat S, Hayat Q, Alyemeni M N, et al. 2012. Role of proline under changing environments: a review[J]. Plant Signal Behav, 7(11): 1456-1466. DOI:10.4161/psb.21949 |
Ma Z, Miyasaka S C. 1998. Oxalate Exudation by Taro in Response to Al[J]. Plant Physiology, 118(3): 861-865. DOI:10.1104/pp.118.3.861 |
Maejima E, Osaki M, Wagatsuma T, et al. 2017. Contribution of constitutive characteristics of lipids and phenolics in roots of tree species in Myrtales to aluminum tolerance[J]. Physiologia plantarum, 160(1): 11-20. DOI:10.1111/ppl.2017.160.issue-1 |
Martins N, Goncalves S, Andrade P B, et al. 2013. Changes on organic acid secretion and accumulation in Plantago almogravensis Franco and Plantago algarbiensis Samp[J]. under aluminum stress. Plant Science, 198(1): 1-6. |
Marina S, Nata-ja Š. 2010. Effects of high temperature on malondialdehyde content, superoxide production and growth changes in wheat seedlings(Triticum aestivum L).[J]. Ekologija, 56(2): 26-33. |
Miyasaka S C, Buta J G, Howell R K, et al. 1991. Mechanism of aluminum tolerance in snapbeans root exudation of citric acid[J]. Plant Physiol, 96(3): 737-743. DOI:10.1104/pp.96.3.737 |
Peng C, Liang X, Liu E E, et al. 2017. The oxalyl-CoA synthetase-regulated oxalate and its distinct effects on resistance to bacterial blight and aluminium toxicity in rice[J]. Plant Biology, 19(3): 345-353. DOI:10.1111/plb.12542 |
Silva I R, Smyth T J, Raper C D, et al. 2001. Differential aluminum tolerance in soybean: an evaluation of the role of organic acids[J]. Physiologia Plantarum, 112(2): 200-210. DOI:10.1034/j.1399-3054.2001.1120208.x |
Shahnaz G, Shekoofeh E, Kourosh D, et al. 2011. Interactive effects of silicon and aluminum on the malondialdehyde(MDA), proline, protein and phenolic compounds in Borago officinalis L[J]. J Med Plants Res, 5(24): 5818-5827. |
Wenzl P, Chaves A L, Patino G M, et al. 2002. Aluminum stress stimulates the accumulation of organic acids in root apices of Brachiaria species[J]. Journal of Plant Nutrition and Soil Science, 165(5): 582-588. DOI:10.1002/1522-2624(200210)165:5<582::AID-JPLN582>3.0.CO;2-W |
Xu G D, Liu D, Wu Y H, et al. 2015. Effects of exogenous salicylic acid on cell wall polysaccharides and aluminum tolerance of trichosanthes kirilowii under aluminum toxicity[J]. Pakistan Journal of Botany, 47(5): 1649-1655. |
Zhao Z Q, Ma J F, Kazuhiro S, et al. 2003. Differential Al resistance and citrate secretion in Barley(Hordeum vulgare L).[J]. Planta, 217(5): 794-800. DOI:10.1007/s00425-003-1043-2 |
 2018, Vol. 54
2018, Vol. 54

