文章信息
- 陈文荣, 潘霞, 邵俊怡, 廖芳蕾, 杨莉, 胡盈盈, 余颖, 郭卫东
- Chen Wenrong, Pan Xia, Shao Junyi, Liao Fanglei, Yang Li, Hu Yingying, Yu Ying, Guo Weidong
- 蓝莓VcLon1基因的克隆、表达及抗旱性分析
- Cloning, Expression and Analysis of Drought Resistance of VcLon1 Gene from Blueberry
- 林业科学, 2018, 54(6): 73-84.
- Scientia Silvae Sinicae, 2018, 54(6): 73-84.
- DOI: 10.11707/j.1001-7488.20180609
-
文章历史
- 收稿日期:2017-08-11
- 修回日期:2017-10-11
-
作者相关文章
水分作为植物体的重要组成部分,是植物代谢过程的介质,也是光合作用的原料。当植物处于干旱条件下,其细胞会出现失水、渗透压升高等现象,同时会降低植物光合速率(Bolwell et al., 1998),表现为叶片萎蔫、发黄,植株矮小。干旱胁迫还会引起植物胞内重要生理代谢途径的紊乱,如光合系统及呼吸链中的电子传递链受损等,光合系统及呼吸链中的元件受损极易引发电子的散逸,导致活性氧自由基(reactive oxygen species, ROS)在细胞内的积聚。因而,干旱胁迫下ROS对膜脂质、蛋白质及DNA等生物大分子的氧化损伤是植物损伤的重要方式。
Lon蛋白酶是一类广泛存在于生物体中的高度保守性ATP依赖蛋白酶,是细胞器中蛋白质质量控制的最主要成分(Rigas et al., 2012)。在原核生物和酵母中,其与细胞分裂、衰老和抗逆等相关(van Melderen et al., 2009; Adam et al., 2012)。在哺乳动物中,Lon蛋白酶的表达水平与细胞衰老程度以及线粒体功能稳定有关(Bota et al., 2002)。目前Lon蛋白酶在植物中的研究较少,拟南芥(Arabidopsis thaliana)中已鉴定出4种Lon基因家族成员(Lon1-4)(Smalle et al., 2003; Janska et al., 2010; Rigas et al., 2012),其中Lon2蛋白酶可能与过氧化物酶体基质蛋白质的输入有关(Lingard et al., 2009)。Lon3可能在植物配子的成熟和双受精中具有潜在作用(Rigas et al., 2009a)。Lon4是Lon1的旁系同源基因(Fukuda et al., 2007),其响应方式和Lon1基因相似,但在拟南芥中表达水平低很多(Lynch et al., 2000)。而Lon1蛋白酶定位于线粒体和叶绿体,对其所定位细胞器的蛋白质量调控、对抗胞内氧化损伤等方面起着重要作用,缺失会导致胚后期发育迟缓和线粒体结构异常(Rigas et al., 2009b)。Lon1蛋白酶参与了幼苗的器官发生以及形态建成(Reumann, 2004; Rigas et al., 2009b),其含量的增加,能相应减少羰基化蛋白质的含量,提高线粒体抵御外界氧化应激的能力(Bota et al., 2002)。ROS积聚及氧化损伤加剧是干旱等逆境对植物损伤的重要途径,而叶绿体、线粒体是植物ROS产生的主要细胞器。因此,Lon1蛋白酶可能对植物抗旱性具有重要作用,但相关功能未见报道。
蓝莓(Vaccinium spp.)具有较高的营养价值和经济价值,近几年,蓝莓产业在浙江等南方省份发展迅速,但蓝莓根系浅,极易受到干旱胁迫的影响。南高丛蓝莓‘夏普蓝’(Vaccinium corymbosum ‘Sharpblue’)为南方省份主栽品种,在生产实践中其苗期生长势及多方面耐受性表现均较为突出。因此,以南高丛蓝莓‘夏普蓝’为材料,在克隆得到VcLon1序列全长的基础上,通过比较干旱胁迫下野生型、VcLon1超表达本氏烟(Nicotiana benthamiana)在叶绿体结构与光合生理方面的差异,探究VcLon1在植物蛋白质量调控中的作用,揭示蓝莓VcLon1的生物学功能,为运用生物技术培育蓝莓抗旱品种提供理论基础,并为其他植物抗旱研究提供基础信息。
1 材料与方法 1.1 VcLon1的克隆和生物信息学分析根据前期南高丛蓝莓‘夏普蓝’转录组测序数据获得的1 025 bp Lon蛋白酶特异序列为探针,利用电子克隆的方法,在NCBI和本实验室转录组库中获得一系列同源EST,拼接后进行基因预测,利用软件ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)预测完整ORF。在ORF序列两侧设计特异引物(表 1)。扩增体系(25 μL):上下游引物各0.5 μL,模板cDNA 0.5 μL,PrimeSTAR HS DNA聚合酶0.25 μL,5×PrimeSTAR buffer 5 μL,dNTP Mixture(各2.5 mmol·L-1)2 μL,ddH2O补足至25 μL。PCR程序:94 ℃预变性4 min;94 ℃变性30 s,57 ℃退火30 s,72 ℃延伸3 min,30个循环;72 ℃延伸10 min。PCR产物纯化后用LA Taq DNA聚合酶进行加‘A’处理。
|
|
利用NCBI网站的BLASTn和BLASTp程序对‘夏普蓝’Lon1序列及其推导的氨基酸序列进行相似性分析。多序列比对分析采用DNAMAN软件,系统进化树用MEGA4.0软件构建。利用ExPASy网站的Protparam预测编码蛋白的分子式、相对分子质量、氨基酸组成和等电点(http://web.expasy.org/protparam/),用NCBI网站的CDD进行氨基酸序列结构域分析(http://www.ncbi.nlm.nih.gov/Structure/cdd/docs/cdd_search.html)。WoLF PSORT在线软件(http://www.genscript.com/psort/wolf_psort.html)预测蛋白的亚细胞定位;TMHMM 2.0在线软件(http://www.cbs.dtu.dk/services/TMHMM/)分析蛋白的跨膜结构域。
1.2 VcLon1-pSH737超表达载体的构建根据VcLon1序列设计上游引物VcLon1-K-F(KpnⅠ)和下游引物VcLon1-S-R(SmaⅠ),以蓝莓cDNA为模板,用高保真酶进行PCR扩增。PCR反应条件:94 ℃预变性4 min;94 ℃变性30 s,57 ℃退火30 s,72 ℃延伸3 min,30个循环;72 ℃延伸10 min。PCR扩增产物回收后连接到pMD19-T Vector上,转化大肠杆菌(Escherichia coli)DH5α,挑选阳性克隆送上海生工生物工程有限公司测序。经测序验证正确的重组克隆质粒VcLon1-pMD19-T和表达载体pSH737用限制性内切酶KpnⅠ和SmaⅠ进行双酶切,经琼脂糖凝胶分离目的片段后,通过SanPrep柱式DNA胶回收试剂盒回收VcLon1和pSH737双酶切片段,再利用T4 DNA连接酶将蓝莓VcLon1连接至植物表达载体pSH737(图 1)。转化大肠杆菌,进行PCR及双酶切验证,重组质粒命名为VcLon1-pSH737。
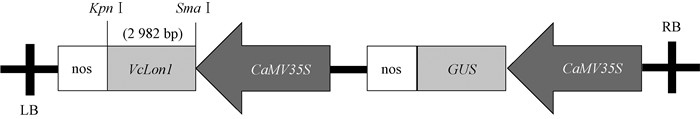
|
图 1 VcLon1基因超表达载体构建示意 Figure 1 Construction of VcLon1 overexpression vector |
重组质粒VcLon1-pSH737采用冻融法转化至根癌农杆菌(Agrobacterium tumefaciens)GV3101,菌液PCR筛选及双酶切验证。利用叶盘法转化本氏烟,使用75 mg·L-1卡那霉素筛选(余柯达, 2016)。取VcLon1转化本氏烟抗性植株的基因组DNA,对其进行特异基因PCR检测。对有目的基因存在的植株,利用半定量PCR分析外源基因VcLon1在烟草中的表达。最后对有VcLon1表达的转化本氏烟抗性植株的叶片进行GUS染色。
1.4 蓝莓VcLon1时空表达分析以5年生南高丛蓝莓‘夏普蓝’为材料,分别就不同组织(幼叶、成熟叶、茎、花、幼果和成熟果)取样,用液氮速冻,-80 ℃保存备用;同时,以生长健壮、长势一致的2年生‘夏普蓝’蓝莓为材料(此时苗高约为40 cm),放入人工气候室进行21天的预培养,温度设为25 ℃/20 ℃(昼/夜),光照设为每天14 h,光照强度设为100 μmol·m-2s-1,控制湿度70%~75%。蓝莓干旱处理采用称重法进行(汪志威等, 2016)。
参照Vashisth等(2011)的改良CTAB法分别提取蓝莓不同组织及干旱胁迫条件下蓝莓植株的RNA。按照大连宝生物有限公司的PrimeScript 1st Strand cDNA Synthesis Kit操作手册进行cDNA的合成,保存于-20 ℃。根据基因序列使用Primer premier 5.0设计VcLon1定量特异引物qRT-V1-F、qRT-V1-R。选取蓝莓GAPDH基因(余柯达, 2016)为内参。
使用SYBR® Premix Ex TaqTMⅡ(TaKaRa)定量试剂盒,分别以蓝莓的幼叶、成熟叶、茎、花、幼果和成熟果的cDNA为模板,各取1 μL(总浓度500 ng),上下游引物(10 μmol·L-1)各0.4 μL,SYBR Premix ExTaq 10 μL,ddH2O补足反应体系至20 μL进行组织特异性表达分析;同样以干旱处理的蓝莓cDNA为模板,进行干旱处理对基因表达的影响检测。PCR程序:95 ℃预变性30 s;95 ℃ 5 s,60 ℃ 30 s,共30个循环。数据用2-ΔΔCt法通过内参基因GAPDH归一化处理。
1.5 转基因本氏烟培养与胁迫处理将野生型和VcLon1超表达转基因T1代烟草种子,消毒后播种于MS及MS+Kan(Kan 75 mg·L-1)培养基,正常生长至2叶期后进行模拟干旱胁迫处理:在MS培养基中添加2%PEG-6000以模拟干旱,处理20天;水培试验中干旱处理条件为1/2Hoagland培养液中添加10%PEG-6000(冯慧芳等, 2011),处理2天后收获样品。以上各处理组均含15株苗并重复3次。
1.6 测定指标及方法取本氏烟苗第3、4、5叶位的叶片进行生理指标测定。电解质渗透率测定参照石慧勤等(2015),游离脯氨酸测定采用磺基水杨酸法(Bates et al., 1973),可溶性蛋白测定参照考马斯亮蓝G-250法(杨颖丽等, 2007)。用丙酮浸提法结合分光光度法测定叶绿素含量(刘晓等, 2017)。参照Sellammal等(2014)方法利用TEM测定烟草叶片叶绿体超微结构,每个生物学重复随机拍取30张细胞结构图,分基本完整、轻度损伤及重度损伤对叶绿体完整性进行统计。按Davey等(2005)的方法测定丙二醛(MDA)含量,H2O2的组织化学分析参考Fryer等(2002)的改进方法,羰基化测定参考Johansson等(2004)的方法。POD酶活性参照Shah等(2001)的方法,Cu/Zn SOD、APX、GR的活性则是通过活性测定试剂盒(南京建成)按照其说明进行测定。各指标分析的每个处理均包含3个以上生物学重复。
1.7 数据分析运用IBM SPSS Statistics 21软件进行统计分析,并采用Sigmaplot 12.2绘制图表。
2 结果与分析 2.1 蓝莓VcLon1的克隆利用VcLon1基因特异引物VcLon1-F/R,以蓝莓叶片cDNA为模板,PCR扩增得到VcLon1的ORF序列长2 982 bp,编码993个氨基酸,预测该蛋白的理论等电点为5.44,分子量为109.5 kDa(图 2)。
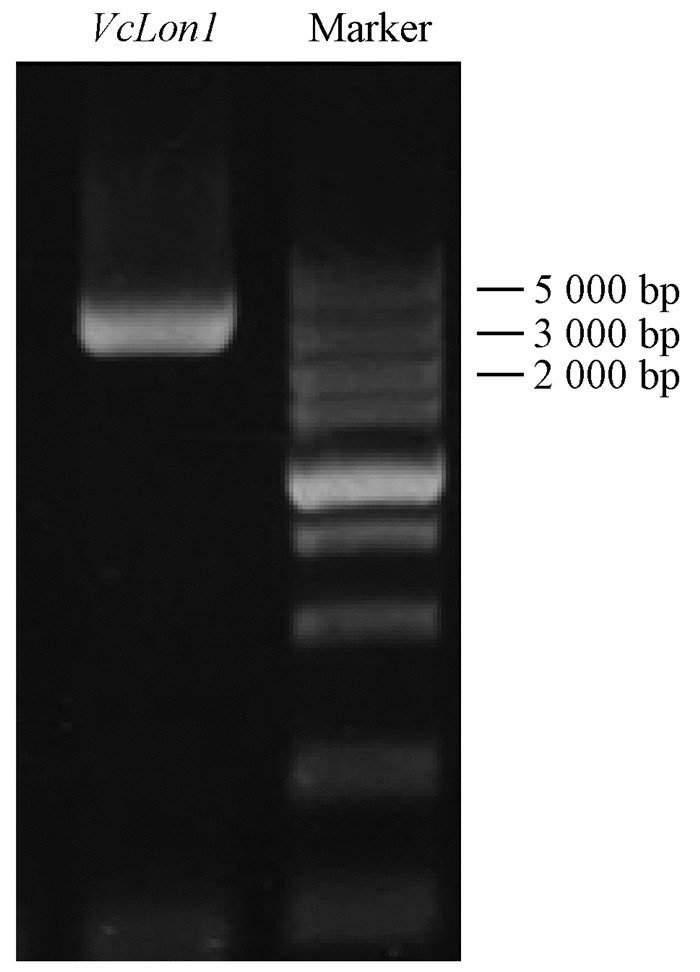
|
图 2 VcLon1的PCR扩增产物凝胶电泳 Figure 2 Electrophoresis of the PCR products of VcLon1 |
将蓝莓VcLon1序列编码的氨基酸序列与其他物种Lon1比较,发现有较高同源性。与苹果(Malus domestica)(XP_008388478.1)、葡萄(Vitis vinifera)(XP_002277956.1)、番茄(Solanum lycopersicum)(XP_004248543.1)和拟南芥(NP_568490.3)的氨基酸同源性分别为81%、80%、80%、75%,与人类(Homo sapiens)(NP_001263408.1)同源性也达到49%。因此确认获得了蓝莓Lon1基因全长的cDNA序列,将其命名为VcLon1(MF972079)。保守结构域预测分析发现VcLon1蛋白中间具有一个AAA+结构域(466-609 aa),属于AAA+超家族;N端则具有Lon蛋白酶家族的N端结构域;C端则具有蛋白水解活性,并具有催化二联体Ser-Lys残基(893和936 aa)(图 3)。用TMHMM2.0在线工具对蓝莓Lon1氨基酸序列跨膜结构预测结果显示,该蛋白未形成跨膜结构域。WoLF PSORT在线软件预测该蛋白定位于叶绿体和线粒体。用MEGA 5.0软件的NJ法构建了Lon1系统进化树,其与葡萄、苹果等Lon1蛋白酶亲缘关系较近,而与番茄、玉米(Zea mays)等亲缘关系较远(图 4)。

|
图 3 VcLon1与同源氨基酸序列的多重比对 Figure 3 Multiple alignment of homologous amino acid sequences and VcLon1 Vc:蓝莓Vaccinium corymbosum MF972079;At:拟南芥Arabidopsis thaliana NP_568490.3;Md:苹果Malus domestica XP_008388478.1;Sl:番茄Solanum lycopersicum XP_004248543.1;Vv:葡萄Vitis vinifera XP_002277956.1;Hs:人类Homo sapiens NP_001263408.1. |
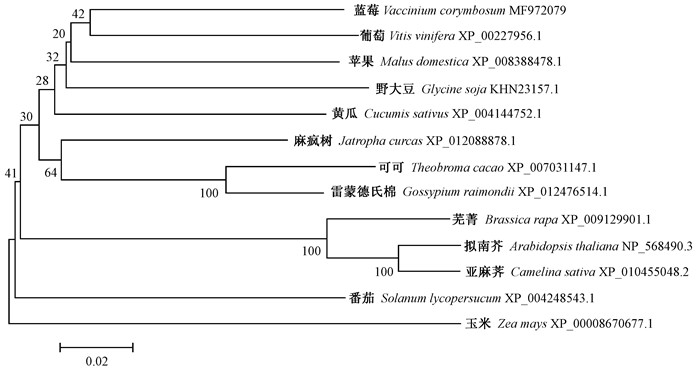
|
图 4 植物Lon1同源蛋白的系统发育树 Figure 4 Phylogenetic tree of homologous proteins of Lon1 in different plants |
采用根癌农杆菌介导的叶盘法,将VcLon1遗传转化本氏烟,经卡那霉素筛选后获得80余株本氏烟抗性植株。特异扩增本氏烟抗性植株的VcLon1,可初步鉴定VcLon1己整合至本氏烟的染色体DNA中。检测结果如图 5A,转基因烟草植株1-10中除3以外均扩增出2 982 bp的条带,WT植株则不能扩增出条带。

|
图 5 转化本氏烟抗性植株的检测 Figure 5 Analyses of transgenic tobacco plants A:PCR检测结果;B:VcLon1基因的半定量PCR分析;C:GUS染色结果。M:DL 5000 marker;1-10:转基因烟草;WT:野生型本氏烟。 A: PCR identification of transgenic tobacoo; B:Semi-quantitative PCR analysis of VcLon1 expression in the tobacco plants of transgenic line and wild type; C: Histochemical GUS staining of WT and transgenic line. M: DL 5000 marker; 1-10: Transgenic tobacco plants; WT: Wild type. |
利用半定量PCR分析外源基因VcLon1在本氏烟中的表达,发现在1、2、4和6-9抗性株系中出现了VcLon1基因条带,而在WT植株中则无该基因表达(图 5B)。各选取VcLon1转化抗性本氏烟植株叶片进行GUS染色,经脱叶绿素后1、6、7呈深蓝色,而WT植株呈浅黄绿色(图 5C),则表明在VcLon1转化抗性本氏烟植株中有大量GUS蛋白。取VcLon1转化抗性本氏烟植株1、6、7的Tl代作为后续非生物胁迫试验材料。
2.4 蓝莓VcLon1时空表达模式分析VcLon1在蓝莓嫩叶、老叶、茎、花、青果和熟果中均有表达,其中嫩叶中表达量最高,是老叶中表达量的33.33倍(图 6);熟果中的表达量与青果差别不显著;干旱胁迫下蓝莓植株叶片的VcLon1表达量显著上升,是正常植株表达量的10.02倍,表明VcLon1的表达与蓝莓的干旱胁迫生理关系密切。
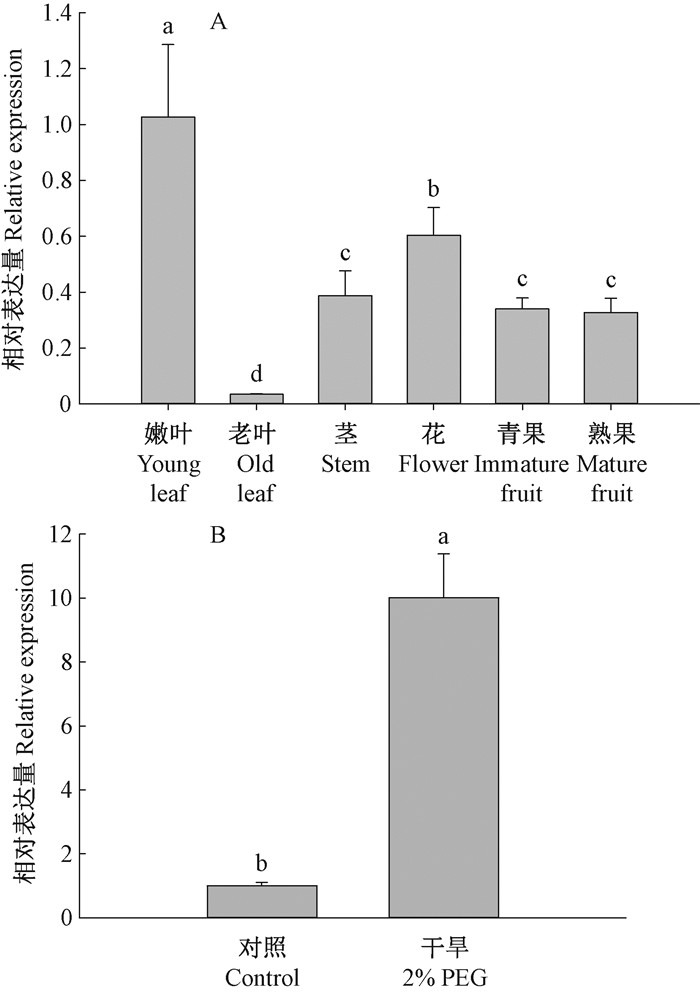
|
图 6 VcLon1在南高丛蓝莓‘夏普蓝’各组织中及干旱胁迫下的相对表达水平 Figure 6 Expression levels of VcLon1 in different tissues and in the leaves of Vaccinium corymbosum 'Sharpblue' subjected to drought stresses |
正常生长条件下,野生型植株WT和VcLon1超表达植株(VL-1、VL-6、VL-7)生长情况相似,表观形态、株高及干质量上均未出现显著差异(图 7)。干旱胁迫下各株系本氏烟生长均受到抑制,但VcLon1超表达植株均较野生型生长健壮,超表达植株又以VL-6长势最佳,叶片未发黄且根系发达,测得其株高、干质量分别比野生型高36.66%、114.29%,这表明VcLon1蛋白酶在增强植物抗旱性、维持植物正常生长方面起重要作用。
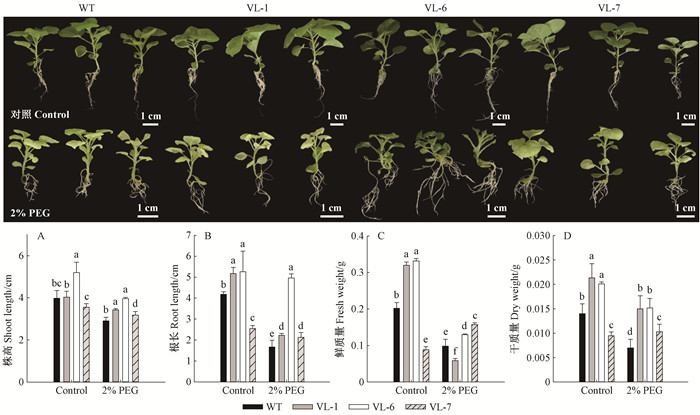
|
图 7 干旱胁迫对本氏烟超表达VcLon1转基因株系的表型及生物量生长的影响 Figure 7 The effects of drought stress on phenotype and biomass growth in tobacco transgenic lines of VcLon1 overexpression |
正常培养条件下,VcLon1超表达的3个株系和野生型(WT)本氏烟叶片的叶绿素均在1.48~1.79 mg·g-1FW范围内;经2%PEG处理后,虽然VL-7与WT未见显著差异,VL-1的叶绿素含量甚至低于WT,但VL-6植株的叶绿素含量比WT高31.96%,且转基因3株系的叶绿素均值亦显著高于WT(图 8)。因而VcLon1可能在缓解干旱胁迫条件下叶绿素的分解方面有一定的作用,有助于维持植株正常的生长。
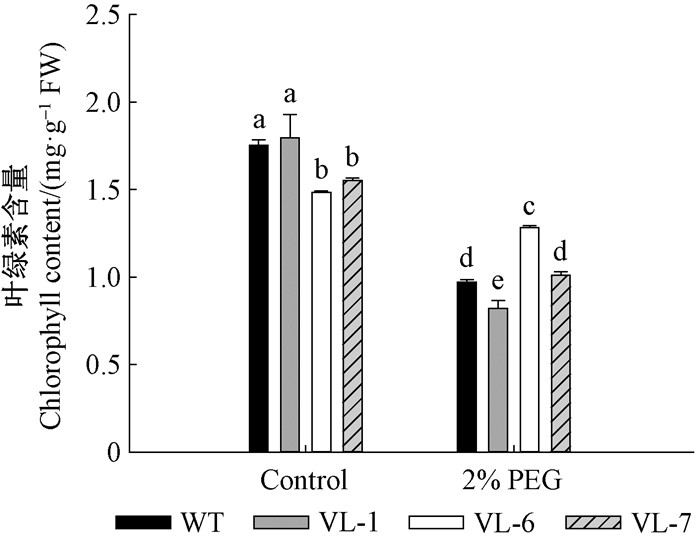
|
图 8 干旱胁迫对本氏烟超表达VcLon1转基因株系叶绿素含量的影响 Figure 8 The effects of drought stress on chlorophyll contents in tobacco transgenic lines of VcLon1 overexpression |
正常培养条件下,VcLon1超表达和野生型(WT)本氏烟叶片的相对电导率都维持在一个较低的水平,仅VL-7略有差异。10%PEG处理后导致本氏烟叶片相对电导率普遍升高(图 9),其中WT上升92.27%,VcLon1超表达本氏烟各株系上升幅度虽有一定差异,但其增幅控制在38.27%~47.36%。因而,VcLon1可能在维护植物细胞膜系统方面有一定的效果。
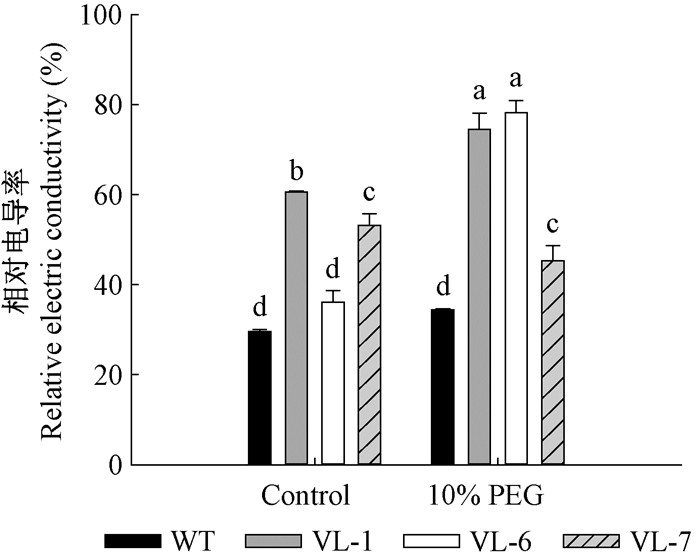
|
图 9 干旱胁迫对本氏烟超表达VcLon1转基因株系相对电导率的影响 Figure 9 The effects of drought stress on relative electric conductivity in tobacco transgenic lines of VcLon1 overexpression |
正常生长条件下,超表达植株的可溶性蛋白含量均高于野生型本氏烟。经10%PEG处理后,VL-1的可溶性蛋白含量与正常条件相比上升12.22%,VL-6、VL-7则无显著性差异,而野生型本氏烟下降17.64%(图 10A)。同样地,VcLon1超表达各株系在干旱处理条件下的脯氨酸含量均显著高于野生型本氏烟,其中VL-6比正常条件上升71.73%(图 10B)。
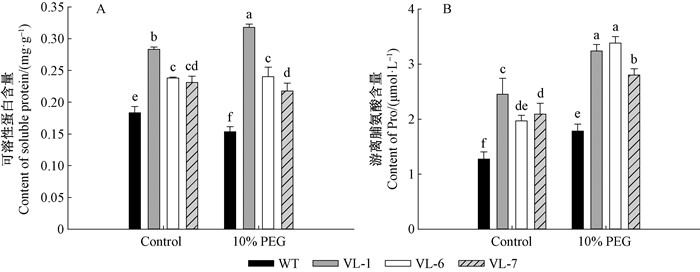
|
图 10 干旱胁迫对本氏烟超表达VcLon1转基因株系渗透调节物质含量的影响 Figure 10 The effects of drought stress on osmotic adjustment substances in tobacco transgenic lines of VcLon1 overexpression |
正常培养下,VcLon1超表达和野生型(WT)本氏烟叶片的H2O2含量、MDA含量和羰基化蛋白含量均维持在一个相对较低的水平。干旱胁迫处理下,VcLon1超表达株系H2O2含量未见显著性增加,但WT叶片H2O2积累量提高显著,褐化面积上升(图 11A)。
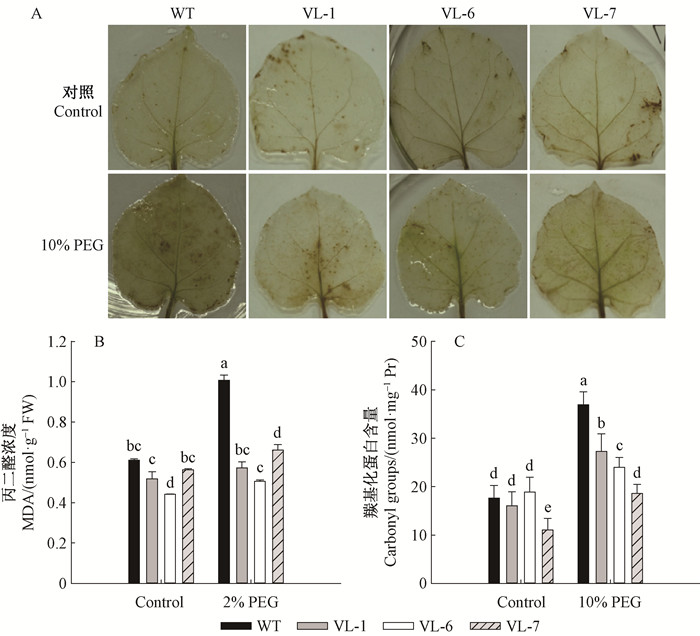
|
图 11 干旱胁迫对本氏烟超表达VcLon1转基因株系氧化水平的影响 Figure 11 Oxidative stress related parameters in tobacco transgenic lines of VcLon1 overexpression under drought stress condition A: H2O2原位染色In vivo localization of H2O2. |
丙二醛(MDA)是细胞膜脂过氧化的重要产物,干旱胁迫普遍导致本氏烟叶内MDA含量的升高(图 11B),相较而言,VcLon1超表达平均含量是相同条件下WT的57.62%;与MDA含量变化趋势类似,干旱胁迫处理的VcLon1超表达株系叶内羰基化蛋白平均含量比相同处理条件下的WT低36.89%(图 11C)。
2.10 VcLon1对本氏烟抗氧化酶系统的影响活性氧清除酶系统是植物在长期的系统进化过程中形成的细胞内防御活性氧、自由基毒害的保护机制。正常培养条件下,VcLon1超表达植株和野生型(WT)本氏烟的抗坏血酸过氧化物酶(APX)、过氧化物酶(POD)及谷胱甘肽还原酶(GR)酶活性基本无显著差异,VcLon1过表达株系中,仅VL-6株系的POD略低于其他3组。WT与VL-7株系相较于VL-1、VL-6 SOD活性较低。而干旱胁迫下,VcLon1过表达植株SOD酶活性显著升高且均高于同组WT,而WT酶活性与正常条件下所测无明显差异(图 12A)。APX酶活性与SOD类似,VcLon1过表达植株均有上升,但VL-1与WT差异不显著(图 12B)。POD酶活性除VL-6与WT无差异,VL-1、VL-7上升显著,平均升高164.56%(图 12C)。干旱胁迫下,各株系GR酶活性均显著上升,且VcLon1过表达植株酶活性上升值远大于WT,平均高出62.76%(图 12D)。
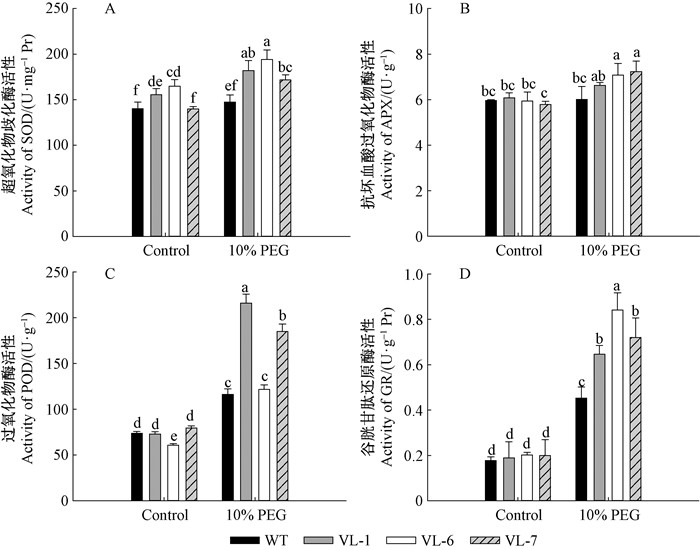
|
图 12 干旱胁迫对本氏烟超表达VcLon1转基因株系抗氧化酶系统的影响 Figure 12 Antioxidant enzymes activities in tobacco transgenic lines of VcLon1 overexpression under drought stress condition |
透射电镜下,正常培养下的各株系本氏烟叶绿体形态结构完整,基粒片层发达且紧密,叶绿体周围线粒体等细胞器形态结构完整(图 13A、B)。10% PEG处理下的VcLon1超表达本氏烟,叶绿体结构均未出现明显的损伤,部分叶绿体基粒片层空隙增大,但线粒体、过氧化物酶体等形态仍能维持正常椭球型,且内部结构保持完整(图 13D、F、H)。但在野生型本氏烟中观察到叶绿体肿胀明显且部分叶绿体基粒片层结构模糊,分层不明显,线粒体出现肿胀、变形,嵴断裂、解体并空泡化的现象(图 13C、E、G)。
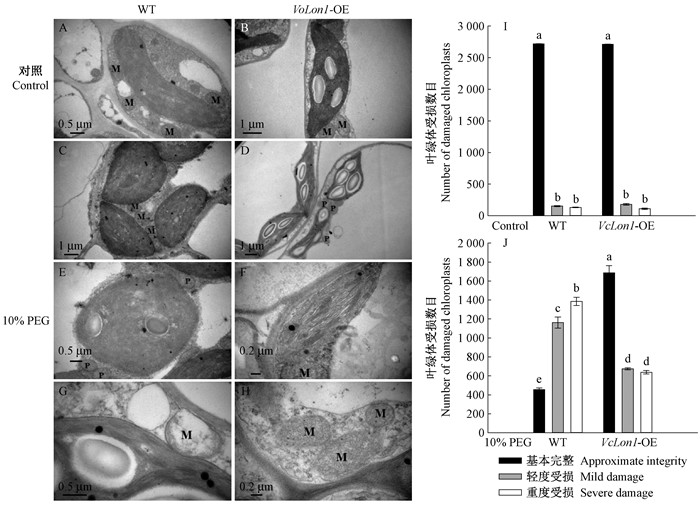
|
图 13 干旱胁迫对本氏烟超表达VcLon1转基因株系(VcLon1-OE)细胞超微结构的影响 Figure 13 The effects of drought stress on the cellular untrastructures in tobacco transgenic lines of VcLon1 overexpression (VcLon1-OE) P:过氧化物酶体; M:线粒体。P: Peroxisome; M: Mitochondrion. |
对叶绿体受损情况计数表明,正常生长条件下野生型及VcLon1超表达本氏烟中的结构受损叶绿体数均维持在一个较低的水平(图 13I)。经10%PEG处理后,野生型及VcLon1超表达本氏烟受损叶绿体数目显著上升,其中野生型中轻度、重度受损叶绿体分别达到38.71%及46.15%;而VcLon1超表达本氏烟受损叶绿体增幅较少,轻度、重度受损叶绿体仅占比22.49%、21.276%(图 13J)。说明VcLon1蛋白酶对叶绿体超微结构的维护具有重要作用。
3 讨论植物细胞中ROS的积累会导致细胞膜和DNA、蛋白质等大分子物质的氧化损伤。在植物细胞核和细胞质中,氧化蛋白质通过泛素化,并被运到26S蛋白酶体降解。而在细胞器中,没有泛素化体系,而是通过可溶性的Lon、CLP和膜结合FtsH蛋白酶家族来降解被氧化的蛋白质。本研究从南高丛蓝莓‘夏普蓝’中克隆得到一个VcLon1蛋白酶基因,其具有Lon蛋白酶的AAA+模块(AAA+ module)(图 3)。WoLF PSORT在线软件预测VcLon1蛋白酶定位于叶绿体和线粒体,在拟南芥中已验证AtLon1通过转录和翻译水平来调节定位于叶绿体和线粒体的双靶向信号(Rigas et al., 2009a)。
本研究利用qPCR对VcLon1的表达模式分析,发现其在‘夏普蓝’蓝莓各组织中均有表达,但嫩叶中的表达量要高于老叶,且干旱胁迫显著提高VcLon1的表达量(图 6)。与本文的结果相似,Lon1在拟南芥中主要于胚、初生根等生长快、耗能多的部位出现高水平表达(Rigas et al., 2014)。在生长迅速或逆境胁迫条件下,VcLon1高表达以应对代谢旺盛或胁迫导致的氧化胁迫水平的升高,也暗示VcLon1与蓝莓的抗旱关系密切。
为进一步深入揭示VcLon1的生物学功能,本研究以本氏烟为材料,进行VcLon1超表达处理。干旱胁迫条件下,VcLon1超表达株系均较野生型生长健壮,表明VcLon1蛋白酶在增强植物抗旱性、维持植物正常生长方面起重要作用。对拟南芥的研究亦表明,Lon1蛋白酶参与了幼苗的器官发生以及形态建成(Reumann, 2004; Rigas et al., 2009b)。
叶片细胞中叶绿体和线粒体是对干旱胁迫比较敏感且所负担的生理功能较为重要的2个细胞器(郁慧等, 2011)。干旱胁迫往往通过降低气孔导度抑制叶绿体光合活性,也可直接诱导叶绿体色素蛋白的破坏和降解,加快细胞坏死(Verslues et al., 2014)。本研究中,野生型本氏烟中的叶绿体肿胀明显且部分叶绿体基粒片层结构模糊,分层不明显,而VcLon1超表达本氏烟除部分叶绿体基粒片层空隙增大外,其叶绿体超微结构未出现明显的损伤(图 13C-H),且干旱条件下结构基本完整的叶绿体数高出野生型本氏烟236.53%~271.51%(图 13J)。除此之外,干旱胁迫下VcLon1超表达本氏烟的叶绿素含量较野生型降幅较小,其中VL-6植株的叶绿素含量比野生型植株高出31.96%,表明VcLon1可通过减少干旱胁迫条件下叶绿素的分解来维护光合生理的正常进行。干旱胁迫同时会造成线粒体膜的破坏、嵴的减少甚至消失而影响到三羧酸循环和生物氧化的进行,从而影响植物叶片的能量代谢(吴凯等, 2007)。本研究中,干旱处理条件下,野生型本氏烟胞内线粒体普遍出现肿胀、变形,嵴断裂、解体并空泡化的现象(图 13G),而VcLon1超表达本氏烟的线粒体仍维持正常椭球形,可见VcLon1蛋白酶对于维护线粒体结构及功能具有重要作用。
拟南芥中,lon1突变导致线粒体内热击蛋白HSP70及大量TCA循环相关蛋白的积聚,但蛋白活性却失活严重且TCA循环效率显著降低(Li et al., 2017);同时还降低线粒体内氧化磷酸化途径(OXPHOS)中多个蛋白复合体的含量及活性(Rigas et al., 2014),这些结果均表明Lon1蛋白酶的低表达会导致线粒体内氧化蛋白的积累从而造成氧化损伤,线粒体是细胞ROS生成及积聚的主要细胞器(van Wijk, 2015)。同时,VcLon1超表达植株显著提高分布于叶绿体、线粒体中的抗氧化酶活性,其中各株系SOD及GR的活性均显著高于野生型本氏烟,APX及POD的酶活性平均值显著高于野生型本氏烟,表明VcLon1蛋白酶同时能够对抗氧化酶蛋白结构进行有效质量控制,维持较高的抗氧化活性。在以上机制的共同作用下,VcLon1的超表达显著减少叶内H2O2的分布(图 11A),并使膜脂过氧化程度降低,使叶内羰基化蛋白维持在相对较低的水平(图 11C),这些结果均表明VcLon1在植物细胞内氧化胁迫调节、增强植物抗逆方面的重要作用。
4 结论干旱胁迫下,南高丛蓝莓‘夏普蓝’内VcLon1的运作机制可能是通过维护细胞膜系统及叶绿体的正常形态结构,同时通过降解线粒体内羰基化蛋白质,使线粒体结构保持完整、能量代谢等功能得以正常维护,并调节细胞内渗透调节物质含量,及维护抗氧化酶类活性,从而有效地降低细胞器内ROS的产生与积聚,并最终降低胞内的氧化胁迫水平,维持正常植物代谢,提高其抗旱能力。
冯慧芳, 薛立, 任向荣, 等. 2011. 4种阔叶幼苗对PEG模拟干旱的生理响应[J]. 生态学报, 31(2): 371-382. (Feng H F, Xue L, Ren X R, et al. 2011. Physiological responses of four broadleaved seedlings to drought stress simulated by PEG[J]. Acta Ecologica Sinica, 31(2): 371-382. [in Chinese]) |
刘晓, 金洋, 冯霞, 等. 2017. 转hpa1Xm基因烟草后代的分子检测及苗期生理生化指标测定[J]. 分子植物育种, (5): 1732-1737. (Liu X, Jin Y, Feng X, et al. 2017. Detection and determination of physiological and biochemical indexes at seedling stage in hpa1Xm-transgenic tobacco plants[J]. Molecular Plant Breeding, (5): 1732-1737. [in Chinese]) |
石慧勤, 张罗沙, 邸葆, 等. 2015. 盐碱胁迫下金叶接骨木根系K含量模型构建[J]. 林业科学, 51(9): 18-23. (Shi H Q, Zhang L S, Di B, et al. 2015. Establishment of the estimation model of K content of Sambucus canadensis root under saline-alkali stress[J]. Scientia Silvae Sinicae, 51(9): 18-23. [in Chinese]) |
吴凯, 周晓阳. 2007. 环境胁迫对植物超微结构的影响[J]. 山东林业科技, (3): 80-83. (Wu K, Zhou X Y. 2007. Effects of environmental stresses on plant ultrastructure[J]. Journal of Shandong Forestry Science and Technology, (3): 80-83. [in Chinese]) |
汪志威, 刘仁祥, 石妙妙, 等. 2016. 基于称重法的烟草伸根期抗旱性鉴定[J]. 西南农业学报, 29(4): 959-965. (Wang Z W, Liu R X, Shi M M, et al. 2016. Drought resistance of tobacco seedlings identified by weighting method at root extending stage[J]. Southwest China Journal of Agricultural Sciences, 29(4): 959-965. [in Chinese]) |
杨颖丽, 杨宁, 王莱, 等. 2007. 盐胁迫对小麦幼苗生理指标的影响[J]. 兰州大学学报:自然科学版, 43(2): 29-34. (Yang Y L, Yang N, Wang L, et al. 2007. Effect of salinity on the physiological characteristic in two wheat cultivars[J]. Journal of Lanzhou University:Natural Sciences, 43(2): 29-34. [in Chinese]) |
郁慧, 刘中亮, 胡宏亮, 等. 2011. 干旱胁迫对5种植物叶绿体和线粒体超微结构的影响[J]. 植物研究, 31(2): 152-158. (Yu H, Liu Z L, Hu H L, et al. 2011. Effect of drought stress on the ultramicrostructure of chloroplasts and mitochondria of five plants[J]. Bulletin of Botanical Research, 31(2): 152-158. DOI:10.7525/j.issn.1673-5102.2011.02.006 [in Chinese]) |
余柯达. 2016. 蓝莓VcLON2蛋白酶对植物抗逆的影响. 金华: 浙江师范大学硕士学位论文. (Yu K D. 2016. VcLoN2 is involved in abiotic stress tolerance in blueberry. Jinhua: MS thesis of Zhejiang Normal University. [in Chinese]) http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y3136761 |
Adam C, Picard M, Déquardchablat M, et al. 2012. Biological roles of the Podospora anserina mitochondrial Lon protease and the importance of its N-domain[J]. PLoS One, 7(5): e38138. DOI:10.1371/journal.pone.0038138 |
Bates L S, Waldren R P, Teare I D. 1973. Rapid determination of free proline for water-stress studies[J]. Plant & Soil, 39(1): 205-207. |
Bolwell G P, Davies D R, Gerrish C, et al. 1998. Comparative biochemistry of the oxidative burst produced by rose and French bean cells reveals two distinct mechanisms[J]. Plant Physiology, 116(4): 1379-1385. DOI:10.1104/pp.116.4.1379 |
Bota D A, van Remmen H, Davies K J A. 2002. Modulation of Lon protease activity and aconitase turnover during aging and oxidative stress[J]. FEBS Letters, 532(1/2): 103-106. |
Davey M W, Stals E, Panis B, et al. 2005. High-throughput determination of malondialdehyde in plant tissues[J]. Analytical Biochemistry, 347(2): 201-207. DOI:10.1016/j.ab.2005.09.041 |
Fryer M J, Oxborough K, Mullineaux P M, et al. 2002. Imaging of photo-oxidative stress responses in leaves[J]. Journal of Experimental Botany, 53(372): 13943-13946. |
Fukuda R, Zhang H, Kim J W, et al. 2007. HIF-1 regulates cytochrome oxidase subunits to optimize efficiency of respiration in hypoxic cells[J]. Cell, 129(1): 111-122. DOI:10.1016/j.cell.2007.01.047 |
Janska H, Piechota J, Kwasniak M. 2010. ATP-dependent proteases in biogenesis and maintenance of plant mitochondria[J]. Biochimica et Biophysica Acta (BBA)-Bioenergetics, 1797(6/7): 1071-1075. |
Johansson E, Olsson O, Nyström T. 2004. Progression and specificity of protein oxidation in the life cycle of Arabidopsis thaliana.[J]. Journal of Biological Chemistry, 279(21): 22204-22208. DOI:10.1074/jbc.M402652200 |
Li L, Nelson C, Fenske R, et al. 2017. Changes in specific protein degradation rates in Arabidopsis thaliana reveal multiple roles of Lon1 in mitochondrial protein homeostasis[J]. Plant Journal, 89(3). DOI:10.1111/tpj.13392 |
Lingard M J, Bartel B. 2009. Arabidopsis LON2 is necessary for peroxisomal function and sustained matrix protein import[J]. Plant Physiology, 151(3): 1354-1365. DOI:10.1104/pp.109.142505 |
Lynch M, Conery J S. 2000. The evolutionary fate and consequences of duplicate genes[J]. Science, 290(5494): 1151-1155. DOI:10.1126/science.290.5494.1151 |
Reumann S. 2004. Specification of the peroxisome targeting signals type 1 and type 2 of plant peroxisomes by bioinformatics analyses[J]. Plant Physiology, 135(2): 783-800. DOI:10.1104/pp.103.035584 |
Rigas S, Daras G, Sweetlove L J, et al. 2009a. Mitochondria biogenesis via Lon1 selective proteolysis:who dares to live forever[J]. Plant Signaling & Behavior, 4(3): 221-224. |
Rigas S, Daras G, Laxa M, et al. 2009b. Role of Lon1 protease in post-germinative growth and maintenance of mitochondrial function in Arabidopsis.[J]. New Phytologist, 181(3): 588-600. DOI:10.1111/j.1469-8137.2008.02701.x |
Rigas S, Daras G, Tsitsekian D, et al. 2012. The multifaceted role of Lon proteolysis in seedling establishment and maintenance of plant organelle function:living from protein destruction[J]. Physiologia Plantarum, 145(1): 215-223. DOI:10.1111/ppl.2012.145.issue-1 |
Rigas S, Daras G, Tsitsekian D, et al. 2014. Evolution and significance of the Lon gene family in Arabidopsis organelle biogenesis and energy metabolism[J]. Frontiers in Plant Science, 5(5): 533-535. |
Sellammal R, Robin S, Raveendran M. 2014. Association and heritability studies for drought resistance under varied moisture stress regimes in backcross inbred population of rice[J]. Rice Science, 21(3): 150-161. DOI:10.1016/S1672-6308(13)60177-8 |
Shah K, Kumar R G, Verma S, et al. 2001. Effect of cadmium on lipid peroxidation, superoxide anion generation and activities of antioxidant enzymes in growing rice seedlings[J]. Plant Science, 161(6): 1135-1144. DOI:10.1016/S0168-9452(01)00517-9 |
Smalle J, Vierstra R D. 2003. The ubiquitin 26S proteasome proteolytic pathway[J]. Annual Review of Plant Biology, 55(1): 555-590. |
van Melderen L, Aertsen A. 2009. Regulation and quality control by Lon-dependent proteolysis[J]. Research in Microbiology, 160(9): 645-651. DOI:10.1016/j.resmic.2009.08.021 |
van Wijk K J. 2015. Protein maturation and proteolysis in plant plastids, mitochondria, and peroxisomes[J]. Annual Review of Plant Biology, 66: 75-111. DOI:10.1146/annurev-arplant-043014-115547 |
Vashisth T, Johnson L K, Malladi A. 2011. An efficient RNA isolation procedure and identification of reference genes for normalization of gene expression in blueberry[J]. Plant Cell Reports, 30(12): 2167-2176. DOI:10.1007/s00299-011-1121-z |
Verslues P E, Lasky J R, Juenger T E, et al. 2014. Genome-wide association mapping combined with reverse genetics identifies new effectors of low water potential-induced proline accumulation in Arabidopsis[J]. Plant Physiology, 164(1): 144-159. DOI:10.1104/pp.113.224014 |
 2018, Vol. 54
2018, Vol. 54

