文章信息
- 王艳梅, 姚兵, 刘伟伟, 王丽君, 颜慧萍, 李非, 刘震
- Wang Yanmei, Yao Bing, Liu Weiwei, Wang Lijun, Yan Huiping, Li Fei, Liu Zhen
- 休眠解除后山桐子种子萌发过程中内源激素的动态变化
- Dynamic Changes of Endogenous Hormones in Seeds Germination of Idesia polycarpa after Dormancy Release
- 林业科学, 2018, 54(6): 44-52.
- Scientia Silvae Sinicae, 2018, 54(6): 44-52.
- DOI: 10.11707/j.1001-7488.20180606
-
文章历史
- 收稿日期:2017-10-20
- 修回日期:2018-04-12
-
作者相关文章
山桐子(Idesia polycarpa)是大风子科(Flacourtiaceae)山桐子属(Idesia)落叶乔木,广泛分布于东亚暖温带与亚热带,层状树冠美观,红果鲜艳,含油率高达26%~45%,富含不饱和脂肪酸,被誉为“美丽的树上油库”,也是良好的园林绿化观赏树种和木本油料树种(代莉,2014)。但山桐子种子自然发芽率低,天然分布多为散生,种群数量稀少。研究发现,分布于日本冲绳与三重县的山桐子种子均具有冬休眠特性,解除其休眠的有效低温范围5~15 ℃,其中10~15 ℃效果最佳,可使发芽率最高达到80%以上(刘震,2000);浸种、添加植物生长调节剂(李淑娴等,2015)、脱蜡、低温湿沙处理(周静波等,2015)以及4 ℃湿沙贮藏(唐晓姗等,2013)等方法可以提高种子的发芽率,但效果均不理想,这可能与休眠解除效果及发芽温度有关。影响种子休眠与萌发的因素较多(于敏等,2016),其中植物激素是调控种子萌发过程中最重要的内源因素(陈香波等,2017;Pawlowski et al, 2016),ABA多为抑制因素,GA3多为促进因素(吴君等,2013;陈疏影等,2011)。与芽休眠具有相似性质的冬芽休眠也是受到激素的调控,悬铃木(Platanus acerifolia)冬芽芽鳞中ABA含量的增加是决定冬芽休眠深度的关键因素, 但叶原基休眠的导入仅与ZR/ABA, IAA/ABA关系密切, 而GA3含量的变化可能与休眠的解除有关(赵俊勇等,2009);泡桐(Paulownia)顶芽由于ABA和IAA、GA3、ZR内源激素含量均降低导致顶芽死亡(王艳梅等,2012)。林木种子和芽休眠都与内源激素具有着密切的关系,低温处理可以明显减少促进休眠内源激素的含量,增加解除休眠内源激素的含量,进而促进种子和芽萌发。置床种子的初始内源激素状态决定着种子能否萌发,经历低温时间长短决定着休眠解除的程度,也决定着内源激素的水平,会直接影响到萌发过程中内源激素的变化动态。探讨解除到不同休眠深度的种子在萌发过程中内源激素的动态变化对丰富种子休眠与催芽理论具有着重要的理论价值和实际意义,本文研究休眠解除后山桐子种子萌发过程中的内源激素的变化,为明确山桐子种子萌发机制提供依据,也为其繁育与开发应用提供理论基础及技术支撑。
1 材料与方法 1.1 试验材料山桐子果实于11月上旬采摘于河南省济源西北部太行山南麓(35°12′N,112°23′E)济源市蟒河林场,属于暖温带大陆性季风型气候,较寒冷干燥。果实于室内阴干后调制。山桐子种子千粒质量为3.7 g。
1.2 试验方法将湿润的种子置于人工气候箱(LRH-250-GSⅠ)中,5 ℃条件下分别处理0、20、40、60天,以自然状态保存0、20、40、60天的种子为对照(CK)。然后将低温处理过的种子置于培养皿中分别于人工气候箱变温下(15 ℃/25 ℃,即夜温15 ℃、昼温25 ℃,各12 h)与恒温25 ℃下进行发芽试验。每个培养皿置100粒种子,每个处理3次重复。在发芽过程中,每4天采集1次种子样品液氮速冻后于-80 ℃保存,用于山桐子内源激素含量的测定。内源激素的测定采用酶联免疫吸附法(梁艳等,2016),分别测定吲哚乙酸(IAA)、脱落酸(ABA)、赤霉素(GA3)、玉米素核苷(ZR)的含量,每个处理3次重复。
1.3 数据处理利用Excel软件计算山桐子发芽率的均值标准差、各内源激素含量的比值和均值。利用IBM SPSS Statistics 19软件对山桐子种子发芽率进行方差分析(ANOVE),差异显著性运用Duncan’s检验进行多重比较,对5 ℃低温处理不同天数后山桐子种子内源激素与发芽率进行相关性分析。利用OriginPro 8对数据处理作图。
2 结果与分析 2.1 不同处理下山桐子种子的发芽率由表 1可知,5 ℃低温处理20、40和60天后,在变温(15 ℃/25 ℃)下发芽率分别为36.7%、80.3%、90.7%和98.0%,而恒温(25 ℃)下的发芽率均不足10%;未经低温处理的种子在变温下的发芽率不足40%,恒温下不足5%。可见,5 ℃低温能有效解除种子的休眠,处理天数越多,休眠解除效果越好,其发芽率可能越高。休眠解除后,变温下的发芽率高于恒温下的发芽率,其中5 ℃低温处理60天的山桐子种子在15 ℃/25 ℃下的发芽率最高,可达98.0%;而恒温下的发芽率均低于10%。方差分析知,5 ℃处理不同天数后在变温下的种子发芽率差异性极显著(P<0.01)。
|
|
由图 1可知,未经低温处理的种子,发芽过程持续了28天。在变温(15 ℃/25 ℃)及恒温(25 ℃)下,IAA含量整体呈下降且变化趋势较为一致;ABA含量整体也呈下降趋势,但变温下波动较大而恒温下变化较平缓。GA3与ZR含量在变温下分别呈上升—下降与上升—下降—上升趋势。
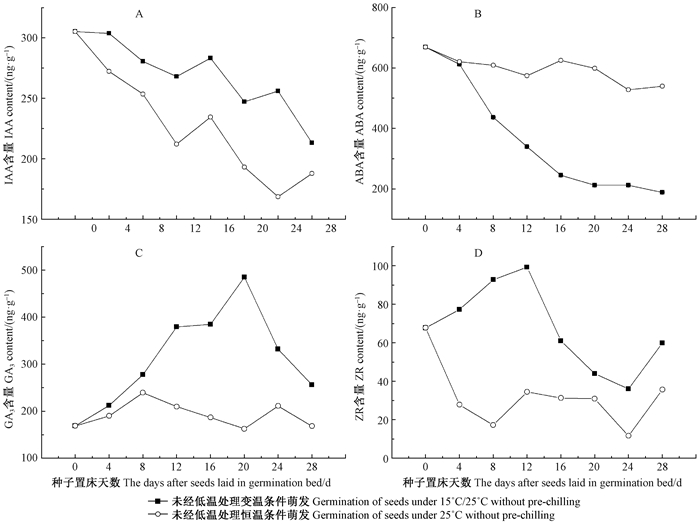
|
图 1 未经低温处理的山桐子种子在发芽过程中内源激素含量的变化 Figure 1 The content dynamics of endogenous hormones of I. polycarpa seeds in the process of germination without pre-chilling |
未经低温处理的种子在变温下的IAA、GA3和ZR的含量均高于恒温下的含量,且差异显著(P<0.05);而变温下ABA的含量低于恒温下ABA的含量且差异极显著(P<0.01)。可见,变温能够显著改变内源激素的含量,进而可能影响到种子的萌发。
2.3 5 ℃低温处理20天的山桐子种子在发芽过程中内源激素的变化由图 2可知,5 ℃低温处理20天后的种子发芽过程持续20天,比未经低温处理的种子发芽持续时间少8天。不同处理下,IAA含量整体呈下降趋势,其中5 ℃低温处理20天、在变温(15 ℃/25 ℃)下呈下降—上升—下降的趋势,在12天时达到最大值345.15 ng·g-1,且在12天时与其他3个处理间差异极显著(P<0.01)。ABA含量变化趋势基本一致,置床0~4天的ABA含量下降幅度较大,4~20天变化比较平缓,而低温处理20天在变温(15 ℃/25 ℃)下含量最低。5 ℃处理后的种子在变温与恒温(25 ℃)下,GA3含量在均呈上升—下降的趋势;ZR含量分别呈上升—下降与下降的趋势,其中变温下、置床第8天时达到最高值90.90 ng·g-1,且与其他处理间差异极显著(P<0.01)。

|
图 2 5℃低温处理20天后的山桐子种子在发芽过程中内源激素含量的变化 Figure 2 The content dynamics of endogenous hormones of I. polycarpa seeds in the process of germination with 20 day pre-chilling |
由图 3可知,经5 ℃处理40天后的山桐子种子,发芽过程持续16天,比未经低温处理少12天,比低温处理20天后的少4天。低温处理后的种子在变温(15 ℃/25 ℃)与恒温(25 ℃)下,IAA含量整体呈上升—下降与下降—上升—下降的趋势且均于置床8天达到峰值,分别为448.58、287.29 ng·g-1;未经低温处理的种子变温与恒温下,IAA含量呈“上升—下降—上升”趋势。ABA含量在不同处理下均呈下降—上升的趋势,置床0~4天的ABA含量下降幅度较大,其中低温处理40天、变温下,在8~16天含量较低且与其它处理间差异极显著(P<0.01)。经5 ℃低温处理40天后的种子在变温下,GA3与ZR含量均呈上升—下降的趋势,分别在12天与4天达到高峰分别为370.47、122.83 ng·g-1,且与其他处理间差异极显著(P<0.01)。

|
图 3 5℃低温处理40天时山桐子种子在发芽过程中内源激素含量的变化 Figure 3 The content dynamics of endogenous hormones of I. polycarpa seeds in the process of germination with 40 day pre-chilling |
由图 4可知,经5 ℃处理60天山桐子种子的发芽过程持续了16天,与处理40天持续时间基本相同。低温处理后的种子在变温(15 ℃/25 ℃)下与恒温(25 ℃)下,IAA含量均呈下降—上升—下降的趋势,其中在变温下第8天时IAA含量达到最高为360.75 ng·g-1,与其他处理间差异极显著(P<0.01);未经低温处理(CK)的种子,在变温与恒温下,IAA含量分别呈上升—下降—上升与下降—上升—下降的趋势。置床0~4天时,ABA含量下降幅度较大,其中低温处理、变温发芽下,在4~16天含量低且与其他处理间差异极显著(P<0.01)。低温处理后变温下,GA3含量呈上升—下降—上升的趋势,8天时含量达到最高381.78 ng·g-1与其他处理间差异极显著(P<0.01),恒温下,GA3含量呈下降—上升—下降的趋势。未经低温的种子,变温与恒温下,GA3含量整体呈下降的趋势。5 ℃低温处理60天时山桐子种子,在变温与恒温下,ZR含量呈上升—下降的趋势。未经低温处理的种子,变温与恒温下,ZR含量内整体呈下降的趋势。

|
图 4 5℃低温处理60天时山桐子种子在发芽过程中内源激素含量的变化 Figure 4 Content dynamics of endogenous hormones of I. polycarpa seeds in the process of germination with 60 day pre-chilling |
由图 5可知,变温(15 ℃/25 ℃)发芽下的(IAA+ GA3+ZR)/ABA比值高于其恒温(25 ℃)下的比值(CK);低温处理过的比值整体大于未经低温处理的比值。低温处理不同天数后,均为5 ℃处理后(含0天)在变温15℃/25 ℃下(IAA+GA3+ZR)/ABA比值最大,其中低温处理0、20、40和60天的山桐子种子在变温的发芽过程中,(IAA+GA3+ZR)/ABA均呈上升—下降的趋势,分别在第20、12、8和8天达到最大值。
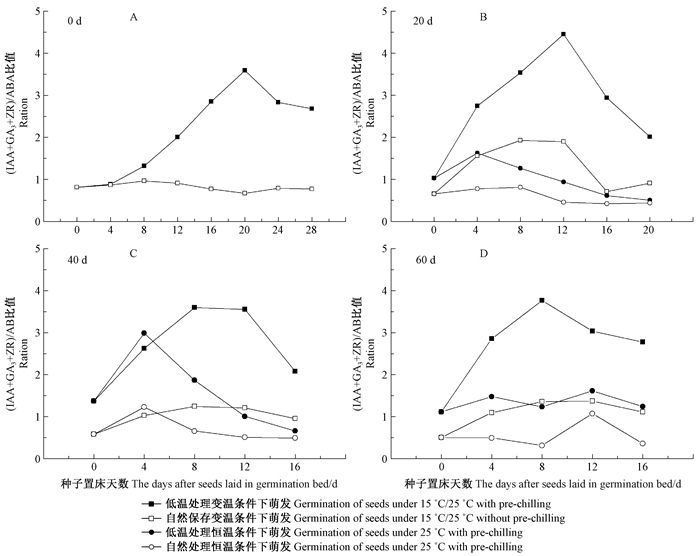
|
图 5 5℃低温处理不同天数时山桐子种子在发芽过程中(IAA+GA3+ZR)/ABA含量的变化 Figure 5 The changing of (IAA+GA3+ZR)/ABA of I. polycarpa seeds in the process of germination after pre-chilling |
由图 6可知,低温处理0、20、40和60天后的山桐子种子在变温(15 ℃/25 ℃)与恒温(25 ℃)下的发芽过程中,GA3/ABA整体呈上升—下降;未经低温处理的种子(CK)在变温与恒温下的发芽过程中,GA3/ABA整体呈上升—下降—上升的趋势。变温下的GA3/ABA比值大于恒温下的比值,低温处理过的比值大于CK下的比值,其中以低温处后变温下发芽的GA3/ABA比值较大,0、20、40和60天处理种子的GA3/ABA比值高峰分别在20、12、12和8天出现。
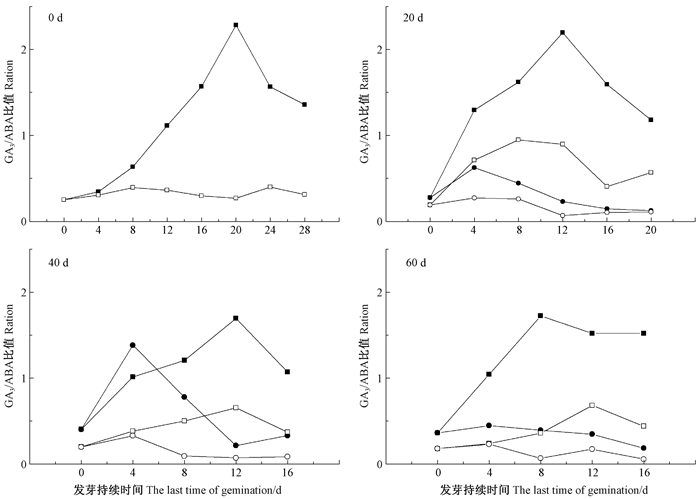
|
图 6 5℃低温处理不同天数后山桐子种子在发芽过程中GA3/ABA含量的变化 Figure 6 The changing of GA3/ABA of I. polycarpa seeds in the process of germination after pre-chilling |
低温处理后的山桐子种子发芽率均与GA3/ABA及(IAA+GA3+ZR)/ABA的比值呈显著或极显著正相关(表 2)。ABA与发芽率相关性虽不显著,但影响却为明显的抑制作用,而IAA、ZR及GA3与发芽率在不同处理下表现出不同的相关性,但均为明显的促进作用。
|
|
植物长期生存进化的结果必然适应其环境,而生境条件最终将有利于种子解除休眠、促进萌发和生长(王桔红等,2015),因此种子萌发所需的温度条件与其起源地生态条件密切有关(李雄等,2014)。5 ℃低温处理60天的济源山桐子种子在变温(15 ℃/25 ℃)下的发芽率可达98.0%,而没有经历低温处理的山桐子种子即使在变温条件下发芽率也仅有33%~37%,说明山桐子种子具有冬休眠的特性,5 ℃低温可以解除山桐子种子的休眠,这与作者以前的研究结果相同(王艳梅等,2015),而与5 ℃低温效果较差而10~15 ℃低温才能有效解除日本冲绳种源山桐子休眠不同(刘震,2000),说明济源的山桐子种子休眠是在长期适应冬季寒冷干燥的大陆性季风气候下获得的,而冲绳山桐子的休眠是在长期适应冬季温暖湿润海洋性气候下获得的;济源山桐子在恒温下无论是否经历低温处理发芽率均低于10%,这与其他种源山桐子种子相同(王艳梅等,2015;劉震,2000),也与水曲柳(Fraxinus mandshurica)种子萌发的最佳条件为变温一致(张鹏等,2007),说明种子休眠和萌发是种子的2种发育状态,两者既彼此联系又相互区别(帅海威等,2016),种子休眠解除是种子萌发的前提条件,但要启动种子萌发需要满足其萌发温度的要求,不同树种适宜萌发温度也是不同的。
3.2 山桐子种子萌发过程中内源激素的动态变化植物激素是调控种子萌发过程中最重要的内源因素,温度可影响种子内源激素的变化,继而影响到种子萌发。本研究发现,变温15℃/25℃条件下济源山桐子种子内源激素IAA、GA3、ZR含量均明显高于恒温(25℃),而ABA含量正好相反,变温提高了促进种子萌发内源激素含量,降低了抑制种子萌发的内源激素,使得种子内源激素平衡打破,(IAA+ GA3+ZR)/ABA或GA3/ABA比值变大,向种子萌发方向发展。这与前人在对紫椴(Tilia amurensis) (杨立学等,2012)、青钱柳(Cyclocarya paliurus) (杨万霞等,2008)及红豆杉(Taxus chinensis var. ‘mairei’) (张艳杰等,2007)等种子萌发研究结果基本一致。
低温解除山桐子休眠的作用反应在变温萌发条件下促进种子萌发的内源激素(IAA+GA3+ZR)与抑制种子萌发的内源激素(ABA)比值升高达到峰值的时间长短,当峰值缩短到8天时,发芽率最大。该现象说明低温解除山桐子种子休眠的效果在于变温萌发温度下快速提高促进萌发的内源激素含量和降低抑制激素含量,从而及早达到最大比值,一旦达到峰值滞后,就会导致种子萌发困难。这与种子休眠与萌发的节点由ABA控制(Léon-Kloosterziel et al., 1996;Feurtado et al., 2007;Albertos et al., 2015)的结果不同,也不是通过ABA与GA3互相抑制对方合成来决定种子萌发过程(Shu et al., 2016;Dekkers et al., 2016)。
4 结论25 ℃恒温条件下,济源山桐子种子难于萌发;在15 ℃/25 ℃变温条件下,未低温处理的山桐子种子发芽率为33.3%~36.7%,5 ℃低温预处理可以显著提高其发芽率,低温处理时间越长发芽率越高,60天的低温处理使种子发芽率达到98%,济源山桐子种子具有明显的冬休眠特征;与恒温相比,变温条件下可以显著提高促进种子萌发的内源激素IAA、GA3及ZR含量,减少抑制萌发内源激素ABA的含量;不同低温处理时间影响到山桐子种子在萌发过程中(IAA+GA3+ZR)/ABA以及GA3/ABA比值升高达到峰值的时间,经历低温处理时间越长,比值达到峰值的时间越早,当达到峰值缩短到第8天时,发芽率达到最高。低温解除休眠的作用在于使种子在萌发过程中及早达到内源激素的平衡态。
陈疏影, 尹品训, 杨艳琼, 等. 2011. 变温层积对解除滇重楼种子休眠及其内源激素变化的研究[J]. 中草药, 42(4): 793-795. (Chen S Y, Yin P X, Yang Y Q, et al. 2011. Rule of breaking Paris polyphylla var. yunnanensis seed dormancy under fluctuating temperature stratification and content changes of endogenous hormone[J]. Chinese Traditional and Herbal Drugs, 42(4): 793-795. [in Chinese]) |
陈香波, 刘杨, 赵明水, 等. 2017. 极度濒危树种羊角槭的种胚发育与休眠解除[J]. 林业科学, 53(4): 65-73. (Chen X B, Liu Y, Zhao M S, et al. 2017. Embryo development and dormancy releasing of Acer yangjuechi, the extremely endangered plant[J]. Scientia Silvae Sinicae, 53(4): 65-73. DOI:10.11707/j.1001-7488.20170408 [in Chinese]) |
代莉. 2014. 山桐子种实地理变异研究. 郑州: 河南农业大学博士学位论文. (Dai L. 2014. Study on geographic variation of fruit and deed of Idesia Polycarpa Maxim. Zhengzhou: PhD thesis of Henan Agricultural University. [in Chinese]) |
李淑娴, 兰思仁, 吴沙沙, 等. 2015. 浸种时间及植物生长调节剂对山桐子种子萌发的影响[J]. 种子, 34(4): 8-12. (Li S X, Lan S R, Wu S S, et al. 2015. Effects of soaking time and plant growth regulators on germination of Idesia polycarpa seeds[J]. Seed, 34(4): 8-12. [in Chinese]) |
李雄, 尹欣, 杨时海, 等. 2014. 温度对高山植物紫花针茅种子萌发特性的影响[J]. 植物分类与资源学报, 36(6): 698-706. (Li X, Yin X, Yang S H, et al. 2014. Effects of temperatures on seed germination characteristics of alpine plant Stipa purpurea (Poaceae)[J]. Plant Diversity and Resources, 36(6): 698-706. [in Chinese]) |
梁艳, 沈海龙, 高美玲, 等. 2016. 红松种子发育过程中内源激素含量的动态变化[J]. 林业科学, 52(3): 105-111. (Liang Y, Shen H L, Gao M L, et al. 2016. Content dynamics of endogenous hormones in different seed developmental stages of Korean pine[J]. Scientia Silvae Sinicae, 52(3): 105-111. [in Chinese]) |
劉震. 2000. 亜熱帯域に分布するイイギリの休眠に関する研究[J]. 三重大学生物資源学部演習林報告, 24: 107-161. (Liu Z. 2000. Studies on the dormancy in Idesia Polycarpa distributing in the subtropical zone[J]. Bulletin of the Mie University Forests, 24: 107-161. [in Chinese]) |
帅海威, 孟永杰, 罗晓峰, 等. 2016. 生长素调控种子的休眠与萌发[J]. 遗传, 38(4): 314-322. (Shuai H W, Meng Y J, Luo X F, et al. 2016. The roles of auxin in seed dormancy and germination[J]. Hereditas, 38(4): 314-322. [in Chinese]) |
唐晓姗, 叶扬, 安小龙, 等. 2013. 不同贮藏方法对山桐子种子发芽的影响[J]. 种子, 32(12): 16-20. (Tang X S, Ye Y, An X L, et al. 2013. Effect of different storage methods on seeds germination of Idesia polycarpa[J]. Seed, 32(12): 16-20. DOI:10.3969/j.issn.1001-4705.2013.12.005 [in Chinese]) |
王桔红, 陈文. 2015. 5种马鞭草科植物种子萌发对低温层积和干燥贮藏的响应及其更新对策[J]. 生态学杂志, 34(12): 3313-3318. (Wang J H, Chen W. 2015. Seed germination responses of five Verbenaceae species to cold stratification and dry storage at room temperature and implications for regenerative strategies[J]. Chinese Journal of Ecology, 34(12): 3313-3318. [in Chinese]) |
王艳梅, 刘震, 牛晓锋. 2012. 1年生泡桐不同部位顶芽内源激素的动态变化[J]. 林业科学, 48(7): 61-65. (Wang Y M, Liu Z, Niu X F. 2012. Dynamic changes of endogenous hormones in terminal buds from different crown position of one-year-old Paulownia[J]. Scientia Silvae Sinicae, 48(7): 61-65. DOI:10.11707/j.1001-7488.20120710 [in Chinese]) |
王艳梅, 王海洋, 代莉, 等. 2015. 不同低温处理对12个种源山桐子种子休眠解除的影响[J]. 山东农业大学学报:自然科学版, 46(1): 51-56. (Wang Y M, Wang H Y, Dai L, et al. 2015. Effect of different low temperature treatments on breaking Idesia polycarpa seed dormancy among 12 provenances[J]. Journal of Shandong Agricultural University:Natural Science Edition, 46(1): 51-56. [in Chinese]) |
吴君, 李因刚, 罗修宝, 等. 2013. 白花树种子处理过程中内源激素动态变化[J]. 江西农业大学学报, 35(5): 988-992. (Wu J, Li Y G, Luo X B, et al. 2013. Dynamic changes of endogenous hormones in Styrax tonkinensis seed during the treatment process[J]. Acta Agriculturae Universitatis Jiangxiensis, 35(5): 998-992. [in Chinese]) |
杨立学, 王海南, 张琳. 2012. 低温层积过程中紫椴种子内源激素含量的变化[J]. 经济林研究, 30(2): 15-18. (Yang L X, Wang H N, Zhang L. 2012. Changes of endogenous hormone content in Tilia amurensis seeds during cold stratification[J]. Nonwood Forest Research, 30(2): 15-18. [in Chinese]) |
杨万霞, 方升佐. 2008. 青钱柳种子综合处理过程中内源激素的动态变化[J]. 南京林业大学学报:自然科学版, 32(5): 85-88. (Yang W X, Fang S Z. 2008. Dynamic changes of endogenous hormones in Cyclocarya paliurus seed during stratification[J]. Journal of Nanjing Forestry University:Natural Science Edition, 32(5): 85-88. [in Chinese]) |
于敏, 徐恒, 张华, 等. 2016. 植物激素在种子休眠与萌发中的调控机制[J]. 植物生理学报, 52(5): 599-606. (Yu M, X H, Zhang H, et al. 2016. Regulation of plant hormones on seed dormancy and germination[J]. Plant Physiology Communications, 52(5): 599-606. [in Chinese]) |
张鹏, 孙红阳, 沈海龙. 2007. 温度对经层积处理解除休眠的水曲柳种子萌发的影响[J]. 植物生理学通讯, 43(1): 21-24. (Zhang P, Sun H Y, Shen H L. 2007. Effect of temperature on germination of stratified seeds of Fraxinus mandshurica Rupr[J]. Plant Physiology Communications, 43(1): 21-24. [in Chinese]) |
张艳杰. 2007. 南方红豆杉种子休眠机理的研究. 南京: 南京林业大学博士学位论文. (Zhang Y J. 2007. Studies on seed dormancy mechanism of Taxus chinensis var. mairei. Nanjing: PhD thesis of Nanjing Forestry University[in Chinese]) |
赵俊勇, 朱平乐, 王艳梅, 等. 2009. 悬铃木冬芽休眠过程中内源激素的动态变化研究[J]. 河南农业大学学报, 43(3): 269-273. (Zhao J Y, Zhu P L, Wang Y M, et al. 2009. Dynamic change of endogenous hormones inside buds in Platanus acerifolia during winter dormancy[J]. Journal of Henan Agricultural University, 43(3): 269-273. [in Chinese]) |
周静波, 江源, 赵子睿, 等. 2015. 脱蜡和低温湿沙处理对毛叶山桐子种子的萌发及相关酶生理生化特征的影响[J]. 安徽农业大学学报, 42(2): 159-164. (Zhou J B, Jiang Y, Zhao Z R, et al. 2015. Improvement of seed germination of Idesia polycarpa by dewaxing and low temperature treatment in moist sand[J]. Journal of Anhui Agricultural University, 42(2): 159-164. [in Chinese]) |
Albertos P, Romero-Puertas M C, Tatematsu K, et al. 2015. S-nitrosylation triggers ABI5 degradation to promote seed germination and seedling growth[J]. Nature Communications, 6: 8669. DOI:10.1038/ncomms9669 |
Dekkers B J, He H, Hanson J, et al. 2016. The arabidopsis delay of germination 1 gene affects abscisic acid insensitive5 (ABI5) expression and genetically interacts with ABI3 during Arabidopsis seed development[J]. The Plant Journal, 85(4): 451-465. DOI:10.1111/tpj.13118 |
Feurtado J A, Yang J, Ambrose S J, et al. 2007. Disrupting abscisic acid homeostasis in western white pine (Pinus monticola Dougl.Ex D. Don) seeds induces dormancy termination and changes in abscisic acid catabolites[J]. Journal of Plant Growth Regulation, 26(1): 46-54. DOI:10.1007/s00344-006-0035-4 |
Léon-Kloosterziel K M, Van de Bunt G A, Zeevaart J A, et al. 1996. Arabidopsis mutants with a reduced seed dormancy[J]. Plant Physiol, 110: 233-240. DOI:10.1104/pp.110.1.233 |
Pawlowski T A, Staszak A M. 2016. Analysis of the embryo proteome of sycamore (Acer pseudoplatanus L.) seeds reveals a distinct class of proteins regulating dormancy release[J]. Plant Physiol, 195(5): 9-22. |
Shu K, Liu X D, Xie Q, et al. 2016. Two faces of one seed:hormonal regulation of dormancy and germination[J]. Molecular Plant, 9(1): 34-45. DOI:10.1016/j.molp.2015.08.010 |
 2018, Vol. 54
2018, Vol. 54

