文章信息
- 郭晓燕, 温婷, 张露, 杜天真, 吴南生, 付立
- Guo Xiaoyan, Wen Ting, Zhang Lu, Du Tianzhen, Wu Nansheng, Fu Li
- 毛红椿落叶腐解物的化感作用及成分
- Allelopathy and Chemical Composition of Decomposing Products from Leaf Litter of Toona ciliata var. pubescens
- 林业科学, 2018, 54(6): 24-32.
- Scientia Silvae Sinicae, 2018, 54(6): 24-32.
- DOI: 10.11707/j.1001-7488.20180604
-
文章历史
- 收稿日期:2017-08-08
- 修回日期:2017-11-28
-
作者相关文章
2. 江西农业大学生物科学与工程学院 南昌 330045
2. College of Bioscience and Bioengineering, Jiangxi Agricultural University Nanchang 330045
毛红椿(Toona ciliata var. pubescens)为楝科(Meliaceae)香椿属落叶速生乔木,国家二级保护濒危物种,约在20龄左右开始结实,11月初复叶开始枯落,11月底蒴果成熟开裂并在较短时间内集中落种,翌年2—3月种子萌发。毛红椿种子具薄翅,易传播,种子发芽率较高,实验室种子发芽率可达60% ~90%,大田播种出苗率为30% ~60%(黄红兰等,2012;郭晓燕等2016)。黄红兰等(2013)调查发现,江西省九连山毛红椿天然林分中近结实母株处仅有少许实生幼苗,且均难以存活,而远离结实母株数米甚至数十米外可见其实生幼苗;毛红椿天然林内通常有2~4 cm厚的枯落物,种子主要落在其枯枝落叶层和腐殖质层。当毛红椿种子被枯枝落叶物覆盖时,出苗率随着枯枝落叶物厚度的增加而降低,枯枝落叶物厚度≥2 cm显著降低出苗率(郭晓燕等,2014),这表明除自身种子活力和枯落物的机械障碍因素外,种子萌发和幼苗建成还可能受到枯落物化感作用的影响。
植物间的化感作用是植物个体(供体)通过挥发、淋溶、根系分泌和残体分解等途径,向环境释放化学物质,从而对环境中其他植物个体(受体)产生直接或间接的有害或有益的作用(Rice,1984;Kimura et al., 2015)。枯枝落叶及残体腐解是化感成分的主要来源,枯枝落叶中的化感成分在土壤微生物的作用下逐步向环境释放,且在不同腐解阶段,源植物的化感成分对受体的化感效应将随着释放的化感成分的变化而变化,这一结果已被诸多学者证实(Bonanomi et al., 2006;Fernandez et al., 2008;张如义等,2016)。化感物质可促进或抑制种子的萌发过程,对于植物的生长发育、植物群落的组成与分布以及生态系统的平衡有着重要影响(陈锋等,2017)。本文通过发芽试验及气相色谱质谱联用技术(GC-MS),研究毛红椿落叶腐解物浸提液及其化学成分对种子萌发和幼苗建成的影响,旨在探讨化感物质对毛红椿天然实生更新影响,为阐明毛红椿濒危机制提供理论依据。
1 材料与方法 1.1 试验材料2015年11月,在江西农业大学毛红椿人工林收集尚未接触地表的毛红椿落叶,带回实验室备用。同时,采集该毛红椿人工林非根际表层土(以下简称林地土),去除杂质,风干后过60目筛,土样备用。新鲜河沙过筛烘干备用。毛红椿种子采自江西农业大学校园内结实母树,千粒质量6.080 g。
1.2 试验方法 1.2.1 毛红椿落叶腐解设置3种处理,A-1:500 g毛红椿落叶;B-1:100 g毛红椿落叶和2 500 g林地土混合;C-1:2 500 g林地土。分别加适量蒸馏水充分混合后,装入黑色腐解桶内避光腐解,腐解过程在室内进行,腐解期间每隔15天向3个黑色腐解桶内各浇1次清水,每次100 mL,腐解3个月后,得到3种腐解物,A-2:腐叶(毛红椿落叶腐解物);B-2:腐叶土(毛红椿落叶林地土混合后腐解物);C-2:林地土腐解物。将3种腐解物分别阴干后备用。
1.2.2 毛红椿落叶腐解物浸提液的制备将A-2、B-2和C-2分别用无水乙醇:丙酮:水=2:2:1(V:V:V)混合溶液浸泡2天,经过滤、离心除去残渣,用旋转蒸发仪(60 ℃,0.8~1.0 MP)浓缩后,蒸馏水定容至浓度为2 000 g·L-1的母液,分别为A:腐叶浸提液;B:腐叶土浸提液;C:林地土浸提液。
1.2.3 生物检测设置3种处理对于3种浸提液处理(A:腐叶浸提液;B:腐叶土浸提液;C:林地土浸提液),每种设置2种浸提液浓度(10 g·L-1和1 000 g·L-1),共6个处理,其中C为对照CK:A1为低浓度腐叶浸提液,A2为高浓度腐叶浸提液,B1为低浓度腐叶土浸提液,B2为高浓度腐叶土浸提液,CK1为低浓度林地土浸提液,CK2为高浓度林地土浸提液,每处理重复3次。每发芽盒装3 cm厚河沙,加入相应浸提液,保持湿润,放入100粒毛红椿种子,置光照培养箱内发芽(温度25 ℃,光照时间段8:00—16:00),每天加15 mL浸提液,并记录和观察种子萌动情况、幼苗发生个数。种子萌动以胚根突破种皮为准,成苗标准为形成完整的幼苗。第30天测量幼苗根长、茎长及幼苗鲜质量和干质量。计算种子发芽率、发芽势、发芽指数、幼苗存活率、化感指数。
| $ \begin{array}{l} 种子发芽率\left(\% \right) = \left({种子发芽数/种子数} \right)\\ \times 100\% 。\\ 发芽势\left(\% \right) = \left({日最高发芽种子数/种子数} \right)\\ \times 100\% 。\\ 发芽指数\left({GI} \right) = \sum {\left({Gt/Dt} \right)} 。Dt为发芽日数, \\ Gt为与{\text{Dt}}相对应的每天发芽种子数。\\ 存活率\left(\% \right) = \left({试验结束时存活幼苗数/种子发芽数} \right)\\ \times 100\% 。\end{array} $ |
用Wiliamson等(1988)提出的敏感指数(RI)来度量不同浸提液对种子及幼苗的化感效应,其表达式为:RI=1-C/T(T≥C)或RI=T/C-1(T<C),式中,T为处理值,C为对照值,RI>0表示促进作用,RI<0表示抑制作用,RI的绝对值代表化感作用强度的大小。
1.2.4 毛红椿落叶腐解浸提液成分的GC-MS分析将A和B母液分别用丙酮进行萃取分离,获得溶于丙酮的弱极性化感成分,定容,0.45 μm滤膜过滤后用于GC-MS分析。GC-MS分析:测定仪器为安捷伦7890AGC(Agilent,美国),安捷伦5975C质谱(Agilent,美国),GC-MS系统配自动进样器,氦(纯度99.999%)用作载气,流速为1.0 mL·min-1,进样1 μL,分流比10:1,进样口温度250 ℃,传输线温度280 ℃,色谱柱为30 mm × 0.25 mm×0.25 μm HP-5毛细管柱(Agilent),柱温箱初始温度为50 ℃,以5 ℃·min-1升至310 ℃,保持10 min;质谱条件为全扫模式,离子源为EI源,离子化能量70 eV,扫描范围为20~500 u,溶剂延迟时间4 min;Agilent MSD (安捷伦科技有限公司)化学工作站(G1701EA,Agilent Technologies)用于数据处理,应用质谱数据库NIST11.L,通过计算机检索系统进行物质的鉴定,采用峰面积归一法进行相对含量的测定。
1.3 数据处理采用SPSS17.0对数据进行单因素方差分析和多重比较,用Excel软件作图。
2 结果与分析 2.1 毛红椿落叶腐解浸提液对毛红椿幼苗发生及存活的影响 2.1.1 毛红椿落叶腐解浸提液对毛红椿种子发芽的影响不同处理的毛红椿种子发芽及幼苗数均随时间整体呈现由低到高再低的趋势(图 1)。方差分析表明,不同处理间种子发芽率(F=530.40,P<0.01)、发芽势(F=67.07,P<0.01)和发芽指数(F=98.26,P<0.01)均存在极显著差异(表 1)。低浓度处理时,A1和B1处理的种子发芽势、发芽指数均显著低于CK1,B1种子发芽率极显著低于CK1;当高浓度处理时,A2和B2处理的种子发芽率、发芽势、发芽指数无显著性差异,但种子发芽率、发芽势极显著低于CK2,种子萌动时间推迟,A2处理的种子萌动时间最晚(第22天)。
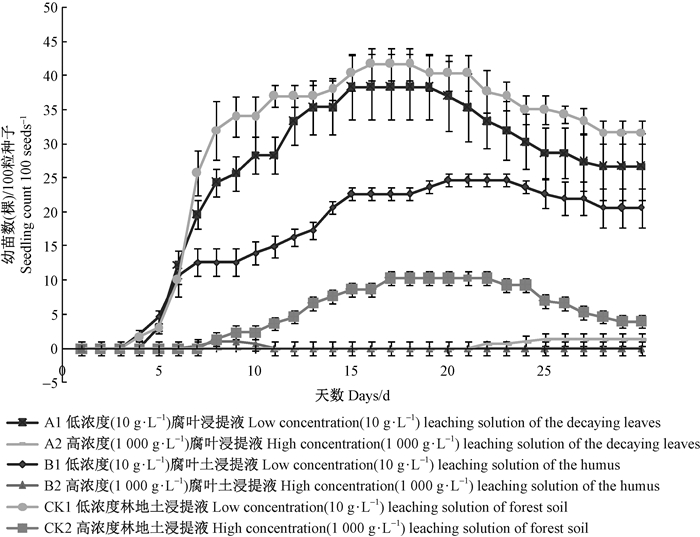
|
图 1 不同浸提液处理毛红椿种子发芽及幼苗数随时间变化情况 Figure 1 Effect of extracts of different depraved components on seedling germination of T. ciliata var. pubescens |
|
|
各浓度浸提液处理,化感指数均为负值,表现为抑制作用(表 1),A1相对其他处理抑制率最低,其发芽率、发芽势、发芽指数的化感指数分别为-0.05、-0.23和-0.19,即抑制率分别为5%、13%和9%。上述结果表明,毛红椿落叶经腐解后能够降低种子发芽率、发芽势和发芽指数,且浸提液浓度越高对毛红椿种子发芽的抑制作用越强,毛红椿落叶对毛红椿种子发芽的延迟作用较强,腐叶土对发芽率的抑制作用较强。
2.1.2 毛红椿落叶腐解浸提液对幼苗存活的影响根据毛红椿存活幼苗数和幼苗发生数计算幼苗存活率,方差分析表明不同处理间幼苗存活数(F=64.50,P=0.00**<0.01)和幼苗存活率(F=77.86,P=0.00**<0.01)存在极显著差异(表 2)。低浓度处理下,A1和B1的毛红椿幼苗存活率与对照(CK1)无显著性差异;高浓度处理下,A2和B2的毛红椿幼苗存活率和对照(CK2)差异极显著,B2处理的幼苗存活率为0,而A2处理因幼苗发生时间较晚(表 1),虽发生数仅有1.33,但试验结束时还未死亡,所以幼苗存活率达100%,表明低浓度的处理液对幼苗保存影响不大,高浓度处理液不利于幼苗存活。
|
|
毛红椿种子发芽后其幼苗继续用不同浓度的浸出液处理,方差分析表明,不同处理间幼苗的根长(F=27.09,P<0.01)、茎长(F=22.20,P﹤0.01)存在极显著差异,幼苗离根最近处的茎直径差异不显著,多重比较结果见表 3。A1处理的幼苗根长极显著高于对照(CK1),茎长也高于对照(CK1),但差异不显著;B1处理的幼苗根长、茎长均显著高于对照(CK1);A2处理的幼苗根长、茎长均显著短于对照(CK2)。
|
|
A1和B1处理下,其化感指数为正值,对茎和根均有不同程度的促进作用(11%~59%);A2抑制根和茎生长,抑制率分别为73%和58%,这表明毛红椿落叶腐解浸提液对幼苗根、茎的生长表现为低浓度促进,高浓度抑制作用,且对根的影响强于对茎的影响,对幼苗直径的生长影响不明显。
2.2.2 毛红椿落叶腐解浸提液对毛红椿幼苗生物量的影响方差分析表明不同处理间幼苗的鲜质量(F=1 508.46,P<0.01)、干质量(F=204 219.51,P<0.01)存在极显著差异(表 4)。A1、B1处理的毛红椿幼苗平均鲜质量和平均干质量极显著高于对照(CK1)处理,对幼苗平均鲜质量的促进率分别为3%和4%,对幼苗平均干质量的促进率分别为21%和24%;A2处理的毛红椿幼苗平均鲜质量和平均干质量极显著低于对照(CK2)处理,对幼苗平均鲜质量和平均干质量的抑制率分别为21%和34%。上述结果可知,低浓度毛红椿落叶腐解浸提液极显著增加毛红椿幼苗生物量,高浓度落叶腐解浸提液极显著降低毛红椿幼苗生物量。
|
|
毛红椿落叶和林地土混合处理获得B母液用丙酮萃取,离心分离后,获得溶于丙酮的弱极性化感成分用于GC-MS分析,分析结果如表 5所示。毛红椿腐叶土存在6种弱极性物质,匹配度大于80%的物质甲氧基苯基肟(76.20%)、邻苯二甲酸二丁酯(9.87%)为其中的主要成分。
|
|
将毛红椿腐叶浸提液A母液用丙酮萃取,离心分离后,获得溶于丙酮的弱极性化感成分,通过GC-MS检测共分离出108个峰,经质谱数据库检索分析,鉴定出了36种主要成分,如表 6所示。
|
|
匹配度大于80%的物质有:甾醇类2种,含量为17.49%;长链脂肪酸及其酯类14种,含量为20.38%;硅氧烷1种,含量为5.81%;萜类3种,含量为3.48%;邻苯二甲酸衍生物2种,含量为1.85%;烷酸内酯类1种,含量为1.07%;植物盐2种,含量为0.42%;植酮1种,含量为0.42%;其他49.08%。其中主要成分为谷甾醇(10.08%)、豆甾-4-烯-3-酮(7.41%)、十六甲基八硅氧烷(5.81%)、棕榈酸(3.24%)、亚油酸乙酯(2.89%)、棕榈酸乙酯(2.45%)亚麻酸乙酯(2.09%)、亚油酸(2.08%)等。经查阅有关资料,硅氧烷类化合物可能为柱流失。因此,腐叶浸提液中主要弱极性成分为甾醇类、脂肪酸及其酯类物质。
3 讨论随着化学生态学、生态毒理学、环境科学理论的深入研究,植物化感效应研究备受关注。自毒作用是化感作用的一个重要方面,是指一种植物释放化感物质抑制同类植物种子萌发及植株生长的现象(Singh et al., 1999)。据报道,很多林木存在自毒作用,例如、油松(Pinus tabulaeformis)、杨树(Populus)、杉木(Cunninghamia lanceolata)等都能分泌自毒物质抑制自身种子萌发或幼苗的生长(李登武等,2010;李冠喜等,2013;Chen et al., 2014)。多项研究结果表明,自毒效应具有一定的浓度依赖性,一般表现为浓度越高抑制作用越强。俞飞等(2010)的研究认为柳杉(Cryptomeria fortunei)凋落物及其表层土壤水浸提液在质量体积比为1:10时对柳杉种子萌发具有抑制作用,随着浸提液比例的降低抑制作用减弱,甚至消失。本研究中,用10 g·L-1的腐叶土浸出液处理毛红椿种子,种子发芽率的抑制强度可达35%,提高处理液浓度抑制强度会更高,说明毛红椿落叶具有较强的化感潜力。腐叶和腐叶土浸出液浇灌毛红椿幼苗对其生长的影响因浓度不同而不同,10 g·L-1的腐叶和腐叶土浸出液对幼苗生长具有促进作用,而1 000 g·L-1的腐叶浸出液对幼苗生长具有抑制作用。毛红椿腐叶和腐叶土的化感作用表现出“高抑低促”质量浓度效应,这一结论与多项研究(李登武等2010;陈立新等,2016;庄正等,2017)的化感与自毒作用的“质量浓度效应”是一致的。
植株残体及凋落物腐解是化感成分的主要来源之一。曹光球等(2007)发现腐解3个月后的杉木枯枝落叶及腐殖土对杉木的种子发芽及幼苗生长存在抑制作用。俞飞等(2010)对浙江天目山柳杉凋落物的自毒作用研究结果表明,自毒作用强度为未分解凋落物>半分解凋落物>表层土壤,通过高效液相色谱仪测定发现,柳杉凋落物和表层土壤中均含有酚酸类化感物质阿魏酸、肉桂酸和对羟基苯甲酸,而且未分解凋落物中的这3种物质的含量均是最高的。经调查,毛红椿林年凋落叶量约100 g·m-2,有活力种子在土壤种子库中主要分布于由凋落物组成的表层土壤(0~5 cm),表层土壤中当年凋落叶和土壤的质量比约为1:25。本研究结果表明,加土腐解的毛红椿落叶自毒作用强于只加水腐解的毛红椿落叶,通过GC-MS分析发现腐叶中含有甾醇、叶绿醇、维生素等成分,可能因为毛红椿落叶中潜在的化感成分未能充分转化,所以化感作用低于腐叶土。当落叶中的化感成分进入土壤,经过土壤微生物的进一步转化后有可能减轻其对受体植物的影响或具有更强的化感潜力,这取决于植物和土壤环境(Shannon-Firestone et al., 2015; Araniti et al., 2016)。进一步研究证实这些化感物质在土壤中与土壤因子的相互作用及转化过程是非常重要的。
植物化感物质主要是植物次生代谢物质,至今已知植物释放的化感物质大概分为14类(Rice,1984)。每种植物释放的化感物质不尽相同,随着研究的深入不断增加。李冠喜等(2013)在不同林龄杨树根际土壤中均检测出对羟基苯甲酸、香草醛、阿魏酸、苯甲酸、肉桂酸等自毒物质,不同浓度的自毒物质均可抑制杨树水培幼苗根系SOD及POD的活性,增加根系细胞膜透性及细胞的MDA含量、降低根系活力;Ruan等(2011)从天山云杉(Picea schrekiana)凋落物和针叶水浸提液中分离纯化出的3,4-二羟基苯乙酮(DHAP),被认为是引起天山云杉自毒作用的主要化感物质之一,章建红等(2014)研究发现DHAP通过打破天山云杉幼苗原有内源激素平衡,使幼苗胚根生长受到抑制。本研究对腐叶土和腐叶浸提液的分析结果表明腐叶土中的主要成分为苯基甲氧基肟和邻苯二甲酸二丁酯。苯基甲氧基肟在某些植物中有检出,例如:大叶黄杨(Euonymus japonicas)茎挥发油中主要成分为苯基甲氧基肟(33.10%),可能具有抗病毒作用(卫强,2016);邻苯二甲酸二丁酯也是一种植物源物质,在很多植物中检测出该物质的存在(洪宏等,2015)。王曌等(2013)研究发现,邻苯二甲酸二丁酯对棉花(Gossypium spp.)幼苗生长在低浓度时表现为促进作用,促进了棉花地上器官和根系生长,降低了超氧化物歧化酶、过氧化氢酶活性,降低了丙二醛含量,提高了根系活力,而在高浓度时表现为抑制作用。毛红椿腐叶浸提液中检测出了36种主要成分,比腐叶土中检出成分多,除邻苯二甲酸二丁酯外,甾醇、脂肪酸及其酯类、维生素等都是腐叶土没有的,其中的棕榈酸、亚油酸、顺-9-十八烯酸(油酸)、肉豆蔻酸等有机酸类化合物及邻苯二甲酸二丁酯在其他作(植)物上被作为化感物质报道(Zou et al., 2014;Ni et al., 2015)。谷甾醇和豆甾-4-烯-3-酮是首次在毛红椿中检出,且在腐叶中含量较高,据报道具有潜在抗癌、抗氧化及抗菌活性(Sneha et al., 2014;Luo et al., 2014;Edilu et al., 2015)。植物枯落残体内含有大量的化学物质,自然状态下,化感作用的产生是许多化感物质共同作用的结果。本研究结果表明,毛红椿腐叶、腐叶土确实都含有某一类物质,但大多数物质是不一样,而热不稳定性和不能气化的成分不能通过GC-MS进行分析鉴定,本研究并不排除还有其他种类的化感物质存在。至于毛红椿的主要化感物质成分和相互作用的机制需要经过深入的研究才能进一步确定。
4 结论毛红椿落叶腐解3个月后,腐叶中的化感成分、腐叶土中的化感成分均对毛红椿种子的萌发和幼苗的生长具有化感作用,且这种化感作用具有浓度依赖性。腐叶、腐叶土中的化感成分对毛红椿种子的萌发具有抑制作用,浓度越高抑制作用越强,腐叶土的抑制作用强于腐叶;低浓度腐叶和腐叶土中的化感成分对毛红椿幼苗的生长具有促进作用,其中腐叶对幼苗根生长促进作用更强,腐叶对幼苗茎生长的促进作用更强,两者生物量均显著增加;高浓度腐叶土中的化感成分对毛红椿幼苗生长具有抑制作用,显著降低幼苗的根长、茎长和生物量;高浓度腐叶土中的化感成分使幼苗不能存活,而高浓度腐叶中的化感成分对幼苗存活没有影响。毛红椿腐叶土中苯甲酸衍生物可能为主要的化感成分;腐叶浸提液中主要弱极性成分为甾醇类、脂肪酸及其酯类物质。
曹光球, 刘学芝, 林思祖, 等. 2008. 腐解6个月后杉木枯枝落叶及腐殖土中的化感成分对杉木种子的化感效应[J]. 植物资源与环境学报, 17(2): 39-43. (Cao G Q, Liu X Z, Lin S Z, et al. 2008. Allelopathic effect of allelochemicals in Cunninghamia lanceolata litter and humus soil on its seed germination after decomposing for six months[J]. Journal of Plant Resources and Environment, 17(2): 39-43. [in Chinese]) |
陈锋, 孟永杰, 帅海威, 等. 2017. 植物化感物质对种子萌发的影响及其生态学意义[J]. 中国生态农业学报, 25(1): 36-46. (Chen F, Meng Y J, Shuai H W, et al. 2017. Effects of plant allelochemicals on seed germination and its ecological significance[J]. Chinese Journal of Eco-Agriculture, 25(1): 36-46. [in Chinese]) |
陈立新, 李少博, 乔璐, 等. 2016. 凋落物叶和土壤浸提液对红松种子萌发及幼苗生长的影响[J]. 南京林业大学学报:自然科学版, 40(2): 81-87. (Chen L X, Li S B, Qiao L, et al. 2016. Influence of leaf litter and soil leaching liquor on seed germination and seedling growth of Pinus koraiensis[J]. Journal of Nanjing Forestry University:Natural Sciences Edition, 40(2): 81-87. [in Chinese]) |
郭晓燕, 张莹莹, 张露, 等. 2016. 浸种对2个毛红椿种源种子萌发和幼苗生长的影响[J]. 浙江林业科技, 36(5): 64-68. (Guo X Y, Zhang Y Y, Zhang L, et al. 2016. Effects of soaking on seed germination and seedling growth in two provenances of Toona ciliata var[J]. pubescens. Journal of Zhejiang Forestry Science & Technology, 36(5): 64-68. [in Chinese]) |
郭晓燕, 张露, 梁跃龙, 等. 2014. 枯枝落叶物厚度影响毛红椿种子出苗的模拟研究[J]. 江西农业大学学报, 36(2): 332-337. (Guo X Y, Zhang L, Liang Y L, et al. 2014. Simulation Study on the effects of litter layer thickness on seedling emergence of Toona ciliata var[J]. pubescens. Acta Agriculturae Universitis Jiangxiensis, 36(2): 332-337. [in Chinese]) |
洪宏, 喻云水, 周蔚虹, 等. 2015. 毛竹薄壁组织抽提物成分的GC-MS分析[J]. 中南林业科技大学学报, 35(6): 114-117. (Hong H, Yu Y S, Zhou W H, et al. 2015. Analysis of extracts components of parenchyma in Phyllostachys pubescens by GC-MS[J]. Journal of Central South University of Forestry & Technology, 35(6): 114-117. [in Chinese]) |
黄红兰, 张露, 廖承开. 2012. 毛红椿天然林种子雨、种子库与天然更新[J]. 应用生态学报, 23(4): 972-978. (Huang H L, Zhang L, Liao C K. 2012. Seed rain, soil seed bank, and natural regeneration of natural Toona ciliata var[J]. pubescens forest. Chinese Journal of Applied Ecology, 23(4): 972-978. [in Chinese]) |
黄红兰, 张露, 郭晓燕, 等. 2013. 九连山毛红椿种群的结实特性及其生殖力[J]. 林业科学, 49(7): 170-174. (Huang H L, Zhang L, Guo X Y, et al. 2013. Fruiting characteristics and sexual fecundity of Toona ciliata var[J]. pubescens populations in Jiulianshan national nature reserve. Scientia Silvae Sinicae, 49(7): 170-174. DOI:10.11707/j.1001-7488.20130725 [in Chinese]) |
李登武, 王冬梅, 姚文旭. 2010. 油松的自毒作用及其生态学意义[J]. 林业科学, 46(11): 174-178. (Li D W, Wang D M, Yao W X. 2010. Autotoxicity of Pinus tabulaeformis and its ecology significance[J]. Scientia Silvae Sinicae, 46(11): 174-178. DOI:10.11707/j.1001-7488.20101128 [in Chinese]) |
李冠喜, 吴小芹, 叶建仁. 2013. 杨树根际土自毒物质的积累、毒害及生物修复[J]. 南京林业大学学报:自然科学版, 37(3): 71-76. (Li G X, Wu X Q, Ye J R. 2013. Accumulation, toxic properties and bioremediation of autotoxic substance in poplar rhizosphere soil[J]. Journal of Nanjing Forestry University:Natural Sciences Edition, 37(3): 71-76. [in Chinese]) |
王曌, 刘连涛, 孙红春, 等. 2013. 棉花腐殖质中主要化感物质对棉花幼苗生长发育的影响[J]. 华北农学报, 28(S1): 192-195. (Wang Z, Liu L T, Sun H C, et al. 2013. Effect of cotton seeding growth and development by main allelochemicals in cotton humus[J]. Acta Agriculturae Boreali-Sinica, 28(S1): 192-195. DOI:10.7668/hbnxb.2013.S1.036 [in Chinese]) |
卫强, 刘洁. 2016. 大叶黄杨叶、茎、果挥发油成分及抗病毒作用[J]. 应用化学, 33(6): 719-726. (Wei Q, Liu J. 2016. Chemical components of the essential oils of leaf, stem and fruit from Euonymus japonicas Thunb[J]. and their antiviral activities. Chinese Journal of Applied Chemistry, 33(6): 719-726. DOI:10.11944/j.issn.1000-0518.2016.06.150323 [in Chinese]) |
俞飞, 侯平, 宋琦, 等. 2010. 柳杉凋落物自毒作用研究[J]. 浙江林学院学报, 27(4): 494-500. (Yu F, Hou P, Song Q, et al. 2010. Autotoxicity of Cryptomeria fortunei litter[J]. Journal of Zhejiang Forestry College, 27(4): 494-500. DOI:10.11833/j.issn.2095-0756.2010.04.003 [in Chinese]) |
章建红, 陈志颖, 阮晓, 等. 2014. DHAP胁迫对天山云杉幼苗内源激素含量变化的影响[J]. 林业科学, 50(4): 121-128. (Zhang J H, Chen Z Y, Ruan X, et al. 2014. Change of endogenous plant hormones contents during seedling growth of Picea schrenkiana treated with DHAP[J]. Scientia Silvae Sinicae, 50(4): 121-128. [in Chinese]) |
张如义, 胡红玲, 胡庭兴, 等. 2016. 核桃凋落叶对萝卜种子发芽和幼苗生长的影响[J]. 西北农林科技大学学报:自然科学版, 44(12): 163-171. (Zhang R Y, Hu H L, Hu T X, et al. 2016. Effect of water extracts and decomposed liquids of walnut leaf litter on seed germination and seedling growth of radish[J]. Journal of Northwest A & F University:Natural Science Edition, 44(12): 163-171. [in Chinese]) |
庄正, 李艳娟, 刘青青, 等. 2017. 凋落物浸提液对杉木种子萌发及幼苗的影响[J]. 森林与环境学报, 37(1): 29-33. (Zhuang Z, Li Y J, Liu Q Q, et al. 2017. Effects of Chinese fir litter extracts on the seed germination and seedlings[J]. Journal of Forest and Environment, 37(1): 29-33. [in Chinese]) |
Araniti F, Gullì T, Marrelli M, et al. 2016. Artemisia arborescens L[J]. leaf litter:phytotoxic activity and phytochemical characterization. Acta Physiologiae Plantarum, 38(5): 1-12. |
Bonanomi G, Sicurezza M G, Caporaso S, et al. 2006. Phytotoxicity dynamics of decaying plant materials[J]. New Phytologist, 169(3): 571-578. DOI:10.1111/nph.2006.169.issue-3 |
Chen L C, Wang S L, Wang P, et al. 2014. Autoinhibition and soil allelochemical (cyclic dipeptide) levels in replanted Chinese fir (Cunninghamia lanceolata) plantations[J]. Plant and Soil, 374(1/2): 793-801. |
Das s, Vasudeva N, Sharma S. 2014. Chemical composition of ethanol extract of Macrotyloma uniflorum (Lam.)Verdc.using GC-MS spectroscopy[J]. Organic and Medicinal Chemistry Letters, 13(4): 1-4. |
Edilu A, Adane L, Woyessa D. 2015. In vitro antibacterial activities of compounds isolated from roots of Caylusea abyssinica[J]. Annals of Clinical Microbiology and Antimicrobials, 14(1): 1-8. DOI:10.1186/s12941-014-0059-8 |
Fernandez C, Voiriot S, Mévy J P, et al. 2008. Regeneration failure of Pinus halepensis, mill:the role of autotoxicity and some abiotic environmental parameters[J]. Forest Ecology & Management, 255(7): 2928-2936. |
Kimura F, Sato M, Kato-Noguchi H. 2015. Allelopathy of pine litter:delivery of allelopathic substances into forest floor[J]. Journal of Plant Biology, 58(1): 61-67. DOI:10.1007/s12374-014-0322-8 |
Luo H, Cai Y Q, Peng Z P, et al. 2014. Chemical composition and in vitro evaluation of the cytotoxic and antioxidant activities of supercritical carbon dioxide extracts of pitaya (dragon fruit) peel[J]. Chemistry Central Journal, 8(1): 1-7. DOI:10.1186/1752-153X-8-1 |
Ni L X, Jie X T, Wang P F, et al. 2015. Effect of linoleic acid sustained-release microspheres on Microcystis aeruginosa antioxidant enzymes activity and microcystins production and release[J]. Chemosphere, 121: 110-116. DOI:10.1016/j.chemosphere.2014.11.056 |
Rice E L. 1984. Allelopathy, The second edition[M]. London: Academic press.
|
Ruan X, Li Z H, Wang Q, et al. 2011. Autotoxicity and allelopathy of 3, 4-dihydroxyacetophenone isolated from Picea schrenkiana Needles[J]. Molecules, 16(10): 8874-8893. DOI:10.3390/molecules16108874 |
Scognamiglio M, D'Abrosca B, Esposito A, et al. 2013. Plant growth inhibitors:allelopathic role or phytotonic effect?Focus on Mediterranean biomes[J]. Phytochemistry Reviews, 12(4): 803-830. DOI:10.1007/s11101-013-9281-9 |
Shannon-Firestone S, Firestone J. 2015. Allelopathic potential of invasive species is determined by plant and soil community context[J]. Plant Ecology, 216(3): 491-502. DOI:10.1007/s11258-015-0453-0 |
Singh H P, Batish D R, Kohli R K. 1999. Autotoxicity:concept, organisms, and ecological significance[J]. Critical Reviews in Plant Sciences, 18(6): 757-772. DOI:10.1080/07352689991309478 |
Sneha D, Neeru V, Sunil S. 2014. Chemical composition of ethanol extract of Macrotyloma uniflorum(Lam.) Verdc. using GC-MS spectroscopy[J]. Organic and Medicinal Chemistry Letters, 4(1): 1-4. DOI:10.1186/2191-2858-4-1 |
Williamson G B, Richardson D. 1988. Bioassays for allelopathy:Mersuring treatment responses with independtent controls[J]. Journal of Chemical Ecology, 14(1): 181-187. DOI:10.1007/BF01022540 |
Zou J C, Liu X Y, Zhong C L, et al. 2014. Effect of palmitic acid on remediation of Scripus triqueter, and enzymes activities of the rhizosphere soil in the simulated diesel-spiked wetland[J]. International Biodeterioration and Biodegradation, 94: 109-114. DOI:10.1016/j.ibiod.2014.07.008 |
 2018, Vol. 54
2018, Vol. 54

