文章信息
- 曾朝彦, 李湘洲, 张胜, 黄丹
- Zeng Zhaoyan, Li Xiangzhou, Zhang Sheng, Huang Dan
- 纳米竹炭对杜仲提取物的吸附和缓释作用
- Adsorption and Sustained Release of Eucommia ulmoides Extract on Nano-Bamboo Charcoal
- 林业科学, 2018, 54(6): 125-131.
- Scientia Silvae Sinicae, 2018, 54(6): 125-131.
- DOI: 10.11707/j.1001-7488.20180615
-
文章历史
- 收稿日期:2016-09-23
- 修回日期:2016-12-02
-
作者相关文章
2. 湖南中医药大学中药粉体与创新药物省部共建国家重点实验室培育基地 长沙 410208
2. State Key Laboratory of Chinese Medicine Powder and Medicine Innovation in Hunan(Incubation), Hunan University of Chinese Medicine Changsha 410208
杜仲(Eucommia ulmoides)为杜仲科(Eucommiaceae)杜仲属(Eucommia)多年生落叶乔木,是我国独有的名贵中药,也是重要的药用类经济林树种,入药历史已达2000年之久。杜仲提取物(Eucommia ulmoides extract,EUE)中最重要的活性成分为绿原酸(chlorogenic acid),又名3-咖啡酰奎尼酸(3-car-feoyquinic acid),EUE不仅具有降血压、提高免疫力、抗炎抗病毒、抗癌防癌、保肝利胆活性及利尿等作用,而且还具有抗氧化、抗衰老和预防肌肉骨骼老化等功效(He et al., 2014;Zhang et al., 2015;Li et al., 2014),已成为保健品、食品、药品和化妆品等行业的重要原料。目前,市场上与EUE相关的产品大多为保健品,如杜仲茶、杜仲酒、杜仲饮料等,而针对EUE缓释产品的研究不多,因此研究开发EUE缓释制剂对增强其疗效、充分发挥其药用价值具有重要意义。
纳米活性炭比表面积大、化学稳定性高、孔隙结构发达、表面活性独特,是一种优良的吸附剂;同时,纳米活性炭还具有选择性高、毒副作用低、生物相容性好等特点,因而近年来常被用做药物缓释材料。有研究将纳米活性炭作为载体来吸附西药如阿霉素,将药物导入淋巴系统,能较好地发挥药物杀灭系统中肿瘤细胞的作用,并可减轻药物毒性(陈浩,2007);但是关于纳米活性炭负载中药的研究甚少。中药缓释制剂是在西药缓释制剂的基础上发展起来的,起步晚且发展缓慢,目前研究比较成熟的中药缓释剂型主要有片剂(包括骨架型、漂浮型和渗透泵型)、注射剂、凝胶剂和脂质体等,但这些缓释剂型还存在制备过程复杂、生物相容性差、载药量少、对胃肠道有刺激等不足。
纳米竹炭(nano-bamboo charcoal, NBC)具备纳米活性炭的所有优点,而且来源无污染、无毒副作用,是一种理想的缓释材料。本文研究纳米竹炭对杜仲提取物的吸附和缓释效果,以期为纳米竹炭天然活性成分缓释制剂的开发和利用提供理论依据。
1 材料与方法 1.1 试验材料、试剂和设备材料:NBC(平均粒径100 nm),上海海若炭业有限公司;EUE,湖南远航生物科技有限公司。
试剂:胎牛血清,美国Gibco公司;0.25%胰蛋白酶,美国Gibco公司;青链霉素双抗,中诺药业有限公司;改良型RPMI-1640培养基,美国HyClone公司;PBS缓冲液,美国HyClone公司;MTT,美国Sigma公司;DMSO(二甲基亚砜),美国Amresco公司;HCT116细胞,中南林业科技大学稻谷及副产物深加工国家工程实验室提供;其他试剂均为分析纯。
设备:热重分析仪(TG),美国PerkinElmer公司Pyris 1型;比表面积测定仪(BET),库尔特SA3100;扫描电镜(SEM),美国FEI公司Quanta450;傅里叶红外光谱仪(FTIR),日本岛津公司IRAffinity-1型;紫外分光光度计(UV2600),上海天美科学仪器有限公司;分析天平(HZ-HG-102N),福州衡之晨电子有限公司;超声波清洗机(SB-5200DTD),宁波新芝生物科技股份有限公司;电热恒温水浴锅水浴锅(HH-S1s),金坛市大地自动化仪器厂;台式高速冷冻离心机,德国HETTICH公司UNIWERSAL 32R型;CO2培养箱,日本三洋公司MCO-15AC型;超净工作台,中国苏州净化设备有限公司;酶联免疫检测仪,中国深圳汇松仪器有限公司MB-530;倒置显微镜,日本Olympus公司CKX41型。
1.2 EUE吸附试验 1.2.1 EUE标准曲线的建立用pH 7.4的蒸馏水将EUE配制成浓度为40、50、60、80、100和120 mg·L-1的标准液,以蒸馏水为空白对照在326 nm波长处测定紫外吸光度值。以紫外吸光度值(D)对浓度(C)作线性回归,建立标准曲线方程。
1.2.2 吸附平衡时间的确定配制浓度为600 mg·L-1的EUE溶液,加入0.1 g NBC,超声振荡6、12、18、24、30和36 min,7 800 r·min-1离心5 min,取上清液稀释一定倍数后测D326值,采用标准曲线方程计算上清液中EUE的浓度,进而求出单位质量NBC吸附EUE的量(X,mg·g-1)。以时间t为横坐标、以吸附量X为纵坐标作图。
X的计算公式如下:
| $ X = \frac{{({C_0} - C)}}{m}V。$ | (1) |
式中:C0为EUE的初始浓度;C为离心后上清液中EUE的浓度;m为NBC用量;V为溶剂体积。
1.2.3 EUE的吸附等温曲线配制浓度为500、550、600、650、700和800 mg·L-1的EUE溶液,分别加入质量分数为0.1%的NBC,超声振荡30 min,达到吸附平衡以7 800 r·min离心5 min,取上清液稀释适当倍数后测D326值。设达到吸附平衡后溶液中游离状态EUE的浓度为C,单位质量活性炭吸附EUE的量为X,以C/C×X-1作图,用Langmuir吸附等温式C/X=1/K×Xm+C/Xm(郑梁元等,2002)拟合,由直线斜率(1/Xm)可计算出NBC对EUE的饱和吸附量Xm。
1.3 EUE体外释放试验取1 g NBC,在超声振荡下使其吸附500 mg EUE达到吸附平衡,去掉上清液,将沉淀在55 ℃下烘干得到的物质即为固体分散体。准确称取0.1 g固体分散体,并量取200 mL 37 ℃人工肠液(取KH2PO43.4 g,加水250 mL使溶解,用0.4%NaOH溶液调节pH至6.8;配成500 mL溶液)于烧杯中,在300 r·min-1的搅拌器下搅拌,每隔0.5 h吸取5 mL缓释液,经0.45 μm滤膜过滤,保留一部分过滤后的缓释液以备生物活性试验用,然后检测滤液在326 nm波长处的紫外吸光度值,同时迅速补充5 mL 37 ℃人工肠液于烧杯中。计算累积释放率,绘制释药曲线,并用Higuchi方程拟合。
累积释放率Q的计算公式如下:
| $ Q\left(\% \right) = \frac{{C \times V \times D}}{{W \times F \times 1{\rm{ }}000}} \times 100\% 。$ | (2) |
式中:C为EUE的浓度(mg·L-1);V为释放介质的体积(mL);D为稀释倍数;W为固体分散体的质量(mg);F为固体分散体中EUE的百分含量(%)。
1.4 负载前后NBC的理化性质NBC的理化性质主要包括表面形貌、比表面积和孔隙结构,所含功能团及质量与温度的变化关系。
通过SEM考察NBC负载EUE表面形貌的变化,BET测定负载前后NBC比表面积与孔隙的变化,FTIR检测负载前后NBC所含官能团的变化,TG分析负载前后NBC质量与温度的变化;并进一步对负载前后的NBC进行热动力学分析,计算NBC负载前后的表观活化能。采用Coats-Redfern法:
| $ \ln \frac{{g\left(a \right)}}{{{T^2}}} = \ln (\frac{{AR}}{{\beta {E_{\rm{a}}}}}) - \frac{{{E_{\rm{a}}}}}{{RT}}。$ | (3) |
式中:a为NBC再分解过程中的转化率;g(a)为TG曲线的积分函数;T、A、R、β和Ea分别为温度、指前因子、气体常数、升温速率和表观活化能。
BET测定条件:以-196 ℃液氮作为吸附介质,在110 ℃下脱气3 h,完成氮气的吸附脱附试验。样品质量为0.07~0.1 g,测定前样品必须干燥以免将其他杂质气体带进样品管。NBC的化学性质主要包括所含官能团以及热解时发生的化学变化。
FTIR测定条件:将样品经KBr压片法处理,扫描区间为400~4 000 cm-1。
TG测试条件:以N2为保护气,流速40 mL·min-1,升温速度10 ℃·min-1。初始温度25 ℃,终温800 ℃,样品装载量约8 mg。
1.5 缓释液体外抑制人直肠癌细胞试验采用MTT法检测缓释液对人工直肠癌细胞的增殖抑制效果。将培养好的HCT116细胞用0.25%胰蛋白酶消化,再用10%胎牛血清RPMI1640培养液配成单个细胞悬液,以每孔8×103个细胞接种于96孔培养板中,每孔体积100 μL。将培养板移到CO2培养箱中,在37 ℃、5%CO2及饱和湿度条件下细胞贴壁培养。加入不同时间释放出来的缓释液50 μL,继续培养24 h。每孔加入MTT(5 mg·mL-1) 20 μL继续孵育4 h,终止培养。吸走上清液,每孔加1 500 μL DMSO,振荡10 min,使结晶物充分溶解。选择490 nm波长,在酶联免疫检测仪上测定各孔中溶解液的吸收值(OD)。缓释液对HCT116细胞抑制率的计算公式为:
抑制率(%)=(1-试验组OD植)/对照组OD值×100%。
2 结果与分析 2.1 NBC对EUE的吸附和缓释作用以紫外吸光度值(D)对浓度(C)作线性回归得到的标准曲线方程为:D=0.007 18C-0.005 207 (r=0.999 5),线性范围为40~100 mg·L-1(图 1)。
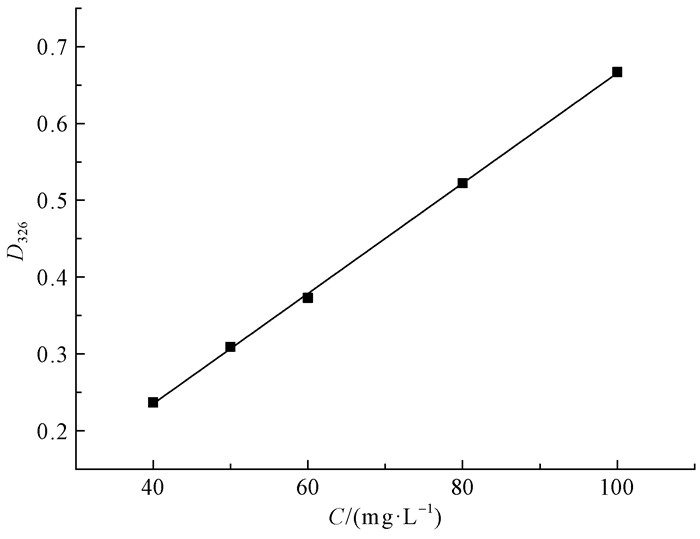
|
图 1 EUE标准曲线 Figure 1 EUE standard curve |
0.1 g NBC对EUE在37 ℃超声振荡6、12、18、24、30和36 min后的吸附量X分别为326.47、369.82、412.83、441.61、454.63和454.88 mg·g-1。以时间t为横坐标、以吸附量X为纵坐标得到NBC对EUE的吸附曲线见图 2。

|
图 2 超声不同时间对NBC吸附EUE含量的影响 Figure 2 Effect of different ultrasonic time on NBC adsorption of EUE |
从吸附曲线可看出,NBC对EUE的吸附量随时间增加而增大,30 min后趋于平衡,因此在37 ℃、pH 7.0及超声条件下,NBC对EUE的吸附平衡时间约为30 min。
用Langmuir吸附模型拟合得到的方程为:Y=0.002 03x+0.997 25(图 3),由直线斜率(1/Xm)可计算出NBC对EUE的饱和吸附量Xm为492.61 mg·g-1 (r=0.998 6),即1 g NBC吸附492.1 mg EUE达到吸附平衡。由此,制备NBC-EUE给药体系二者的最佳质量比为2:1。
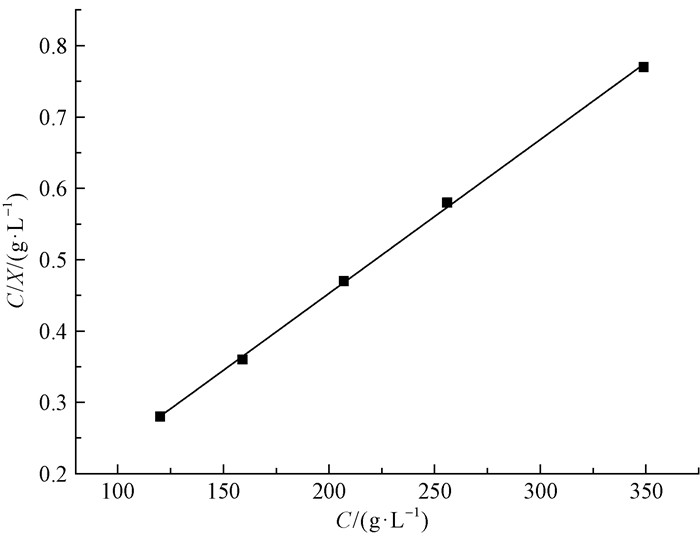
|
图 3 NBC对EUE的等温吸附曲线 Figure 3 The adsorption isotherm curves for NBC on EUE |
图 4为NBC吸附EUE体外累积释放曲线。由图可知,该曲线可分为突释、缓释和平衡释放3个阶段。在突释阶段,NBC表面含有较多EUE,较为容易以游离形式扩散到人工肠液中,因此释放的EUE较多且速度较快,该阶段维持时间为1 h。在缓释阶段,人工肠液中已经含有一定浓度的EUE,因此NBC表面和内部负载的EUE会伴随着浓度差的减小而减缓释放,该阶段维持时间为3 h。在平衡释放阶段,人工肠液中的EUE与NBC所负载的EUE浓度接近,达到动态平衡,因此EUE浓度基本维持不变,释放速率趋于平缓。上述阶段可用Higuchi方程拟合:Mt=48.68X1/2 -19.21(r= 0.956 1),Higuchi释药模型能较好地描述NBC对EUE的释药过程。

|
图 4 NBC吸附EUE累积释放曲线 Figure 4 NBC adsorption cumulative release curve of EUE |
利用扫描电镜观察(放大20 000倍)NBC吸附EUE前后的表面形貌,结果见图 5。可以看出, 吸附前NBC表面光滑,颗粒大小分布均匀,表面没有负载任何物质(图 5a); 吸附后NBC表面负载了EUE,而且所有吸附后的NBC均比吸附前要白(图 5b)。这是因为EUE中含有绿原酸、京尼平苷酸等有机物,导电率差,从而导致负载后的NBC泛白。上述结果证实NBC负载了EUE。

|
图 5 吸附前(a)和吸附后(b)的NBC表面形貌 Figure 5 SEM image of nano bamboo charcoal before(a) and after (b)adsorption |
NBC的比表面积和孔径分布是表征其吸附性能的有效指标之一,比表面积和孔结构不同会引起活性炭对于同种药物吸附能力的差异。采用静态N2吸附法分析吸附前后及缓释后NBC的比表面积和孔径分布,结果见表 1。
|
|
根据N2吸附等温曲线计算得知,吸附前NBC的比表面积为820.32 m2·g-1,孔容积为0.483 3 mL·g-1;吸附后NBC的比表面积下降到443.80 m2·g-1,孔容积下降到0.288 5 mL·g-1。这说明EUE被NBC吸附到表面或孔隙里,使得NBC的表面积和孔容积均减少。缓释后的NBC虽然释放出了EUE,但人工肠液中的KH2PO4、NaOH负载到了NBC上,从而使比表面和孔容积没有得到恢复。
2.2.3 热重分析图 6为NBC吸附EUE前后在10 ℃·min-1下测定的TG-DTG曲线。从吸附前的TG曲线可知,NBC在40~100 ℃内曲线上出现了一个较小的失重阶梯,这是NBC失去表观水造成的;当温度升高到400 ℃时,NBC发生热分解,因而出现了一个较大的失重阶梯。结合DTG曲线分析NBC的2个失重阶梯更明显(宋军等,2012)。

|
图 6 NBC吸附前后的TG-DTG曲线 Figure 6 DTG-TG curves of nano bamboo charcoal before and after Eucommia ulmoides extract adsorption |
NBC负载EUE后的TG曲线与负载前相比,在200~380 ℃内出现了一个较大的失重阶梯,结合DTG曲线和绿原酸的熔点(208 ℃)可知EUE有效成分发生了热分解,经液相分析得出EUE的主要成分为绿原酸(郭满满等,2011)。由此可知,NBC负载了EUE。
以ln[g(a)/T2]对1/T作图,进行线性拟合,可得到一条直线,见图 7, 从直线斜率(-Ea/R)可得到动力学参数Ea。吸附前NBC的表观活化能为54.83 kJ·mol-1,小于吸附后的表现活化能(63.44 kJ·mol-1),表面活化能越低物质越稳定,因此吸附EUE后NBC的稳定性有所降低。

|
图 7 负载前(a)和负载后(b)的NBC热动力学相关分析曲线 Figure 7 NBC thermodynamic correlation analysis curves before (a) and after load (b) |
NBC吸附EUE前后的红外图谱见图 8a。吸附前NBC的吸收峰主要集中在1 719~ 400 cm-1。3 724 cm-1处可能为羟基官能团O—H的伸缩振动,2 919 cm-1和2 849 cm-1处的吸收峰较弱,为—CH3的特征吸收峰;1 573、1 240 cm-1处为羧酸吸收峰,1 066 cm-1处可能是醚的C—O伸缩振动(Kumar et al., 2015;Reffas et al., 2010;Puziy et al., 2005;Terzyk,2001)。而负载EUE后的NBC在3 382、667 cm-1处出现了新的吸收峰,1 573、1 240和1 066 cm-1处的吸收峰增强,1 450、1 108 cm-1处出现了倒峰。将吸附后的NBC和EUE的红外图谱进行对比(图 8b)可发现,在3 382、2 904、1 700、1 527、1 242、1 062和667 cm-1处二者的吸收峰接近,1 633、1 527、1 274和688 cm-1处是EUE中含有苯类衍生物的特征吸收峰。由此可知,NBC已经负载了EUE。
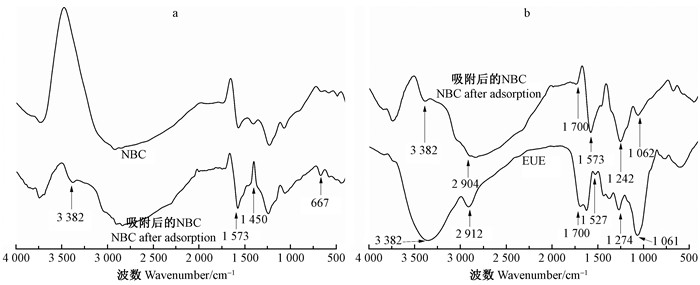
|
图 8 NBC吸附EUE前(a)后(b)的红外分析 Figure 8 Infrared spectra of nano bamboo charcoal before(a) and after(b) adsorption of Eucommia ulmoides extract |
不同时间释放出来的缓释液对人直肠癌细胞(HCT116)的抑制效果见图 9。由图可知,随着缓释时间增加,EUE缓释液对HCT116细胞的抑制效果越来越强,在3.0 h时对HCT116细胞的抑制率达到了23.07%。这说明缓释液对HCT116细胞具有抑制效果,且缓释效果明显。
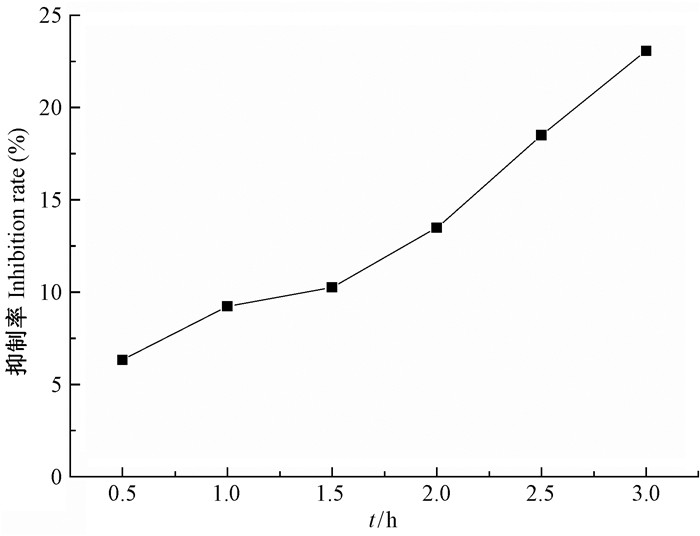
|
图 9 缓释液对HCT116细胞的增殖抑制效果 Figure 9 Inhibitory effect of release liquid on HCT116 cells |
1) 构建了杜仲提取物的模拟体外释药试验模型,获得了纳米竹炭对杜仲提取物的载药和释药量。纳米竹炭和杜仲提取物到达吸附平衡的时间为30 min。采用Langmuir吸附模型得到纳米竹炭对杜仲提取物的饱和吸附量为492.61 mg·g-1,二者的最佳质量比为2:1。以上研究结果为制备纳米竹炭-杜仲提取物缓释体提供了依据。
2) 设计并获得了纳米竹炭吸附杜仲提取物缓释体模拟体外释药的试验方法。纳米竹炭-杜仲提取物缓释体在人工肠液中的累积释放率为70.6%,采用Higuchi方程对释放数据进行拟合,得到的方程为:Mt=48.68X1/2-19.21(r=0.956 1)。该研究结果可以诠释纳米竹炭释药的特点,为杜仲天然提取物药物开发的动力学提供参考。
3) 完成了对纳米竹炭-杜仲提取物缓释体的一系列表征,验证了试验结果的合理性和科学性。纳米竹炭吸附杜仲提取物前表面光滑,颗粒大小分布均匀;吸附杜仲提取物后其表面形貌粗糙,导电率下降。纳米竹炭含有丰富的—OH、—COOH等不同种类的含氧官能团,是其主要活性位,这些活性位点使得纳米竹炭表面呈现微弱的亲水性、氧化性和酸性等性质。杜仲提取物中含有—NH、—CO—、—OH等极性很强的官能团,能被纳米竹炭中的活性位点吸附。SEM、BET、FTIR及TG分析均验证了纳米竹炭吸附杜仲提取物的合理性和客观性。
4) 采用MTT法完成了体外抗肿瘤试验。纳米竹炭-杜仲提取物缓释体所释放出的缓释液可有效抑制HCT116细胞,表明纳米竹炭对杜仲提取物的吸附和缓释作用基本满足了药用成分缓释剂的要求。
陈浩, 黄广建, 倪泉兴, 等. 2007. 纳米活性炭作为药物载体在淋巴靶向治疗中的作用[J]. 复旦学报:医学版, 34(4): 518-521. (Chen H, Huang G J, Ni Q X, et al. 2007. The application of nanometric activated carbon particles in the intralymphatic chemotherapy as a drug carrier[J]. Fudan University Journal of Medical Sciences, 34(4): 518-521. [in Chinese]) |
郭满满, 肖卓炳, 于华忠, 等. 2011. 热重法研究绿原酸的热稳定性、分解动力学及贮存期[J]. 药物评价研究, 34(5): 348-352. (Guo M M, Xiao Z B, Yu H Z, et al. 2011. Study on thermal stability, decomposition kinetics, and shelflife of chlorogenic acid by thermogravimetry method[J]. Drug Evaluation Research, 34(5): 348-352. [in Chinese]) |
宋军, 王鉴, 邴国强, 等. 2012. 载体活性炭的热分析动力学研究[J]. 应用化工, 41(2): 304-306. (Song J, Wang J, Bing G Q, et al. 2012. Study on thermal analysis kinetics of carbon support[J]. Applied Chemical Industry, 41(2): 304-306. [in Chinese]) |
郑梁元, 胡一桥. 2002. 吸附//屠锡德, 张钧寿, 朱家壁. 药剂学. 3版. 北京: 人民卫生出版社, 125-144. (Zheng L Y, Hu Y Q. 2002. Adsorption//Tu X D, Zhang J S, Zhu J B. Pharmacy. 3rd edition. Beijing: People's Medical Publishing House, 125-144.) |
He X R, Wang J H, Li M X, et al. 2014. Eucommia ulmoides Oliv.:ethnopharmacology, phytochemistry and pharmacology of animportant traditional Chinese medicine[J]. Journal of Ethnopharmacology, 151(1): 78-92. DOI:10.1016/j.jep.2013.11.023 |
Kumar A, Jena H M. 2015. High surface area microporous activated carbons prepared from Fox nut(Euryale ferox)shell by zinc chloride activation[J]. Applied Surface Science, 356: 753-761. DOI:10.1016/j.apsusc.2015.08.074 |
Li Y, Han C, Wang J, et al. 2014. Investigation into the mechanism of Eucommia ulmoides Oliv.based on a systems pharmacology approach[J]. Journal of Ethnopharmacology, 151(1): 452-460. DOI:10.1016/j.jep.2013.10.067 |
Puziy A M, Poddubnaya O I, Martinez-Alonso A, et al. 2005. Surface chemistry of phosphorus-containing carbons of lignocellulosic origin[J]. Carbon, 43(14): 2857-2868. DOI:10.1016/j.carbon.2005.06.014 |
Reffas A, Bernardet V, David B, et al. 2010. Carbons prepared from coffee grounds by H3PO4 activation:characterization and adsorption of methylene blue and Nylosan Red N-2RBL[J]. J Hazard Mater, 175(1/3): 779-788. |
Terzyk A P. 2001. The influence of activated carbon surface chemical composition on thadsorption of acetaminophen(paracetamol)in vitro:Part Ⅱ.TQ FTIR, and XPS analysis of carbons and the temperature dependence of adsorption kinetics at the neutral pH[J]. Colloids and Surfaces A, 177(1): 23-45. DOI:10.1016/S0927-7757(00)00594-X |
Zhang Y, Zhang H, Wang F, et al. 2015. The ethanol extract of Eucommia ulmoides Oliv.leaves inhibits disaccharidase and glucose transport in Caco-2 cell[J]. Journal of Ethnopharmacology, 163: 99-105. DOI:10.1016/j.jep.2015.01.015 |
 2018, Vol. 54
2018, Vol. 54

