文章信息
- 陈志成, 姜丽娜, 冯锦霞, 万贤崇
- Chen Zhicheng, Jiang Lina, Feng Jinxia, Wan Xianchong
- 木本植物木质部栓塞测定技术的争议与进展
- Progress and Controversy of Xylem Embolism Determination Techniques in Woody Plants
- 林业科学, 2018, 54(5): 143-151.
- Scientia Silvae Sinicae, 2018, 54(5): 143-151.
- DOI: 10.11707/j.1001-7488.20180516
-
文章历史
- 收稿日期:2017-11-20
- 修回日期:2018-01-05
-
作者相关文章
近年来,在气候变化背景下,极端干旱、高温事件增多,导致全球尺度上森林衰败、树木死亡增多(陈志成等, 2016, Chen et al., 2017; Young et al., 2017),使树木死亡机制研究成为热点,其中植物的水分生理、水力结构研究是核心(McDowell et al., 2008)。此外,把植物水力性状综合考虑进动态的全球植被模型中,有助于预测森林植被对气候变化响应(Choat et al., 2012),而准确测定植物水分是关键。
内聚力-张力理论提出后,植物长距离水分运输的研究已经超过120年(Dixon et al., 1895)。植物进化出许多导管(或管胞)连接起来的长距离输水通路,水流上升的动力来自于叶片蒸腾产生的张力(低水势),这种张力逐级传递到根系(即土壤、根系、叶片、大气的水势依次降低) (万贤崇等, 2007; Cochard et al., 2013),使根系吸收的水分可以快速地传输到冠层叶片。因此,木本植物的输水过程几乎不需要自身的能量,而是由太阳能驱动,形成高效的输水系统。但依据内聚力-张力理论认为木本植物输水过程中,木质部中的液流处在负压下,水分呈亚稳定状态(Dixon et al., 1895)。这种负压的程度由地上树木高度、土壤水分状况、大气饱和亏缺、植物蒸腾速率和土壤-植物水力路径的阻力综合决定(Koch et al., 2004; 万贤崇等, 2007; 陈志成等, 2017a)。当蒸腾需求高或者土壤水分有效性低时,强的负压会使“气种”由导管(或管胞)纹孔膜上的小孔进入导管,导致木质部水柱出现栓塞,破坏水柱的完整性,阻碍木质部液流向上运输(Sperry et al., 1988; Jarbeau et al. 1995)。如果木质部栓塞程度过大,树木冠层顶端会因水力失衡(hydraulic failure)枯死,甚至整树死亡(McDowell et al., 2008; 陈志成等, 2017b)。
木本植物木质部栓塞的研究是植物水分关系研究中的核心内容。木质部栓塞除了与树木自身水分平衡、树木死亡相关(McDowell et al., 2008; 陈志成等, 2017b),还关系到植物光合作用(Tyree et al., 1991)、森林生产力(Anderegg et al., 2012)、树木极限高度(Koch et al., 2004; 陈志成等, 2017a)和树种在自然界的分布规律(Choat et al., 2012)等。树木栓塞抵抗能力通过木质部栓塞脆弱性曲线获得,是评价树种在干旱胁迫下生存能力的关键指标,可作为干旱立地条件下选择合适造林树种的判断依据(McDowell et al., 2008),并且还是预测未来干旱是否导致森林衰败的重要功能性状(Choat et al., 2012)。因此,准确测定木质部栓塞非常重要,这也有助于跨学科间的合作和大量集合数据的荟萃分析。而国内对木质部栓塞的研究报道较少,很大程度上是受限于对栓塞测定方法的掌握。
木质部气穴栓塞测定方法的研究经历了一个较漫长的过程,最初用肉眼或显微镜观察木质部横切片导管中的小气泡(Haines, 1935),但这种方法很难量化木质部栓塞,也难以普及应用。液流可以在非栓塞的木质部导管中运移,所以利用重力或压力将染色后的溶液经过木质部横截面,可以判断栓塞和非栓塞导管的比例(Sperry, 1986)。番红、碱性品红和荧光染料都可作为染色剂,但是如果染色剂溶解不充分或遇到窄导管的树种,有可能染色剂本身就堵塞导管从而影响测定的准确性,且这种方法定量化栓塞费力、低效。目前,木质部栓塞的主要测定方法是声学检测法(acoustic detection)、低压液流技术(low pressure flow meter, LPFM)和非破坏性成像技术。核磁共振成像技术(magnetic resonance imaging technology, MRI)及X-射线显微断层成像系统(X-ray computed microtomography system,microCT) 2种非破坏性成像技术是最新的研究木质部栓塞的方法,但由于其设备昂贵,还难以被广泛应用。低压液流法是近30年来应用最广泛、最普遍的方法,绝大部分木质部栓塞的研究是用的这种方法。但是Wheeler等(2013)研究发现这种方法会人为造成“张力-剪断假象”(tension-cutting artifact),从而对低压液流方法造成了冲击,甚至质疑了之前众多的木质部栓塞的研究结果。但是随后针对性的研究并没有重复出“张力-剪断假象”,并且认为避免“张力-剪断假象”的压力释放过程发生了栓塞修复,这证明低压液流方法仍然是高效实用的一种测定木质部栓塞的方法(Scoffoni et al., 2014; Trifilò et al., 2014; Fukuda et al., 2015; Venturas et al., 2015)。本文介绍了声学检测法、非破坏性成像技术和低压液流技术3类方法及其优缺点,详细讲述了低压液流法的原理步骤及Wheeler等(2013)发现的张力-剪断假象,并综述了其他科学家对Wheeler等(2013)试验的验证过程。张力-剪断假象虽然对低压液流技术造成了争议,但是重新警醒研究人员应规范操作这个方法,这具有重要意义,本文最后提出了利用低压液流测定木质部栓塞的注意事项及操作建议。
1 声学检测法与非破坏性成像技术 1.1 声学检测法当栓塞发生时,导管中的负压突然上升到0 MPa,部分能量以声波辐射(acoustic emission)的方式散失,且此声波占据了一个较宽的声谱范围(Cochard et al., 2013; Nolf et al., 2015)。声学检测法就是基于这种声波辐射来检测木质部栓塞,1966年开始应用(Milburn et al., 1966),其主要优点是对植物材料无破坏性,传感器固定到枝条之后声波辐射可被自动记录,该技术具有较高的时间分辨率,可精确检测栓塞发生的时间。目前,声学检测系统还可以分析多个参数,如振幅、能量和波形等特征(Wolkerstorfer et al., 2012)。对于某些树种(比如针叶树),声学检测法测定的声波辐射积累值,与低压液流方法得到的栓塞值具有很好的相关性(Hacke et al., 1995),并且栓塞形成所释放的声波能量可以反映导管的大小和干旱胁迫的强度(Mayr et al., 2011)。声波辐射最活跃时的水势值与低压液流方法测定的栓塞50%时的水势值相关,即干旱胁迫加重过程中声波辐射的密度可以估计树种的栓塞脆弱性(Nolf et al., 2015)。
不止栓塞的导管产生超声波,有些树种即使导管完全栓塞后,仍会有声波辐射(Tyree et al., 1986; Wolkerstorfer et al., 2012),还有可能非输水功能的细胞或厚壁组织、树皮等也产生超声波(Tyree et al., 1986; Kikuta et al., 2003),因此声波检测法测定栓塞的结果不够可靠。声学检测法无法测定传感器安装之前已经发生的栓塞,不容易量化栓塞,因此,声学检测法更倾向于定性检测木质部栓塞。这个方法曾兴盛于20世纪80年代,目前用这个方法定量测定栓塞的研究比较少。
1.2 非破坏性成像技术核磁共振成像技术是首个研究木质部栓塞的非破坏性成像技术,可对导管非破坏性地、无偏差地三维成像。Holbrook等(2001)最先应用这种技术可视化木质部导管的水分状态,发现干旱胁迫后葡萄(Vitis vinifera)的栓塞修复只发生在复水和暗处理下。Fukuda等(2015)用核磁共振技术发现连香树(Cercidiphyllum japonicum)和白桦(Betula platyphylla)2个树种在干旱胁迫后,当年生年轮的导管发生栓塞要滞后于前1~2年的年轮中的导管,这对今后研究木质部栓塞时的采样具有启示意义。但核磁共振技术的缺点是分辨率较低(约20 μm),相比之下,microCT (微CT)技术更有优势。
Fromm等(2001)最先应用微CT技术测定木质部栓塞。微CT技术具有核磁共振成像的非破坏性、三维成像的优点,且空间分辨率小于2 μm,可以让研究者直接观察更详尽的、高分辨率的木质部导管栓塞程度和分布模式,还可实时评定栓塞形成和修复的动态(Brodersen et al., 2013),该技术更适合木质部水分的研究(Choat et al., 2016)。在任何的试验性研究领域,科学发展过程常常与技术的突破性发展紧密相关。由于微CT方法的优点,近年用此方法取得了许多显著的关于木质部栓塞的研究成果(Choat et al., 2015, 2016;Cochard et al., 2015; Brodersen et al., 2016; Scoffoni et al., 2017)。栓塞修复是木质部栓塞研究中的重要问题,Choat等(2015)用木质部中缺少薄壁组织的针叶树作为材料,发现干旱胁迫后经过复水,茎水势在24 h内恢复到了干旱胁迫前的水平,而栓塞即使在充足水分条件下的2周后也没有修复。微CT技术还可直接测定完整植株的栓塞脆弱性(Choat et al., 2016)。另外,微CT技术还被当作“绝对正确的方法”来校对其他测定木质部栓塞的方法(Cochard et al., 2015)。
2 低压液流技术的原理及操作步骤水饱和程度不同的枝条(即不同栓塞程度枝条)导水率不同(Ewart, 1906),基于此,对直接测定枝条栓塞的方法进行了很长时间的摸索(Zimmermann, 1978; Sperry, 1986; Tyree et al., 1986),最终建立了目前最常用的、可定量化测定木质部栓塞的低压液流技术(Sperry et al., 1988)。
低压液流技术是用导水损失率(percentage loss of conductivity, PLC, %)来表示栓塞,即木质部栓塞导管所占的导水率与无栓塞时最大导水率的比值。计算方法是一段具有完全输水功能的木质部(枝条、木质化的叶柄和根系)导水率为Kmax,产生一定栓塞后导水率为Kx(即初始导水率),则PLC=100×(1-Kx/Kmax)。这个方法必须剪下一段植物材料(如枝条)来测定导水率,所以具有破坏性。低压液流系统主要由储水器、连接储水器和枝条的管路、读数装置组成(图 1)。首先用一定的初始压力驱动水流通过枝条测定初始导水率Kx,初始压强一般为3~5 kPa,由进水端储水器液面与出水端液面的高差所形成的重力获得。所以低压液流法也被称为改良重力法。一般常用的读数装置有移液管、流量计和可与电脑进行交互的万分之一天平。获得Kx后,再用一定的高压冲洗枝条木质部,完全冲洗掉木质部中造成栓塞的气泡,这个冲洗高压一般在0.1~0.2 MPa之间,往往用压缩空气或高压氮气这样的高压气体结合可控制气体流量的压力表获得冲洗高压来驱动水流。最后再用同样大小的初始压力测定木质部的导水率,为最大导水率Kmax,计算得出PLC。
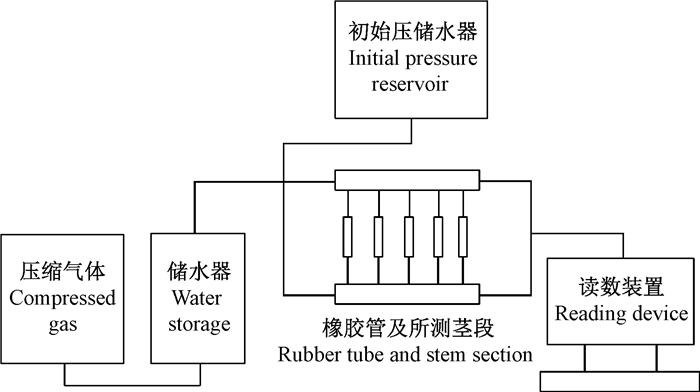
|
图 1 低压液流方法示意 Figure 1 Concept map for low pressure flow meter |
植物木质部导管常常处于大的负压下(导管内存在张力),当木质部被剪断时,剪断的导管即开放的导管(open vessels)中的水暴露在大气压下,会瞬间沿着导管收缩。针叶树的管胞长度只有几毫米,而有些阔叶树,如环孔材和藤本树种,最大导管长度可达几米,不同张力下不同的树种枝条剪断时水分收缩的长度不同,这就要求测栓塞取样时从树上剪下的枝条长度至少要大于这个树种的1个最大导管长度,然后把距剪断切面长于最大导管长度的枝条部分浸入水中剪断,取得要测定栓塞的茎段。之前的研究认为在水中剪断枝条会保持木质部导管水力的连续性,可以准确测定木质部栓塞,Wheeler等(2013)研究发现自然张力下和释放张力(在测定茎段栓塞之前,茎段泡在水中一段时间释放张力)的枝条的PLC有很大的不同,认为在张力下剪断枝条(即使在水中剪断)后直接测定会人为地增加所测样品的PLC,即“张力-剪断假象”(tension-cutting artifact) (Wheeler et al., 2013; Trifilò et al., 2014; Venturas et al., 2015)。
传统观点认为一天中环境因子的变化会导致树木蒸腾、水势发生日变化,从而木质部栓塞存在日变化(Zwieniecki et al., 1998)。但是Wheeler等(2013)在研究Acer rubrum树种时没有发现PLC日变化,即使枝条在水中剪断仍是如此。Wheeler等(2013)通过一系列的试验进行验证。试验1:在水中剪断枝条后,枝条剪断的一段插入水中30~60 min,叶片的一端罩上大的塑料袋,以此释放枝条中的张力;另外对在空气中剪断的枝条,在水中剪下要测定的茎段,然后浸泡30~60 min以释放茎段张力。研究发现用这2种方式释放枝条张力后,A. rubrum和Betula papyrifera 2个树种的PLC都很低,并且凌晨和中午的PLC没有显著差异,即没有出现栓塞日变化,而这2个树种的中午水势显著低于凌晨水势。相反,对自然张力下的枝条立即测定,则中午PLC显著高于凌晨,由此推测PLC日变化是木质部存在张力(水势较负)时剪断枝条样品形成人为栓塞导致的,即由采样引起。试验2:美国白蜡(Fraxinus americana)是长导管植物,利用外力通过树干对白蜡冠层注水,以释放木质部张力,中午的PLC显著低于注水之前自然张力下测定的PLC,而注水前后枝条的水势没有显著变化。这个结果也与“张力-剪断假象”假说一致,即没有供水的白蜡枝条在剪断(在水中)时诱导了更高的PLC。试验3:用自然干燥法构建A. rubrum和B. papyrifera 2个树种的木质部栓塞脆弱性曲线,一组样品释放张力后测定栓塞,另一组样品在自然张力下测定栓塞。B. papyrifera在自然张力和释放张力2种情况下测定的曲线没有差别,而A. rubrum在这2种情况下测定的曲线具有显著的不同,释放张力组曲线的栓塞值在相当大的水势范围内低于自然张力下测定的栓塞值。即用自然干燥法构建木质部脆弱性曲线时,不释放张力测定栓塞得到的曲线脆弱性更大。试验4:为了明确释放张力是否在30 min乃至更长的时间里修复了自然状态的栓塞进行了快速释放张力的试验。即用自然干燥法获得一系列不同水势的枝条后,用来测定栓塞的较长的茎段在水中一分为二,一段立即测定(自然张力),一段在水中释放张力2 min再测定。如果在水中剪断会维持枝条的水力连续性,相邻的这2个茎段的PLC将没有差异,但是,研究发现所用的2个树种在快速释放张力后测定的PLC都显著低于自然张力下测定的PLC。为了避免采样时人为影响栓塞测定,Wheeler等(2013)建议在切取最终测定栓塞的茎段之前,先用2 min~2 h的时间释放木质部的张力。
释放张力和自然张力下测定的PLC不同可能是栓塞的导管在释放张力的过程中得到了修复。但Wheeler等(2013)从2个方面质疑,首先是有学者认为当韧皮部被破坏后,张力下的木质部栓塞不能被修复(Salleo et al., 1996; Tyree et al., 1999; Bucci et al., 2003),更何况测定时整个茎段被剪断。其次是试验所用树种的导管产生的毛细作用修复栓塞速度慢(Yang et al., 1992),不能用来解释释放张力和自然张力下PLC的差异,以往报道中栓塞修复所用的时间较长(Hacke et al., 2003; Brodersen et al., 2010)。因此,Wheeler等(2013)认为在水中剪断枝条并不能保持枝条的水柱连续性,并且如果木质部张力足够大时,剪断导管的操作会诱导更大的栓塞,导致测定自然张力下枝条的PLC会更高,即人为的张力-剪断假象,这可能是水中存在微小气泡,剪断枝条时会把气泡吸进开放的导管,而气泡进入导管的距离则依赖于木质部张力的大小,即“错误”栓塞的程度与木质部张力的大小有关。鉴于这种用低压液流方法测定栓塞的不确定性,Wheeler等(2013)认为在剪断所测茎段(安装在低压液流系统上的茎段)前应释放张力是避免测定出虚假偏高的PLC。
3.2 张力-剪断假象对低压液流方法的影响如果“张力-剪断假象”是真实存在的,将对木质部栓塞的研究产生重大影响,主要有以下两点。1)如果这种失误发生在了很多树种上,可能就需要重新评定这些树种在中午干旱时的木质部栓塞及修复情况。在植物水势日变化过程及干旱后复水的过程中,木质部栓塞修复的相关研究都依赖于在更负的水势下PLC更大和较高的水势下PLC更低的数据,以此作为栓塞修复存在的证据(Zwieniecki et al., 1998; Nardini et al., 2011; Hacke et al., 2003; Zufferey et al., 2011),如果这种人为假象存在,这些研究的结果都将受到质疑。2)用自然干燥法构建脆弱性曲线需要在大的张力下剪断要测定的木质部茎段,所以这种人为假象将潜在的否定用自然干燥法测定的脆弱性曲线研究结果(Jarbeau et al., 1995; Choat et al., 2012)。自然干燥法还被认为是鉴定其他构建脆弱性曲线方法的标准方法(Sperry et al., 2012),所以对这些方法的研究也产生了负面影响。而树种的抗栓塞能力由脆弱性曲线获得,对树种抗栓塞能力的质疑也关系到了干旱导致植物死亡的水力失衡阈值(McDowell et al., 2008)。
4 对张力-剪断假象的验证张力-剪断假象的发现在植物水力研究领域引起了激烈的讨论、重视及进一步的试验重复(Sperry, 2013; Trifilò et al., 2014; Fukuda et al., 2015; Jansen et al., 2015; Venturas et al., 2015),而其他植物水分生理学家设计的具有针对性的试验并没有重复出张力-剪断假象,但这个事件使相关研究者重新重视了低压液流技术的规范操作和细节把握。
Sperry作为低压液流方法的创始人对张力-剪断假象发表了评论,认为张力-剪断假象可能是剪断有张力的木质部时,有气体被吸入了导管,从而堵塞了开放的导管,但还并不确定这个假象的真正机制(Sperry,2013)。在评论中Sperry指出Dixon在一百年前就有先知的预见,即“可能一些气泡出现在测定的准备阶段”(Dixon, 1914),但是研究人员在过去几十年的植物水力测定中并不都是非常注意这个问题。在稍早于低压液流方法发明前的水力结构研究中,也提到了需要小心地准备试验和设计以避免木质部水力测定中出现的气泡(Zimmermann, 1978),后来建立的低压液流方法也延续了这种理念(Sperry et al., 1988)。但是因为试验准备工作和试验细节较为繁琐,这种预防错误的细致操作在此类试验中常被忽视(Sperry, 2013)。而植物水力研究中出现的这些问题会混淆研究结论并阻碍研究的进一步发展(Jansen et al., 2015)。
Trifilò等(2014)和Venturas等(2015)对“张力-剪断假象”设计了针对性的试验,最终证明在水中剪断存在张力的枝条不会造成人为栓塞。有大量研究表明,一些树种的茎和根可以在负压下修复栓塞(Salleo et al., 1996; Tyree et al., 1999; Stiller et al., 2005; Nardini et al., 2011),这个过程被称为“特殊修复”(novel refilling) (Hacke et al., 2003),以区别木质部在高水势时的栓塞修复(Tyree et al., 1992)。Wheeler等(2013)认为,释放张力后栓塞降低可能是栓塞修复导致的,所以在其研究中也设计了一个2 min的快速释放张力的试验,但是作者最终否定了栓塞修复是张力-剪断假象的原因。在理论条件下,对于完整枝条的栓塞2 min修复时间过短,但是先前也有导管栓塞快速修复的证据,如擦伤叶柄的表皮之后,通过伤口吸水,叶柄导水率会快速大幅升高(Bucci et al., 2003);Trifilò等(2003)报道栓塞的叶片木质部导管剪断后,在水中5~10 min得到了修复。
Trifilò等(2014)对油橄榄(Olea europaea)和月桂(Laurus nobilis)的研究证明,释放张力后出现更低的PLC就是因为栓塞修复,因此更低的PLC不代表张力存在时的真实的栓塞水平,即并不存在张力-剪断假象,其设计了如下试验。试验1:所研究的2个树种在自然张力下测定存在栓塞日变化。但是重复Wheeler等(2013)的试验,在水中释放张力后,水势显著升高,而2个树种的中午PLC与凌晨PLC差异不显著,即释放张力后栓塞日变化不存在。对2个树种在自然张力下进行环割韧皮部(阻碍木质部栓塞修复)和原钒酸钠(一种木质部栓塞修复抑制剂)处理,处理后的PLC与自然张力下的对照枝条无显著差异;当2种处理的枝条释放张力1 h后,PLC仍然与自然张力下的对照枝条无显著差异,虽然释放张力枝条的水势显著升高。试验2:通过2 min的枝条末端吸水和枝条叶片吸水2种快速释放张力方法及原钒酸钠溶液释放张力的方法都导致木质部水势升高。但2种快速吸水释放张力的枝条PLC都显著低于自然张力枝条,而在原钒酸钠溶液中快速释放张力的枝条PLC与自然张力枝条一致。并且相对于自然张力的枝条,快速释放张力枝条的PLC降低幅度没有长时间(60 min)释放张力枝条的PLC降低幅度大(分别是降低40%和70%)。即不论是长时间的还是快速的木质部吸水释放张力,低的PLC都是栓塞修复的结果。因此释放张力产生了错误的低PLC值,从而掩盖或降低了栓塞形成及修复的日变化模式。鉴于此,张力释放过程是错误地低估了实际的栓塞水平,即否定了张力-剪断假象(Trifilò et al., 2014)。
Venturas等(2015)专门设计针对性的试验,也没有重复出张力-剪断假象。在试验中Venturas等(2015)使用的是长2.5~4 m的分叉多的大枝条,目的就是枝条长度可以大于树种最大导管长度,在空气中剪断张力枝条时避免导管吸入空气造成试验误差,并用大枝条上相邻的分叉枝条,测定自然张力下的栓塞和释放张力后的栓塞,以保证数据间的可比性,其主要设计的试验如下。试验1:用普通的水溶液和除气的水溶液来检验张力-剪断假象。如果张力-剪断假象与溶液杂质(如水中气泡)有关,使用过滤的除气溶液能降低张力下剪断的枝条的PLC。但是试验发现在普通的水溶液和除气的水溶液中剪断枝条的PLC没有显著差异。试验2:Wheeler等(2013)认为长导管树种的张力-剪断假象会更严重,但是通过长导管和短导管树种的对比,并没有发现长导管树种更趋向于发生张力-剪断假象(Venturas et al., 2015)。试验3:在Venturas等(2015)研究的5个树种中,只有Laurus nobilis这1个树种的自然张力下和释放张力后的PLC存在显著差异,虽然释放张力后所有树种的水势都显著升高。而L. nobilis树种释放张力后的PLC也显著低于环割处理的PLC,而自然张力下和环割处理的PLC之间无显著差异,表明释放张力后其PLC降低是因为栓塞修复。另外,在叶片水力上,通过对4个树种进行研究,张力-剪断假象也未得到证明(Scoffoni et al., 2014);Fukuda等(2015)用核磁共振的方法,也没有发现张力-剪断假象。
5 低压液流方法测定木质部栓塞操作中的建议目前,低压液流方法仍然是国际上认可的高效、实用、可行的1种测定木质部栓塞的主流方法。虽然“张力-剪断假象”对低压液流方法测定木质部栓塞产生了争议,但是这促使了植物水力研究者更加重视对这种方法的规范操作和细节处理(Sperry, 2013; Scoffoni et al., 2014; Trifilò et al., 2014; Fukuda et al., 2015; Venturas et al., 2015)。根据实际操作经验,笔者提出的对低压液流方法操作中应该注意的几点问题及建议。
1) 重视树种的最大导管长度。很多环孔材树种的最大导管长度超过了1 m,在进行栓塞测定试验前应该首先测定所测树种的最大导管长度。在空气中从树上剪下的枝条长度应该1.5~2倍于树种的最大导管长度,测栓塞的茎段应该取自距离切口处至少1.2倍最大导管长度的位置,并且是在水中剪下最终要测栓塞的茎段。对于长导管植物的幼树,可能没有足够长的枝条,可环绕要取的枝条基部做一临时简易漏斗,在水中剪断取枝条。
2) 用剪刀在水中剪下最终要测的茎段时,茎段和剪刀表面可能都附着有空气,剪断时空气会被吸入导管。可小心地擦拭茎段剪断处和剪刀表面,去除空气,再进行剪断。
3) 树木的导管中不是纯水,而是含有很多离子的溶液,在低压液流测定中往往是用15~25 mmol·L-1浓度的KCl溶液进行测定(Trifilò et al., 2014; Venturas et al., 2015; Chen et al., 2017)。而很多其他溶液容易与导管壁产生交互作用,在测定过程中导致导水率下降(Van Ieperen et al., 2000),造成较大误差。用纯净水配制的KCl溶液中也可能含有小颗粒,会堵塞导管(Rockwell et al., 2014),在测定前KCl溶液应该用0.2~0.4 μm的微孔过滤膜进行过滤。
4) 低压液流系统的储水器及管路系统应该经常清洗。可用滴入少许次氯酸钠或洗洁精的水溶液浸泡过夜,再用清水冲洗几次。
5) 进行栓塞测定的茎段在水中剪下之后,要用新的锋利的刀片把茎段两端的切口修平(Venturas et al., 2015)。
6) 低压液流系统中接入茎段的橡胶皮管的粗细应该与茎段的粗细相匹配,如果皮管太粗,则与茎段安装不紧密,测定过程中容易漏水;如果皮管太细,则接入茎段时会给茎段较大的压力,这个压力往往就会把茎段中的栓塞气泡挤压出来,特别是当茎段栓塞程度大或为长导管树种茎段时,因为长导管树种的茎段包含两头开放的导管会比较多,气泡更容易溢出。
7) 测定栓塞值较大或包含两头开放导管比较多的茎段时,测初始导水率的压强可以低一些(2~3 kPa),以避免测初始导水率时就把茎段中的气泡冲出来。
8) 冲洗茎段气泡的条件一定要把握好,因为每个树种的性质不同,需要经过预试验调试。冲洗条件主要包括冲洗压强及冲洗时间。冲洗压强一般为0.1~0.2 MPa,木质部中含有树脂或乳胶的树种在测定中容易出现堵塞,冲洗压强应该调低。另外,对于木质部中薄壁组织丰富的树种,或木质化程度低的茎段(如幼嫩的茎段),冲洗压强也要低,否则会出现冲洗后的最大导水率反而低于初始导水率的情况,这样栓塞为零,肯定是不符合实际的,这种情况下冲洗压强甚至可设为0.08 MPa。冲洗时在冲洗压强下导水率达到最大的时间为冲洗时间,但即使为同一树种,不同栓塞程度下冲洗时间也往往不固定,所以应以实际情况为准。
9) 在低压液流系统接入茎段之前,就应该排除整个测定系统中的气泡。对于栓塞较大的茎段,冲洗过程中会冲出较多气泡,堵塞低压液流系统管路,影响试验结果,这部分气泡也应该去除。
10) 环孔材树种非当年生枝条中的导管易因冬季冻融形成栓塞,且不容易被修复(Cochard et al., 1997),往往只能依赖当年生的导管进行导水。所以非当年生的木质部中包含没有输水功能的由空气填充的导管(非由干旱失水导致),当这样的茎段被冲洗后,冻融栓塞的导管重新具有了导水功能,栓塞值就会被高估。所以对于环孔材树种,建议只测定当年生枝条。
陈志成, 刘畅, 刘晓静, 等. 2017a. 光强和树体大小对锐齿栎树木水、碳平衡的影响[J]. 林业科学, 53(9): 18-25. (Chen Z C, Liu C, Liu X J, et al. 2017a. Effects of irradiation and tree size on the carbon-water balances of Quercus aliena var acuteserrata[J]. Scientia Silvae Sinicae, 53(9): 18-25. [in Chinese]) |
陈志成, 陆海波, 刘晓静, 等. 2017b. 宝天曼三桠乌药对降雨减少后的生理生态响应[J]. 林业科学研究, 30(3): 430-435. (Chen Z C, Lu H B, Liu X J, et al. 2017b. Ecophysiological Responses of Lindera obtusiloba to rainfall reduction in baotianman nature reserve[J]. Forest Research, 30(3): 430-435. [in Chinese]) |
陈志成, 万贤崇. 2016. 虫害叶损失造成的树木非结构性碳减少与树木生长、死亡的关系研究进展[J]. 植物生态学报, 40(9): 958-968. (Chen Z C, Wan X C. 2016. The relationship between the reduction of nonstructural carbohydrate induced by defoliator and the growth and mortality of trees[J]. Chinese Journal of Plant Ecology, 40(9): 958-968. DOI:10.17521/cjpe.2015.0443 [in Chinese]) |
万贤崇, 孟平. 2007. 植物体内水分长距离运输的生理生态学机制[J]. 植物生态学报, 31(5): 804-813. (Wan X C, Meng P.. 2007. Physiological and ecological mechanisms of long-distance water transport in plants: a review of recent issues[J]. Chinese Journal of Plant Ecology, 31(5): 804-813. DOI:10.17521/cjpe.2007.0102 [in Chinese]) |
Anderegg W R L, Berry J A, Smith D D, et al. 2012. The roles of hydraulic and carbon stress in a widespread climate-induced forest die-off[J]. Proceedings of the National Academy of Sciences of the United States of America, 109(1): 233-237. DOI:10.1073/pnas.1107891109 |
Brodersen C R, McElrone A J, Choat B, et al. 2013. In vivo visualizations of drought-induced embolism spread in Vitis vinifera[J]. Plant Physiology, 161(4): 1820-1829. DOI:10.1104/pp.112.212712 |
Brodersen C R, McElrone A J, Choat B, et al. 2010. The dynamics of embolism repair in xylem: in vivo visualizations using high-resolution computed tomography[J]. Plant Physiology, 154(3): 1088-1095. DOI:10.1104/pp.110.162396 |
Brodersen C R, Rico C, Guenni O, et al. 2016. Embolism spread in the primary xylem of Polystichum munitum: implications for water transport during seasonal drought[J]. Plant, Cell & Environment, 39(2): 338-346. |
Bucci S J, Scholz F G, Goldstein G, et al. 2003. Dynamic changes in hydraulic conductivity in petioles of two savanna tree species: factors and mechanisms contributing to the refilling of embolized vessels[J]. Plant, Cell & Environment, 26(10): 1633-1645. |
Chen Z, Wang L, Dai Y, et al. 2017. Phenology-dependent variation in the non-structural carbohydrates of broadleaf evergreen species plays an important role in determining tolerance to defoliation (or herbivory)[J]. Scientific Reports, 7. DOI:10.1038/s41598-017-09757-2 |
Choat B, Badel E, Burlett R, et al. 2016. Noninvasive measurement of vulnerability to drought-induced embolism by X-ray microtomography[J]. Plant Physiology, 170(1): 273-282. DOI:10.1104/pp.15.00732 |
Choat B, Brodersen C R, McElrone A J. 2015. Synchrotron X-ray microtomography of xylem embolism in Sequoia sempervirens saplings during cycles of drought and recovery[J]. New Phytologist, 205(3): 1095-1105. DOI:10.1111/nph.13110 |
Choat B, Jansen S, Brodribb T J, et al. 2012. Global convergence in the vulnerability of forests to drought[J]. Nature, 491(7426): 752-755. DOI:10.1038/nature11688 |
Cochard H, Badel E, Herbette S, et al. 2013. Methods for measuring plant vulnerability to cavitation: a critical review[J]. Journal of Experimental Botany, 64(15): 4779-4791. DOI:10.1093/jxb/ert193 |
Cochard H, Delzon S, Badel E. 2015. X-ray microtomography (micro-CT): a reference technology for high-resolution quantification of xylem embolism in trees[J]. Plant, Cell & Environment, 38(1): 201-206. |
Cochard H, Peiffer M, Le Gall K, Granier A. 1997. Developmental control of xylem hydraulic resistances and vulnerability to embolism in Fraxinus excelsior L[J]. Impacts on water relations. Journal of Experimental Botany, 48(308): 655-663. |
Dixon H H. 1914. Transpiration and the ascent of sap. Macmillan and Co. Ltd., London.
|
Dixon H H, Joly J. 1895. On the ascent of sap[J]. Philosophical Transactions of the Royal Society of London B, 186(4): 563-576. |
Ewart A J. 1906. The ascent of water in trees[J]. Science, 20(501): 179-179. |
Fukuda K, Kawaguchi D, Aihara T, et al. 2015. Vulnerability to cavitation differs between current-year and older xylem: non-destructive observation with a compact magnetic resonance imaging system of two deciduous diffuse-porous species[J]. Plant, Cell & Environment, 38(12): 2508-2518. |
Hacke U G, Sauter J J. 1995. Vulnerability of xylem to embolism in relation to leaf water potential and stomatal conductance in Fagus sylvatica f. purpurea and Populus balsamifera[J]. Journal of Experimental Botany, 46(290): 1177-1183. |
Hacke U G, Sperry J S. 2003. Limits to xylem refilling under negative pressure in Laurus nobilis and Acer negundo[J]. Plant, Cell & Environment, 26(2): 303-311. |
Haines F M. 1935. Observations on the occurrence of air in conducting tracts[J]. Annals of Botany, 49(194): 367-379. |
Holbrook N M, Ahrens E T, Burns M J, et al. 2001. In vivo observation of cavitation and embolism repair using magnetic resonance imaging[J]. Plant Physiology, 126(1): 27-31. DOI:10.1104/pp.126.1.27 |
Jansen S, Schuldt B, Choat B. 2015. Current controversies and challenges in applying plant hydraulic techniques[J]. New Phytologist, 205(3): 961-964. DOI:10.1111/nph.13229 |
Jarbeau J A, Ewers F W, Davis S D. 1995. The mechanism of water-stress-induced embolism in two species of chaparral shrubs[J]. Plant, Cell & Environment, 18(2): 189-196. |
Kikuta S B, Richter H. 2003. Ultrasound acoustic emissions from freezing xylem[J]. Plant, Cell & Environment, 26(3): 383-388. |
Koch G W, Sillett S C, Jennings G M, et al. 2004. The limits to tree height[J]. Nature, 428(22): 851-854. |
Mayr S, Rosner S. 2011. Cavitation in dehydrating xylem of Picea abies: energy properties of ultrasonic emissions reflect tracheid dimensions[J]. Tree Physiology, 31(1): 59-67. DOI:10.1093/treephys/tpq099 |
McDowell N G, Pockman W T, Allen C D, et al. 2008. Mechanisms of plant survival and mortality during drought: why do some plants survive while others succumb to drought?[J]. New Phytologist, 178(4): 719-739. DOI:10.1111/j.1469-8137.2008.02436.x |
Milburn J A, Johnson R P C. 1966. The conduction of sap Ⅱ. Detection of vibrations produced by sap cavitation in Ricinus xylem[J]. Planta, 69(1): 43-52. DOI:10.1007/BF00380209 |
Nardini A, Lo Gullo M A, Salleo S. 2011. Refilling embolized xylem conduits: is it a matter of phloem unloading?[J]. Plant Science, 180(4): 604-611. DOI:10.1016/j.plantsci.2010.12.011 |
Nolf M, Beikircher B, Rosner S, et al. 2015. Xylem cavitation resistance can be estimated based on time-dependent rate of acoustic emissions[J]. New Phytologist, 208(2): 625-632. DOI:10.1111/nph.2015.208.issue-2 |
Rockwell F E, Wheeler J K, Holbrook N M. 2014. Cavitation and its discontents: opportunities for resolving current controversies[J]. Plant Physiology, 164(4): 1649-1660. DOI:10.1104/pp.113.233817 |
Salleo S, Lo Gullo M A, De Paoli D, et al. 1996. Xylem recovery from cavitation-induced embolism in young plants of Laurus nobilis: a possible mechanism[J]. New Phytologist, 132(1): 47-56. DOI:10.1111/nph.1996.132.issue-1 |
Scoffoni C, Albuquerque C, Brodersen C R, et al. 2017. Leaf vein xylem conduit diameter influences susceptibility to embolism and hydraulic decline[J]. New Phytologist, 213(3): 1076-1092. DOI:10.1111/nph.14256 |
Scoffoni C, Sack L. 2014. Are leaves 'freewheelin'? Testing for a Wheeler-type effect in leaf xylem hydraulic decline[J]. Plant, Cell & Environment, 38(3): 534-543. |
Sperry J S. 1986. Relationship of xylem embolism to xylem pressure potential, stomatal closure, and shoot morphology in the palm Rhapis excelsa[J]. Plant Physiology, 80(1): 110-116. DOI:10.1104/pp.80.1.110 |
Sperry J S. 2013. Cutting-edge research or cutting-edge artefact? An overdue control experiment complicates the xylem refilling story[J]. Plant Cell & Environment, 36(11): 1916-1918. |
Sperry J S, Christman M A, Torres-Ruiz J M, et al. 2012. Vulnerability curves by centrifugation: is there an open vessel artefact, and are 'r' shaped curves necessarily invalid?[J]. Plant, Cell & Environment, 35(3): 601-610. |
Sperry J S, Donnelly J R, Tyree M T. 1988. A method for measuring hydraulic conductivity and embolism in xylem[J]. Plant, Cell & Environment, 11(1): 35-40. |
Stiller V, Sperry J S, Lafitte R. 2005. Embolized conduits of rice (Oryza sativa, Poaceae) refill despite negative xylem pressure[J]. American Journal of Botany, 92(12): 1970-1974. DOI:10.3732/ajb.92.12.1970 |
Trifilò P, Raimondo F, Lo Gullo M A, et al. 2014. Relax and refill: xylem rehydration prior to hydraulic measurements favours embolism repair in stems and generates artificially low PLC values[J]. Plant, Cell & Environment, 37(11): 2491-2499. |
Tyree M T, Dixon M A. 1986. Water stress induced cavitation and embolism in some woody plants[J]. Physiologia Plantarum, 66(3): 397-405. DOI:10.1111/ppl.1986.66.issue-3 |
Tyree M T, Ewers F W. 1991. The hydraulic architecture of trees and other woody plants[J]. New Phytologist, 119(3): 345-360. DOI:10.1111/nph.1991.119.issue-3 |
Tyree M T, Salleo S, Nardini A, et al. 1999. Refilling of embolized vessels in young stems of laurel[J]. Do we need a new paradigm? Plant Physiology, 120(1): 11-22. |
Tyree M T, Yang S. 1992. Hydraulic conductivity recovery versus water pressure in xylem of Acer saccharum[J]. Plant Physiology, 100(2): 669-676. DOI:10.1104/pp.100.2.669 |
Van Ieperen W, Van Meeteren U, Van Gelder H. 2000. Fluid ionic composition influences hydraulic conductance of xylem conduits[J]. Journal of Experimental Botany, 51(345): 769-776. DOI:10.1093/jexbot/51.345.769 |
Venturas M D, Evan D. MacKinnon, et al. 2015. Excising stem samples underwater at native tension does not induce xylem cavitation[J]. Plant, Cell & Environment, 38(6): 1060-1068. |
Wheeler J K, Huggett B A, Tofte A N, et al. 2013. Cutting xylem under tension or supersaturated with gas can generate PLC and the appearance of rapid recovery from embolism[J]. Plant, Cell & Environment, 36(11): 1938-1949. |
Wolkerstorfer S V, Rosner S, Hietz P. 2012. An improved method and data analysis for ultrasound acoustic emissions and xylem vulnerability in conifer wood[J]. Physiologia Plantarum, 146(2): 184-191. DOI:10.1111/j.1399-3054.2012.01605.x |
Yang S, Tyree M T. 1992. A theoretical model of hydraulic conductivity recovery from embolism with comparison to experimental data on Acer saccharum[J]. Plant, Cell & Environment, 15(6): 633-643. |
Young D J N, Stevens J T, Earles J M, et al. 2017. Long-term climate and competition explain forestmortality patterns under extreme drought[J]. Ecology Letters, 20(1): 78-86. DOI:10.1111/ele.2017.20.issue-1 |
Zimmermann M H. 1978. Hydraulic architecture of some diffuseporous trees[J]. Canadian Journal of Botany, 56(18): 2286-2295. DOI:10.1139/b78-274 |
Zufferey V, Cochard H, Ameglio T, et al. 2011. Diurnal cycles of embolism formation and repair in petioles of grapevine (Vitis vinifera cv. Chasselas)[J]. Journal of Experimental Botany, 62(11): 3885-3894. DOI:10.1093/jxb/err081 |
Zwieniecki M A, Holbrook N M. 1998. Diurnal variation in xylem hydraulic conductivity in white ash (Fraxinus americana L.), red maple (Acer rubrum L.) and red spruce (Picea rubens Sarg.)[J]. Plant, Cell & Environment, 21(11): 1015-1020. |
 2018, Vol. 54
2018, Vol. 54

