文章信息
- 王娟, 陈辉
- Wang Juan, Chen Hui
- 华山松大小蠹冷休克结合蛋白的鉴定与表达
- Identification and Expression of Cold Shock Domain-containing Protein Gene in Dendroctonus armandi
- 林业科学, 2018, 54(4): 58-66.
- Scientia Silvae Sinicae, 2018, 54(4): 58-66.
- DOI: 10.11707/j.1001-7488.20180407
-
文章历史
- 收稿日期:2016-11-28
- 修回日期:2018-01-11
-
作者相关文章
2. 西北农林科技大学林学院 杨凌 712100;
3. 华南农业大学林学与风景园林学院 广州 510642
2. College of Forestry, Northwest A & F University Yangling 712100;
3. College of Forestry and Landscape Architecture, South China Agricultural University Guangzhou 510642
生物有机体在环境温度发生明显改变时会产生某种蛋白以调节机体功能适应温度变化。热激蛋白(heat shock proteins,HSPs)又称热休克蛋白,是细胞在应激原(如高温)刺激下生成的一组蛋白质,温度明显增高时热激蛋白表达会显著提高(孙卫忠等,2003)。近年来研究发现当环境温度降低时,生物体也会产生一组蛋白质适应环境温度的变化,通常将这组蛋白质称为“冷休克结合蛋白”(cold shock domain-containing proteins,CSPs),且CSPs的表达与环境温度的下降有高度相关性(王辉等,2015)。现阶段冷休克结合蛋白表达调控机制的研究对象多以微生物为主,重点研究其复制、转录和翻译等过程中CSPs的表达调控(Tateno et al., 2007)。Turner等(2007)和Inouye等(2008)研究表明,大肠杆菌(Escherichia coli)冷诱导的蛋白并非直接发生在冷休克之后,而是依赖核糖体不能有效地翻译蛋白质(Bae et al., 1999; Ding et al., 2008)。对于CSPs的生物学功能,目前一致认为作为RNA伴侣(RNA-chaperone)与mRNA结合,起到稳定RNA、避免降解和促进翻译的功能(Awano et al., 2007; Kuhlmann et al., 2011)。尽管不同CSPs间存在差异,但CSP与RNA或DNA(单链)的结合具有非特异性(Eriksson et al., 2011; Mojib et al., 2011)。
特殊的地理环境和气候特征造就独特的生物生态系统。在生态系统中威胁生物生存的胁迫因素包括pH、盐度、氧浓度和温度等,其中低温是制约生物生命活动的一个主要因素(Khani et al., 2007; Koštál et al., 2011; Wang et al., 2017)。长期进化过程中生物体形成多种抗逆机制,逆境胁迫下昆虫体内通过诱导多基因表达、产生应激蛋白等方式帮助细胞在新的环境下完成其生理功能,使昆虫对逆境胁迫作出积极的反应(Lee et al., 1987; Hou et al., 2010; Wang et al., 2011)。多数昆虫受到非冰冻低温胁迫后,抗寒性得到明显提升,这一现象称为冷驯化或低温驯化(Koštál et al., 2011)。生物体冷驯化过程中,会启动相关基因的转录和翻译,生成耐寒相关蛋白质产物,这类低温诱导下可进行表达的蛋白质称为冷诱导蛋白(Zhu et al., 2007; Chinnusam et al., 2010)。冷诱导蛋白主要有抗冻蛋白、脱水蛋白、冷激蛋白和热激蛋白等,均与生物抗寒性紧密相关(Chinnusamy et al., 2007; Roy et al., 2011)。广泛存在于生物体中的冷激蛋白是一种应激蛋白,存在于细菌、植物和动物中,是一类高度保守的核酸结合蛋白,冷激蛋白以RNA分子伴侣形式参与生物体内生长发育及逆境胁迫应答等细胞活动(Chaikam et al., 2010)。冷休克反应(cold shock response)通常是生物为减小低温环境对有机体的伤害而表现出的一系列生理变化。在缓慢低温环境下生物首先产生冷休克行为反应,如身体蜷缩、寒战、寻找热源等,之后随着低温的持续和保持稳定寒冷刺激,生物体的一系列代谢发生特异性变化,如甲状腺激素分泌增多、冷休克相关酶代谢活性增强、能量代谢升高等,使有机体在低温下的存活时间延长(Weber et al., 2001; Yamanaka et al., 2001; Wang et al., 2016; Wang et al., 2017)。进一步的研究发现,当外界温度降低时生物有机体会产生多种多肽类物质、细胞因子和一类特殊蛋白(CSPs),这种蛋白在低温时高度表达(Santagata et al., 2012)。同时,部分学者推测在低温条件下CSPs的高表达与器官或组织的保护作用密切相关(Nonoguchi et al., 1999)。
小蠹虫在世界森林生态系统内的持续发生与小蠹虫对寄主树木的高度选择、隐蔽性生活方式有密切关系(Liu et al., 2010; Chen et al., 2011; Liu et al., 2014)。小蠹虫因忍受寒冷低温等自然环境对种群的影响,进化形成自身忍耐寒冷低温的机制(Preisler et al., 2012; Creeden et al., 2014)。为此,小蠹虫的耐寒性成为研究小蠹虫种群密度、扩散和分布的重要指标。华山松大小蠹(Dendroctonus armandi)是仅分布于我国秦岭巴山地区天然森林生态系统内最具危害性的小蠹种类,集中入侵危害秦岭巴山林区30年以上健康华山松(Pinus armandi),以幼虫(少量蛹或成虫)在韧皮部与木质部间越冬,抵御秦岭巴山林区低温和寒冷的侵袭,维持种群密度的相对稳定和持续发生(Chen et al., 2007; Hu et al., 2015; Chen et al., 2015; Dai et al., 2015)。目前对华山松大小蠹耐寒策略的调控机制研究主要是在耐寒性、过冷却点和抗冻保护物质等生理生化方面(Wang et al., 2016; 2017)。本研究通过探究冷休克结合蛋白在华山松大小蠹幼虫越冬期间的变化情况,对比越夏成虫和越冬幼虫在不同低温下暴露不同时间后的相对表达量,揭示冷休克结合蛋白基因在华山松大小蠹克服低温胁迫的作用和功能。
1 材料与方法 1.1 华山松大小蠹的采集华山松大小蠹越冬幼虫采于2014年9月至2015年4月每月中旬,成虫采于2015年7月。采样地位于陕西省秦岭森林生态定位站(33°17′— 33°27′N,108°22′—108°40′E)。每次采集共选取3个样方,每个样方大小为20 m × 20 m,每个样方按照5点取样,各选取5株被华山松大小蠹入侵危害的华山松,在被害树木地径至树高3 m以下剥去华山松韧皮部(20 cm × 20 cm),在韧皮部和木质部间采集华山松大小蠹越冬幼虫及成虫,装入冰壶带回试验室,以保证华山松大小蠹存活率。
1.2 总RNA的提取与cDNA的合成提取RNA前,对华山松大小蠹依次用灭菌三蒸水冲洗虫体表面,70%酒精表面消毒30 s,再用灭菌三蒸水冲洗虫体2次。将其放置在10 mmol·L-1的PBS缓冲液(NaCl 138 mmol·L-1,KCl 2.7 mmol-1,Na2HPO4 10 mmol·L-1,KH2PO4 2 mmol·L-1,pH 7.4)中浸泡30 s,灭菌三蒸水冲洗3遍,置于1.5 mL灭菌离心管中备用。
华山松大小蠹总RNA的提取采用UNlQ-10柱式Trizol总RNA抽提试剂盒(上海生工生物工程股份有限公司)。分别各取3头华山松大小蠹成虫、5头幼虫放于加有液氮的研钵中,迅速研磨至粉末状,在液氮挥发完之前,将粉末迅速转至含有Trizol裂解液的EP管中,充分振荡,混匀;其余操作按试剂盒的说明进行(阮梦鸽等,2015)。用1%琼脂糖凝胶电泳检测总RNA的完整性;用紫外/可见分光光度计(Nano Drop ND-1000 Spectrophotometer)检测总RNA的浓度和纯度(阮梦鸽等,2015)。以500 ng(OD260/OD280=1.80~2.10)总RNA为模板进行cDNA的合成。第1链cDNA的合成采用PrimeScriptTM RT reagent Kit with gDNA Eraser(Perfect real time)试剂盒(大连Takara-宝生物工程有限公司,中国)方法,置于-80 ℃冰箱保存反转录产物cDNA。
1.3 华山松大小蠹DarmCSP基因的克隆用Primer Premier 5.0软件设计华山松大小蠹转录组结果中获取的DarmCSP序列PCR引物:DarmCSP-F1:CGGATGAGAAACCCTT,DarmCSP-R1:AGGTCGGCAAATGAAC。引物由上海生物工程有限公司合成。产物最终体系为50 μL,包括25 μL 2 × Taq Master Mix(北京康为世纪生物科技有限公司),上、下游引物各0.5 μL(10 μmol·L-1),1 μL合成的cDNA和23 μL RNase-free水。PCR反应条件:95 ℃ 3 min;95 ℃ 30 s,51 ℃ 30 s,72 ℃ 30 s,24个循环;72 ℃ 10 min。用1%琼脂糖凝胶电泳分离PCR产物后,用凝胶纯化试剂盒(离心柱)(北京百泰克生物技术有限公司)切胶回收、纯化,送金斯瑞生物科技有限公司测序。用DNAMAN软件将测序后的片段序列翻译成氨基酸序列,并进行相似性比对(阮梦鸽等,2015)。
1.4 低温胁迫处理将采集于2014年9月至2015年4月的越冬幼虫装入冰壶带回冲洗后,直接置于液氮中研磨,进行RNA提取,并反转录合成cDNA,留作实时荧光定量PCR检测。
将采集到的越冬幼虫(采集于2015年1月)和越夏成虫(采集于2015年7月)分别置于不同低温(4、0、-2、-4、-6、-8和-10 ℃)下处理1、3、6、12、18和24 h,采用干式恒温金属浴(浙江杭州朗基科学仪器有限公司,中国)低温处理2 160头华山松大小蠹(1 260头幼虫、900头成虫)。预试验结果表明,华山松大小蠹越夏成虫无法在-8、-10 ℃下存活,因此,越夏成虫低温处理调整为5个梯度,即4、0、-2、-4和-6 ℃。将所有低温处理后的华山松大小蠹成虫和幼虫在室温下放置1 h,用镊子检查华山松大小蠹是否存活(Ma et al., 2006; Atapour et al., 2009)。选取存活的成虫和幼虫进行RNA提取,并反转录合成cDNA,进行实时荧光定量PCR检测。
1.5 实时荧光定量PCR引物设计及标准质粒构建根据华山松大小蠹DarmCSP基因的cDNA序列,将低温胁迫处理后的华山松大小蠹成虫和幼虫进行CFX-96实时荧光定量PCR(Bio-Rad,Hercules,CA,USA),以华山松大小蠹actin(GenBank登录号:KJ507200)基因作为内参基因。实时荧光定量PCR引物为F1:GTTCGCTGGATTCGTTTG,R1:AAGCTC GACTGTTCTTTCACTT。PCR反应体系为:95 ℃ 10 min,95 ℃ 15 s,57 ℃ 30 s,72 ℃ 25 s,39个循环;72 ℃ 10 min。样品,内参和阴性对照均重复3次以确保重现性。用1%琼脂糖凝胶电泳分离PCR产物后,用PCR产物纯化回收试剂盒纯化回收PCR产物(北京百泰克生物技术有限公司)。构建至pMDTM 18-T重组质粒,转化至大肠杆菌DH5α,将白色单菌落挑取并接种于含有Amp+抗性的SOC液体培养基,送金斯瑞生物科技有限公司测序;将测序正确的重组质粒溶液用紫外分光光度计OD260/OD280测定其纯度,并记录其浓度(阮梦鸽等,2015)。用-80 ℃冰箱储存此溶液作为标准品原液备用,配置不同浓度的标准品,进行荧光定量PCR,以Ct值作图,获得标准曲线(阮梦鸽等,2015)。
取1 μL稀释7倍后的cDNA进行实时荧光定量PCR。反应体系为20 μL,包括10 μL 2 × SYBR Premix Ex Taq(Roche Diagnostics GmbH,Sandhofer Straẞe,Mannheim,Germany),上、下游引物各0.3 μL(10 μmol·L-1),cDNA模板1 μL,和8.4 μL DEPC水。每份样品同时扩增actin参照基因,每个样品重复测3次。扩增DarmCSP和actin基因的PCR反应条件相同:95 ℃ 10 min,95 ℃ 15 s,57 ℃ 30 s,72 ℃ 25 s,39个循环;72 ℃ 10 min。在每次PCR程序完成后,将60 ℃设置为检测产物溶解曲线的温度,阴性对照中不加入模板,记录Ct值(阮梦鸽等,2015)。
1.6 数据分析试验所用方法为SYBE GREEN Ⅰ的荧光染料法,基因相对表达量计算采用2-ΔΔCt法。基因表达量最终与对照组相比,得到相对表达量的倍数(阮梦鸽等,2015)。数据采用统计学软件SPSS 18.0进行单因素方差分析(one-way ANOVA),作图采用Sigma Plot 12.5软件。
2 结果与分析 2.1 华山松大小蠹DarmCSP基因序列比对和系统发育树的构建本研究DarmCSP基因通过已测序的华山松大小蠹cDNA转录组序列克隆获得,经Blast比对,发现鞘翅目昆虫冷休克结合蛋白基因与华山松大小蠹DarmCSP基因具有较高同源性,相似性在65%以上。将6种鞘翅目昆虫冷休克结合蛋白氨基酸序列与DarmCSP进行相似性比较,发现:华山松大小蠹DarmCSP与黑山大小蠹(Dendroctonus ponderosae)冷休克结合蛋白的序列相似性最高(92%),与光肩星天牛(Anoplophora glabripennis)的次之(75%),与圣甲虫(Oryctes borbonicus)和赤拟谷盗(Tribolium castaneum)的达74%,与埋葬虫(Nicrophorus vespilloides)的达71%,与白蜡窄吉丁(Agrilus planipennis)的达67%(表 1)。将华山松大小蠹DarmCSP与这6种鞘翅目昆虫冷休克结合蛋白氨基酸序列进行系统发育树(neighbor-joining tree)构建,发现黑山大小蠹与华山松大小蠹聚为一支,与其他鞘翅目昆虫的遗传距离也较近(图 1)。
|
|

|
图 1 7种鞘翅目昆虫冷休克结合蛋白基因系统发育树分析 Figure 1 Phylogenetic relationships of CSPs gene of 7 Coleoptera insects |
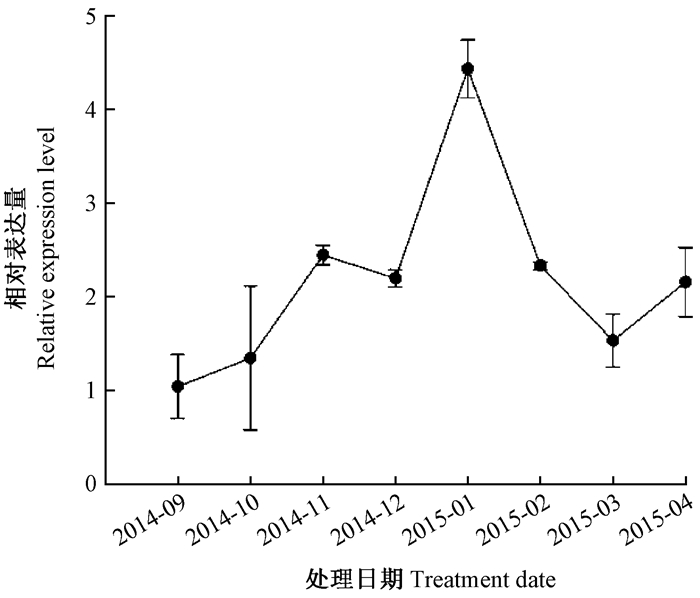
利用实时荧光定量PCR分析越冬期间(2014年9月—2015年3月)DarmCSP表达特性,结果显示:越冬期间华山松大小蠹DarmCSP相对表达量上调。越冬期(1月)DarmCSP相对表达量是越冬前期(9月)的4.26倍,越冬后期(3月)的2.90倍,各月份间DarmCSP相对表达量差异显著(P < 0. 05)(图 2)。
|
图 2 DarmCSP在华山松大小蠹幼虫各月份(2014年9月—2015年4月)的表达 Figure 2 Expression of DarmCSP in each month (Sep. 2014-Apr. 2015) of D. armandi |
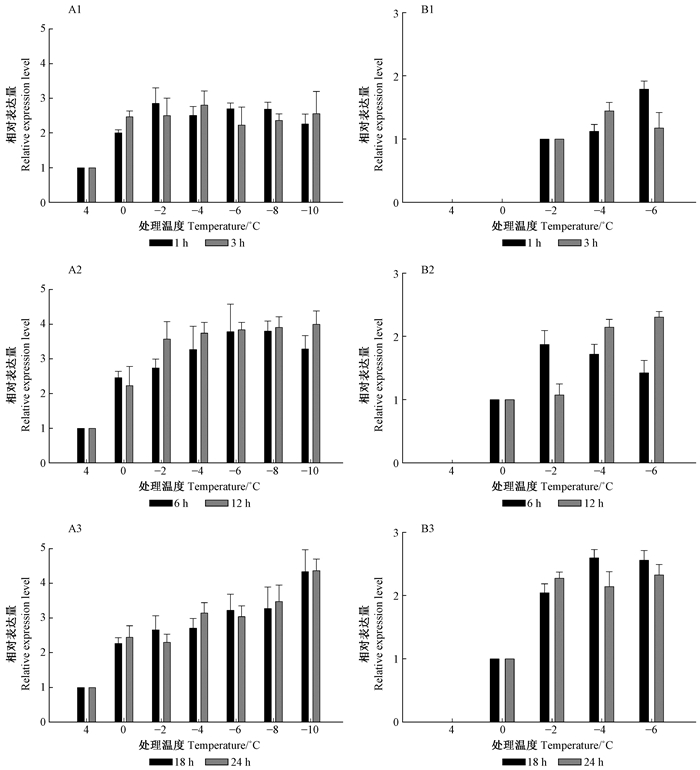
将越冬幼虫(2015年1月)和越夏成虫(2015年7月)置于不同低温下检测华山松大小蠹DarmCSP相对表达量差异,发现越冬幼虫和越夏成虫DarmCSP相对表达量在低温胁迫下均上调(图 3),且2种虫态低温处理不同时间后DarmCSP表达量存在差异。-10 ℃低温下处理华山松大小蠹越冬幼虫1~24 h,DarmCSP相对表达量呈升高趋势,最大峰值出现在-10 ℃胁迫24 h,相对表达量为室温对照的4.37倍(图 3 A3)。DarmCSP表达在0~ -10 ℃低温下可被诱导(图 3A)。-2、-4、-6、-8 ℃低温下胁迫12 h,DarmCSP相对表达量均达各自最大峰值,分别为室温对照的3.58、3.74、3.84、3.91倍(图 3A2)。
|
图 3 DarmCSP在华山松大小蠹越冬幼虫(2015年1月,A)和越夏成虫(2015年7月,B)中的表达 Figure 3 Expression of DarmCSP of overwintering D. armandi larvae (Jan. 2015, A) and oversummering D. armandi adults (Jul. 2015, B) A1—A3:越冬幼虫低温处理(4~-10 ℃)的不同时长(1~24 h) Overwintering D. armandi larvae were treated at low temperature (4--10 ℃) for different time (1-24 h); B1—B3:越夏成虫低温处理(0~-6 ℃)的不同时长(1~24 h) Oversummering D. armandi adults were treated at low temperature (0--6 ℃)for different time (1~24 h). |
低温(4~-6 ℃)使华山松大小蠹越夏成虫的DarmCSP相对表达量也呈上调趋势(图 3B),且低于越冬幼虫DarmCSP相对表达量。4 ℃胁迫1~24 h和0 ℃胁迫1、3 h均未出现冷休克结合蛋白的表达(图 3B1),直至0 ℃胁迫6 h时表现出DarmCSP相对表达量变化(图 3B2)。DarmCSP相对表达量最大峰值出现在0 ℃和-4 ℃处理18 h(图 3B3)。此外,华山松大小蠹越冬幼虫DarmCSP基因表达水平均高于越夏成虫。
3 讨论本研究中华山松大小蠹CSP cDNA序列从转录组测序结果中获得,DarmCSP与鞘翅目昆虫CSP具有较高同源性,氨基酸序列一致性处于67%~92%之间;与黑山大小蠹氨基酸序列一致性最高,表明CSP在物种间具有高度保守性。利用实时荧光定量PCR分析华山松大小蠹越冬幼虫和越夏成虫冷休克结合蛋白DarmCSP基因表达差异,发现华山松大小蠹冷休克结合蛋白DarmCSP相对表达量越冬期间上调,且可通过低温胁迫诱导其表达;同时,低温胁迫越夏成虫DarmCSP相对表达量也呈上调趋势,但低于越冬幼虫DarmCSP相对表达量。
冷休克结合蛋白在动物、植物与细菌均有发现,最早被发现的是大肠杆菌冷休克结合蛋白CspA(Jones et al., 1987; Movahedi et al., 2002),随后在对大肠杆菌研究中又发现8种CspA的同源性蛋白(CspB—CspI),CspA、CspB、CspE、CspG和CspI可被低温诱导(Uppal et al., 2015),说明大肠杆菌冷休克结合蛋白由多同源性蛋白组成。本研究从华山松大小蠹转录组测序结果中成功克隆到一条冷休克结合蛋白DarmCSP基因,并未发现其他同源性蛋白基因的存在,说明在华山松大小蠹转录组测序样品中DarmCSP相对表达量高,但是否存在华山松大小蠹冷休克结合蛋白其他同源性基因还需要进一步验证。
短时低温暴露可产生昆虫快速冷适应(rapid cold hardening)(Lee et al., 1987),小分子渗透保护类物质(Lee et al., 1987)、膜相关蛋白(Qin et al., 2005)、热激蛋白(Feder et al., 1999; Wang et al., 2011)和抗冻蛋白(Hou et al., 2010)等耐寒相关基因及其产物会迅速表达与合成。非洲爪蟾(Xenopus laevis)冷诱导RNA结合蛋白(cold inducible RNA-binding protein,CIRP)的表达研究发现CSP在肝脏和脑组织中的表达方式不同,低温可诱导脑组织CIRP表达,当温度升高逐渐恢复至24 ℃时,脑组织CIRP表达量显著下降;冬季非洲爪蟾脑组织CIRP强烈表达,在夏季表达量很低,肝脏中则未见上述现象(Saito et al., 2010)。Sugimoto等(2008)利用RT-PCR定量分析CIRP表达量,发现在冷应激的条件下,日本树蛙(Hyla japonica) CIRP在脑、眼及睾丸中表达量高,且脑、眼12月的CIRP表达总量显著高于7月。上述研究表明动物冬眠过程中CIRP基因可能发挥着一定的作用,通过对众多目标基因的表达调控,影响生物体的越冬和冬眠行为。
冷驯化(cold-acclimation)是将昆虫暴露于亚致死低温一段时间可有效地提高其在致死低温下存活率的过程和现象,适当的冷驯化可以提高昆虫的抗寒能力,增强昆虫耐寒性的2种主要驯化策略包括快速冷驯化(rapid cold hardening,RCH)和长时冷驯化(cold acclimation,CA)。黑腹果蝇(Drosophila melanogaster)在暴露于-5 ℃之前经RCH(以0.1 ℃·min-1从25 ℃降温至0 ℃,并在0 ℃保持1 h)处理72 h的死亡率为37%,显著低于直接进行冷休克处理的60%(Overgaard et al., 2007)。RCH可以抑制昆虫体内物质的产生,避免细胞甚至虫体死亡。Yi等(2011)的研究表明,RCH通过抑制红尾肉蝇(Sarcophaga crassipalpis)半胱氨酸酶前体的活化,避免冷休克诱导的细胞程序性死亡,从而降低组织细胞的死亡率。Shintani等(2007)对黄星天牛(Psacothea hilaris)卵的耐寒性研究表明,经CA(15.5 ℃保持9天)处理再暴露于0~22 ℃低温时,卵存活率显著高于未经CA处理(25 ℃保持5天后进行低温暴露);在冷胁迫(-10 ℃暴露8 h以上)条件下经CA处理的卵存活率显著高于经RCH(0 ℃暴露4 h)处理的卵。本研究通过对华山松大小蠹DarmCSP基因进行低温胁迫发现,越冬过程越深入,幼虫DarmCSP相对表达量越高,且不同低温胁迫后的DarmCSP表达水平均高于对照组(4 ℃)。上述研究结果表明,华山松大小蠹快速冷适应机制可能与冷诱导下CSP相对表达量的上升有关,华山松大小蠹DarmCSP基因积极响应低温胁迫,华山松大小蠹越冬幼虫DarmCSP的上调表达可能是其应对冷适应的机制之一。
生物体遭遇不利环境胁迫时会产生一种进化上高度保守的特定应激性蛋白——热激蛋白(Lindquist 1986; 景晓红等,2002; Zhao et al., 2012),有机体遭遇冷或热胁迫最明显的生理变化之一就是上调热激蛋白表达量(陈亮,2007);同样,生物体遭遇正常生理温度以下的环境低温时也会产生瞬时冷诱导反应,并伴随着细胞生长速率的下降和蛋白质合成的抑制,但冷诱导蛋白(cold induced protein,CIP)表达量却会显著上调,其中冷休克结合蛋白诱导最为强烈(Welker et al., 1999)。在本研究中华山松大小蠹越冬幼虫冷休克结合蛋白在冬季相对表达量上调,且越冬幼虫冷休克结合蛋白的相对表达量明显高于越夏成虫,说明低温诱导使华山松大小蠹越冬幼虫冷休克结合蛋白高表达。华山松大小蠹越夏成虫冷休克结合蛋白4 ℃胁迫1~24 h和0 ℃胁迫1 h和3 h均不表达,在0 ℃胁迫6 h时冷休克结合蛋白开始表达,这可能是由于0 ℃ 6 h的低温胁迫使越夏成虫产生瞬时冷诱导反应,刺激冷休克结合蛋白进行表达,增强越夏成虫的低温忍耐能力以保证存活率,这也可能是华山松大小蠹遭遇短时骤然降温或较大昼夜温差变化时仍能保证种群数量的原因之一。
4 结论本研究分析了华山松大小蠹CSP基因在响应低温下的表达特性,表明华山松大小蠹DarmCSP基因受低温诱导,可能在华山松大小蠹响应寒冷过程中发挥重要作用。研究结果有助于深入了解分布和持续发生于秦岭巴山寒冷地带的华山松大小蠹对外界环境温度刺激的信号转导机制。
陈亮. 2007. 光滑鳖甲热休克蛋白70基因及抗冻蛋白基因表达规律的初步研究. 乌鲁木齐: 新疆大学硕士学位论文. (Chen L. 2007. Expression analysis of antifreeze protein gene and shock heat protein 70 gene from Anatolica polita borealis. Urumuqi: MS thesis of Xinjiang University. [in Chinese]) |
景晓红, 康乐. 2002. 昆虫耐寒性研究[J]. 生态学报, 22(12): 2202-2207. (Jing X H, Kang L. 2002. Research progress in insect cold hardines[J]. Acta Ecological Sinica, 22(12): 2202-2207. DOI:10.3321/j.issn:1000-0933.2002.12.026 [in Chinese]) |
阮梦鸽, 李洁琼, 孟闪闪, 等. 2015. 荒漠昆虫小胸鳖甲Ras GTP酶激活蛋白基因MpRasGAP的克隆及低温表达分析[J]. 昆虫学报, 58(4): 367-374. (Ruan M G, Li J Q, Meng S S, et al. 2015. Cloning and expression profiling in response to low temperature of Ras GTPase-activating protein gene MpRasGAP in the desert beetle Microdera punctipennis (Coleoptera:Tenebrionidae)[J]. Acta Entomologica Sinica, 58(4): 367-374. [in Chinese]) |
孙卫忠, 李斌, 王彦文, 等. 2003. 热激蛋白研究进展[J]. 蚕学通讯, 23(1): 21-27. (Sun W Z, Li B, Wang Y W, et al. 2003. Research progresses of heat shock proteins[J]. Newsletter of Sericultural Science, 23(23): 21-27. [in Chinese]) |
王辉, 丁协刚, 李世文, 等. 2015. 冷休克蛋白的生物学功能研究进展[J]. 中华临床医师杂志:电子版, 9(8): 1418-1423. (Wang H, Ding X G, Li S W, et al. 2015. Progress of biological function of cold shock protein[J]. Chinese Journal of Clinicians:Electronic Edition, 9(8): 1418-1423. [in Chinese]) |
Atapour M, Moharramipour S. 2009. Changes of cold hardiness, supercooling capacity, and major cryoprotectants in overwintering larvae of Chilo suppressalis (Lepidoptera:Pyralidea)[J]. Environmental Entomology, 38(1): 260-265. DOI:10.1603/022.038.0132 |
Awano N, Xu C, Ke H, et al. 2007. Complementation analysis of the cold-sensitive phenotype of the Escherichia coli csdA deletion strain[J]. Journal of Bacteriology, 189(16): 5808-5815. DOI:10.1128/JB.00655-07 |
Bae W, Phadtare S, Severinov K, et al. 1999. Characterization of Escherichia coli cspE, whose product negatively regulates transcription of cspA, the gene for the major cold shock protein[J]. Molecular Microbiology, 31(5): 1429-1441. DOI:10.1046/j.1365-2958.1999.01284.x |
Chaikam V, Karlson D T. 2010. Comparison of structure, function and regulation of plant cold shock domain proteins to bacterial and animal cold shock domain proteins[J]. BMB Reports, 43(1): 1-8. DOI:10.5483/BMBRep.2010.43.1.001 |
Chen G F, Song Y S, Wang P X, et al. 2015. Semiochemistry of Dendroctonus armandi Tsai and Li (Coleoptera:Curculionidae:Scolytinae):both female-produced aggregation pheromone and host tree kairomone are critically important[J]. Chemoecology, 25(3): 135-145. DOI:10.1007/s00049-014-0182-1 |
Chen H, Li Z, Bu S H, et al. 2011. Flight behavior of the Chinese white pine beetle (Coleoptera:Scolytidae) in relation to sex, body weight and energy reserve[J]. Bulletin of Entomological Research, 101(1): 53-62. DOI:10.1017/S0007485310000209 |
Chen H, Tang M. 2007. Spatial and temporal dynamics of bark beetles in Chinese white pine in Qinling Mountains of Shaanxi province, China[J]. Environmental Entomology, 36(5): 1124-1130. DOI:10.1093/ee/36.5.1124 |
Chinnusamy V, Zhu J, Zhu J K. 2007. Cold stress regulation of gene expression in plants[J]. Trends in Plant Science, 12(10): 444-451. DOI:10.1016/j.tplants.2007.07.002 |
Chinnusamy V, Zhu J K, Sunkar R. 2010. Gene regulation during cold stress acclimation in plants[J]. Methods in Molecular Biology, 639(1): 39-55. |
Creeden E P, Hicke J A, Buotte P C. 2014. Climate, weather, and recent mountain pine beetle outbreaks in the western United States[J]. Forest Ecology and Management, 312(312): 239-251. |
Dai L L, Ma M Y, Wang C Y, et al. 2015. Cytochrome P450s from the Chinese white pine beetle, Dendroctonus armandi (Curculionidae:Scolytinae):expression profiles of different stages and responses to host allelochemicals[J]. Insect Biochemistry and Molecular Biology, 65: 35-46. DOI:10.1016/j.ibmb.2015.08.004 |
Ding X, Lv Z M, Zhao Y, et al. 2008. MTH1745, a protein disulfide isomerase-like protein from thermophilic archaea, Methanothermobacter thermoautotrophicum involving in stress response[J]. Cell Stress and Chaperones, 13(2): 239-246. DOI:10.1007/s12192-008-0026-4 |
Eriksson S K, Kutzer M, Procek J, et al. 2011. Tunable membrane binding of the intrinsically disordered dehydrin Lti30, a cold-induced plant stress protein[J]. Plant Cell, 23(6): 2391-2404. DOI:10.1105/tpc.111.085183 |
Feder M E, Hofmann G E. 1999. Heat-shock proteins, molecular chaperones and the stress response:evolutionary and ecological physiology[J]. Annual Review Physiology, 61(1): 243-282. DOI:10.1146/annurev.physiol.61.1.243 |
Hou F, Ma J, Liu X, et al. 2010. Seasonal changes in antifreeze protein gene transcription and water content of beetle Microdera punctipennis (Coleoptera:Tenebrionidae) from Gurbantonggut desert in central Asia[J]. Cryoletters, 31(5): 359-370. |
Hu X, Li M, Chen H. 2015. Community structure of gut fungi during different developmental stages of the Chinese white pine beetle (Dendroctonus armandi)[J]. Scientific Reports, 5(5315): 8411. |
Inouye S, Sahara Y. 2008. Soluble protein expression in E. coli cells using IgG-binding domain of protein A as a solubilizing partner in the cold induced system[J]. Biochemical and Biophysical Research Communications, 376(3): 448-453. DOI:10.1016/j.bbrc.2008.08.149 |
Jones P G, VanBogelen R A, Neidhardt F C. 1987. Induction of proteins in response to low temperatures in Escherichia coli[J]. Journal of Bacteriology, 169(5): 2092-2095. DOI:10.1128/jb.169.5.2092-2095.1987 |
Khani A, Moharramipour S, Barzegar M. 2007. Cold tolerance and trehalose accumulation in overwintering larvae of the codling moth, Cydia pomonella (Lepidoptera:Tortricidae)[J]. European Journal of Entomology, 104(3): 385-392. DOI:10.14411/eje.2007.057 |
Koštál V, Doležal P, Rozsypal J, et al. 2011. Physiological and biochemical analysis of overwintering and cold tolerance in two Central European populations of the spruce bark beetle, Ips typographus[J]. Journal of Insect Physiology, 57(8): 1136-1146. DOI:10.1016/j.jinsphys.2011.03.011 |
Kuhlmann A, Hoffmann T, Bursy J, et al. 2011. Ectoine and hydroxyectoine as protectants against osmotic and cold stress:uptake through the SigB-controlled betaine-choline-carnitine transporter-type carrier EctT from Virgibacillus pantothenticus[J]. Journal of Bacteriology, 193(18): 4699-4708. DOI:10.1128/JB.05270-11 |
Lee R E, Chen C, Denlinger D L. 1987. A rapid cold-hardening process in insects[J]. Science, 238(4832): 1415-1417. DOI:10.1126/science.238.4832.1415 |
Lindquist S. 1986. The heat-shock response[J]. Annual Review of Biochemistry, 55(1): 1151-1191. DOI:10.1146/annurev.bi.55.070186.005443 |
Liu H, Zhang Z, Ye H, et al. 2010. Response of Tomicus yunnanensis (Coleoptera:Scolytinae) to infested and uninfested Pinus yunnanensis bolts[J]. Journal of Economic Entomology, 103(1): 95-100. DOI:10.1603/EC09080 |
Liu Z D, Xu B B, Sun J H. 2014. Instar numbers, development, flight period, and fecundity of Dendroctonus valens (Coleoptera:Curculionidae:Scolytinae) in China[J]. Annals of the Entomological Society of America, 107(1): 152-157. DOI:10.1603/AN13066 |
Ma R Y, Hao S G, Kong W N, et al. 2006. Cold hardiness as a factor for assessing the potential distribution of the Japanese pine sawyer Monochamus alternatus (Coleoptera:Cerambycidae) in China[J]. Annals of Forest Science, 63(5): 449-456. DOI:10.1051/forest:2006025 |
Mojib N, Andersen D T, Bej A K. 2011. Structure and function of a cold shock domain fold protein, CspD, in Janthinobacterium sp[J]. Ant5-2 from East Antarctica. FEMS Microbiology Letters, 319(2): 106-114. |
Movahedi S, Waites W. 2002. Cold shock response in sporulating Bacillus subtilis and its effect on spore heat resistance[J]. Journal of Bacteriology, 184(19): 5275-5281. DOI:10.1128/JB.184.19.5275-5281.2002 |
Nonoguchi K, Itoh K, Xue J H, et al. 1999. Cloning of human cDNAs for Apg-1 and Apg-2, members of the Hsp110 family, and chromosomal assignment of their genes[J]. Gene, 237(1): 21-28. DOI:10.1016/S0378-1119(99)00325-X |
Overgaard J, Malmendal A, Sorensen J, et al. 2007. Metabolomic profiling of rapid cold hardening and cold shock in Drosophila melanogaster[J]. Journal of Insect Physiology, 53(12): 1218-1232. DOI:10.1016/j.jinsphys.2007.06.012 |
Preisler H K, Hicke J A, Ager A A, et al. 2012. Climate and weather influences on spatial temporal patterns of mountain pine beetle populations in Washington and Oregon[J]. Ecology, 93(11): 2421-2434. DOI:10.1890/11-1412.1 |
Qin W, Neal S J, Ribertson R M, et al. 2005. Cold hardening and transcriptional change in Drosophila melanogaster[J]. Insect Molecular Biology, 14(6): 607-613. DOI:10.1111/j.1365-2583.2005.00589.x |
Roy S J, Tucker E J, Tester M. 2011. Genetic analysis of abiotic stress tolerance in crops[J]. Current Opinion in Plant Biology, 14(3): 232-239. DOI:10.1016/j.pbi.2011.03.002 |
Saito T, Fukuda N, Matsumoto T, et al. 2010. Moderate low temperature preserves the stemness of neural stem cells and suppresses apoptosis of the cells via activation of the cold-inducible RNA binding protein[J]. Brain Research, 1358(2): 20-29. |
Santagata S, Xu Y M, Wijeratne E M, et al. 2012. Using the heat-shock response to discover anticancer compounds that target protein homeostasis[J]. ACS Chemistry Biology, 7(2): 340-349. DOI:10.1021/cb200353m |
Shintani Y, Ishikawa Y. 2007. Relationship between rapid cold hardening and cold-acclimation in the eggs of the yellow spotted longicorn beetle Psacothea hilaris[J]. Journal of Insect Physiology, 53(10): 1055-1062. DOI:10.1016/j.jinsphys.2007.05.012 |
Sugimoto K, Jiang H. 2008. Cold stress and light signals induce the expression of cold-inducible RNA binding protein (cirp) in the brain and eye of the Japanese treefrog (Hyla japonica)[J]. Comparative Biochemistry and Physiology. Part A:Molecular and Integrative Physiology, 151(4): 628-636. DOI:10.1016/j.cbpa.2008.07.027 |
Tateno T, Fukuda H, Kondo A. 2007. Direct production of L-lysine from raw corn starch by Corynebacterium glutamicum secreting Streptococcus bovis alpha-amylase using cspB promoter and signal sequence[J]. Applied Microbiology and Biotechnology, 77(3): 533-541. DOI:10.1007/s00253-007-1191-6 |
Turner A M, Love C F, Alexander R W, et al. 2007. Mutational analysis of the Escherichia coli DEAD box protein CsdA[J]. Journal of Bacteriology, 189(7): 2769-2776. DOI:10.1128/JB.01509-06 |
Uppal S, Jawali N. 2015. Cyclic AMP receptor protein (CRP) regulates the expression of cspA, cspB, cspG and cspI, members of cspA family, in Escherichia coli[J]. Archives of Microbiology, 197(3): 497-501. DOI:10.1007/s00203-015-1085-4 |
Wang H H, Lei Z R, Li X, et al. 2011. Rapid cold hardening and expression of heat shock protein genes in the B-biotype Bemisia tabaci[J]. Environmental Entomology, 40(1): 132-139. DOI:10.1603/EN09357 |
Wang J, Gao G, Zhang R, et al. 2017. Metabolism and cold tolerance of Chinese white pine beetle Dendroctonus armandi (Coleoptera:Curculionidae:Scolytinae) during the overwintering period[J]. Agricultural and Forest Entomology, 19(1): 10-22. DOI:10.1111/afe.2017.19.issue-1 |
Wang J, Zhang R R, Gao G Q, et al. 2016. Cold tolerance and silencing of three cold-tolerance genes of overwintering Chinese white pine larvae[J]. Scientific Reports, 6: 34698. DOI:10.1038/srep34698 |
Weber M H, Volkov A V, Fricke L, et al. 2001. Localization of cold shock proteins to cytosolic spaces surrounding nucleoids in Bacillus subtilis depends on active transcription[J]. Journal of Bacteriology, 183(21): 6435-6443. DOI:10.1128/JB.183.21.6435-6443.2001 |
Welker C, Böhm G, Schurig H, et al. 1999. Cloning, overexpression, purification, and physicochemical characterization of a cold shock protein homolog from the hyperthermophilic bacterium Thermotoga maritima[J]. Protein Science, 8(2): 394-403. |
Yamanaka K, Inouye M. 2001. Selective mRNA degradation by polynucleotide phosphorylase in cold shock adaptation in Escherichia coli[J]. Journal of Bacteriology, 183(9): 2808-2816. DOI:10.1128/JB.183.9.2808-2816.2001 |
Yi S X, Lee R E. 2011. Rapid cold-hardening blocks cold induced apoptosis by inhibiting the activation of procaspases in the flesh fly Sarcophaga crassipalpis[J]. Apoptosis, 16(3): 249-255. DOI:10.1007/s10495-010-0570-0 |
Zhao L, Jones W A. 2012. Expression of heat shock protein genes in insect stress responses[J]. ISJ-Invertabrate Survival Journal, 9(1): 93-101. |
Zhu J, Dong C H, Zhu J K. 2007. Interplay between cold-responsive gene regulation, metabolism and RNA processing during plant cold acclimation[J]. Current Opinion in Plant Biology, 10(3): 290-295. DOI:10.1016/j.pbi.2007.04.010 |
 2018, Vol. 54
2018, Vol. 54

