文章信息
- 杨国栋, 钱慧蓉, 陈林, 王贤荣
- Yang Guodong, Qian Huirong, Chen Lin, Wang Xianrong
- 中国特有植物短丝木犀的繁育系统
- Reproduction System of Osmanthus serrulatus, an Endemic Plant to China
- 林业科学, 2018, 54(4): 17-29.
- Scientia Silvae Sinicae, 2018, 54(4): 17-29.
- DOI: 10.11707/j.1001-7488.20180403
-
文章历史
- 收稿日期:2017-09-14
- 修回日期:2017-11-06
-
作者相关文章
当今进化生物学研究领域中最为活跃的就是植物繁育系统。植物的繁育系统表述的是交配亲和性及其组分的构造,包括异交和自交(张大勇,2004)。Darwin通过人工杂交方法明确自交和异交的效果,探讨不同花型对繁育系统的适应和影响,最终建立了植物繁育系统研究的基本理论和方法(Darwin,1862;1876;1877)。1905年Blakelee和1928年Correns将繁育系统分为了包括雌雄同株、单性同株、雌全同株、雄全同株和多全同株在内的同型繁育系统,以及包括单性异株、雌全异株、雄全异株、多全异株和三型异株在内的异型繁育系统(方炎明,2012),其中,雄全异株是指同种植物中既有雄性植株又有两性植株的繁育系统,是被子植物中极为罕见的一类繁育系统,在植物繁育系统的演化方面具有特殊意义(Pannell et al., 1999;Honnay et al., 2009;Pierson et al., 2013)。目前对雄全异株研究的方向主要集中在繁育系统进化及性比方面,分子系统学层面上研究较少,其中雄全异株是雌雄异株与雌雄同株之间进化过程中的重要途径之一,是生态学研究的热点问题(Banuelos et al., 2004;Hesse et al., 2011;Smith et al., 1996)。功能性的雄全异株是种群中的雄性植株仅具雄性功能,而两性株同时具有雄性和雌性功能(Akimoto et al., 1999),在自然界极为罕见,不少形态上的雄全异株种类实质为功能性的雌雄异株或雌雄同株。近年的研究已确认10种以上的被子植物为雄全异株植物,多存在于四数木科(Tetramelaceae)和木犀科(Oleaceae)中(Krähenbühl,2002;Liston et al., 1990;Lepart et al., 2010;Dommee et al., 1999)。
短丝木犀(Osmanthus serrulatus)属木犀科木犀属(Osmanthus),为我国特有树种,其模式产地为四川省宝兴县。《中国植物志》曾记载其在四川、广西、福建有分布,但近年来仅在四川的西岭雪山、峨眉山、东拉山等地有所发现(杨国栋等,2105),其中在东拉山谷集中分布于海拔1 800~2 300 m的短丝木犀种群是迄今为止发现的面积最大的自然种群(陈林等,2016)。短丝木犀是木犀属少数春季开花的种之一,花大而芬芳,花梗长而纤细,极为美丽。
雄全异株的现象在木犀科木犀属植物中广泛存在,但目前还不确定短丝木犀的性别表达特征,也不能明确天然居群的短丝木犀是否为功能性的雄全异株。本研究以短丝木犀野生居群作为研究对象,利用SSR分子标记,针对在自然状况下进行授粉的雄株及两性株的雄性功能,比较了单性雄株与两性株之间的差异及其后代产生的贡献比例,对短丝木犀雄全异株的繁育系统的进化与维持机制进行了探讨。
1 材料与方法 1.1 研究区设置及样品采集将四川省宝兴县东拉山的样本统计区域根据样本分布划分为9个群落,全长14 km,分别为樵夫桥、青衣源、十里彩林路中段、观光车终点、赶羊沟、桂嫱湾、猫子湾、东拉沟、鹿井沟;其中,赶羊沟、桂嫱湾、猫子湾、东拉沟、鹿井沟由于地域过大,每个地区再细分为4个亚群落(图 1,表 1)。先统计以上群落的所有样本植株总数,再统计其中的开花和不开花株数,最后统计开花株中的单性雄株和两性株分别有多少,雄性比率用单性雄株占植株总数的比例来计算。

|
图 1 东拉山短丝木犀群落的24个样点 Figure 1 24 samples of the Osmanthus serrulatus group in Dongla Mountain |
|
|
在每个种群内进行选择,母本应为1株长势优良的两性株,种群范围内可取到的成年株作为候选父本,并对各母本和候选父本GPS定位,记录候选父本与各自母本间的距离。子代采集自母本植株上的种子,选用分散随机取样的方法,并分别剪取母本及候选父本上长势良好、无病虫害的幼嫩叶片10片,清理干净后放入硅胶中干燥保存备用。
1.1.2 父本分析试验样本组成本研究区域的24个种群内共发现成年个体271株,其中雄株139株,两性株132株,全部列为候选父本,其对应的母本编号分别为D1-D24(表 1)。用作父本分析的子代为494粒新鲜成熟的种子,随机采自于24株母本。
1.2 试验方法 1.2.1 短丝木犀生殖物候观察虫媒传粉:选择短丝木犀初花期、盛花期和末花期植株各10个花序,观察访花者的类别、行为、频率和速率。通过全天候观察确定昆虫传粉时间段以后,在7:00—17:00每间隔2 h观察1次,持续1 h,记录所有来访昆虫的次数、停留时间、访花行为,拍照、摄像并捕捉带回鉴定。同时,观察不同天气条件对主要传粉昆虫访花行为的影响(李稚等,2014)。
风媒传粉:以盛花期的短丝木犀为花粉源,自花粉源起,在树冠中层的东西南北4个方向分别布置5个载玻片,间距0.5 m,并涂布甘油以收集花粉后,用显微镜进行镜检。
1.2.2 花粉粒形态的观察用扫描电子显微镜直接扫描观察单性雄株的雄花和两性株的两性花的花粉粒的外部形态,并拍照记录(郝日明等,2011)。
1.2.3 花部雄蕊形态的观察用体视显微镜观察不同发育时期的雄蕊外部形态,并采用常规石蜡切片染色法,光学显微镜观察雄蕊纵切面解剖结构,分别拍照记录。
1.2.4 试验样本DNA的提取将去皮后干燥种子切成碎块,称取80 mg置入2.0 mL EP管中,每个EP管中加入2粒直径3 mm的钢珠,用高通量组织研磨仪在3 min内以30次·s-1的速率研磨,以天根植物基因组DNA提取试剂盒(DP305,天根生化科技公司)提取DNA。
1.2.5 SSR-PCR扩增引物的筛选进行父本分析时,依据文献Chen(2015),选取了10对多态性较高的引物(表 2)并将其扩增信息导入Cervus软件,分析24个群组前需将明显偏离哈迪·温伯格平衡的引物去除。
|
|
参考叶占洋等(2016)的方法,通过梯度PCR试验(55~65 ℃)确定引物的最适退火温度。经琼脂糖电泳后,初步筛选出条带清晰且长度符合预期大小的引物进行多态性检测。然后通过8%聚丙烯酰胺凝胶电泳对PCR产物进行检测后,银染拍照,根据条带结果,确定多态性引物(Zalapa et al., 2012)。
1.3 数据处理分析父本分析:应用QuantityOne软件,以Pbr322DNA/MspI marker作为参照,以条带大小表示碱基的数量。然后通过Cervus软件进行数据分析,置信度水平设置为80%(周伟等,2014)。
生殖力测定:用平均单个雄株产生的子代数和平均单个两性株产生的子代数分别表示雄株与两性株的雄性繁殖力,即F雄株=(P/M),F两性株= (O/H)。式中:P为雄株的子代数,O为两性株的子代数,M为种群中雄株个体数,H为种群中两性株的个体数。
2 结果与分析 2.1 短丝木犀生殖物候观察从图 2可以看出,盛花期是短丝木犀传粉昆虫活动的高峰时期。从短丝木犀花蕾期到初花期,除了少数的蜂类光顾停驻之外,极少有昆虫访问;此时蜂类的活动频率还不高,访花频率在6.4次·h-1。从初花期开始,蝶类在每朵花之间活动开始出现,但是花量不是很大,所以访花频率和数量都不是很大。但在盛花期中明显增多,短丝木犀的访花昆虫以蜂类与蝶类最为多见,蝇类、蛾类和蝽类次之但出现频率明显不如前2种昆虫,其中蜂类在盛花期访花频率最高,为56.6次·h-1。在末花期,各类昆虫访花频率有所下降,仅蜂类保持在32次·h-1之上,可见蜂类是短丝木犀的高效传粉者。
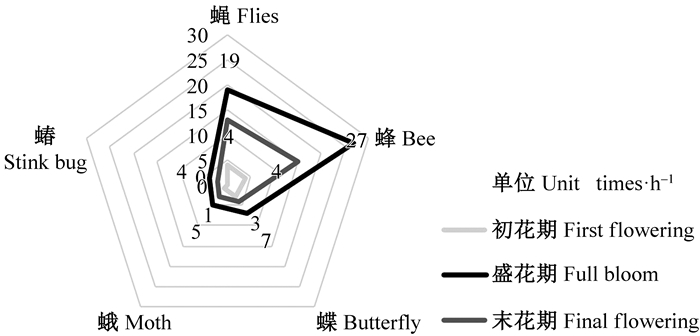
|
图 2 短丝木犀主要传粉者的访花频率 Figure 2 Flower-visiting frequency of main Osmanthus serrulatus pollinators |
通过黏性载玻片镜检,在试验所布玻片中均发现短丝木犀的花粉,短丝木犀天然种群的花粉散播在晴朗白天峰值高达345.23粒·cm-2。因此认为短丝木犀是存在风媒传粉现象的自花传粉植物。
2.2 花粉粒形态观察短丝木犀中的两性花和雄花的花粉粒基本结构较为一致,花粉极面观为三裂圆形(图 3D、H),外壁分2层(图 3A 、E),外层基柱明显,表面具网状纹饰(图 3B、F),萌发孔为三孔沟类型。雄花花粉粒为长球形(图 3G),两性花花粉粒为球型(图 3C)。雄花花粉萌发沟长, 占整个极轴长的64%~73%,雄花的花粉败育率极低。

|
图 3 扫描电镜下短丝木犀两性花和雄花的花粉粒形态 Figure 3 Pollen morphology of hermaphrodite and unisexual male individuals of Osmanthus serrulatus under scanning electron microscope A-D:两性株花粉粒;E-H:雄株花粉粒。 A-D: Pollen of hermaphrodite flower from hermaphrodite individuals; E-H: Pollen of male flower from unisexual male individuals. |
短丝木犀两性株的花部子房形态发育完全,柱头膨大;而单性雄株的花中有呈鳞片状退化程度不等的子房痕迹,但是不明显。通过短丝木犀雄株花部纵切面的解剖观察发现,单性雄株的雄花纵切面有明显的退化雌蕊痕迹,其子房部位中空,仅在基部有一小突起(图 4)。

|
图 4 短丝木犀雄株花部纵切面石蜡切片 Figure 4 Anatomical structure in longitudinal section of unisexual male flower of Osmanthus serrulatus 箭头所指小突起为雄株败育雌蕊。 The small projection of the arrow is the abortive pistil of unisexual male. |
应用符合哈迪温伯格平衡的10对多态性引物对765个个体(271个候选父本,494个子代)DNA进行SSR-PCR扩增,部分扩增效果如图 5、6所示。对10个多态性位点进行检测,发现等位基因共103个,每位点具7~17个等位基因,平均每个位点具有10.3个(表 3),其中最高的是具有17个等位基因的DSMX48,最低的是具有7个的DSMX49;试验群体的平均观测杂合度、期望杂合度以及多态信息含量分别为0.776、0.837以及0.702。筛选的10对引物,因多态性良好,可以用来检测交配系统与进行父系分析。
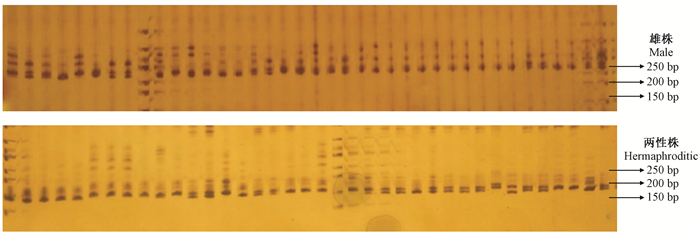
|
图 5 引物DSMX-25-SSR扩增结果 Figure 5 Results of primer DSMX-25-SSR amplification |
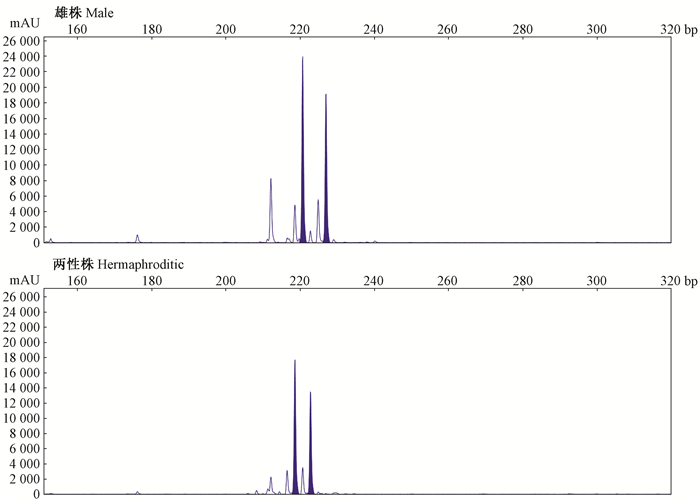
|
图 6 引物DSMX-25毛细管电泳结果 Figure 6 Results of primer DSMX-25 capillary electrophoresis |
|
|
运用Cervus3.0软件,在80%置信度水平下,494个子代中,共有376个子代确定了父本,占76.11%。共163个(O=163)即33%子代的父本为两性株,其中花粉来自于母本自身的子代有18个(3.64%);子代来自于雄株的有213个(P=213),占43.12%。雄株与两性株的繁殖力比的范围是0.40~4.29(表 4)。
|
|
候选父本的空间分布情况与交配格局结果(图 7)显示,不同的母本与父本间的交配距离(花粉散布的有效距离)及父本数量存在一定的差异。其中,群落母株D14与D24具有较远的交配距离与较多父本,D5及D6具有较短的交配距离与较少的父本,表明短丝木犀雌雄配子的结合具有一定的选择性,其选择机制有待进一步研究。
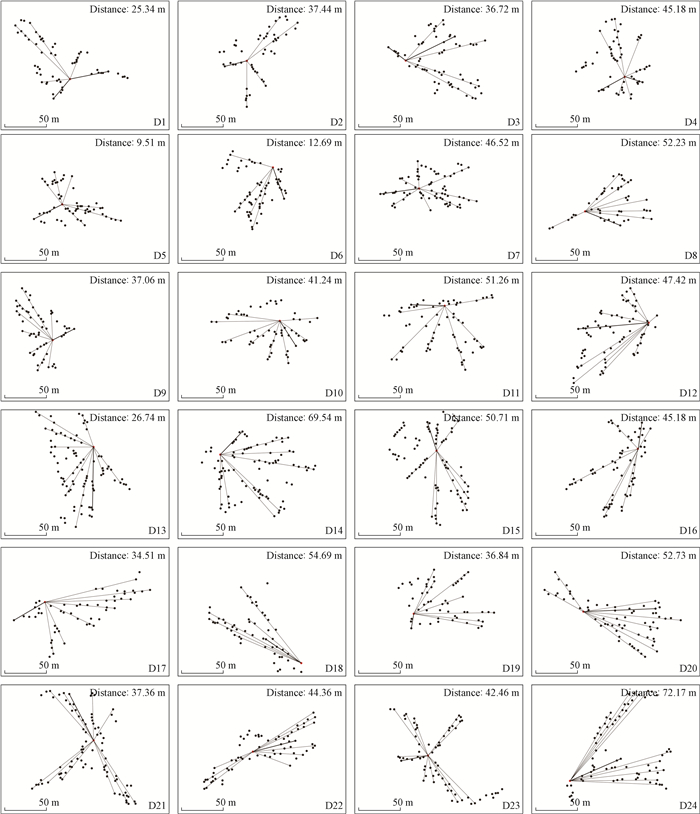
|
图 7 候选父本的空间分布与交配格局 Figure 7 The spatial distribution of paternal candidates and mating pattern for 24 maternal tree in the experimental population of Osmanthus serrulatus ●:候选父本;—:有效花粉流,线的粗细反映有效花粉量。 Black dots(●): Paternal candidates; Lines(—): Pollen flow to the maternal tree, line thickness is proportional to the number of successful pollen grains of the paternal tree. |
从图 7中可以看出,在母株D1、D3、D5、D6、D15已确定的父本子代中,距离0~15 m的个体间交配比例均最高;母株D12、D13、D17、D18、D19已确定父本的子代中,距离15~30 m的个体间的交配比例最高;母株D2、D8、D10、D11、D22已确定的父本子代中,距离30~45 m的个体间的交配比例最高;在母株D4、D9、D16、D20、D21、D23已知父本的子代中,个体间距离在45~60 m间的具有最高的交配比例;母株D14和D24已知父本的子代中,个体间距离60~80 m的交配比例最高;母株D7已知父本的子代中,个体间距离为50~75 m和75~100 m的交配比例相对较高。但是整体来说,各个距离段的个体间交配比例基本没有太大差别。短丝木犀的个体间交配距离并不一致,种群中的平均有效花粉散布距离为(46.35±25.62) m,各母株的交配距离近似呈正态分布。
短丝木犀24个种群的有效花粉散布距离表明,24株母树获得的平均花粉传播距离为42.08 m,其中种群D14的最大,种群D5最小。
2.7 短丝木犀种群间的基因流利用SSR数据计算短丝木犀24个种群间的基因流。24个种群间的基因流最大5.583,最小2.789(表 5);24个种群两性株之间的基因流最大5.393,最小2.964(表 6);24个种群两性株与雄性株之间的基因流最大5.776,最小3.331(表 7)。Lloyd(1975)认为,当种群间的基因流达到1时,基因流就可以起到均质化作用。短丝木犀种群间的基因流都大于2,表明短丝木犀种群间基因流可以有效消除遗传漂变、地理阻隔造成的遗传分化,且这些种群间存在较为普遍的基因交流。
|
|
|
|
|
|
24个种群内两性株和雄性株之间的基因流数值(表 7)表明,短丝木犀的单性雄株的雄花和两性株的两性花的花粉粒均具有较高活力,均能在两性花柱头上正常萌发。可见,两性株两性花的雄蕊具有雄性功能。也就是说,短丝木犀的两性花不只是形态上的,而且是功能性的两性花。24个种群间的距离为14 km,因为地形原因,一些群落比较孤立,海拔上也有一定差异,比如D20,可是其与D1之间的基因流为3.917,表明地理位置并没有阻碍种群间的基因交流,鸟类或昆虫的活动可能是种群之间基因交流的主要来源。
3 讨论 3.1 功能性雄全异株鉴定、维持与进化机制通过对宝兴县东拉山短丝木犀天然种群的24组的761个试验样本的父本分析发现,在494个子代中,可确定其中76.11%(376个)的子代父本唯一。具有确定父本的子代中,有213个(56.65%)来自雄株,163个(43.35%)来自于两性株。试验证明,短丝木犀两性花的花粉与雄花花粉自交亲和,并且都具有雄性功能,能产生子代,短丝木犀的自然种群确定为功能性的雄全异株。
由于短丝木犀自然生境的复杂性,难以对不同种群的地形地貌下的候选父本数量、相对高度及与母本距离等进行均一化处理,同时母本自身传粉带来的“花粉贴现”也会造成部分异交结实损失。而在进化稳定策略(ESS)的雄全异株理论模型中,雄株必须比两性植株的雄性功能适合度高2倍以上,才能形成稳定的雄全异株繁育系统(Hill et al., 2008;Arias et al., 2011)。本研究结果显示,雄株与两性株的平均雄性繁殖力之比介于0.40~4.29之间,24组试验中,除DLS4、6、11和17这4组外,其余20组的F值均小于2.0,可见该短丝木犀种群目前尚未形成较为稳定的雄全异株繁育系统。物种会因斑块化的生境而形成集合种群,因此大大降低了雄株在两性种群内所维持的上限。
植物在斑块化的生境中形成的集合种群中,两性株中只有性别分配偏雌的个体得以被保存,因为当两性个体数量过少时,繁殖后代只能通过自交完成,且局域配偶竞争愈加激烈,然而,性别分配偏雌的个体的雄性功能必将下降,出现如花粉产生数量减少或繁殖能力下降等现象,且花粉的可获得性会因不断增大的种群与种群内密度而受到越来越大的限制(胡文清等,2011)。同时,对两性个体来说,长期的自交又会产生自交衰退,导致自交后代的生存能力下降。因此,以偏雌的两性个体组成的种群稳定性降低,大大增加雄性个体的入侵和异交成功率,且雄性个体的侵入并不需要高于两性个体2倍以上的适合度优势即可完成。短丝木犀具有风媒植物的规模传粉效应正好可以提高其种群的生殖能力。另外,因既可优先进行异交,又可以延迟自交的方式在花粉受到限制的情况下可保障繁殖,故雌蕊先成熟的两性株更具优势(孙亚光等,2007)。
3.2 短丝木犀种群的亲本分析和花粉散布特征本研究的短丝木犀24个种群中,雄性与两性个体的数量分别为139和132,比值为1.05。ESS理论模型认为雄全异株种群中雄性个体的比例必须少于两性个体,但目前有研究表明,雄全异株植物种群中也有类似的1:1比例,甚至雄性个体居多的现象(Wallander,2008;Philipp et al., 2014);Dommee等(1999)认为,这种比例的出现或许只是因为雄株因繁殖消耗较低而使其寿命更长,或是由于雄株的开花频率更高导致的,而并非天然种群的实际性比(Delph et al., 2005)。本研究结果的出现很可能正是这一原因导致。
在对东拉山短丝木犀种群进行全面调查期间,发现雄性花的开花时间比两性花早2~4天,同时通过对单性雄株和两性株的花粉粒数量比较发现单性雄株平均每个花药的花粉粒数量多于两性株(两性花3 544,雄性花9 662),t检验结果显示单性雄株与两性株间每个花药的花粉粒数量平均值有显著差异(P<0.05)。
在种群样点4、11和17中,雄株与两性株的繁殖力比都在2.0以上,F17高达4.29。这3个种群中候选父本的雄株与两性株的数量之比分别为0.75、0.71和0.33,从种群的母本与候选父本距离来看,在母本辐射20 m范围内,分别有1雄株3两性株、2雄株3两性株和1雄株2两性株,雄株在距离与数量上与两性株差距不大,但雄株具有花粉粒数量和形态上的传粉优势,使得雄株繁殖力高于两性株。在样点21和23,雄株与两性株的繁殖力比分别为0.40和0.44,这2个种群的母本都位于山体较为活跃的碎石滑坡山,其周围20 m范围内分别有0雄株2两性株和1雄株3两性株,其余候选父本都分布在样方边缘,缺少雄性个体和位置的劣势使繁殖力比值低。在进行父本分析时发现,在花粉贡献率方面,当雄株和两性株与母本具相同的距离与位置时,雄株父本明显高于两性父本。
短丝木犀的花粉有效散播模式与距离均取决于候选父本自身的生长特性及周边环境,一般情况下,传粉距离越小,交配机会越大,距离增加,花粉流的强度就会减弱,相应交配机会就会减少(Rathcke,2010)。本研究结果显示短丝木犀的平均花粉散布距离为22.24~46.31 m,说明大部分有效花粉流均来自种群母本周围这一区域;有效花粉散布距离因不同母本而异,最远可传播至72.17 m处,即证明短丝木犀的有效花粉散布范围较宽。
3.3 短丝木犀群落传粉生物学短丝木犀的花同时具有适应虫媒和风媒传粉的特征,表现为:花大、香,较短的花被片不易限制花粉的散布使其更利于受空气流动影响而进行风媒传粉;另外,两性花的胚珠利用率因其柱头在整个花期内均具可授性而得到很大提高,这正适应了花药的开裂与散粉具有不同步性的特点。
花粉外壁具黏丝或细网状纹饰,这是虫媒花植物特有的花粉外形(Weeks et al., 2015)。短丝木犀的雄花和两性花在形状、大小和外壁表面纹饰等方面都有一定的区别。从形态上说,短丝木犀长椭圆形的雄花花粉不适于风媒传粉,而球形的两性花更适合风媒,但雄株花朵繁密,花序与花序间排列紧密,在一定的风力作用下,可以在距离相近的不同植株间进行异株异花传粉。而且雄花花粉的萌发沟较宽、较深,沟内有细小的疣状凸起;表面的网状纹饰分布有疏密不等的网孔,且具有颗粒状凸起,这些都有助于虫媒传粉。雄花和两性花的花粉均以其形态来适应各自的传粉方式,在东拉山复杂的自然生境中,虫媒传粉的特性更利于短丝木犀的群落演替。
短丝木犀兼具风媒和虫媒传粉的特征,雄花花丝比两性花花丝略长,开花成熟时间更早,这些都增加了雄花花粉扩散的能力,同时两性花雌蕊先熟,也増加了雄株的适合度优势。在基于APG Ⅳ的木犀科分类系统中,这些具有雄全异株的属均被置于同一个族,即木犀榄族(Trib.Oleeae)中,其中木犀属、流苏树属(Chionanthus)和总序桂属(Phillyrea)3个属在同一亚族Oleinae中,在进化上它们有着独立的起源,而雄全异株现象是伴随着从虫媒传粉到风媒传粉演变过程中雌雄同株进化到雌雄异株的过渡阶段(Billiard et al., 2015)。另外,也有观点认为雌雄异株也可能与虫媒到风媒协同进化而来(Tedder et al., 2015),短丝木犀具有风媒传粉和虫媒传粉的双重特性,其雄花花粉粒更适于虫媒传粉。
4 结论短丝木犀的繁育系统应属功能性的雄全异株,这种繁育系统可能为两性同体与雌雄异株间的过渡类型。在短丝木犀种群中,两性个体为了群落的演替承受着较大的繁殖负担,短丝木犀的两性个体权衡了繁殖资源在两性花中的雄性和雌性间的分配,两性花出于对繁殖率的维持,适当地减少分配给雄性个体的资源,但不过分降低雄性功能,以减少两性个体的雄性适合度,从而增加雄性个体入侵的几率。
花粉的体积与表面积的比值越大,其调控传播功能越小,适应性越低,而短丝木犀两性花的球型花粉的体积与表面积之比明显大于雄性的长椭圆形花粉,雄性花粉具有更高的调控功能,从进化的角度来看,球型花粉更倾向于原始的特征,而长球形的雄性花粉更倾向于一种进化的类型,雄性可能从两性的祖先进化而来。此外,短丝木犀的雄性个体是从两性个体中的雌性不育突变进化而来的证据就是雄花具有退化的雌蕊。
短丝木犀的雄性和两性花的花粉经过组织培养后均能萌发,通过人工授粉套袋,均能产生种子。这些都说明花粉并不是短丝木犀的限制因素,雄全异株有极大可能并非出于对繁殖的保障的角度而由雌雄异株中的雌株恢复部分雄性功能进化而来的,也可能是从两性祖先进化而来,但仍需要进一步的证据来确认雄全异株最初起源。而短丝木犀的繁育系统反映了木犀科的系统演化趋向,启示了研究被子植物特殊类群的系统演化时,应注重其种群繁育系统所表现出的重要信息。
陈林, 李龙娜, 杨国栋, 等. 2016. 特有植物短丝木犀(Osmanthus serrulatus)转录组微卫星特征分析[J]. 分子植物育种, 14(4): 959-965. (Chen L, Li L N, Yang G D, et al. 2016. Microsatellites characteristics of transcriptomic sequences from Osmanthus serrulatus[J]. Molecular Plant Breeding, 14(4): 959-965. [in Chinese]) |
方炎明. 2012. 森林植被的显花、传粉与繁育系统[J]. 南京林业大学学报:自然科学版, 36(6): 1-7. (Fang Y M. 2012. Florescence, pollination and breeding systems of forest vegetation[J]. Journal of Nanjing Forestry University:Natural Sciences Edition, 36(6): 1-7. [in Chinese]) |
郝日明, 赵宏波, 王金虎, 等. 2011. 野生桂花繁育系统的观察和研究[J]. 植物资源与环境学报, 20(1): 17-24. (Hao R M, Zhao H B, Wang J H, et al. 2011. Observation and study on breeding system of wild Osmanthus fragrans[J]. Journal of Plant Resources and Environment, 20(1): 17-24. [in Chinese]) |
胡文清, 鲁衡, 刘伟, 等. 2011. 芍药野生居群父系分析与遗传结构研究[J]. 园艺学报, 38(3): 503-511. (Hu W Q, Lu H, Liu W, et al. 2011. Paternity identification and genetic structure analysis on the wild population in Paeonia lactiflora Pallas[J]. Acta Horticulturae Sinica, 38(3): 503-511. [in Chinese]) |
李稚, 杨国栋, 段一凡, 等. 2014. 桂花访花昆虫及其访花行为观察[J]. 南京林业大学学报:自然科学版, 38(S1): 47-50. (Li Z, Yang G D, Duan Y F, et al. 2014. Study on major pollinators and their flower-visiting behavior of Osmanthus serrulatus[J]. Journal of Nanjing Forestry University:Natural Sciences Edition, 38(S1): 47-50. [in Chinese]) |
孙亚光, 李火根. 2007. 利用SSR分子标记对鹅掌楸自由授粉子代的父本分析[J]. 植物学报, 24(5): 590-596. (Sun Y G, Li H G. 2007. The paternity analysis for open-pollination progenies of Liriodendron L[J]. using SSR markers. Chinese Bulletin of Botany, 24(5): 590-596. [in Chinese]) |
杨国栋, 王贤荣, 段一凡, 等. 2015. 中国特有香花植物短丝木犀种子萌发研究[J]. 现代园林, 12(10): 761-765. (Yang G D, Wang X R, Duan Y F, et al. 2015. A study on seed germination of an aromatic plant that endemic in China-Osmanthus serrulatus[J]. Modern Landscape Architecture, 12(10): 761-765. [in Chinese]) |
叶占洋, 王兆山, 李云晓, 等. 2016. 中国特有濒危植物翅果油树的SSR引物开发及特性[J]. 西北植物学报, 36(2): 274-279. (Ye Z Y, Wang Z S, Li Y X, et al. 2016. Development and characterization of microsatellite markers in the Elaeagnus mollis Diels[J]. Acta Botanica Boreali-Occidentalia Sinica, 36(2): 274-279. [in Chinese]) |
张大勇. 2004. 植物生活史进化与繁殖生态学[M]. 北京: 科学出版社. (Zhang D Y. 2004. Plant life history evolution and reproductive ecology[M]. Beijing: Science Press. [in Chinese]) |
周伟, 王红. 2014. 基于DNA分子标记的花粉流动态分析[J]. 生物多样性, 22(1): 97-108. (Zhou W, Wang H. 2014. Pollen dispersal analysis using DNA markers[J]. Biodiversity Science, 22(1): 97-108. [in Chinese]) |
Akimoto J, Fukuhara T, Kikuzawa K. 1999. Sex ratios and genetic variation in a functionally androdioecious species, Schizopepon bryoniaefolius (Cucurbitaceae)[J]. American Journal of Botany, 86(6): 880-886. DOI:10.2307/2656708 |
Arias R S, Techen N, Rinehart T A, et al. 2011. Development of simple sequence repeat markers for Chionanthus retusus (Oleaceae) and effective discrimination of closely related taxa[J]. Hortscience:A Publication of the American Society for Horticultural Science, 46(1): 23-29. |
Banuelos M J, Obeso J R. 2004. Resource allocation in the dioecious shrub Rhamnus alpinus:the hidden costs of reproduction[J]. Evolutionary Ecology Research, 6(3): 397-413. |
Billiard S, Husse L, Lepercq P, et al. 2015. Selfish male-determining element favors the transition from hermaphroditism to androdioecy[J]. Evolution, 69(3): 683-693. DOI:10.1111/evo.2015.69.issue-3 |
Chen L, Li L, Dai Y, et al. 2015. De novo, transcriptome analysis of Osmanthus serrulatus Rehd[J]. flowers and leaves by Illumina sequencing. Biochemical Systematics & Ecology, 61(10/11): 531-540. |
Darwin C. 1862. On the various contrivances by which British and foreign orchids are fertilised by insects[M]. London: Cambridge University Press.
|
Darwin C. 1876. The effects of cross and self fertilization in the vegetable kingdom[M]. London: Cambridge University Press.
|
Darwin C. 1877. The different forms of flowers on plants of the same species[M]. London: Cambridge University Press.
|
Delph L F, Wolf D E. 2005. Evolutionary consequences of gender plasticity in genetically dimorphic breeding systems[J]. New Phytologist, 166(1): 119-128. DOI:10.1111/j.1469-8137.2005.01339.x |
Dommee B, Geslot A, Thompson J D, et al. 1999. Androdioecy in the entomophilous tree, Fraxinus ornus (Oleaceae)[J]. New Phytologist, 143(2): 419-426. DOI:10.1046/j.1469-8137.1999.00442.x |
Hesse E, Pannell J R. 2011. Sexual dimorphism in androdioecious Mercurialis annua, a wind-pollinated herb[J]. International Journal of Plant Sciences, 172(1): 49-59. DOI:10.1086/657279 |
Hill L M, Brody A K, Tedesco C L. 2008. Mating strategies and pollen limitation in a globally threatened perennial Polemonium vanbruntiae[J]. Acta Oecologica, 33(3): 314-323. DOI:10.1016/j.actao.2008.01.009 |
Honnay O, Jacquemyn H, Looy K V, et al. 2009. Temporal and spatial genetic variation in a metapopulation of the annual Erysimum cheiranthoides, on stony river banks[J]. Journal of Ecology, 97(1): 131-141. DOI:10.1111/jec.2009.97.issue-1 |
Lepart J, Dommee B. 2010. Is Phillyrea angustifolia L. (Oleaceae) an androdioecious species?[J]. Botanical Journal of the Linnean Society, 108(4): 375-387. |
Liston A, Rieseberg L H, Elias T S. 1990. Datisca glomerata is functionally androdioecious[J]. Nature, 343: 641-642. DOI:10.1038/343641a0 |
Lloyd D G. 1975. The maintenance of gynodioecy and androdioecy in angiosperms[J]. Genetica, 45(3): 325-339. DOI:10.1007/BF01508307 |
Krähenbühl M, Yuan Y M, Küpfer P. 2002. Chromosome and breeding system evolution of the genus Mercurialis (Euphorbiaceae):implications of ITS molecular phylogeny[J]. Plant Systematics & Evolution, 234(1/4): 155-169. |
Pannell J R, Charlesworth B. 1999. Neutral genetic diversity in a metapopulation with recurrent local extinction and recolonization[J]. Evolution, 53(3): 664-676. DOI:10.1111/evo.1999.53.issue-3 |
Philipp M, Adsersen H. 2014. Colonization of an empty island:how does a plant with a plastic gender system respond?[J]. Biogeosciences, 11(23): 6657-6665. DOI:10.5194/bg-11-6657-2014 |
Pierson J C, Allendorf F W, Drapeau P, et al. 2013. Breed locally, disperse globally:Fine-scale genetic structure despite landscape-scale panmixia in a fire-specialist[J]. PLoS One, 8(6): e67248. DOI:10.1371/journal.pone.0067248 |
Rathcke B J. 2010. Do inbreeding depression and relative male fitness explain the maintenance of androdioecy in white mangrove, Laguncularia racemosa (Combretaceae)?[J]. New Phytologist, 176(4): 891-901. |
Smith J F, Burke C C, Wagner W L. 1996. Interspecific hybridization in natural populations of Cyrtandra (Gesneriaceae) on the Hawaiian Islands:Evidence from RAPD markers[J]. Plant Systematics & Evolution, 200(1/2): 61-77. |
Tedder A, Helling M, Pannell J R, et al. 2015. Female sterility associated with increased clonal propagation suggests a unique combination of androdioecy and asexual reproduction in populations of Cardamine amara (Brassicaceae)[J]. Ann Bot, 115(5): 763-776. DOI:10.1093/aob/mcv006 |
Wallander E. 2008. Systematics of Fraxinus (Oleaceae) and evolution of dioecy[J]. Plant Systematics & Evolution, 273(1/2): 25-49. |
Weeks S C, Benvenuto C, Reed S K, et al. 2015. A field test of a model for the stability of androdioecy in the freshwater shrimp, Eulimnadia texana[J]. J Evol Biol, 27(10): 2080-2095. |
Zalapa J E, Cuevas H, Zhu H, et al. 2012. Using next-generation sequencing approaches to isolate simple sequence repeat (SSR) loci in the plant sciences[J]. American Journal of Botany, 99(2): 193-208. DOI:10.3732/ajb.1100394 |
 2018, Vol. 54
2018, Vol. 54

