文章信息
- 谢普军, 黄立新, 张彩虹, 丁莎莎, 邓叶俊
- Xie Pujun, Huang Lixin, Zhang Caihong, Ding Shasha, Deng Yejun
- 羟基酪醇快速硝基化及产物波谱表征
- A Fast Nitration Reaction of Hydroxytyrosol and Characterization on Its products with Spectroscopy
- 林业科学, 2018, 54(4): 121-127.
- Scientia Silvae Sinicae, 2018, 54(4): 121-127.
- DOI: 10.11707/j.1001-7488.20180414
-
文章历史
- 收稿日期:2016-09-02
- 修回日期:2016-11-18
-
作者相关文章
2. 中国林业科学研究院林业新技术研究所 北京 100091
2. Research Institute of Forestry New Technology, CAF Beijing 100091
羟基酪醇(3, 4-二羟基苯乙醇)是一种广泛分布于油橄榄(Olea europaea)中的小分子多酚化合物(原娇娇等,2015),具有抗氧化(王晓飞等,2011;Bisignano et al., 1999)、抗炎(De Leonardis et al., 2007)、抗癌(Owen et al., 2004)、保护心血管疾病(Visioli et al., 1998)和降血糖(Jemai et al., 2009)等生物活性。羟基酪醇的硝基化反应是林产化学加工的一个重要过程,广泛用于生产染料、药物、农用化学品和爆炸品等(Conlon et al., 1996;Tamiri et al., 2009)。传统酚类硝基化反应一般使用高强氧化性的混酸(硝酸与硫酸混合)或四氟硼酸硝酰阳离子等(冯柏成等,2006),但这些方法均存在一些缺陷,如副产物二硝基化合物的形成、反应底物过氧化而生成氧化产物,且反应过程污染大(Firouzabadi et al., 1998)。目前,国内外对羟基酪醇的研究主要集中在提取分离、检测及其简单酯化和酰基化改性等方面(Pereira-Caro et al., 2009;Uyama et al., 1994),而对羟基酪醇的硝基化反应鲜见报道。另外,硝基是强吸电子基团,在键合羟基酪醇后可增强鳌合Cu2+、Fe3+等金属离子能力,且保持更高的稳定性(Cornard et al., 2005),硝基羟基酪醇可用于儿茶酚-O-甲基转移酶(COMT)抑制剂,作为治疗帕金森病的药物中间体,在药物合成方面应用非常广泛(Bonifácio et al., 2014)。因此,很有必要建立一种温和、经济和环境友好的酚类硝基化方法。
本研究以亚硝酸盐为原料,在室温和弱酸条件下,建立一种对羟基酪醇进行快速硝基化反应的新方法,同时运用Uv-vis、FTIR、HPLC-MS、1HNMR和13CNMR等手段表征硝基化产物的结构,以期为邻二苯酚类化合物的硝基化及产物鉴定提供理论和数据支持。
1 材料与方法 1.1 化学试剂羟基酪醇,分析纯,美国Sigma-Aldrich试剂有限公司;DMSO,色谱纯,百灵威试剂有限公司;亚硝酸钠、乙酸、乙酸钠、乙酸乙酯和正己烷,南京化学试剂有限公司。
1.2 试验仪器数显水浴锅H4,江苏金坛市荣华仪器有限公司;旋转蒸发仪RE-5000,上海亚荣设备有限公司;紫外分光光度计T6,北京普析分析通用仪器有限公司;Aglient-5973液质联用仪(ESI源),美国安捷伦仪器有限公司;FTIR-Nicolet IS10,美国赛默飞仪器有限公司;核磁共振仪Bruke DKX-500,德国布鲁克有限公司;高效薄层色谱硅胶板(GF254),规格为2 cm×10 cm。
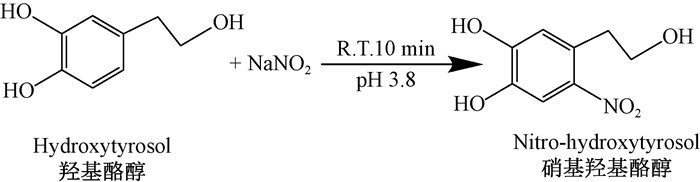
1.3 硝基羟基酪醇的合成硝基羟基酪醇的合成方法(Napolitano et al., 2002;Kono et al., 1995)如下:精确称取231.0 mg(1.5 mmol)羟基酪醇(HT),加入到300 mL乙酸缓冲液(0.1 mol ·L-1, pH 3.8)中,再加入亚硝酸钠207.0 mg(3.0 mmol),室温下搅拌下10 min后通过乙酸乙酯萃取(6×60 mL);汇集萃取的乙酸乙酯层液体,经无水硫酸钠干燥,获得黄色液体残留物(265.0 mg)。将残留物通过柱色谱纯化(乙酸乙酯:正己烷=3 :1)获得高纯度的硝基羟基酪醇(HT-NO2)(225.3 mg, 产率85.0%,黄色固体,熔点197.3 ℃)。
1.4 TLC薄层色谱和Uv-vis扫描检测在合成反应过程中,用毛细点样管取样,每隔2 min点样,进行TLC跑板,跟踪羟基酪醇硝基化反应进程,其中TLC所使用的展开剂为氯仿:甲醇=9 :1(V/V),使用碘进行显色。
将最终柱色谱纯化获得的硝基羟基酪醇溶解于甲醇中,进行Uv-vis全波长扫描,以获得其最大吸收波长(λmax)。
1.5 HPLC-MS 1.5.1 色谱条件色谱柱:Hypersil ODS2 C18 (150 mm×4.6 mm,5 μm,美国赛默飞有限公司);流动相:10%甲醇水溶液,柱温30 ℃,检测波长280 nm,流速1.0 mL ·min-1,进样量20 μL。
1.5.2 质谱条件离子源为ESI源,负离子模式。扫描范围m/z 50~1 000,干燥气体N2,干燥器体积流量10 L ·min-1;干燥器温度340 ℃,雾化器压力206.85 kPa。液相色谱与质谱之间分流,进入质谱的流速为0.5 mL ·min-1。
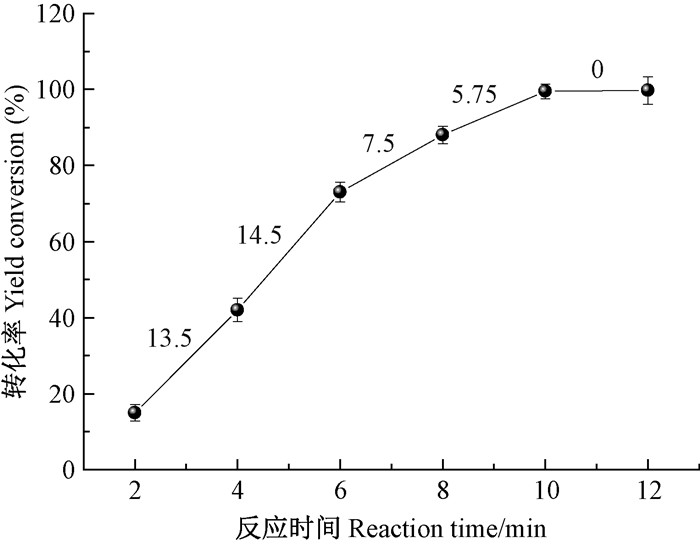
2 结果与分析由图 1可知,随着时间增加,硝基羟基酪醇的转化率逐渐升高,10 min后全部转化,4~6 min内转化速率最快,平均每分钟转化率达14.5%(图 1所示的斜率,也即单位时间的转化率)。从图 2反应原料与产物颜色的深浅程度也可知,羟基酪醇硝基化反应10 min较2 min反应更完全,通过对比展开剂为氯仿:甲醇=9 :1(V/V)的TLC跑板结果,发现羟基酪醇的比移值Rf1=0.83,硝基羟基酪醇的比移值Rf2=0.72,说明前者的极性大于后者,反应过程如图 3所示。与硝酸铁对水杨酸甲酯硝基化的反应方法相比,反应温度过高达90 ℃,反应时间过长达3 h,且反应专一性不强形成2种硝基取代化合物(刘艳珠等,2010),本研究方法具有时间更短、产物转化效率更高且专一性更强的特点。
|
图 1 反应时间对硝基羟基酪醇转化率的影响 Figure 1 Effects of reaction time on nitro-hydroxytyrosol yield conversion |

|
图 2 TLC薄层色谱 Figure 2 TLC spectroscopy |
|
图 3 羟基酪醇硝基化反应 Figure 3 Nitration reaction of hydroxytyrosol |
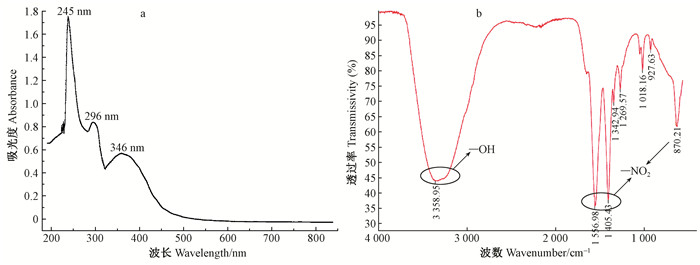
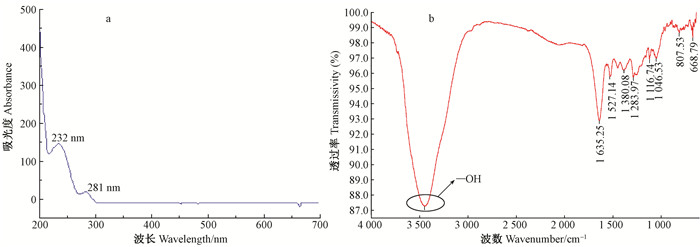
由图 4a可知,硝基羟基酪醇(甲醇溶液)的最大吸收波长(λmax)为245、296和346 nm。实际上,苯的3个主要紫外吸收带为183、207和264 nm,这3个吸收带与苯环上π电子的诱导效应和共轭效应密切相关(曹海华,2013)。羟基酪醇的紫外吸收最大波长分别为232和281 nm(图 5a),因硝基羟基酪醇含有2个羟基,与—NO2形成p-π共轭效应,使化合物吸收带红移,并且—NO2是生色团,含有π键与苯环形成π-π共轭体系。此外,—NO2为吸电子基团,吸电子能力越强红移越明显(隽英华等,2009)。
|
图 4 硝基羟基酪醇的紫外吸收扫描(a)和红外波谱(b) Figure 4 Full wavelengths scan with Uv-vis(a) and FTIR(b) of nitro-hydroxytyrosol |
|
图 5 羟基酪醇的紫外吸收扫描(a)和红外波谱(b) Figure 5 Full wavelengths scan with Uv-vis(a) and FTIR(b) of hydroxytyrosol |
由图 4b可知,硝基羟基酪醇在波数3 359 cm-1处有强吸收峰,为化合物的O—H伸缩振动,当分子间氢键增强时会使吸收峰变宽(Çırak et al., 2013),与羟基酪醇的红外吸收波数3 410 cm-1(图 5b)相近,表明产物含有羟基,羟基酪醇中的羟基反应过程未发生变化,而红外吸收波数1 557和1 405 cm-1处存在强吸收峰,分别与硝基羟基酪醇中的不对称(N=O)2伸缩振动和(N=O)2对称伸缩振动导致的吸收匹配,波数870 cm-1处有较强吸收峰,即为产物结构中C—N的伸缩振动(李改云等,2014)。
由图 6可知,硝基羟基酪醇分子离子的m/z为198(图 6A),由于检测方式为负电模式(M-H),表明其分子质量为199,与实际相对分子质量吻合(Slatnar et al., 2014)。此外,由于使用的流动相为乙腈,在电子轰击下会产生—CH2CN,易与硝基羟基酪醇键合形成化合物B,其m/z为240。硝基羟基酪醇在电子轰击下也会产生带正电的羟基酪醇,进一步与化合物B结合生成化合物C,其m/z为393。硝基羟基酪醇在电子轰击下,除了生成羟基酪醇外,同时也会产生[NO2]-,碎片粒子[NO2]-与化合物C结合,会生成化合物D,其m/z为439。
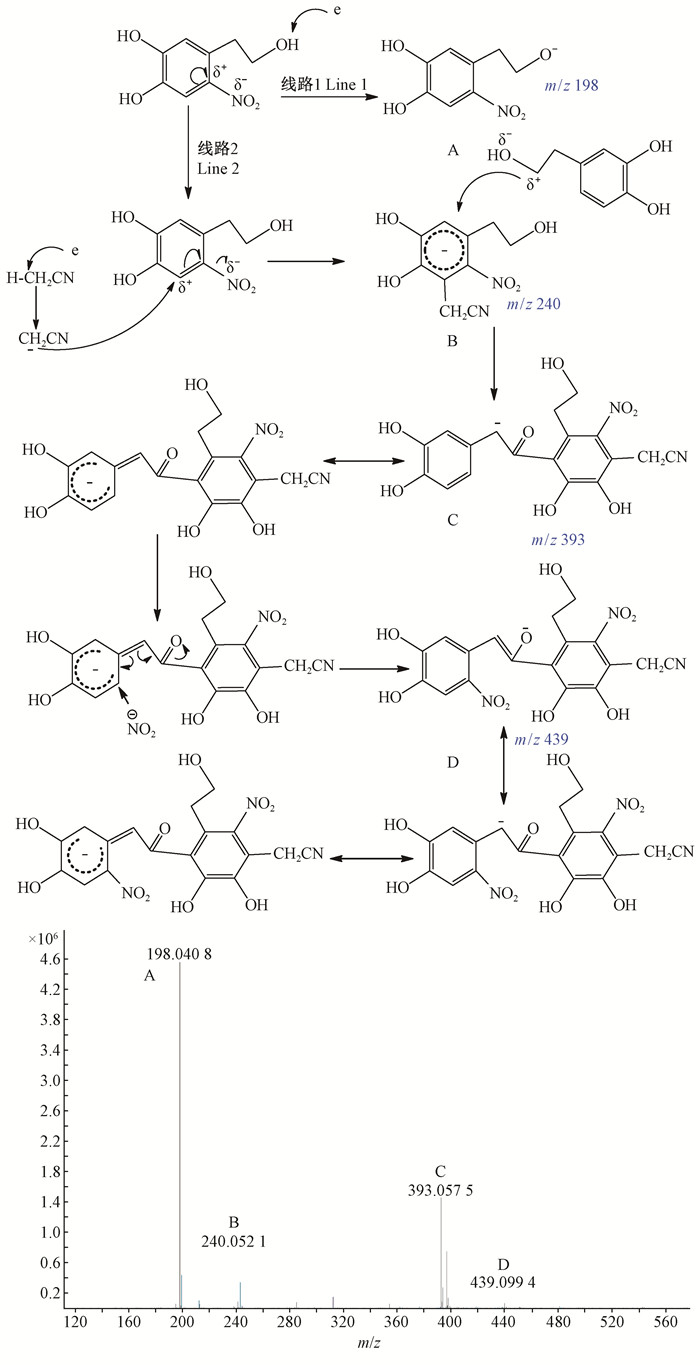
|
图 6 硝基羟基酪醇的MS Figure 6 MS of nitro-hydroxytyrosol |
由图 7a可知,酚羟基的1HNMR化学位移一般处于低场(化学位移7.5~4.5 ppm),当存在吸电子的—NO2基团时具有强诱导效应,使酚类化合物的化学位移进一步向低场移动。从结构上立体效应分析,—NO2基团离酚羟基a更近,较酚羟基b产生的影响更大(Witanowski et al., 2002),因此,酚羟基a的化学位移为10.33 ppm(单峰),酚羟基b的化学位移为9.80 ppm(单峰)。同理,对苯环上氢c的化学位移为7.45 ppm(单峰),氢d的化学位移为6.76 ppm(单峰)。化学位移2.93 ppm(单峰)和2.5 ppm(单峰)对应的峰分别为H2O和DMSO溶剂杂质峰。硝基羟基酪醇中的醇羟基化学位移为3.56 ppm(单峰),而其附近碳上的氢g和氢f相互影响,会产生自旋将峰裂分现象,并且醇羟基的诱导效应较苯环更强,降低了氢原子受到的屏蔽效应,引起氢原子向低场移动。综合推断得出硝基羟基酪醇中氢f的化学位移为1.91、1.91和1.99 ppm(三峰),氢g的化学位移为1.23、1.23和1.16 ppm(三峰)。
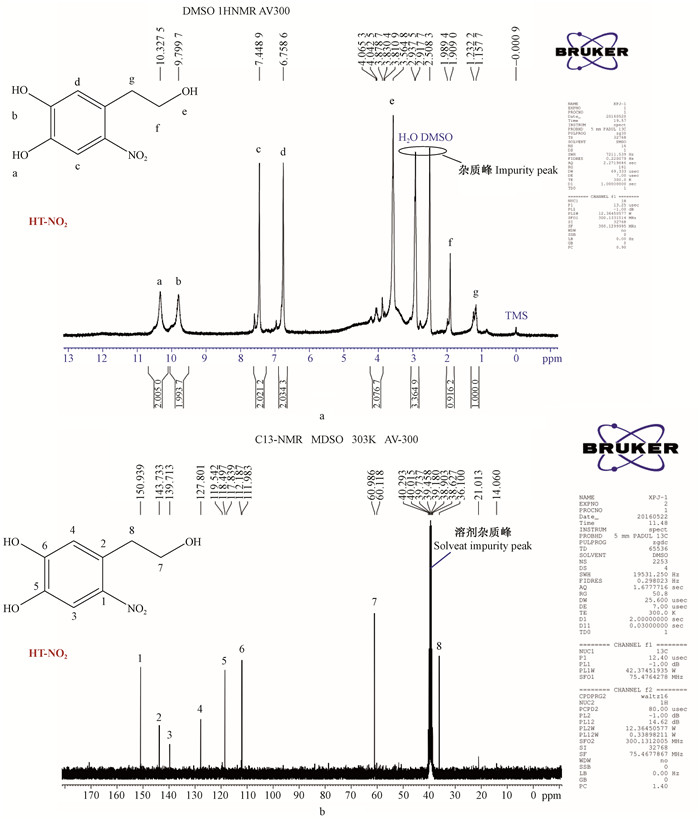
|
图 7 硝基羟基酪醇的1HNMR和13CNMR Figure 7 1HNMR and 13CNMR of nitro-hydroxytyrosol |
硝基羟基酪醇中苯环上碳为sp2杂化,而C=C sp2杂化的碳化学位移90~160 ppm,从产物的13CNMR (图 7b)可知,包含有C1-C6的化学位移在112~151 ppm区间,也即苯环上的6个碳原子,不同取代基对苯环上碳的化学位移影响也不同,当取代基为强电负性的基团时,其化学位移向低场移动,如—NO2较—CH2和酚羟基电负性更强。因此,推断出与—NO2连接的为C1,当酚羟基与苯环存在p-π共轭效应时,使其向高场移动;此外,由于离—NO2更近的间位(m-)碳较对位(p-)碳受诱导效应影响更强(Hill et al., 2015)。因此,推断出产物中C5处于—NO2的间位,C6处于—NO2的对位,同理C3和C4编号如图 7B所示。苯环外2个sp3的碳(C7和C8)化学位移为0~60 ppm,由于与醇羟基连接的碳会使其向低场运动(Dega-Szafran et al., 2005),表明C7与醇羟基相连,另一个碳则为C8。
3 结论1) 在室温和弱酸条件下,10 min后羟基酪醇的硝基化反应完全,在4~6 min内反应速率最快。
2) 硝基羟基酪醇的最大紫外可见吸收峰为245、296和346 nm,在波数1 557和1 405 cm-1存在强吸收FTIR峰,分别为其硝基基团的不对称(N=O)2伸缩振动和(N=O)2对称伸缩振动。一级MS硝基羟基酪醇的分子离子为198,1HNMR和13CNMR的化学位移证实了硝基处于羟基酪醇的对位,其化学结构式与论文结果一致。
本研究所得结论可为其他天然酚类化合物的快速硝基化及其产物图谱的结构解析提供数据和理论支持。
曹海华. 2013. 紫外光谱在化合物结构分析中的应用[J]. 内蒙古石油化工, 39(8): 34-36. (Cao H H. 2013. Compound structure analysis with ultraviolet spectrum[J]. Inner Mongo Petrochem, 39(8): 34-36. [in Chinese]) |
冯柏成, 韩德彰, 吴祖望, 等. 2006. 3, 4-亚甲二氧基硝基苯合成和晶体结构[J]. 大连理工大学学报, 46(4): 488-490. (Feng B C, Han D Z, Wu Z W, et al. 2006. Synthesis and crystal structure of 3, 4-methylenedioxy-nitrobenzene[J]. J Dalian Univ Technol, 46(4): 488-490. [in Chinese]) |
隽英华, 武志杰, 陈利军. 2009. 基于紫外吸收光谱的酚类衍生物含量检测研究[J]. 光谱学与光谱分析, 29(8): 2232-2235. (Juan Y H, Wu Z J, Chen L J. 2009. Study of Determination of phenol derivatives based on ultraviolet absorption spectra[J]. Spectrosc Spect Ana, 29(8): 2232-2235. [in Chinese]) |
李改云, 朱显超, 邹献武, 等. 2014. 微波辅助杨木快速苯酚液化及产物表征[J]. 林业科学, 50(11): 115-121. (Li G Y, Zhu X C, Zou X W, et al. 2014. Rapid wood liquefaction with phenol by microwave heating and product characterization[J]. Scientia Silvae Sinicae, 50(11): 115-121. [in Chinese]) |
刘艳珠, 李永绣, 李霞, 等. 2010. 硝酸铁对水杨酸甲酯的硝化及位置选择性[J]. 应用化学, 27(4): 432-436. (Liu Y Z, Li Y X, Li X, et al. 2010. Nitration reaction between methyl salicylate and iron(Ⅲ) nitrate and its regioselectivity[J]. Chin J Appl Chem, 27(4): 432-436. [in Chinese]) |
王晓飞, 李辰, 郑媛媛, 等. 2011. 油橄榄叶多酚类成分研究[J]. 中草药, 42(5): 848-851. (Wang X F, Li C, Zheng Y Y, et al. 2011. Polyphenols from leaves of Olea europaea[J]. Chin Tradit Herb Drugs, 42(5): 848-851. [in Chinese]) |
原姣姣, 叶建中, 王成章, 等. 2015. 油橄榄羟基酪醇的生物合成及其衍生物研究进展[J]. 林产化学与工业, 35(2): 154-162. (Yuan J J, Ye J Z, Wang C Z, et al. 2015. Advance in biosynthesis and biological activities of olive hydroxytyrosol and its derivatives[J]. Chem Ind Fore Prod, 35(2): 154-162. [in Chinese]) |
Bisignano G, Tomaino A, Lo Cascio R, et al. 1999. On the in-vitro antimicrobial activity of oleuropein and hydroxytyrosol[J]. J Pharm Pharmacol, 51(8): 971-974. DOI:10.1111/(ISSN)2042-7158 |
Bonifácio M J, Sutcliffe J S, Torrão L, et al. 2014. Brain and peripheral pharmacokinetics of levodopa in the cynomolgusmonkey following administration of opicapone, a third generation nitrocatechol COMT inhibitor[J]. Neuropharmaco, 77: 334-341. DOI:10.1016/j.neuropharm.2013.10.014 |
ÇırakÇ, SertY, UcunF. 2013. Effect of intermolecular hydrogen bonding, vibrational analysis and molecular structure of 4-chlorobenzothioamide[J]. Spectrochimica Acta A:Molecular and Biomolecular Spectroscopy, 113: 130-136. |
Conlon D A, Lynch J E, Hartner F W, et al. 1996. Nitrous acid-catalyzed nitration of 4-bromo-2, 5-dichlorophenol:observation of an unusually facile rearrangement of a 4-bromo-2-nitrophenol during nitration[J]. J Org Chem, 61(18): 6425-6429. DOI:10.1021/jo960290v |
Cornard J P, Merlin J C. 2005. Molecular structure and spectroscopic properties of 4-nitrocatecholat different pH:UV-visible, Raman, DFT and TD-DFT calculations[J]. Chem Phys, 309(2/3): 239-249. |
De Leonardis A, Macciola V, Lembo G., et al. 2007. Studies on oxidative stabilization of lard by natural antioxidants recovered from olive-oil mill wastewater[J]. Food Chem, 100(3): 998-1004. DOI:10.1016/j.foodchem.2005.10.057 |
Dega-Szafran Z, Katrusiak A, Szafran M. 2005. Molecular structure of the complex of n-methylmorpholine betaine with 2, 4-dinitrophenol[J]. J Mol Struct, 741(1/3): 1-9. |
Firouzabadi H, Iranpoor N, Zolfigol M A. 1998. Dinitrogen tetroxide complexes of iron (Ⅲ) and copper (Ⅱ) nitrates as new versatile reagents for organic synthesis.efficient and elective oxidation of sulfides to their corresponding sulfoxides under mild conditions[J]. Synth Commun, 71(9): 377-385. |
Hill D E, Vasdev N, Holland J P. 2015. Evaluating the accuracy of density functional theory for calculating 1H and 13C NMR chemical shifts in drug molecules[J]. Comput Theor Chem, 1051: 1161-172. |
Jemai H, El Feki A, Sayadi S. 2009. Antidiabetic and antioxidant effects of hydroxytyrosol and oleuropein from olive leaves in alloxan-diabetic rats[J]. J Agric Food Chem, 57(19): 8798-8804. DOI:10.1021/jf901280r |
Kono Y, Shibata H, Kodama Y., et al. 1995. The suppression of the N-nitrosating reaction by chlorogenic acid[J]. Biochem J, 312(3): 947-953. DOI:10.1042/bj3120947 |
Napolitano A, Camera E, Picardo M, et al. 2002. Reaction of hydro(pero)xy derivatives of polyunsaturated fatty acids/esters with nitrite ions under acidic conditions. Unusual nitrosative breakdown of methyl 13-hydro(pero)xyoctadeca-9, 11-dienoate to a novel 4-nitro-2-oximinoalk-3-enal product[J]. J Org Chem, 67(4): 1125-1132. DOI:10.1021/jo015973b |
Owen R W, Haubner R, Hull W E, et al. 2004. Olive and olive oil in cancer prevention[J]. Eur J Cancer Prev, 13(4): 319-326. DOI:10.1097/01.cej.0000130221.19480.7e |
Pereira-Caro G, Andrés M, Laura B, et al. 2009. Antioxidant activity evaluation of alkyl hydroxytyrosyl ethers, a new class of hydroxytyrosol derivatives[J]. Food Chem, 115(1): 86-91. DOI:10.1016/j.foodchem.2008.11.069 |
Slatnar A, Mikulic-Petkovsek M, Stampar F, et al. 2014. HPLC-MSn identification and quantification of phenolic compound sinhazelnut kernels, oil and bagasse pellets[J]. Food Res Int, 64: 783-789. DOI:10.1016/j.foodres.2014.08.009 |
Tamiri T, Rozin R, Lemberger N, et al. 2009. Urea nitrate, an exceptionally easy-to-make improvised explosive:studies towards trace characterization[J]. Anal Bioanal Chem, 395(2): 421-428. DOI:10.1007/s00216-009-2882-x |
Uyama H, Kurioka H, Kaneko I, et al. 1994. Synthesis of a new family of phenol resin by enzymatic oxidative polymerization[J]. Chem Lett, 23(3): 423-426. DOI:10.1246/cl.1994.423 |
Witanowski M, Biedrzycka Z, Sicinska W, et al. 2002. A study of solvent polarity and hydrogen bonding effects on the nitrogen NMR shieldings of N-nitramines and ab initio calculations of the nitrogen shieldings of C-nitro, N-nitro and O-nitro systems[J]. J Mol Struct, 602-603: 199-207. DOI:10.1016/S0022-2860(01)00734-7 |
 2018, Vol. 54
2018, Vol. 54

