文章信息
- 成敏敏, 陈柯伊, 朱雪玉, 王凯利, 周明兵, 杨海芸
- Cheng Minmin, Chen Keyi, Zhu Xueyu, Wang Kaili, Zhou Mingbing, Yang Haiyun
- 花叶矢竹复绿期光合特性及叶绿体结构
- Photosynthetic Characteristics and Chloroplast ultrastructure of Pseudosasa japonica f. akebonosuji during Green-Revertible Albino Stage
- 林业科学, 2018, 54(4): 1-10.
- Scientia Silvae Sinicae, 2018, 54(4): 1-10.
- DOI: 10.11707/j.1001-7488.20180401
-
文章历史
- 收稿日期:2017-03-29
- 修回日期:2017-06-02
-
作者相关文章
竹除用于工业生产领域外,还是重要的园林观赏植物。自然界中的竹子普遍存在秆色、叶色、笋箨等颜色多变特性,但无论白色、黄色、红色等都只在幼年期呈现,难以长期维持较佳的观赏特性。花叶矢竹(Pseudosasa japonica f. akebonosuji)引种自日本,是一种珍稀观赏竹,引种后竹林里出现绿叶株和花叶株,花叶株中白叶具有复绿特性,表现为同一主枝、不同位置的叶片复绿速度不一致,其中第1~3片叶展开时呈现白色,第4~7叶展开时淡绿,且第3~7叶复绿程度最高可达绿叶株的90%。这种复杂的叶色变异使其应用于园林景观、家庭盆景,还为研究竹子叶色变异的提供了理想材料,具有广阔的发展前景(杨海芸等,2010)。
禾本科(Poaceae)的水稻(Oryza stativa)(Peng et al., 2012;全瑞兰等,2015)、小麦(Triticum aestivum)(李宁等,2012)、大麦(Hordeum vulgare)(Qin et al., 2015)、玉米(Zea mays)(徐冬平等,2012)等均有叶色变异现象,其中,水稻中有较多与花叶矢竹白叶转绿的相似表型,但其复绿机制各不相同,水稻转绿型白化突变系W25白叶开始转绿前,叶绿素含量极低,叶绿素a/b的比值很高,转绿后与野生种的正常值接近,光合速率逐渐上升(吴殿星等,1996;翁晓燕等,2000);水稻白化转绿突变体在二叶期与抽穗初期叶片净光合速率、气孔导度、蒸腾速率和细胞间CO2浓度均显著低于野生型(和金鹏,2015);白化转绿型水稻V14的Fv/Fm值变化与叶绿素a,叶绿素b和类胡萝卜素含量的变化趋势一致。这些研究都证明叶片白化材料的光合色素含量较低,光合能力受损,但叶色转绿后,光合色素和光合能力均能逐渐恢复(吕典华等,2009;Zhang et al., 2014)。
目前,竹子叶色变异研究还较少。王啸晨等(2012)发现2种观赏竹的白叶组织中叶绿体异常,基粒片层降解;Xia等(2015)发现黄秆乌哺鸡竹(Phyllostachys vivax‘aureocaulis’)秆黄色组织的质体中没有类囊体,而在绿色组织叶绿体发育良好。Jiang等(2016)研究发现花叶矢竹叶绿素生物合成途径及过程中叶绿素合成相关PjPORB基因在白叶中特异表达;杨海芸等(2015)研究发现花叶矢竹白叶形成过程中生理特性及基因表达差异,但关于其白叶转绿的研究还尚未见报道。
基于花叶矢竹白叶复杂的复绿模式,且不同枝位和叶位复绿的速度不一致,本研究首先通过无损伤叶绿素活体测定(SPAD-502叶绿素仪)花叶矢竹叶片的不同复绿期程度,以绿叶株同位置叶片为对照,研究复绿叶光合色素含量、气体交换参数、光响应曲线、叶绿素荧光参数及叶绿体超微结构等的动态变化以及白叶转绿过程中光合特性和光合机构的恢复情况,为进一步探索花叶矢竹叶色变异机制提供依据,为解析竹子在自然界中存在的叶色变异现象提供参考。
1 材料与方法 1.1 试验材料花叶矢竹组培苗驯化移栽后3年的盆苗,放置于浙江农林大学智能温室内,为了控制试验叶片发育过程的一致性,均选取相同培养条件的绿叶株与花叶株当年生新竹主枝叶片,即初展时白色又能完全复绿(90%)的第3片叶为研究对象,从展叶第1天开始记录,依据叶片颜色变化和叶绿素相对含量的变化,最终确定白叶复绿过程中6个不同复绿阶段:即复绿程度0(全白叶、A)、10%(B)、30%(C)、50%(D)、70%(E)和90%(F)作为试验材料,以绿叶株相同位置的成熟绿叶为对照(CK)。
1.2 试验方法 1.2.1 SPAD值测定方法叶片SPAD值测定:利用SPAD-502叶绿素仪测定叶绿素相对含量(即SPAD值),测定部位为叶片中部长2 cm范围内,随机选取10个点取其平均值,即为该叶片SPAD。花叶矢竹白叶不同复绿程度(0、10%、30%、50%、70%和90%)的叶片确定方法为:首先测量对照绿叶株第3成熟绿叶的SPAD值,重复6个叶片并计算平均值,测得SPAD值为45.8;然后以相同方法测量花叶株上主枝第3叶完全复绿叶的平均SPAD值,为42.5,依据公式(复绿程度百分比=测量叶片平均SPAD值/绿叶平均SPAD值×100%)计算完全复绿叶复绿程度为绿叶的92.8%,即为复绿90%(F)处理,以此类推,寻找测量白叶不同复绿程度即SPAD值为0(A)、4.58(B)、17.4(C)、22.9(D)、32.06(E)的叶片,选择其值误差±5%内的叶片作为不同复绿程度的试验材料。
1.2.2 光合色素含量测定采用80%丙酮提取法提取叶片叶绿素,用DU800紫外/可见分光光度计(Beckman Coulter,USA)测定并用Arnon法(张宪政,1986)修正公式计算叶绿素含量。
1.2.3 气体交换参数测定晴天上午9:00— 11:30时间段内,利用LI-6400XT便携式光合测定仪(LI-COR,USA)02标准叶室,对叶片进行活体气体交换参数测定。设置测量光强800 μmol·m-2s-1,测定温度25 ℃,CO2浓度为400 μmol·m-2s-1,由小型CO2钢瓶提供,气体流量500 μmol·s-1,相对湿度约50%(陈根云等,2010)。测定前用600 μmol·m-2s-1光强对叶片进行光诱导20 min,每个不同阶段样本重复5次,分别取平均值。记录净光合速率(Pn,μmol CO2·m-2s-1)、蒸腾速率(Tr,mmolH2O·m-2s-1)、气孔导度(Gs,molH2O·m-2s-1)、胞间CO2浓度(Ci,μmolCO2·mol-1)。每个不同阶段样本重复5次,分别取平均值。白叶A无光合能力,不在图表中列出。
光响应曲线测定设置10个光合有效辐射强度(PAR)梯度:1 200、800、600、400、300、200、150、100、50和0 μmol·m-2s-1。利用文献(叶子飘,2010;叶子飘等,2009)的方法进行模型模拟并计算最大净光合速率(Pmax)、光补偿点(LCP)、光饱和点(LSP)、暗呼吸速率(Rd)、光补偿点处量子效率(Φc)和表观量子效率(AQY,Pn-PAR回归直线的初始斜率(PAR≤200 μmolCO2·mol-1) (Schreiber et al., 2009)。每个不同阶段样本重复5次,分别取平均值。白叶A无光合能力,不在图表中列出。
1.2.4 叶绿素荧光特性测定利用便携式调制叶绿素荧光仪Imaging-PAM,测定前已将叶片暗适应20 min。首先用弱测量光测定暗适应下初始光Fo,然后给1个饱和脉冲光(6 000 μmol·m-2s-1,脉冲时间0.8 s)测暗适应下最大荧光Fm;将叶片置于持续光化学活性光(76 μmolphotons·m-2s-1)下照射5 min以上,测量光适应下稳态荧光,每个阶段样本重复5次。测得参数为:光系统Ⅱ的初始荧光Fo、最大光化学量子产量Fv/Fm、实际原初光能捕获效率Y(Ⅱ)、非光化学淬灭系数NPQ、光化学淬灭系数qP及电子传递速率ETR的值。每个不同阶段样本重复5次,分别取平均值。白叶A无光合能力,不在图表中列出。
1.2.5 叶绿体超微结构观察叶肉细胞的叶绿体超微结构观察参照Lichtenthaler等(1982)和赵云等(2003)的方法。选取健康的不同复绿程度叶片,在叶中部主脉侧1 cm处,将叶片切成1 mm×2 mm的块状,置于4%戊二醛溶液中,4 ℃下固定7天。样品经磷酸缓冲液漂洗4次后,转入1%(pH7.2)锇酸中,再置于4 ℃下固定4 h,然后用磷酸缓冲液冲洗3次,经乙醇逐级脱水后,转入Epon812环氧树脂内浸透包埋。用Leica EMUC6型超薄切片机切片,经醋酸双氧铀和柠檬酸铅对切片双重染色后,在日产JEM-1200EXⅡ型透射电镜下观察、拍照。
1.3 数据统计分析数据用Spss统计软件进行方差分析,用Duncan法进行多重比较,用Sigmaplot17.0作图。
2 结果与分析 2.1 花叶矢竹叶色复绿过程的光合色素变化由图 1可知,花叶矢竹刚展叶叶片除了叶基部有少量绿色外全叶接近全白,随着时间的推移,从叶尖及叶基部开始逐渐复绿,初期呈浅绿色,此后绿色逐渐加深至翠绿,肉眼观测颜色与正常绿叶基本一致。由表 1可知,花叶矢竹不同阶段复绿叶的叶绿素a(Chla)、叶绿素b(Chlb)、叶绿素(a+b) [Chl (a+b)]及类胡萝卜素(Car)含量均随着复绿程度的增加呈上升趋势。复绿叶(F)的叶Chlb与CK差异不显著,而Chlb、Chl(a+b)及Car含量均差异显著,分别为绿叶的87.02%、89.37%、85.02%;复绿叶Chla/b比值呈升高趋势,虽然B-C复绿阶段变化缓慢,但D阶段后Chla/b值逐渐增加,E阶段后与CK差异不显著;类胡萝卜素/叶绿素[Car/Chl(a+b)]的比值逐渐降低,白叶A时期为最大,显著高出CK 3.15倍,复绿至D阶段以后与CK无显著差异。

|
图 1 花叶矢竹不同复绿阶段叶片 Figure 1 Different degrees of return-green leaves of Pseudosasa japonica f. akebonosuji |
|
|
由图 2可知,花叶矢竹不同复绿程度叶片的各光合指标差异明显。复绿叶净光合速率增长迅速,不同复绿程度之间净光合速率(Pn)差异显著,B、C、D、E、F叶片净光合速率分别为CK的2.51%、6.44%、36.99%、55.73%、89.98%;气孔导度(Gs)在复绿初期B阶段显著增加至C阶段后,C-F阶段与CK均无显著差异;胞间CO2浓度(Ci)变化趋势与净光合速率变化趋势相反,复绿前期(B-C)变化缓慢,而后迅速下降,但各阶段Ci值均显著高出CK,分别为CK的2.17、2.18、1.88、1.69和1.31倍;蒸腾速率缓慢上升。

|
图 2 花叶矢竹不同复绿程度复绿叶及正常绿叶的气体交换参数 Figure 2 Gas exchange parameters of return-green leaves and nomal green leaves of P. japonica f. akebonosuji A:净光合速率The net photosynthetic rate (Pn);B:气孔导度Stomatal conductance(Gs);C:胞间CO2浓度Intercellular CO2 (Ci);D:蒸腾速率Transpiration rate (Tr) |
在CO2恒定400 μmol·mol-1浓度和一定光强范围内测得光响应曲线并得出拟合参数(图 3)。不同阶段复绿叶及绿叶的净光合速率均呈上升趋势,复绿程度越高的叶片净光合速率越高;在较低光强下Pn迅速升高至一定程度后速率变缓最后逐渐平稳,且复绿程度越高达到稳定时的光强越高。由表 2可知,复绿叶光饱和点、表观量子效率和最大净光合效率逐渐上升,光补偿点逐渐下降,暗呼吸速率除B时期显著低于CK外,变化不大;与CK相比,完全复绿叶F的光饱和点、光补偿点、暗呼吸速率和最大净光合速率均差异不显著,分别为CK的103.62%、75.42%、77.78%和96.99%,但表观量子效率显著低于CK,仅为78.66%。
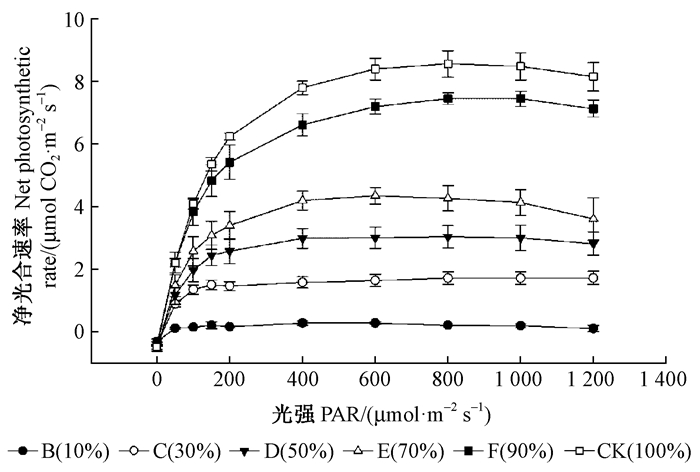
|
图 3 花叶矢竹不同复绿阶段叶片净光合速率Pn对光强度的响应 Figure 3 Light response curves among different stages of return-green leaves |
|
|
对花叶矢竹的叶绿素荧光参数研究复绿过程光系统Ⅱ对光能的吸收、传递、耗散、分配等过程的恢复情况。初始荧光Fo变化趋势先上升后下降,在D时期达到最大并显著高于CK,达到CK的2.25倍;光化学淬灭系数NPQ变化趋势与Fo一致;PSⅡ最大光化学效率Fv/Fm变化呈递增趋势,但在D阶段复绿50%后变化趋势变缓,完全复绿叶F与CK的差异不显著,为对照组CK的0.92%;复绿叶的实际光化学效率Y(Ⅱ)与表观电子传递速率(ETR)的变化均为递增趋势,复绿过程中各个试验组与对照组相比均差异显著,完全复绿叶F仅达到全绿叶片的89.71%和89.81%;qP在复绿阶段变化不大。
2.4 花叶矢竹叶色复绿过程的叶绿体超微结构分析 2.4.1 叶绿体数量及大小由表 3可知,白叶与复绿叶的平均单个细胞叶绿体数显著低于绿叶,其中全白叶A和B(10%)阶段复绿叶片的平均单个细胞叶绿体数之间无显著差异,随着叶片复绿在C-F之间虽有所增加,但无显著差异,而B-E阶段也仍显著低于对照,完全复绿叶(F)单细胞平均叶绿体数只有绿叶CK的49.89%;白叶叶绿体长度和宽度均显著低于其他,长宽分别为绿叶的0.43,B-E阶段有缓慢增长,但E-F阶段增长迅速,F(90%)阶段叶绿体长、宽与CK相比差异不显著。

|
图 4 花叶矢竹不同复绿程度复绿叶及正常绿叶的叶绿素荧光参数初始荧光Fo、最大光化学效率Fv/Fm、实际原初光能捕获效率Y(Ⅱ)、光化学淬灭系数qP及电子传递速率ETR Figure 4 Chlorophyll fluorescence parameters of Initial fluorescence(Fo), the photochemical quantum yield (Fv/Fm), the actual solar energy capture efficiency (Y (Ⅱ)), photochemical quenching coefficient (qP) and the apparent quantum transport rate (ETR) |
|
|
通过对花叶矢竹不同复绿阶段叶片叶绿体超微结构观察可知(图 2),内膜系统中的类囊体结构变化较大。复绿过程中叶绿体内膜系统由无序泡状到有序的片层和基粒类囊体排列。其中,全白叶片(A1-A2)的叶肉细胞中的质体外膜完好、近圆形,内膜呈混浊泡状和碎片、基质颜色较浅,内有若干噬锇颗粒存在。B阶段复绿叶叶绿体(B1-B2)基质内溶物着色变深,嗜锇颗粒逐渐集中变小,但囊泡变大而空,开始出现类囊体单片层;C阶段复绿叶叶绿体内部(C1、C2),类囊体片层清晰可见,仍排列无规则,噬锇颗粒较前一阶段集中变小,囊泡纯白色变大且形状不规则;D阶段(D1、D2)复绿叶叶绿体形状近长梭形,类囊体片层开始垛叠但基粒片层数不多,有淀粉粒出现;E阶段复绿叶(E1、E2)叶绿体基质染色加深,基粒垛叠厚度增加,排列规律一致,淀粉颗粒变大,完整的基粒类囊体数量较少;F复绿叶(F1、F2)叶绿体基质着色深,叶绿体内垛叠清晰、基粒类囊体数量多、排列紧密的,基质片层伸展的方向顺着叶绿体的长轴方向排列,基粒与基质类囊体共同组成完整的光合膜系统;对照组绿叶(CK1、CK2)叶绿体为不规则的椭圆形,着色深、紧密排列并沿细胞壁排列,叶绿体内部的基粒类囊体结构清晰、垛叠紧密,基粒数量多至重叠,淀粉颗粒大。
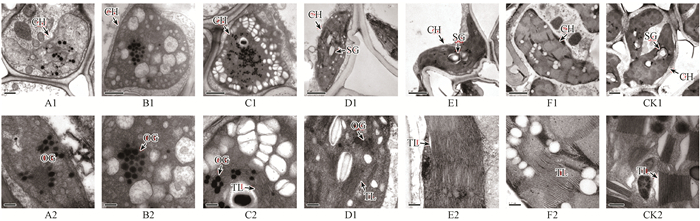
|
图 5 花叶矢竹不同复绿叶片叶绿体超微结构 Figure 5 The chloroplast ultrastructure of different return-green level CH:叶绿体Chloroplast TL:类囊体片层Thylakoid lamella SG:淀粉颗粒Starch grain OG:嗜饿颗粒Osmiophilic granute A1、A2:花叶矢竹全白叶片;B1、B2:复绿10%时期的叶片;C1、C2:复绿30%时期的叶片;D1、D2:复绿50%时期的叶片;E1、E2:复绿70%时期的叶片;F1、F2:完全复绿叶(复绿90%时期);CK1、CK2:花叶矢竹正常绿叶。 A1, A2: White leaf; B1, B2: 10% level of the return-green leaf; C1, C2: 30% level of the return-green leaf; D1, D2: 50% level of the return-green leaf; E1, E2: 70% level of the return-green leaf; F1, F2: 90% level of the return-green leaf (completely return-green leaf); CK1, CK2: Green leaf. |
叶绿素是植物叶绿体中参与光合作用的重要色素,其含量的变化也会导致叶色变化(Chen et al., 2007)。生育期依赖型的白化转绿水稻突变体G9与野生型对照比较研究表明,复绿前二叶期Chla、Chlb的含量为对照的0.24%和0.40%,四叶期开始复绿、色素含量提高,至六叶期时突变体叶绿素含量显著提高,达到对照97.34%和90.47%(李瑞清,2010)。本研究中花叶矢竹全白叶总叶绿素含量极低,随着叶色复绿过程,Chla、Chlb、Car等色素含量均逐渐升高,这与水稻白化转绿突变体G9(马春雷等,2015)和小麦矮变一号的返白突变体(王保莉,1996)等研究结果一致;但Chla/Chlb的比值逐渐增大,Car/Chl的比值逐渐降低,表明花叶矢竹复绿过程中Chla合成速度比Chlb快,Car合成速度比Chl慢,且复绿F阶段Chlb恢复至绿叶水平,而Chla仍与CK存在差异,这与马春雷等(2015)研究结果不一致。
3.2 叶片色素累积提高花叶矢竹叶片光合能力叶绿素捕获光能并将能量传递到光反应中心从而产生化学能(朱明库等,2012),因此植物光合机构的光合活性与叶色变化密切相关。花叶矢竹全白叶叶绿体无正常类囊体结构,缺乏光合作用场所,因此无光合能力;复绿后,各光合指标逐渐恢复,其中净光合速率和光饱和点逐渐升高,光补偿点逐渐降低,表明复绿叶对光能的吸收及利用能力逐渐提高;胞间CO2浓度逐渐下降,暗呼吸速率及气孔导度在复绿过程中变化不大,表明光合速率提高不受气孔因素的限制,这与前人关于叶色变异材料的研究结果(谭新星等,1996;肖华贵等,2013a)一致;复绿F阶段,光合效率仍显著低于绿叶水平,可能是捕光色素不足导致光能捕获的能力低于对照组绿叶,这与常青山等(2013)对菊花(Chrysanthemum×morifolium ‘Jinlingguozi’)黄绿叶突变体的研究一致。因此,花叶矢竹白叶复绿过程光合固碳能力逐渐提高,但光系统部分功能仍未恢复到正常绿叶的水平,具体原因有待进一步研究。
叶绿素荧光参数是研究光系统Ⅱ对光能的吸收、传递、耗散、分配等过程的重要指标。植物初始荧光Fo与叶绿素含量相关,同时与植物类囊体膜受损程度有关,Fo增加量越多,类囊体膜受损程度越严重(陈建明等,2006),因此花叶矢竹白叶复绿过程中Fo先上升后下降是由叶绿素水平提高和类囊体膜恢复2个因素共同导致的;非光化学淬灭NPQ值在复绿初期较低,光保护能力较弱,可能与复绿初期叶片叶绿素含量过低导致的捕光能力及光饱和点过低有关,与肖华贵等(2013b)研究结果一致;最大光化学量子产量Fv/Fm逐渐增大并恢复至绿叶水平,表明复绿叶的光合系统潜在的光合能力已恢复,这与已有研究一致(Lv et al., 2013;Lokstein et al., 1993);Y(Ⅱ)、ETR 2个参数在复绿过程中逐渐恢复,但与绿叶仍差异显著,表明光合电子传递链中光化学反应导致碳固定的电子传递部分仍与绿叶存在差异。这些参数的变化说明光合色素含量逐渐升高后,光系统Ⅱ天线色素的光能捕获、光能转换及电子传递能力均逐渐恢复,使复绿叶的光合能力提高。
3.3 花叶矢竹类囊体形成并有序排列、垛叠使光系统活性恢复叶绿体类囊体片层结构与光合能力密切相关(Anderson,1973),类囊体是光合作用光反应的场所,是光捕获、光合电子传递、质子易位及ATP合成的位点(Chow et al., 2005)。本研究中白叶复绿过程中类囊体形成并逐渐有序排列、垛叠,形成完整类囊体膜结构(Waters et al., 2009);同时,光合效率、PSⅡ最大光化学效率Fv/Fm和表观电子传递速率ETR等指标均逐渐恢复,这可能与光合作用相关的光合复合体在类囊体上的组装和功能启动有关(Staehelin, 2005)。水稻“斑马叶”突变体B411的叶绿体超微结构的观察表明,叶片黄区变成绿色时叶绿体结构恢复正常、类囊体膜系统重建(邱义兰等,2010);小白菜(Brassica chinensis)黄苗突变体的叶绿素荧光特性研究中,小白菜黄苗突变体只有较弱的捕光能力,在强光下比其野生型有较强的热耗散能力和更有效的活性氧清除系统(郭士伟等,2003)。因此,花叶矢竹复绿过程中,类囊体片层垛叠使光合复合体逐渐组装到类囊体膜上,光合电子传递载体活力激发,促进光系统活性的恢复,是花叶矢竹白叶复绿的根本原因。
4 结论光合色素累积及类囊体片层有序排列、垛叠是促进花叶矢竹复绿叶片光合功能逐渐恢复的2个重要的非气孔因素。叶绿素水平显著提高是白叶复绿的直接原因,而白叶复绿过程中伴随着光合性能的恢复,类囊体片层的垛叠恢复了光合系统性能,是光合色素累积、叶片转绿的根本原因。
陈根云, 陈娟, 许大全. 2010. 关于净光合速率和胞间CO2浓度关系的思考[J]. 植物生理学报, 46(1): 64-66. (Chen G Y, Chen J, Xu D Q. 2010. Thinking about the relationship between net photosynthetic rate and intercellular CO2 concentration[J]. Plant Physiology Communications, 46(1): 64-66. [in Chinese]) |
陈建明, 俞晓平, 程家安. 2006. 叶绿素荧光动力学及其在植物抗逆生理研究中的应用[J]. 浙江农业学报, 62(1): 51-55. (Chen J M, Yu X P, Cheng J A. 2006. The application of chlorophyll fluorescence kinetics in the dtudy of physiological responses of plants to environmental stresses[J]. Acta Agriculturae Zhejiangensis, 62(1): 62-76. [in Chinese]) |
常青山, 张利霞, 陈煜, 等. 2013. 菊花黄绿叶突变体的光合与类囊体膜光谱[J]. 林业科学, 49(2): 72-78. DOI:10.11707/j.1001-7488.20130211 |
Chang Q S, Zhang L X, Cheng Y, et al. 2006. Characteristics of photosynthesis and spectra properties of thylakoid membranes in the yellow-green leaf mutant of chrysanthemum[J]. Scientia Silvae Sinicae, 49(2): 72-78. |
郭士伟, 张云华, 金永庆, 等. 2003. 小白菜(Brassica chinensis L.)黄苗突变体的叶绿素荧光特性栽[J]. 作物学报, 29(6): 958-960. (Guo S W, Zhang Y H, Jin Y Q, et al. 2003. Characteriization of ChlorophyⅡ Fluorescence in a Mutant of Brassica chinensis L. with Xantha Seedling Leaves[J]. Acta Agronomica Sinica, 29(6): 958-960. [in Chinese]) |
和金鹏. 2015. 水稻白化转绿突变体bai S的生理生化特性及分子机理研究. 南昌: 江西农业大学硕士学位论文. (He J P. 2015. Study on physiologica biochemical and molecuolar mechanism of a green-revertible albino rice mutant bai S. Nanchang: MS thesis of Agricultural University of Jiangxi. [in Chinese]) |
李宁. 2012. 小麦黄绿突变体特性研究与遗传分析. 北京: 中国农业科学院博士学位论文. (Li N. 2012. Characterization and genetic analysis of yellow green mutants in wheat. Beijing: PhD thesis of Chinese Academy of Agricultural Sciences. [in Chinese]) |
李瑞清. 2010. 水稻白化转绿突变体G的特性分析和基因定位研究. 合肥: 安徽农业大学硕士学位论文. (Li R Q. 2010. Characteristic analysis and gene mapping of a rice albino green mutant G. Hefei: MS thesis of Anhui Agriculture University. [in Chinese]) |
吕典华, 宗学凤, 王三根, 等. 2009. 两个水稻叶色突变体的光合特性研究[J]. 作物学报, 35(12): 2304-2308. (Lü D H, Zong X F, Wang S G, et al. 2009. Characteristics of photosynthesis in two leaf color mutants of rice[J]. Acta Agronomica Sinica, 35(12): 2304-2308. [in Chinese]) |
马春雷, 姚明哲, 王新超, 等. 2015. 茶树叶绿素合成相关基因克隆及在白叶1号不同白化阶段的表达分析[J]. 作物学报, 41(2): 240-250. (Ma C L, Yao M Z, Wang X C, et al. 2015. Cloning and expression of three genes involved in chlorophyll biosynthesis at different albescent stages of tea plant variety"Baiye 1"[J]. Acta Agronomica Sinica, 41(2): 240-250. [in Chinese]) |
邱义兰, 李红, 彭克勤, 等. 2010. 水稻"斑马叶"突变体B411叶绿体超微结构的观察[J]. 作物学报, 36(1): 184-190. (Qiu Y L, Li H, Peng K Q, et al. 2010. Observation of chloroplast ultrastructure of zebra leaf in rice mutant B411[J]. Acta Agronomica Sinica, 36(1): 184-190. [in Chinese]) |
全瑞兰, 王青林, 马汉云, 等. 2015. 水稻白化转绿突变体研究进展[J]. 安徽农学通报, 21(12): 17-20. (Quan R L, Wang Q L, Ma H Y, et al. 2015. Research advances on green-revertible albino mutants of rice[J]. Anhui Agricultural Science Bulletin, 21(12): 17-20. DOI:10.3969/j.issn.1007-7731.2015.12.010 [in Chinese]) |
谭新星, 许大全, 汤泽生. 1996. 叶绿素缺乏的大麦突变体的光合作用和叶绿素荧光[J]. 分子植物, 1996(1): 51-57. (Tan X X, Xu D Q, Tang Z S. 1996. Photosynthesis and chlorophyll fluorescence in barley mutants deficient in chlorophyll[J]. Molecular Plant, 1996(1): 51-57. [in Chinese]) |
王保莉, 郭蔼光, 汪沛洪. 1996. 小麦突变体返白系返白阶段叶绿素代谢的变化[J]. 植物学报, 1996(7): 45-50. (Wang B L, Guo A G, Wang P H. 1996. Changes of chlorophyll metabolism during the albinic stage of a wheat mutant[J]. Acta Bot Sin, 1996(7): 45-50. [in Chinese]) |
王啸晨, 岳祥华, 吴杰, 等. 2012. 2种观赏彩叶竹形态结构的观察与分析[J]. 中国农学通报, 28(16): 233-238. (Wang X C, Yue X H, Wu J, et al. 2012. Appearance and structure analysis of chimeric leaves from two ornamental bamboos[J]. Chinese Agricultural Science Bulletin, 28(16): 233-238. [in Chinese]) |
翁晓燕, 蒋德安, 陆庆. 2000. 水稻转绿型白化突变系W_(25)转绿过程中Rubisco、Rubisco活化酶活性与光合速率的变化[J]. 植物生理学报, 26(3): 213-225. (Weng X Y, Jiang D A, Lu Q. 2000. Changes of activities of Rubisco, Rubisco and photosynthetic rate in the green turning albino mutant W_(25) of rice[J]. Acta Phytophysiologica Sinica, 26(3): 213-225. [in Chinese]) |
吴殿星, 舒庆尧, 夏英武, 等. 1996. 一个新的水稻转绿型白化突变系W25的叶色特征及遗传[J]. 浙江农业学报, 1996(8): 372-374. (Wu D X, Shu Q Y, Xia Y W, et al. 1996. Leaf color character and genetics of a new greenable albino mutation line W25 of rice (Oryza sativa)[J]. Acta Agriculturae Zhejiangensis, 1996(8): 372-374. [in Chinese]) |
肖华贵, 杨焕文, 饶勇, 等. 2013a. 甘蓝型油菜黄化突变体的叶绿体超微结构、气孔特征参数及光合特性[J]. 中国农业科学, 46(4): 715-727. (Xiao H G, Yang H W, Rao Y, et al. 2013a. Analysis of chloroplast ultrastructure, stomatal characteristic parameters and photosynthetic characteristics of chlorophyll reduced mutant in Brassica napus L[J]. Scientia Agricultura Sinica, 46(4): 715-727. [in Chinese]) |
肖华贵, 杨焕文, 饶勇, 等. 2013b. 甘蓝型油菜黄化突变体的光合特性及叶绿素荧光参数分析[J]. 作物学报, 39(3): 520-529. (Xiao H G, Yang H W, Rao Y, et al. 2013b. Photosynthetic Characteristics and chlorophyll fluorescence kinetic parameters analyses of chlorophyll-reduced mutant in Brassica napus L[J]. Acta Agronomica Sinica, 39(3): 520-529. [in Chinese]) |
徐冬平, 汪瀚宇, 张采波, 等. 2012. 一个新的玉米黄化突变体的初步研究[J]. 核农学报, 26(7): 988-993. (Xu D P, Wang H Y, Zhang C B, et al. 2012. The preliminary study sf a novel yellow-green leaf mutant in maize[J]. Journal of Nuclear Agricultural Sciences, 26(7): 988-993. [in Chinese]) |
杨海芸. 2015. 花叶矢竹叶色变异机理研究. 北京: 北京林业大学博士学位论文. (Yang H Y. 2015. Study on mechanism of spontaneous leaf color variation of Pseudosasa japonica f. akebonosuji H. Okamura. Beijing: PhD thesis of Beijing Forestry University.) |
杨海芸, 王晓芹, 张宁, 等. 2010. 日本花叶矢竹组织培养与叶色变异研究[J]. 竹子研究汇刊, 29(4): 15-20. (Yang H Y, Wang X Q, Zhang N, et al. 2010. Tissue culture and Leaf color variation of Pseudosasa japonica cv[J]. akebonosuji.Journal of Bamboo Research, 29(4): 15-20. [in Chinese]) |
叶子飘, 于强. 2009. 植物气孔导度的机理模型[J]. 植物生态学报, 33(4): 772-782. (Ye Z P, Yu Q. 2009. Mechanism model of stomatal conductance[J]. Chinese Journal of Plant Ecology, 33(4): 772-782. [in Chinese]) |
叶子飘. 2010. 光合作用对光和CO2响应模型的研究进展[J]. 植物生态学报, 34(6): 727-740. (Ye Z P. 2010. A review on modeling of responses of photosynthesis to light and CO2[J]. Chinese Journal of Plant Ecology, 34(6): 727-740. [in Chinese]) |
赵云, 王茂林, 李江, 等. 2003. 幼叶黄化油菜(Brassica napus L[J]. )突变体Cr3529叶绿体超微结构观察.四川大学学报:自然科学版, 40(5): 974-977. (Zhao Y, Wang M L, Li J, et al. 2003. Observation of the chloroplast in chlorophyll-reduced seedling mutant Cr3529 Brassica napus L[J]. Journal of Sichuan University:Natural Science Edition, 40(5): 974-977. [in Chinese]) |
张宪政. 1986. 植物叶绿素含量的测试——丙酮乙醇混合液法[J]. 辽宁农业科学, 1986(3): 26-28. (Zhang X Z. 1986. Measurement of chlorophyll content in plants:acetone ethanol mixture[J]. Liaoning Agricultural Sciences, 1986(3): 26-28. [in Chinese]) |
朱明库, 胡宗利, 周爽, 等. 2012. 植物叶色白化研究进展[J]. 生命科学, 24(3): 255-261. (Zhu M K, Hu Z L, Zhou S, et al. 2012. Research progress of plant leaf albino[J]. Chinese Bulletin of Life Sciences, 24(3): 255-261. [in Chinese]) |
Anderson J M, Goodchild D J, Boardman N K. 1973. Composition of the photosysterms and chloroplast structure in extreme shade plants[J]. Biochimica et Biophysica Acta, 325(3): 573-585. DOI:10.1016/0005-2728(73)90217-X |
Chen T, Zhang Y, Zhao L, et al. 2007. Physiological character and gene mapping in a new green-revertible albino mutant in rice[J]. Journal of Genetics & Genomics, 34(4): 331-338. |
Chow W S, Kim E H, Horton P, et al. 2005. Granal stacking of thylakoid membranes in higher plant chloroplasts:the physicochemical forces at work and the functional consequences that ensue[J]. Photochemical & Photobiological Sciences Official Journal of the European Photochemistry Association & the European Society for Photobiology, 4(12): 1081-1090. |
Lichtenthaler H K, Kuhn G, Prenzel U, et al. 1982. Adaptation of chloroplast-ultrastructure and of chlorophyll-protein levels to high-light and low-light growth conditions[J]. Zeitschrift für Naturforschung, 37(5/6): 464-475. |
Lokstein H, Härtel H, Hoffmann P, et al. 1993. Comparison of chlorophyll fluorescence quenching in leaves of wild-type with a chlorophyll-b-less mutant of barley (Hordeum vulgare L[J]. ). Photochem Photobiol B:Biology, 19(3): 217-225. DOI:10.1016/1011-1344(93)87087-4 |
Lv Q D, Xu J M, Wu P. 2013. Ospapst1, a useful mutant for identifying seed purity and authenticity in hybrid rice[J]. Plant Signaling & Behavior, 8(7): 7-9. |
Jiang K Y, Zhou M B. 2016. Cloning and functional characterization of PjPORB, a member of the POR gene family in Pseudosasa japonica cv[J]. Akebonosuji. Plant Growth Regulation, 79(1): 95-106. DOI:10.1007/s10725-015-0115-1 |
Osborne B A, Raven J A. 1986. Light absorption by plants and its implications for photosynthesis[J]. Biological Reviews, 61(1): 1-60. DOI:10.1111/brv.1986.61.issue-1 |
Peng Y, Zhang Y, Lv J, et al. 2012. Characterization and fine mapping of a novel rice albino mutant low temperature albino 1[J]. Journal of Genetics and Genomics, 39(8): 385-396. DOI:10.1016/j.jgg.2012.05.001 |
Qin D D, Dong J, Xu F C, et al. 2015. Characterization and fine mapping of a novel barley stage green-revertible albino gene (HvSGRA) by bulked segregant analysis based on SSR assay and specific length amplified fragment sequencing[J]. BMC Genomics, 16(1): 838-852. DOI:10.1186/s12864-015-2015-1 |
Schreiber U, Bilger W, Neubauer C. 1995. Chlorophyll fluorescence as a nonintrusive indicator for rapid assessment of in vivo photosynthesis. ecophysiology of photosynthesis[J]. Springer Berlin Heidelberg, 100: 49-70. |
Staehelin L A. 2005. Chloroplast structure:from chlorophyll granules to supra-molecular architecture of thylakoid membranes[J]. Photosynthesis Research, 76(1/3): 185-196. |
Waters M, Langdale J. 2009. The making of a chloroplast[J]. Embo Journal, 28(19): 2861-2873. DOI:10.1038/emboj.2009.264 |
Xia X W, Gui R Y, Yang H Y, et al. 2015. Identification of genes involved in color variation of bamboo culms by suppression subtractive hybridization[J]. Plant Physiology & Biochemistry, 97(10): 156-164. |
Zhang Q Y, Xue D X, Li X Y, et al. 2014. Characterization and molecular mapping of a new virescent mutant in rice[J]. Journal of Genetics and Genomics, 41(6): 353-356. DOI:10.1016/j.jgg.2014.01.010 |
 2018, Vol. 54
2018, Vol. 54

