文章信息
- 田梦迪, 李燕杰, 张平冬, 王健, 郝静颐
- Tian Mengdi, Li Yanjie, Zhang Pingdong, Wang Jian, Hao Jingyi
- 高温诱导银灰杨花粉染色体加倍创制杂种三倍体
- Pollen Chromosome Doubling Induced by High Temperature Exposure to Produce Hybrid Triploids in Populus canescens
- 林业科学, 2018, 54(3): 39-47.
- Scientia Silvae Sinicae, 2018, 54(3): 39-47.
- DOI: 10.11707/j.1001-7488.20180305
-
文章历史
- 收稿日期:2017-04-13
- 修回日期:2017-06-10
-
作者相关文章
2. 新疆阿勒泰地区林业科学研究所 阿勒泰 836500;
3. 包头黄河国家湿地公园管理处 包头 014030
2. Forestry Research Institute of Altay Region, Xinjiang Altay 836500;
3. Baotou Yellow River National Wetland Park Management Office Baotou 014030
三倍体育种综合了倍性效应与杂种优势,通过一次育种过程可实现生长、材性以及适应性等多目标性状综合遗传改良,是杨树遗传改良的重要途径与方法(康向阳,2002)。高温作为一种行之有效的物理诱变途径,已成功用于杨树(Populus)、杜仲(Eucommia ulmoides)以及橡胶树(Hevea brasiliensis)等木本植物的配子染色体加倍诱导(康向阳等,2000a;毛彦科等,2013;张源源,2013),获得了数以百计的多倍体新种质,完全可以满足林木多倍体育种实践的需要。但对不同树种而言,高温处理诱导配子染色体加倍的处理温度、有效处理时期以及持续处理时间等关键技术环节却不尽相同(康向阳等,2000;李云等,2000;张磊等,2010;Zhang et al., 2013)。因此,针对不同树种,开展高温诱导配子染色体加倍选育林木多倍体时,对处理温度、有效处理时期以及持续处理时间等开展研究是十分必要的。
银灰杨(Populus canescens)原产于欧洲,在我国仅分布于新疆额尔齐斯河流域。其树干通直、抗病虫害、抗寒、耐干旱贫瘠、寿命长、材性好(徐秀琴,2008),具有重大的遗传改良潜力。银灰杨具有良好的遗传变异基础和丰富的遗传多样性(Smith,1943; 郑书星等,2013),杂交可配性好,是白杨派树种杂交育种的优良亲本材料。李天权等(1989)开展了银灰杨与毛新杨(Populus tomentosa × P. bolleana)的正反交杂交育种,并且获得6个毛新杨×银灰杨双杂种无性系。段安安等(1998)进一步从叶片解剖结构、枝条电导率等方面对这6个无性系进行了抗旱性评价,但有关银灰杨的三倍体育种至今还未见报道。本研究以银灰杨为材料,在研究银灰杨花粉母细胞减数分裂与花芽外部形态以及花药颜色变化规律的基础上,对高温诱导花粉染色体加倍技术条件、杂交选育多倍体等进行了研究,为加快银灰杨遗传改良步伐,创制抗逆性强的林木新种质,选育银灰杨林木新品种奠定了基础。
1 材料与方法 1.1 试验材料银灰杨雄花枝和银白杨(Populus alba)雌花枝采自新疆阿勒泰市的优良单株,用塑料薄膜包裹,托运至北京林业大学,避风低温保存待用。
1.2 研究方法 1.2.1 花芽外部形态与花粉母细胞减数分裂进程观察将银灰杨雄花枝水培于10~20 ℃的温室,每隔2~3 h,随机摘取2~3个花芽,去除鳞片,分别从花芽基部、中部和顶部摘取2~3朵小花,运用Olympus SZX12体式显微镜观察不同花芽外部形态特征及花药颜色,利用Olympus C5060 Wide Zoom型数码相机照相并记录。然后,将花芽放置于新配制的卡诺固定液中,4 ℃冰箱固定24 h。采用醋酸洋红染色压片法进行花粉母细胞减数分裂进程观察,具体制片操作参考鲁敏(2013)方法。在Olympus BX-51光学显微镜下观察花粉母细胞减数分裂进程(Bajer, 1965),并运用Olympus DP70数码摄像系统进行照相。
1.2.2 高温诱导产生2n花粉的技术条件优化将银灰杨雄花枝分成2部分,分别水培于10~20 ℃的温室。其中一部分作为对照组,水培至花药开裂,收集花粉,4 ℃干燥保存备用。利用醋酸洋红染色压片法,实时观察另一部分雄花枝花粉母细胞的减数分裂进程。当花粉母细胞进入减数分裂后,大多数花粉母细胞处于细线期、细线期-偶线期、偶线期-粗线期、粗线期-双线期、双线期-终变期、终变期-中期Ⅰ时,分别取6~8个花枝放置在38、41 ℃的光照培养箱内,持续处理3、6 h,并对不同处理组合进行编号。高温处理结束后,从培养箱中取出花枝,继续在温室水培至花药开裂,按不同编号分别收集花粉,4 ℃干燥保存备用。试验重复3次,每次重复2~3个花枝。
从每处理组合中,随机选取少量花粉,分别制作3~5个临时涂片,在Olympus BX-51光学显微镜下,每涂片随机观察5~10个视野,统计2n花粉诱导率。统计2n花粉诱导率时,以对照组花粉粒平均直径的1.28倍作为2n花粉判别的标准(Orjeda et al., 1990),花粉粒直径大于对照组花粉粒平均直径1.28倍则可视为2n花粉。2n花粉诱导率=(2n花粉数/观察的花粉总数)×100%。试验重复3次,每次重复观察200~300个花粉粒。
1.2.3 银灰杨杂种多倍体创制将银白杨雌花枝从塑料布中取出,水培于10~20 ℃的温室。待雌花序柱头发育至最佳授粉状态时(康向阳, 2002),以对照组中收集的花粉为对照,选用2n花粉比例较高的诱导花粉,分别给银白杨雌花序柱头进行授粉杂交。授粉结束后,雌花枝继续水培至种子成熟,分别收集种子,统计各处理组合的种子数,并进行常规播种育苗。
1.2.4 杂交子代倍性测定1) 流式细胞仪检测杂交子代倍性检测参考Zhao等(2017)的方法,取0.5 g左右的杂交子代幼嫩叶片,放置于小培养皿中,加入700 μL细胞核裂解液(Galbraith et al., 1983)中,用刀片快速将其切碎,经40 μm尼龙网过滤,弃去杂质,加入5 μg ·mL-1的DAPI染液染色5 min后,使用Quanta SC流式细胞仪,以二倍体植株作为对照,分析细胞核DNA含量。2)体细胞染色体记数旺盛生长期,采集植物茎尖分生组织,放置于饱和对二氯苯溶液中,常温条件下预处理4 h。经蒸馏水冲洗后,转移至卡诺固定液中,4 ℃条件下固定24 h。随后,将固定好的材料放入浓盐酸中,温室条件下解离20 min。经蒸馏水清洗3次(每次8 min)后,利用改良卡宝品红染色、压片,在Olympus BX-51光学显微镜下观察染色体数目并照相。
1.2.5 数据分析2n花粉诱导率等百分比数据先经倒数(1/p)变换(Zubizarreata et al., 2007)后,利用SPSS统计软件进行差异显著性分析和多重比较。
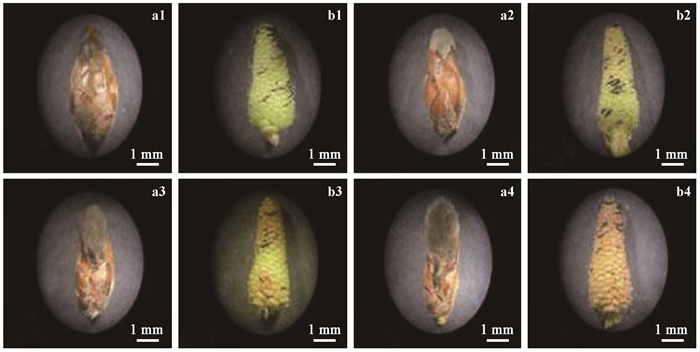
2 结果与分析 2.1 银灰杨雄花芽减数分裂进程的不同步性温室水培条件下,银灰杨花粉母细胞发育明显加速,由减数分裂细线期发育至末期Ⅱ、四分体时期大约历时5~6天(图 1;表 1)。该过程与杨属其他植物花粉母细胞发育相似,无明显差异。但银灰杨同一花芽顶部、中部以及基部花粉母细胞的减数分裂存在不同步性,同一部位不同的花粉母细胞的减数分裂进程也存在不同步性(表 1)。同一花芽不同部位花粉母细胞的减数分裂进程与花芽外部形态以及花药颜色变化存在着明显的对应关系(图 2)。雄花芽水培24 h,花芽略微膨大(图 2a1),花芽顶部和基部的花粉母细胞已进入细线期(图 1a;表 1),花药颜色为嫩绿色(图 2b1)。水培至108 h,花芽进一步膨大,芽鳞开裂,花序露出约1/4(图 2a2),花芽基部花药颜色由嫩绿色转变为黄绿色,中部花药仍为嫩绿色,顶部花药颜色转变为微红色(图 2b2),花芽顶部、中部以及基部的小孢子母细胞分别发育至后期Ⅰ(图 1g)、偶线期(图 1b)和终变期(图 1e)。水培126 h,花序露出芽鳞约1/3(图 2a3),花芽顶部、中部以及基部花药颜色分别转变为鲜红色、微红色和浅红色(图 2b3),花粉母细胞发育至后期Ⅱ(图 1k)、中期Ⅰ(图 1f)和前期Ⅱ(图 1i)。水培136 h,此时花序露出芽鳞约1/2(图 2a4),花芽顶部和基部花粉母细胞进入四分体时期,此时花药为深红色,中部小孢子母细胞进入末期Ⅱ(图 1l),花药则为鲜红色(图 2b4)。

|
图 1 银灰杨花粉母细胞第1次减数分裂前期 Figure 1 Prophase of the first meiotic division of pollen mother cells in Populus canescens a.细线期; b.偶线期; c.粗线期; d.双线期; e.终变期; f.中期Ⅰ; g.后期Ⅰ; h.末期Ⅰ; i.前期Ⅱ; j.中期Ⅱ; k.后期Ⅱ; l.末期Ⅱ。 a.Leptotene; b.Zygotene; c.Pachytene; d.Diplotene; e. Diakinesis; f.MetaphaseⅠ; g. AnaphaseⅠ; h. TelophaseⅠ; i. ProphaseⅡ; j.MetaphaseⅡ; k.AnaphaseⅡ; l.TelophaseⅡ. |
|
|
|
图 2 不同水培时间银灰杨雄花芽不同部位形态变化 Figure 2 The morphological changes of different position within the same male bud with culture time passing by in Populus canescens a1.水培24 h,雄花芽略微膨大,芽鳞微开裂;b1.水培24 h,花药呈嫩绿色;a2.水培108 h,雄花芽芽鳞开裂,花序露出约1/4;b2.水培108 h,顶部花药呈微红色,中部花药呈嫩绿色,基部花药呈黄绿色;a3.水培126 h,花序露出芽鳞约1/3;b3.水培126 h,顶部花药呈鲜红色,中部花药呈微红色,基部花药呈浅红色;a4.水培136 h,花序露出芽鳞约1/2;b4.水培136 h,顶部花药呈深红色,中部花药呈鲜红色,基部花药呈深红色。 a1. Inflated male bud and slightly dehisced bud scale when cultured for 24 h; b1.The color of anthers was peak green when cultured for 24 h; a2. One fourth of the catkin emerged from the bract scales when cultured for 108 h; b2. The color of anthers on the top of male buds was slightly red, peak green for the middle and yellow green for the bottom when cultured for 108 h; a3. One third of the catkin emerged from the bract scales when cultured for 126 h; b3. The color of anthers on the top of male buds was bright red, slightly red for the middle and light red for the bottom when cultured for 126 h; a4. One second of the catkin emerged from the bract scales when cultured for 136 h; b4. The color of anthers on the top of male buds was deep red, bright red for the middle and deep red for the bottom when cultured for 136 h. |
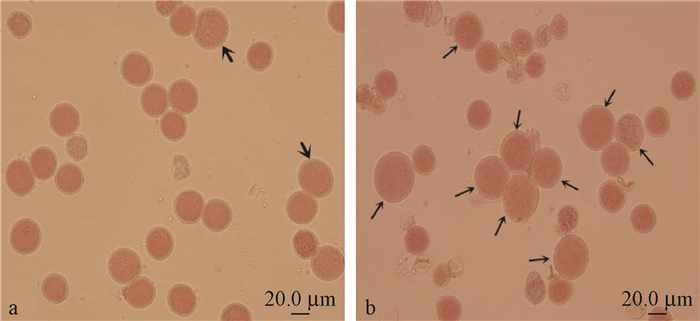
高温处理不同发育时期的银灰杨雄花序,均可诱导花粉染色体加倍,获得2n花粉(图 3)。但由于高温伤害,部分花序出现干枯或提前脱落现象,未收集到花粉。不同处理组合2n花粉诱导率统计结果见表 2。
|
图 3 银灰杨单倍性花粉、天然2n花粉与高温诱导型2n花粉 Figure 3 Haploid pollen, natural 2n pollen and induced 2n pollen by high temperature exposure in Populus canescens a.单倍性花粉与天然2n花粉(粗箭头);b.高温诱导型2n花粉(箭头)。 a. Haploid pollen and natural 2n pollen(arrow); b. Induced 2n pollen by high temperature exposure(arrow). |
|
|
从表 2可以看出,不同处理组合间获得的2n花粉诱导率存在明显差异,2n花粉平均诱导率介于9.23% ~56.33%之间,其中以38 ℃高温处理双线期至终变期的花粉母细胞、持续处理6 h的处理组合效果最好,平均2n花粉诱导率可达56.33%±2.23%;38 ℃高温处理细线期的花粉母细胞、持续处理3 h的处理组合效果最差,平均2n花粉诱导率仅为9.23%±3.27%。未经高温处理的对照组合也可观察到天然2n花粉的存在,天然2n花粉发生频率为4.89%±1.14%。进一步对不同处理组合获得的2n花粉诱导率进行差异显著性分析,结果表明始处理时期(F=56.6,P<0.001)、持续处理时间(F=21.4,P<0.001)对银灰杨2n花粉诱导率具有极显著影响,处理温度(F=1.09,P=0.300)对2n花粉诱导率的影响不显著。分别对始处理时期、持续处理时间进行多重比较,结果显示双线期至终变期的2n花粉诱导率显著高于细线期至粗线期的2n花粉诱导率;持续处理6 h的2n花粉诱导率显著高于持续处理3 h的2n花粉诱导率(表 3)。因此,当花粉母细胞发育至双线期至终变期时,利用38 ℃或41 ℃的高温、持续处理6 h是银灰杨花粉染色体加倍的优化处理组合。
|
|
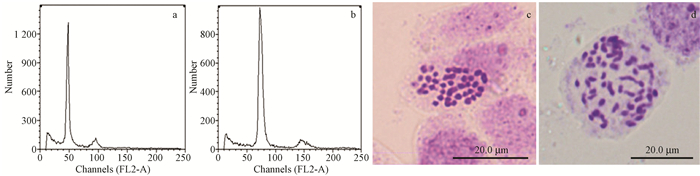
选取2n花粉得率相对较高、花粉产量大的8个处理组合,分别与银白杨雌花枝进行授粉杂交,经种子收集、播种育苗,最终收获种子4 616粒,成苗911株(表 4)。所有杂交子代经流式细胞仪检测和染色体镜检确认后,共筛选出42株三倍体杂种子代(图 4b)。二倍体杂种子代的染色体数目为2n=2x=38(图 4c),三倍体植株的染色体数目为2n=3x=57(图 4d)。未处理的对照组中未检出三倍体(图 4a),表明低频率的天然2n花粉未参与受精。
|
|
|
图 4 高温处理诱导银灰杨花粉染色体加倍子代流式细胞分析及染色体计数 Figure 4 Flow cytometric analysis of the offspring derived from pollen chromosome doubling induced by high temperature exposure and chromosome counting a.二倍体流式分析;b.三倍体流式分析;c.二倍体染色体数目;d.三倍体染色体数目。 a. Flow cytometric analysis of diploid plant; b. Flow cytometric analysis of triploid plant; c. Chromosome number of diploid plant (2n=2x=38); d. Chromosome number of triploid plant(2n=3x=57). |
从表 4的研究结果还可以看出,不同比例的2n花粉与银白杨雌株授粉后,三倍体平均得率为4.74%。但不同杂交处理组合之间,三倍体得率表现出较为明显的差异,三倍体得率介于0~10.71%之间。其中,YB×YH19杂交组合的三倍体得率最高,达10.71%;而YB×YH24杂交组合未获得三倍体。从2n花粉比率与三倍体得率间的比较来看,所有杂交组合的三倍体得率均远低于参与授粉的2n花粉比率,表明2n花粉与单倍性花粉在受精过程存在激烈竞争,且2n花粉的授粉竞争能力明显差于单倍性花粉。不同2n花粉比率与三倍体得率间的相关分析结果表明,三倍体得率与2n花粉比率间存在弱正相关(r=0.599,P=0.116),说明获得高比率的2n花粉有助于提高三倍体得率。
3 讨论杨树花芽发育时,花粉母细胞减数分裂进程的不同步性具有普遍性。在毛白杨(康向阳等,2000b)、通辽杨(Populus simonii × P. nigra ‘Tongliao’)(王君等,2006)、响叶杨(Populus adenopoda)(鲁敏等,2011)以及美洲黑杨(Populus deltoides)(辛昊阳等,2016)花粉母细胞减数分裂的研究中均发现不同步性。这种不同步性主要表现在同一花枝不同部位或同一花芽不同小花,其花粉母细胞减数分裂时期具有明显的差异。康向阳等(2000)对毛白杨雄花芽的减数分裂进行了观察,发现长枝上的花芽减数分裂进程较短枝上的花芽减数分裂快,同一花芽基部发育较快,顶部较迟缓。王君等(2006)对通辽杨花粉母细胞减数分裂的研究发现,同一小花内不同花药间花粉母细胞减数分裂具有不同步性。辛昊阳等(2016)对美洲黑杨的研究表明,同一花芽中,中部小花发育明显早于基部和顶部小花,但同一小花中不同花药间花粉母细胞减数分裂进程基本一致。本研究中,银灰杨同一个花芽不同部位的小花减数分裂进程差异显著,花芽顶端发育最快,基部次之,中部发育最慢(图 2)。这种复杂的花芽发育不同步性可以延长花期,增强两性功能的有效作用时间,对其种群繁殖后代有利,可能是物种适应当地气候环境条件的进化结果(Harder et al., 1989)。
处理温度、有效处理时期以及持续处理时间是影响2n花粉得率的重要因素。不同树种适宜的处理温度、有效处理时期以及持续处理时间各不相同(康向阳等,2000a;张磊等,2010)。因此,对于一个具体树种来说,选择适宜的处理温度、有效处理时期和持续处理时间至关重要,决定着高温诱导花粉染色体加倍的成败。康向阳等(2000a)对高温处理诱导毛新杨产生2n花粉的技术条件进行了优化研究,筛选出最佳诱导条件为花粉母细胞发育至终变期至中期Ⅰ,利用38 ℃持续处理2 h,可获得高达87.6%的2n花粉。高温诱导银白杨产生2n花粉的最佳条件为花粉母细胞发育至中期Ⅰ时,利用36 ℃高温持续处理4 h,最高可获得39.6%的2n花粉(张磊等,2010)。在本研究中,高温诱导银灰杨产生2n花粉的最佳处理组合为当花粉母细胞发育至双线期至终变期时,利用38 ℃或41 ℃的高温,持续处理6 h,可获得58.03%的2n花粉。本研究的2n花粉得率显著低于毛新杨,这可能与银灰杨花芽发育的同步性较毛新杨差有关。
在人工诱导杨树多倍体的育种实践中,秋水仙碱是一种广泛应用的化学诱变剂。现已有研究报道,利用秋水仙碱溶液处理正在减数分裂的杨树雄花芽可以获得不同比例的2n花粉(Johnsson et al., 1940; 张志毅等,1992;康向阳等,1999;李开龙等,2006;李赟等,2014)。然而,采用秋水仙碱溶液注射或浸泡处理诱导2n配子具有成本高、毒性大、工作量大以及秋水仙碱溶液渗透慢等特点,致使处理规模受到限制,难以获得2n花粉比率高、花粉产量大的处理组合。而采用高温等物理诱变处理具有操作简单、成本低、一次可以实现大批量材料快速处理的目的。本试验进一步证实了高温诱导杨树配子染色体加倍是一种高效的多倍体诱导方法,多倍体的诱导率可达10.71%。同时也证实了混合花粉授粉后,2n花粉在受精竞争中处于劣势,致使三倍体得率降低。但三倍体得率与2n花粉比率间存在不显著的正相关,说明提高2n花粉得率有助于提高三倍体得率。
4 结论温室水培条件下,银灰杨花粉母细胞完成减数分裂大约需要5~6天。其减数分裂过程与其他杨属植物相似,无明显差异。但银灰杨同一花芽不同部位花粉母细胞减数分裂进程存在明显的不同步性,花芽顶部花粉母细胞发育最快,基部次之,中部发育最慢。通过对不同减数分裂时期的花粉母细胞进行高温处理,筛选出高温诱导银灰杨花粉染色体加倍的最佳处理技术组合为当花粉母细胞发育至双线期至终变期时,利用38 ℃或41 ℃的高温,持续处理6 h,可获得56.33%的2n花粉。利用2n花粉比率相对高的混合花粉与银白杨雌配子杂交,获得杂种苗木911株,检测出三倍体42株,三倍体得率最高可达10.71%。2n花粉比率与三倍体得率的相关分析结果表明,三倍体得率与2n花粉比率间存在弱正相关(r=0.599,P=0.116),说明提高2n花粉比率有助于提高三倍体得率。本研究证明了高温诱导银灰杨花粉染色体加倍选育三倍体的可行性,并首次获得了银灰杨三倍体。
段安安, 杨敏生. 1998. 毛新×银灰双杂种无性系抗寒抗旱性的生理测定[J]. 云南林业科技, 84(3): 27-31. (Duan A A, Yang M S. 1998. Physiological determination of cold and drought resistance of (Populus tomentosa × P. bolleana) × P. canescens[J]. Yunnan Forestry Science and Technology, 84(3): 27-31. [in Chinese]) |
康向阳. 2002. 毛白杨细胞遗传与三倍体选育[M]. 北京: 中国环境科学出版社. (Kang X Y. 2002. Cytogenetics and triploid breeding of Populus tomentosa[M]. Beijing: China Environmental Science Press. [in Chinese]) |
康向阳, 朱之悌, 张志毅. 2000a. 高温诱导白杨2n花粉有效处理时期的研究[J]. 北京林业大学学报, 22(3): l-4. (Kang X Y, Zhu Z T, Zhang Z Y. 2000a. Suitable period of high temperature treatment for 2n pollen of Populus tomentosa × P. bolleana[J]. Journal of Beijing Forestry University, 22(3): l-4. [in Chinese]) |
康向阳, 朱之悌, 张志毅. 2000b. 毛白杨花粉母细胞减数分裂及其进程的研究[J]. 北京林业大学学报, 22(6): 5-8. (Kang X Y, Zhu Z T, Zhang Z Y. 2000b. Meiosis and its stages of pollen mother cells in Chinese white poplar[J]. Journal of Beijing Forestry University, 22(6): 5-8. [in Chinese]) |
康向阳, 朱之悌, 林惠斌. 1999. 杨树花粉染色体加倍有效处理时期的研究[J]. 林业科学, 35(4): 21-24. (Kang X Y, Zhu Z T, Lin H B. 1999. Study on the effective treating period for pollen chromosome doubling of Populus tomentosa × P. bolleana[J]. Scientia Silvae Sinicae, 35(4): 21-24. [in Chinese]) |
李开龙, 肖静, 刘桂丰, 等. 2006. 秋水仙碱处理诱导大青杨2n花粉方法的优化[J]. 核农学报, 20(4): 282-286. (Li K L, Xiao J, Liu G F, et al. 2006. Optimization of inducing 2n pollen grain of Populus ussuriensis Kom by colchicines[J]. Journal of Nuclear Agricultural Sciences, 20(4): 282-286. [in Chinese]) |
李天权, 朱之悌. 1989. 白杨派内杂交难易程度及杂交方式的研究[J]. 北京林业大学学报, 11(3): 54-59. (Li T Q, Zhu Z T. 1989. Study on difficulty of hybridization and patterns of crossing within Leuce[J]. Journal of Beijing Forestry University, 11(3): 54-59. [in Chinese]) |
李云, 朱之悌, 田砚亭, 等. 2000. 极端温度处理白杨雌花芽培育三倍体植株的研究[J]. 北京林业大学学报, 22(5): 7-12. (Li Y, Zhu Z T, Tian Y T, et al. 2000. Obtaining triploids by high and low temperature treating female flower buds of white poplar[J]. Journal of Beijing Forestry University, 22(5): 7-12. [in Chinese]) |
李赟, 郭倩, 王君, 等. 2014. 秋水仙碱诱导银白杨花粉染色体加倍及其细胞学效应研究[J]. 核农学报, 28(5): 1749-1756. (Li Y, Guo Q, Wang J, et al. 2014. Colchicine-induced pollen chromosome doubling and its cytological effects in Populus alba L[J]. Journal of Nuclear Agricultural Sciences, 28(5): 1749-1756. [in Chinese]) |
鲁敏. 2013. 响叶杨三倍体和四倍体诱导技术研究. 北京: 北京林业大学博士学位论文. (Lu M. 2013. Techniques of triploid and teraploid induction in Populus adenopoda Maxim. Beijing: PhD thesis of Beijing Forestry University. [in Chinese]) |
鲁敏, 王君, 王旭军, 等. 2011. 响叶杨小孢子母细胞减数分裂及染色体行为的研究[J]. 植物科学学报, 29(2): 171-177. (Lu M, Wang J, Wang X J, et al. 2011. Studies on the meiosis and chromosome behavior of microsporocytes in Populus adenopoda Maxim[J]. Plant Science Journal, 29(2): 171-177. [in Chinese]) |
毛彦科, 张平冬, 石乐, 等. 2013. 高温诱导杜仲2n花粉最佳处理条件研究[J]. 北京林业大学学报, 35(1): 53-58. (Mao Y K, Zhang P D, Shi L, et al. 2013. Optimum conditions for inducing 2n pollen chromosome doubling by high temperature in Eucommia ulmoides[J]. Journal of Beijing Forestry University, 35(1): 53-58. [in Chinese]) |
王君, 康向阳, 李代丽, 等. 2006. 通辽杨花粉母细胞减数分裂及其染色体行为研究[J]. 西北植物学报, 26(11): 2231-2238. (Wang J, Kang X Y, Li D L, et al. 2006. Meiosis and chromosome behavior of pollen mother cell in Populus simonii Carr.×P. nigra L. 'Tongliao'[J]. Acta Botanica Boreali-Occidentalia Sinica, 26(11): 2231-2238. [in Chinese]) |
辛昊阳, 刘帅, 刘光欣, 等. 2016. 美洲黑杨小孢子母细胞减数分裂进程与花芽及花药外部形态相关性研究[J]. 南京林业大学学报:自然科学版, 40(2): 48-52. (Xin H Y, Liu S, Liu G X, et al. 2016. Relationship between the meiosis processes of microsporocytes and morphology of male flower buds and anthers in Populus deltoides Marsh[J]. Journal of Nanjing Forestry University:Natural Sciences Edition, 40(2): 48-52. [in Chinese]) |
徐秀琴. 2008. 银灰杨育种[J]. 中国林业, 7A(13): 57. (Xu X Q. 2008. Breeding of Populus canescens[J]. Forestry of China, 7A(13): 57. [in Chinese]) |
张磊, 王君, 索玉静, 等. 2010. 高温诱导银白杨花粉染色体加倍研究[J]. 核农学报, 24(6): 1158-1165. (Zhang L, Wang J, Suo Y J, et al. 2010. Pollen chromosome doubling under high temperature in Populus alba L[J]. Journal of Nuclear Agricultural Sciences, 24(6): 1158-1165. [in Chinese]) |
张源源. 2013. 橡胶树座果规律及三倍体诱导研究. 北京: 北京林业大学硕士学位论文. (Zhang Y Y. 2013. Disciplines of fruit-set success and triploid induction of Hevea brasiliensis. Beijing: MS thesis of Beijing Forestry University. [in Chinese]) |
张志毅, 李凤兰. 1992. 白杨染色体加倍技术研究及三倍体育种(Ⅰ):花粉染色体加倍技术[J]. 北京林业大学学报, 14(S3): 52-58. (Zhang Z Y, Li F L. 1992. Study on chromosome doubling technique and triploid breeding of Populus tomentosa (Ⅰ):pollen chromosome doubling technique[J]. Journal of Beijing Forestry University, 14(S3): 52-58. [in Chinese]) |
郑书星, 张建国, 段爱国, 等. 2013. 新疆阿尔泰地区白杨派3个树种半同胞家系子代遗传多样性分析[J]. 林业科学研究, 26(3): 366-372. (Zheng S X, Zhang J G, Duan A G, et al. 2013. The genetic diversity of half-sib family progenies of Populus (Section Leuce) in Altai of Xinjiang[J]. Forest Research, 26(3): 366-372. [in Chinese]) |
Bajer A. 1965. Cine-micrographic studies on dicentric chromosomes[J]. Chromosoma, 15(5): 630-651. |
Galbraith D W, Harkins K R, Maddox J M, et al. 1983. Rapid flow cytometric analysis of the cell cycle in intact plant tissues[J]. Science, 220(4601): 1049-1051. DOI:10.1126/science.220.4601.1049 |
Harder L D, Thomson J D. 1989. Evolutionary options for maximizing pollen dispersal of animal pollinated plants[J]. The American Naturalist, 133(3): 323-344. DOI:10.1086/284922 |
Johnsson H, Eklundh C. 1940. Colehicine treatment as a method in breeding hardwood species[J]. Svensk Papperstidning, 43: 373-377. |
Orjeda G, Freyre R, Iwanaga M. 1990. Production of 2n pollen in diploid Ipomoea trifida, a putative wild ancestor of sweet potato[J]. Journal of Heredity, 81(6): 462-467. DOI:10.1093/oxfordjournals.jhered.a111026 |
Smith E C. 1943. A study of cytology and speciation in the genus Populus L.[J]. Journal of the Arnold Arboretum, 24(3): 275-305. |
Zhang P D, Kang X Y. 2013. Occurrence and cytological mechanism of numerically unreduced pollen in diploid Populus euphratica[J]. Silvae Genetica, 62(6): 285-291. |
Zhao C G, Tian M D, Li Y J, et al. 2017. Slow-growing pollen-tube of colchicine-induced 2n pollen responsible for low triploid production rate in Populus[J]. Euphytica, 213(4): 94. DOI:10.1007/s10681-017-1881-9 |
Zubizarreata G A, Peltola H, Pulkkinen P, et al. 2007. Difference in growth and wood property traits in cloned Norway spruce(Picea abies)[J]. Canadian Journal of Forest Research, 37(12): 2600-2611. DOI:10.1139/X07-113 |
 2018, Vol. 54
2018, Vol. 54

