文章信息
- 金克霞, 王坤, 崔贺帅, 杨淑敏, 田根林, 刘杏娥, 马建锋
- Jin Kexia, Wang Kun, Cui Heshuai, Yang Shumin, Tian Genlin, Liu Xing, Ma Jianfeng
- 拉曼光谱在木质素研究中的应用进展
- Application of Raman Spectroscopy to the Research on Lignin
- 林业科学, 2018, 54(3): 144-151.
- Scientia Silvae Sinicae, 2018, 54(3): 144-151.
- DOI: 10.11707/j.1001-7488.20180315
-
文章历史
- 收稿日期:2016-06-14
- 修回日期:2016-07-12
-
作者相关文章
拉曼光谱(Raman spectra),是一种分子散射光谱。拉曼光谱分析法是基于印度科学家C.V.拉曼(Raman)所发现的拉曼散射效应,对与入射光频率不同的散射光谱进行分析以得到分子振动、转动等方面信息,并应用于分子结构研究的一种分析方法。相对于红外光谱,拉曼光谱能提供快速、简单、可重复且无损伤的定性定量分析,无需样品准备,样品可直接通过光纤探头或者通过玻璃、石英和光纤测量,已被广泛用于分子化学结构研究和化学组成分析,可以定性和半定量地测定样品中组分含量。木质素是总量仅次于纤维素的第二大天然高分子材料,是自然界中唯一能提供可再生芳基化合物的非石化资源,木质素及其分子结构研究备受关注。本文首先对G、S、H型木质素模型物拉曼光谱特征峰及这些结构单元在生物质原料中的特征峰进行归属,并简要介绍影响木质素拉曼光谱的因素,在此基础上综述该技术在植物细胞壁木质素微区分布和生物质预处理过程中木质素溶解规律等方面的研究进展,最后对该技术在木质素研究领域的发展方向进行展望,以期为植物生理学和生物炼制研究领域,尤其是设计高效的生物质预处理工艺提供新思路和新方法,进而拓宽该技术在生物大分子研究中的应用范围。
1 木质素拉曼光谱特征峰归属 1.1 G、S、H型结构单元拉曼特征峰拉曼光谱应用于木质素结构研究最早始于对其3种基本结构单元模型物特征峰的归属。Takayama等(1997)采用傅里叶变换拉曼光谱仪选取1 064 nm激发波长获取了S型和G型木质素结构单元的拉曼光谱,结果发现二者可以通过1 594和1 599 cm-1特征峰进行区分。为了能更好地区别G、S、H型木质素结构单元,Saariaho等(2003)选用紫外光(244和257 nm)进行激发以产生共振增强的拉曼信号,结果发现G、S、H型木质素分别在1 289~1 285、1 274~1 267 cm-1,1 333~1 330、1 514~1 506 cm-1和1 217~1 214、862~817 cm-1范围内有较强的拉曼信号。Larsen等(2010)利用傅里叶变换拉曼光谱仪采用1 064 nm激发波长系统研究了G、S、H型木质素模型物的拉曼光谱,结果发现G、S、H型木质素分别在1 379、1 288、1 186、793 cm-1,1 331、1 043、799 cm-1和1 380、1 216、843 cm-1等位置有明显的拉曼特征峰。Sun等(2012)在相同测试条件下获取了一系列木质素模型物的拉曼光谱,对比不同模型物和生物质原料的拉曼特征峰,进一步将1 275~1 262、1 338~1 331、1 218~1 213 cm-1分别归属为G、S、H型木质素。类似地,在木质生物质原料中,Perera等(2012)采用色散型(532 nm)共聚焦显微拉曼光谱仪,在1 270、1 333、1 211 cm-1位置也发现了明显的拉曼特征峰。在木质素结构单元的特征峰归属研究中,由于木质素来源、激发波长、仪器校准和光谱数据后处理采用的拟合函数等差异,不同研究者对G、S、H型木质素拉曼特征峰的归属也有所不同。本文对G、S、H型木质素结构单元三者的特征峰进行了归属,结果见表 1。综合考虑信噪比、特征峰重叠和信号强度等因素,本文认为1 274~1 267、1 333~1 330、1 217~1 214 cm-1可以较为准确地表征G、S、H型木质素结构单元。
|
|
在植物细胞壁中,由于受到以共价键连接的碳水化合物影响,木质素官能团振动引起的拉曼特征峰相对其模型物拉曼特征峰的峰位发生了偏移,见表 2(Agarwal,1999;Agarwal et al., 2010;2011;Larsen et al., 2010)。
|
|
值得注意的是,比较木本和禾本科生物质拉曼光谱发现,后者在1 152~1 197 cm-1位置出现额外的特征峰(图 1)(Ma et al., 2014),这一特征峰有可能来自于禾本科植物中特有的对羟基肉桂酸类化合物的肉桂酰酯键(Calheiros et al., 2008;Chundawat et al., 2011)。
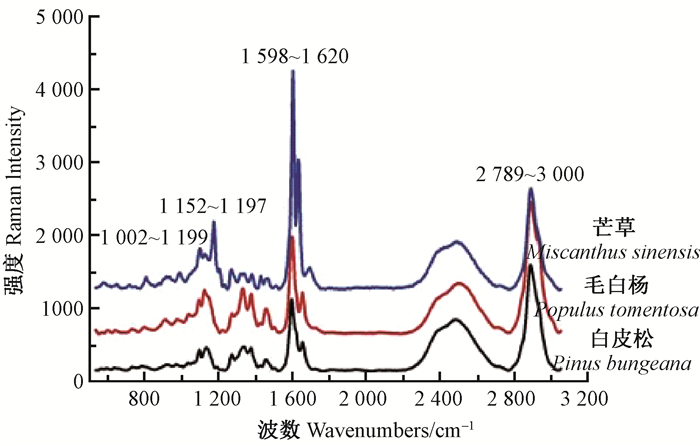
|
图 1 芒草、毛白杨和白皮松纤维细胞次生壁层平均拉曼光谱 Figure 1 Raman spectra extracted from the fiber secondary wall of Miscanthus sinensis, Populus tomentosa and Pinus bungeana |
由于木质素本身具有较高的荧光信号,若选用可见光范围内的激发光激发木质素,通常会诱导产生强烈的自发荧光背景。选用紫外光进行激发时,芳香环结构及共轭的木质素结构单元能够产生共振增强的拉曼信号,进而能够屏蔽掉与拉曼信号重叠的荧光信号。
不同的紫外激发波长所产生的拉曼强度不一致。例如,采用244 nm激发波长激发3种H型木质素模型物(4-甲基苯酚、4-甲基苯甲醚和4-羟基苯甲醛)时,3种模型物在1 217~1 214、1 179~1 167和862~817 cm-1波数范围内均出现了特征峰(Saariaho et al., 2003),而采用275 nm激发波长激发时,拉曼光谱只揭示了H型木质素很少的结构信息。当采用257 nm激发波长激发G型木质素模型物时,791~704 cm-1波数范围内的拉曼特征峰强度是244 nm激发波长激发产生拉曼信号强度的6倍。由此可知,利用拉曼光谱测定样品时激发波长选择非常重要。在紫外区域不同木质素结构单元的最适拉曼激发波长见表 3。
|
|
拉曼光谱领域存在一种特殊现象,即表面增强拉曼散射(SERS),主要是吸附在粗糙金属(一般是银和金)表面的化合物引起的电磁增强可使被测定物的拉曼散射产生极大的增强效应(105~106)。
不同银颗粒的尺寸和形态以及银浓度对木质素表面增强拉曼光谱均有影响。Agarwal等(2009)研究发现,当磨木木素在乙醇溶液存在下与银颗粒混合时,部分拉曼特征峰(1 136、1 272、1 508和1 650 cm-1)表现出明显的表面增强效应。当银颗粒尺寸为100~150 nm时,与2~3.5 μm的银颗粒比较,1 136、1 597和2 939 cm-1处特征峰强度更明显。随着银颗粒比例增加,1 491、1 267、960、641、587和525 cm-1处的拉曼特征峰强度增强,同时伴随有频移现象:1 589 cm-1处的特征峰移向1 581 cm-1,半高宽从39 cm-1变至31 cm-1,频移的出现可能是因为形成了银-木质素复合物。
1.3.3 荧光干扰利用拉曼光谱获取木质素拉曼信号的一个先决条件是木质素的自发荧光现象不会干扰其拉曼信号。但实际情况却截然不同,在可见光范围内,大部分生物质材料均具有较强的荧光背景。目前生物质样品避免荧光干扰的方法主要有:1)变换激光器激发波长;2)硼氢化钠还原处理;3)光漂白;4)共聚焦模式采集;5)曲线拟合(Atalla et al., 1986;Agarwal,2006;Gierlinger et al., 2007)。
样品类型不同,选择避免荧光干扰的方法也有所不同。在木材中,选择光漂白和532或633 nm激发波长能够有效避免荧光干扰。适当的光漂白处理能够有效降低样品的荧光背景,但是长时间光漂白会使木质素发生光降解反应,针、阔叶材最适漂白时间为0.2~0.5 s。在禾本科中,一般选择532 nm激发波长和硼氢化钠还原处理。硼氢化钠能够有效将木质素前驱体中的醛羰基还原成酮羰基,降低部分样品的荧光背景,但是在组织木质化过程研究中该方法不适用。特别是在竹材中,根据样品干燥状态所选择的方法不同:对新鲜的竹材样品选用532 nm激发波长即可获得较好的拉曼光谱;若使用干燥的竹材块体,则785 nm激发波长更为合适。而在棕榈藤材中,选用785 nm激发波长和共聚焦模式能够更为有效地避免荧光干扰。
1.3.4 pH不同pH环境对木质素样品的拉曼特征峰位置和强度影响巨大,这主要是由于木质素结构中含有大量的酚羟基,酚羟基是木质素反应活性的重要体现,易与酸发生反应。Lähdetie(2012)研究发现,当pH为6时,G、S型木质素结构单元在紫外共振拉曼光谱中特征峰位置分别在1 609、1 605 cm-1,当pH增至12时,G、S型木质素结构单元特征峰在1 582、1 579 cm-1位置分别产生位移27、26 cm-1。同时,增大pH苯酚模型物拉曼光谱强度显著增强,尤其是在1 168、1 018、992 cm-1特征峰位置。pH对拉曼光谱的位移影响程度还与酚羟基数量有关。从中性环境到碱性环境,木质素模型物产生的位移为8~35 cm-1;纸浆样品与木质素模型物相比,含有的酚羟基较少,产生的位移也较小,在2~7 cm-1范围内。因此,在分析拉曼光谱之前应将木质素样品所处的化学环境因素考虑在内。
1.3.5 光降解在光照条件下木质素不稳定,易发生光降解反应。Chu等(2010)对比芒草在532 nm激发波长下不同曝光时间的拉曼光谱,结果发现在0.5 s时,木质素特征峰1 170、1 266、1 601 cm-1光谱强度较高,随着照射时间延长,木质素特征峰均明显降低。当照射时间大于14 s时,1 170、1 266 cm-1特征峰信号几乎消失。积分1 550~1 650 cm-1区域发现,木质素拉曼强度在前10 s内急剧下降,10 s后拉曼强度下降速率变缓,在50 s后趋于稳定。进一步,Cogulet等(2016)选取1 064 nm激发波长照射木质素样品,结果发现1 652、1 602、1 456、1 270 cm-1处拉曼特征峰强度均随着照射时间延长而下降。拉曼光谱仪采集全段光谱一般只需要0.036 s,但为了得到更好的信噪比,并确保木质素样品达到稳定状态,研究者们一般选取激光照射时间为0.1 s。
2 显微拉曼光谱成像技术应用当传统拉曼光谱仪与显微镜联用时,兼具高空间和高光谱分辨率的特点,能够广泛用于植物细胞壁区域化学领域。
2.1 植物细胞壁木质素沉积运用显微拉曼光谱成像技术研究发现,木材、竹材和禾本科原料细胞壁中木质素的微区分布规律类似(Ji et al., 2014;Ma et al., 2014;Zhou et al., 2014)。总体而言,植物细胞壁中木质素在细胞角隅(CC)浓度最高,其次是胞间层(CML),次生壁(S2)层浓度最低(图 2)。
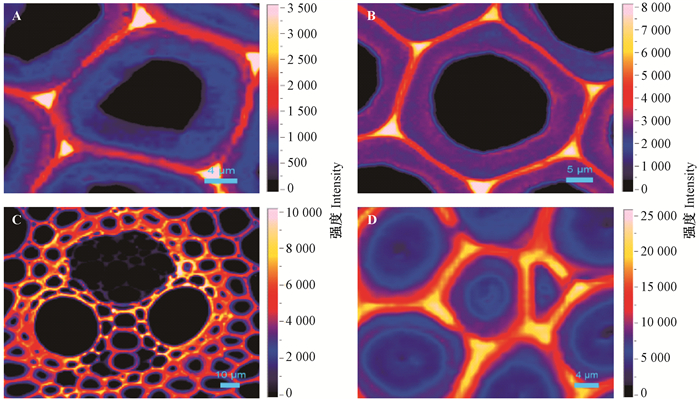
|
图 2 毛白杨(A)、白皮松(B)、芒草(C)和毛竹(D)木质素分布拉曼光谱成像 Figure 2 Raman images showing the lignin distribution in Populus tomentosa (A), Pinus bungeana (B), Miscanthus sinensis (C) and Phyllostachys edulis (D) |
Agarwal(2006)通过拉曼光谱成像方法对黑云杉(Picea mariana)木质素特征峰(1 519~1 712 cm-1)区域进行积分,结果发现木质素在不同形态区域中的分布存在明显不均一性,该结果与Gierlinger(2014)对杨木(Populus spp.)木质素特征峰(1 550~1 640 cm-1)进行积分成像后得到的分布规律类似,都是在CML浓度较高,S2层浓度较低。Hänninen等(2011)采用该方法研究控制木质素形成的前期物质——松柏醇和松柏醛(1 649~1 677 cm-1)的分布规律,结果发现不同树种间不同细胞差异较大。在云杉(Picea asperata)中,松柏醇和松柏醛在S2层浓度比在CML和初生壁层高,CML和初生壁层浓度差异不大,而在樟子松(Pinus sylvestris var.mongolica)中,松柏醇和松柏醛在CML的浓度明显高于S2层。
与传统的木质素分布规律不同的是,阔叶木受拉木S2层中含有大量未木质化的胶质层(G层)。Gierlinger等(2006)在应拉木杨树中,通过对1 600 cm-1区域积分成像发现,CC和CML木质化程度较高,而S2层木质化程度较低。与S2层相邻的G层拉曼信号很弱,改变积分范围发现G层内层含有芳香族化合物。Lehringer等(2008)对枫树(Acer spp.)与复栎(Quercus robur)受拉木细胞壁的区域化学进行研究,积分1 536~1 699 cm-1区域发现,复栎与枫树CC和CML处高度木质化,而G层中木质素的拉曼信号近乎为零;通过扫描成像后发现,复栎G层内层出现了低浓度的芳香族化合物。
在禾本科中,Richter等(2011)运用相同方法研究了新西兰麻(Phormium tenax)中不同细胞木质素(1 600 cm-1)的分布,结果发现其韧皮部和木质部木质化程度高,特别是在CC和维管束周围的厚壁纤维细胞;厚壁组织和厚角组织的细胞壁木质化程度一般,薄壁组织木质化程度最低。Ma等(2014)运用拉曼成像方法研究芒草中木质素(1 603 cm-1)与羟基肉桂酸(1 173 cm-1)的关系,结果发现这2种物质主要集中分布在导管、纤维细胞的CML和S2层中, 并且二者浓度存在伴生关系,即木质素含量越多,羟基肉桂酸含量也越多。
与传统研究方法相比,显微拉曼光谱成像技术在无损状态下获得的细胞和亚细胞水平的木质素微区分布信息更加准确,并且能够同时获取木质素及其相连接的结构单元(G、S、H前驱体松柏醛,芥子醛,松柏醇,芥子醇,对羟基肉桂酸类等)的分子结构信息,有助于进一步了解植物细胞壁的生物合成。
2.2 木质纤维生物质细胞壁木质素溶解木质纤维生物质常用的预处理方法有酸、碱和离子液体。在生物炼制过程中,组分的溶出能够在很大程度上提高生物质转化效率,而监控预处理过程中生物质形态和组分变化是控制预处理程度的关键因素。显微拉曼光谱技术能够在无损条件下同时获得生物质形貌和组分变化信息,因此在生物质预处理过程中得到广泛应用。
在中等酸性条件下,Ji等(2015)采用拉曼光谱成像技术发现芒草薄壁细胞木质素拉曼信号大大减弱。增加酸浓度,发现木质部导管、纤维细胞木质素拉曼信号反而增强,通过拉曼光谱发现1 599、1 627和1 654 cm-1处特征峰强度增加,这可能是由于酸预处理后移除了与木质素相连接的碳水化合物,使更多的木质素暴露在外。增加酸预处理时间,何川等(2015)发现1 599、1 654 cm-1处特征峰强度均不同程度下降,且在不同区域强度下降不一致:S2层下降程度最大,CML次之,CC最小。
Ji等(2014)采用浓度2.0%的NaOH预处理杨树,结果发现随着预处理时间增加,木质素在1 595、1 653 cm-1处强度均不同程度减弱。当预处理时间增至90 min时,无论在S2层还是CC区域,在1 653 cm-1处特征峰均消失。Li等(2015)采用不同NaOH浓度(0.4%、1.0%、2.0%、3.0%和5.0%)分离木质素,用拉曼显微镜发现经碱预处理后木质素拉曼强度(1 547~1 707 cm-1)在CML和S2层均明显下降,并随着碱浓度增加,拉曼信号越来越弱;进一步比较拉曼光谱发现,1 599、1 654 cm-1处特征峰强度均随着碱浓度增加而减少;当碱浓度增至5.0%时,S2层1 599 cm-1处拉曼特征峰强度只有未处理时强度的1/4,1 654 cm-1处特征峰几乎消失。
Sun等(2013)利用拉曼光谱成像技术发现经离子液体([C2mim][OAc])处理玉米(Zea mays)杆茎后,CML和CC区域拉曼强度几乎没有变化,但随着时间延长,S2层木质素(1 560~1 660 cm-1)的拉曼信号强度逐渐减弱,表明润胀主要发生在S2层,并且厚壁细胞和管胞的变形程度要比薄壁细胞明显。Zhang等(2014)在相同条件下处理杨树也发现类似规律,同时揭示出细胞壁组分溶解是伴随润胀发生的。Kanbayashi等(2015)选择与纤维素反应活性更强的离子液体([C2mim][C1])处理柳杉(Cryptomeria fortunei),结果表明该离子液体对细胞壁中多糖类物质的作用不存在区域选择性,而木质素的规律与此相反;进一步通过拉曼光谱发现,S2层拉曼浓度减少主要是因为在1 620、1 657和1 138 cm-1处归属于松柏醛、芥子醛和松柏醇、芥子醇的拉曼特征峰减少,而1 600 cm-1特征峰强度几乎不变。
在生物质预处理过程中,不同预处理方式对生物质组分的溶出具有选择性,光谱的变化也具有差异(表 4)。总体而言,化学试剂与木质素反应从细胞腔由里向外难度增大,S2层的木质素更容易与化学试剂反应,CML和CC区域木质素较为稳定。相对于传统光学显微镜、电子显微镜以及其他类型的显微光谱技术,显微拉曼光谱监测生物质预处理过程具有明显优势,能够在细胞甚至亚细胞水平提供生物质预处理过程中样品形态和组分变化规律。整合显微研究信息与传统湿部化学获得的信息,能够进一步构建完整的生物质预处理路线。
|
|
拉曼光谱已广泛应用于细胞壁内木质素的分子结构鉴定、微区分布、空间取向以及生物质预处理过程中木质素溶解规律等领域,借助拉曼光谱可以有效区分不同类型的木质素结构单元。在木质素拉曼光谱研究中,众多研究学者均将芳香环伸缩振动引起的在1 600 cm-1左右处的特征峰归属为木质素,然而其他芳香族化合物亦会对这一特征峰产生贡献。为了更加准确地反映木质素在细胞壁中的相对浓度,应采用差谱法扣除其他芳香族化合物的贡献。此外,样品自发的荧光背景仍然是限制拉曼光谱在植物细胞壁研究中广泛应用的一个瓶颈,而具有时间分辨能力高灵敏度检测器的开发有望从根本上解决这一困境。目前木质素拉曼光谱研究主要是基于定性分析,定量研究的相关报道还较少。在今后的研究中,研究人员应充分利用化学计量学方法,如偏最小二乘法、顶点成分分析等方法定量或半定量地获取拉曼光谱背后隐藏的信息。在木质素空间分布研究中,拉曼光谱的空间分辨率是主要限制因素。拉曼光谱仪与原子力学显微镜等有更高分辨率的仪器联用后,能够突破衍射极限,将空间分辨率提高至纳米水平,这为在纳米尺度研究生物质细胞壁,尤其是细胞壁CML、S2层及宽窄层交替的竹材细胞壁的化学信息提供了可能。
何川, 周霞, 姚春丽, 等. 2015. 拉曼光谱对稀酸预处理奇岗细胞壁区域化学的研究[J]. 光谱学与光谱分析, 35(9): 2555-2557. (He C, Zhou X, Yao C L, et al. 2015. Raman spectroscopy study on topochemistry in Miscanthus×giganteus cell wall during in dilute acid pretreatment[J]. Spectroscopy and Spectral Analysis, 35(9): 2555-2557. [in Chinese]) |
Agarwal U P. 1999. An overview of Raman spectroscopy as applied to lignocellulosic materials//Argyropoulos D S. Advances in lignocellulosics characterization. TAPPI Press, Atlanta, 201-225.
|
Agarwal U P. 2006. Raman imaging to investigate ultrastructure and composition of plant cell walls:distribution of lignin and cellulose in black spruce wood (Picea mariana)[J]. Planta, 224(5): 1141-1153. DOI:10.1007/s00425-006-0295-z |
Agarwal U P, Reiner R S. 2009. Near-IR surface-enhanced Raman spectrum of lignin[J]. Journal of Raman Spectroscpy, 40(40): 1527-1534. |
Agarwal U P, Atalla R H. 2010. Vibrational spectroscopy//Heitner C, Dimmel D R, Schmidt J A. Lignin and lignans: advances in chemistry. Boca Raton: CRC Press, 103-136.
|
Agarwal U P, Mcsweeny J D, Ralph S A. 2011. FT-Raman investigation of milled-wood lignins:softwood, hardwood, and chemically modified black spruce lignins[J]. Journal of Wood Chemistry and Technology, 31(4): 324-344. DOI:10.1080/02773813.2011.562338 |
Atalla R H, Agarwal U P. 1986. Recording Raman spectra from plant cell walls[J]. Journal of Raman Spectroscopy, 17(2): 229-231. DOI:10.1002/jrs.v17:2 |
Chu L Q, Masyuko R, Sweedler J V, et al. 2010. Base-induced delignification of miscanthus X giganteus studied by three-dimensional confocal raman imaging[J]. Bioresource Technology, 101(13): 4919-4925. DOI:10.1016/j.biortech.2009.10.096 |
Chundawat S P S, Donohoe B S, Elder T, et al. 2011. Multi-scale visualization and characterization of lignocellulosic plant cell wall deconstruction during thermochemical pretreatment[J]. Energy and Environmental Science, 4(3): 973-984. DOI:10.1039/c0ee00574f |
Cogulet A, Blanchet P, Landry V. 2016. Wocder UV irradiation:a lignin characterization[J]. Journal of Photochemistry and Photobiology, B:Biology, 158: 184-191. DOI:10.1016/j.jphotobiol.2016.02.030 |
Calheiros R, Machado N F L, Fiuza S M, et al. 2008. Antioxidant phenolic esters with potential anticancer activity:a Raman spectroscopy study[J]. Journal of Raman Spectroscpy, 39(1): 95-107. DOI:10.1002/jrs.v39:1 |
Gierlinger N, Schwanninger M. 2006. Chemical imaging of poplar wood cell walls by confocal Raman microscopy[J]. Plant Physiology, 140(4): 1246-1254. DOI:10.1104/pp.105.066993 |
Gierlinger N, Schwanninger M. 2007. The potential of Raman microscopy and Raman imaging in plant research[J]. Spectroscopy, 21(2): 69-89. DOI:10.1155/2007/498206 |
Gierlinger N. 2014. Revealing changes in molecular composition of plant cell walls on the micron-level by Raman mapping and vertex component analysis (VCA). Frontiers in Plant Science, doi: 10.3389/fpls.2014.00306.
|
Hänninen T, Kontturi E, Vuorinen T. 2011. Distribution of lignin and its coniferyl alcohol and coniferyl aldehyde groups in Picea abies and Pinus sylvestris as observed by Raman imaging[J]. Phytochemistry, 72(14/15): 1889-1895. |
Ji Z, Ma J F, Xu F. 2014. Multi-scale visualization of dynamic changes in poplar cell walls during alkali pretreatment[J]. Microscopy and Microanalysis, 20(2): 1-11. |
Ji Z, Zhang X, Ling Z, et al. 2015. Visualization of Miscanthus×giganteus cell wall deconstruction subjected to dilute acid pretreatment for enhanced enzymatic digestibility[J]. Biotechnology for Biofuels, 8(1): 1-14. DOI:10.1186/s13068-014-0179-6 |
Kanbayashi T, Miyafuji H. 2015. Raman microscopic analysis of wood after treatment with the ionic liquid, 1-ethyl-3-methylimidazolium chloride[J]. Holzforschung, 69(3): 273-279. |
Lähdetie A. 2012. Effect of pH on lignin analysis by Raman spectroscopy[J]. Holzforschung, 66(4): 451-457. |
Larsen K L, Barsberg S. 2010. Theoretical and Raman spectroscopic studies of phenolic lignin model monomers[J]. Journal of Physical Chemistry B, 114(23): 8009-8021. DOI:10.1021/jp1028239 |
Lehringer C, Gierlinger N, Koch G. 2008. Topochemical investigation on tension wood fibres of Acer spp., Fagus sylvatica L. and Quercus robur L[J]. Holzforschung, 62(3): 255-263. |
Li H Y, Sun S L, Wang C Z, et al. 2015. Structural and dynamic changes of lignin in Eucalyptus cell walls during successive alkaline ethanol treatments[J]. Industrial Crops and Products, 74: 200-208. DOI:10.1016/j.indcrop.2015.04.048 |
Ma J F, Zhou X, Ma J, et al. 2014. Raman microspectroscopy imaging study on topochemical correlation between lignin and hydroxycinnamic acids in Miscanthus sinensis[J]. Microscopy and Microanalysis, 20(3): 956-963. DOI:10.1017/S1431927614000658 |
Perera P N, Schmidt M, Chiang V L, et al. 2012. Raman-spectroscopy-based noninvasive microanalysis of native lignin structure[J]. Analytical and Bioanalytical Chemistry, 402(2): 983-987. DOI:10.1007/s00216-011-5518-x |
Richter S, Gierlinger N. 2011. Functional plant cell wall design revealed by the Raman imaging approach[J]. Planta, 233(4): 763-772. DOI:10.1007/s00425-010-1338-z |
Saariaho A M, Jääskeläinen A S, Nuopponen M, et al. 2003. Ultra violet resonance Raman spectroscopy in lignin analysis:determination of characteristic vibrations of p-hydroxyphenyl, guaiacyl, and syringyl lignin structures[J]. Applied Spectroscopy, 57(1): 58-66. DOI:10.1366/000370203321165214 |
Sun L, Varanasi P, Yang F, et al. 2012. Rapid determination of syringyl:guaiacyl ratios using FT-Raman spectroscopy[J]. Biotechnology and Bioengineering, 109(3): 647-656. DOI:10.1002/bit.v109.3 |
Sun L, Li C L, Xue Z J, et al. 2013. Unveiling high-resolution, tissue specific dynamic changes in corn stover during ionic liquid pretreatment[J]. RSC Advances, 3(6): 2017-2027. DOI:10.1039/C2RA20706K |
Takayama M, Johjima T, Wariishi H. 1997. Fourier transform Raman assignment of guaiacyl and syringyl marker bands for lignin determination[J]. Spectrochimica Acta, 53(10): 1621-1628. DOI:10.1016/S1386-1425(97)00100-5 |
Zhang X, Ma J, Ji Z, et al. 2014. Using confocal Raman microscopy to real-time monitor poplar cell wall swelling and dissolution during ionic liquid pretreatment[J]. Microscopy Research and Technique, 77(8): 609-618. DOI:10.1002/jemt.v77.8 |
Zhou X, Ma J, Ji Z, et al. 2014. Dilute acid pretreatment differentially affects the compositional and architectural features of Pinus bungeana Zucc[J]. compression and opposite wood tracheid walls. Industrial Crops and Products, 62: 196-203. DOI:10.1016/j.indcrop.2014.08.035 |
 2018, Vol. 54
2018, Vol. 54

