文章信息
- 王哲, 王喜明
- Wang Zhe, Wang Ximing
- 活立木生理干燥过程中水分传输和散失机制探讨
- Discussion on Mechanism of Water Transmission and Loss for Standing Trees Physiological Drying
- 林业科学, 2018, 54(3): 123-133.
- Scientia Silvae Sinicae, 2018, 54(3): 123-133.
- DOI: 10.11707/j.1001-7488.20180313
-
文章历史
- 收稿日期:2016-06-27
- 修回日期:2017-03-07
-
作者相关文章
木材作为一种天然多孔高分子聚合物,具有可再生、可循环利用、高强重比、纹理优美、颜色舒适以及良好的声学、电学和热学性能等优点,是一种重要的工程和建筑辅助材料。然而,木材也具有一些固有的缺陷,如尺寸稳定性差、易腐朽等。这些性质与木材含水率有密切关系,因此,使木材含水率控制在适宜范围内,对其加工和使用性能具有重要意义。
木材干燥方法很多,常规蒸汽干燥能耗巨大,通常占木材加工企业总耗能的70%左右(Bergman,2010;Shmulsky et al., 2011),同时还会排出烟尘、CO2、SO2和NO2等污染物(张璧光,2001)。因此,从节能及提高热效率角度出发,很多新型节能干燥技术不断涌现,如热泵除湿干燥、太阳能干燥和压缩干燥(compression drying)等(Laurila et al., 2014),这些干燥技术虽具有热效率高等优点,但同时也存在规模小、干燥时间长和不易控制等缺点,工业化应用尚不理想(Jankowsky et al., 2006;张璧光,2001)。此外,最古老的大气干燥方法,虽然能耗较低,但需要1个月到1年甚至更长时间,而且需要特定的干燥场所,干燥质量不易控制(Bergman,2010;Shmulsky et al., 2011),单一应用也较少。可见,单一干燥技术各有优缺点,很难满足对节能、快速和环保的要求,而将2种或2种以上干燥技术进行优化组合的联合干燥技术应该是今后干燥技术发展的重点,其中常将大气干燥、太阳能干燥等低耗能干燥技术作为预干燥技术,将较高含水率降低至纤维饱和点附近,然后再进行常规干燥。因此,开发新型低能耗或零能耗、快速、绿色且无缺陷干燥技术是未来的发展方向和研究热点。
本文从木材水分来源和树木水分生理特性出发,探讨基于蒸腾作用降低木材水分的新型零耗能、无缺陷干燥技术——生理干燥(physiological drying),阐述生理干燥的理论基础及植物水分传输和散失机制的研究现状,为探讨生理干燥的水分传输和散失机制提供理论基础。
1 木材生理干燥木材中的水分源自树木生长过程中摄取的水分。在树木生长过程中,每产生1 kg干物质,就需要从根部吸收500 kg水分,其中约95%的水分在蒸腾过程中从树叶散失到大气中(Canny,1998;Taiz et al., 2006),1棵生长中的树木每天可散失200~400 L水(Pallardy,2008),且该过程是被动进行的,不需要消耗新陈代谢产生的能量(Taiz et al., 2006)。因此,是否可以从树木的生理特点出发,利用蒸腾作用实现对树木的零能耗干燥呢?
基于具体试验和相关文献数据(表 1)可知,通过截断边材切断根部水分来源后,保留树冠(整树)的新疆杨(Populus alba var. pyramdalis,阔叶材),其含水率在10天左右由约65%快速降至约40%,含水率约下降了25%,而移除树冠的新疆杨,其含水率在相同时间内仅下降了4%左右;同样是阔叶材的糖桉(Eucalyptus cladocalyx),在根部截断树干切断根部水分来源后,保留树冠(整树)的桉树,其含水率在8天内下降了22.25%,而去掉树冠和枝桠的原木含水率仅下降了6.50%(Visser et al., 1986)。对于针叶材而言,在根部截断树干切断根部水分来源后,保留树冠(整树)的火炬松(Pinus taeda),其含水率在28天内由112.77%下降至75.44%,含水率下降了37.33%(Cutshall et al., 2013);相似地,辐射松(Pinus radiata)的含水率在32天内也下降了42.86%(Visser et al., 1986)。可见,切断根部水分来源后,无论是针叶材还是阔叶材,均可通过树叶蒸腾散失水分,但阔叶材的水分散失速率较快,有效散失时间为8~10天(树叶完全干枯的时间),而针叶材的水分散失速率较慢,有效散失时间为30天左右(Visser et al., 1986)。
|
|
另外,在树叶蒸腾散失水分期间,去树皮并不能加快水分的散失速率。去掉树皮的新疆杨,其含水率在10天内下降了20.22%,与不去树皮的结果(21.59%)相近(表 1);同样,去树皮和不去树皮的糖桉,其含水率在8天内分别下降了29.87%和28.21%(Visser et al., 1986),非常接近。而在相同时间内,原木是否去树皮对含水率下降有着明显影响,去掉树皮的糖桉原木在8天内其含水率下降了19.05%,不去树皮原木的含水率仅下降了6.38%(Visser et al., 1986)。可见,树干通过树叶蒸腾散失水分与原木自然干燥散失水分的机制是不同的。
综上可知,通过树叶蒸腾作用对树干进行干燥完全可行,而且其水分散失机制与原木自然干燥的水分散失机制并不完全相同。本文将树木切断根部水分来源后,利用未干枯树叶蒸腾作用散失水分实现树干干燥的技术称为生理干燥。当树叶完全干枯后,树叶不能再进行蒸腾作用,此后保留树冠树木的水分散失应通过自然干燥进行,该种方式的干燥速率比原木自然干燥速率要快(糖桉或辐射松在8天或30天之后的整树干燥速率明显高于原木干燥速率,表 1),因此,本文将树叶完全干枯后,仍保留树冠(整树)进行干燥的方法称为整树自然干燥(whole-tree natural drying),将生理干燥和整树自然干燥统称为整树干燥(whole-tree drying)。
从表 1可以看出,生理干燥可以获得40%(阔叶材)或70%(针叶材)左右的终含水率,而整树干燥在合适的环境条件和干燥时间下可以获得更低的含水率,特别是对于针叶材而言。可见,生理干燥并不能实现完全干燥,但该含水率完全可以满足运输、能源材和预干燥处理的需要,因此,在实践应用中,根据干燥目的不同,可选用不同的干燥技术或不同干燥技术相结合的方式进行干燥,以提高干燥效率或降低干燥能耗。如用于能源材的干燥,可以选用生理干燥或整树干燥;用于降低运输成本,仅选用生理干燥即可快速实现目的;而要对树木进行完全干燥,可以首先选用生理干燥或整树干燥进行短时快速预干燥处理,然后通过窑干或除湿干燥等干燥技术将原木含水率降至目标含水率,这种联合干燥技术不仅可以有效降低能耗,而且生理干燥可以有效改善木材的卷曲或蓝变等缺陷(Visser et al., 1986)。此外,通过研究生理干燥过程中的水分移动和散失机制,对深入理解植物生理过程中水分的传输和散失机制以及植物叶片对水分胁迫的应答机制具有重要理论意义。
2 木材生理干燥的理论基础 2.1 植物体内水分传输的动力与方向水分在植物体内长距离移动和传输的动力主要来自叶片蒸腾作用(transpiration)产生的拉力。蒸腾作用是水分从活的植物体表面(主要是叶子)以水蒸气状态散失到大气中的过程,即植物通过水分散失使体内水分平衡的现象。常用蒸腾速率(transpiration rate, E)或蒸腾强度来定量表征蒸腾作用的大小,即单位叶面积单位时间内通过蒸腾作用散失的水分总量,一般用g H2O·m-2h-1表示。根据水分散失位置不同,一般将蒸腾作用分为气孔蒸腾(stomatal transpiration)、角质层蒸腾(cuticular transpiration)和皮孔蒸腾(lenticular transpiration)。植物体内90% ~95%的水分通过气孔蒸腾作用散失,仅有5% ~10%的水分通过角质层蒸腾散失,但在干旱条件下,当叶孔关闭阻止气孔蒸腾作用时,角质层蒸腾作用就会变得非常显著(Hopkins et al., 2008),皮孔蒸腾在整个蒸腾作用中贡献很小。因此,植物叶片蒸腾的最主要形式还是气孔蒸腾。叶片蒸腾过程中,一般用气孔导度(stomatal conductance, gs, mmol H2O·m-2s-1)来描述气孔开度的大小,即单位时间内单位叶面积散失的水蒸气量。
水分在植物体内的移动方向可根据水势[water potential, ψw,式(1)]来判断。在植物体内,水分会自发地从水势高的区域移动到水势低的区域。一般认为,植物细胞的水势组成为:
| $ {\mathit{\psi }_{\rm{w}}}{\rm{ = }}\frac{{{\rm{\Delta }}{\mathit{\mu }_{\rm{w}}}}}{{{{\mathit{\bar V}}_{\rm{w}}}}}{\rm{ = }}{\mathit{\psi }_{\rm{s}}}{\rm{ + }}{\mathit{\psi }_{\rm{p}}}{\rm{ + }}{\mathit{\psi }_{\rm{g}}}{\rm{ + }}{\mathit{\psi }_{\rm{m}}}。$ | (1) |
式中:μw为水的化学势;Vw为水的偏摩尔体积;ψs为溶质势(solute potential)或渗透势(osmotic potential),取决于溶液中溶质分子或离子的数量;ψp为压力势(pressure potential),为溶液的静压力,正压力增加水势,反之降低水势,通常组织的膨胀压(turgor pressure)为正值,木质部或细胞壁间产生的张力(tension)或负静压力(negative hydrostatic pressure)为负值;ψg为重力势(gravitational potential),与水的密度(ρw)和距离参考水面的高度(h)有关,水高度每增加10 m,水势增加0.1 MPa,因此,在细胞水平研究水分传输时可忽略不计;ψm为衬质势(matrix potential),是液泡未形成前细胞胶体物质亲水性和毛细管对自由水的束缚而引起的水势降低,液泡形成后,ψm趋于0,计算时一般忽略不计(Pallardy,2008;Taiz et al., 2006)。
2.2 植物体内水分传输的途径植物体内水分主要由根部从土壤中吸收,然后经由茎(木质部)传输到叶子及其他器官。水分在植物体内的完整传输途径(李合生,2012)为:土壤水→根毛→根皮层→根中柱鞘→根导管→茎导管→叶柄导管→叶脉导管→叶肉细胞→叶肉细胞间隙→气孔下腔→气孔→以水蒸气的形式散失到大气中(图 1)。水分在植物体内的传输,总是从水势高的区域传向水势低的区域。植物体不同位置的水势及其组成如图 2所示。
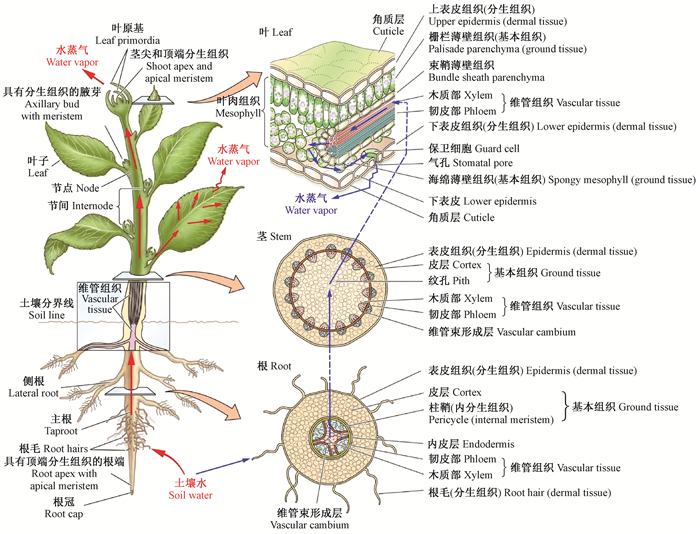
|
图 1 水分在植物体内的传输途径(Taiz et al., 2006) Figure 1 The paths of water movement in plant |

|
图 2 水分从土壤传输至大气过程中不同位置的典型水势及其组成(Taiz et al., 2006) Figure 2 Representative overview of water potential and its components at various points in the transport pathway from the soil through the plant to the atmosphere |
树木通过蒸腾作用的水分散失,主要是在叶片上蒸发为水蒸气而完成的,那么,叶内水分是在哪里蒸发为水蒸气的呢?
很多理论模型都支持Tanton等(1972)提出的假说,即大部分水分都是从距离气孔(stomatal pore)最近的细胞蒸发的(图 3)。Cowan(1977)通过试验测得77%的蒸发量来自保卫细胞(guard cell)、副卫细胞(subsidiary cell)和毗邻叶孔的表皮细胞(epidermal cell),Tyree等(1980)通过建立同时考虑热质转移的数学模型预测气孔附近细胞的蒸发量在60% ~80%之间;然而,Meidner(1976)用按比例放大的气孔下腔室(substomatal cavity)物理模型测得距气孔最近区域的蒸发量占总蒸发量的37%,Boyer(1985)认为水分蒸发自邻近维管组织(vascular tissue)的区域。内角质层(interior cuticle)的相继发现(Appleby et al., 1983;Norris et al., 1968;Wullschleger et al., 1989),尤其是表皮细胞内壁上角质层的发现(Pesacreta et al., 1999),严重挑战着水分从离气孔最近细胞蒸发的假说,因为内角质层的组成和外角质层相似,对水分散失具有阻碍作用。因此,如果这样的内角质层被普遍发现,则大量的水分蒸发可能发生于叶肉细胞。
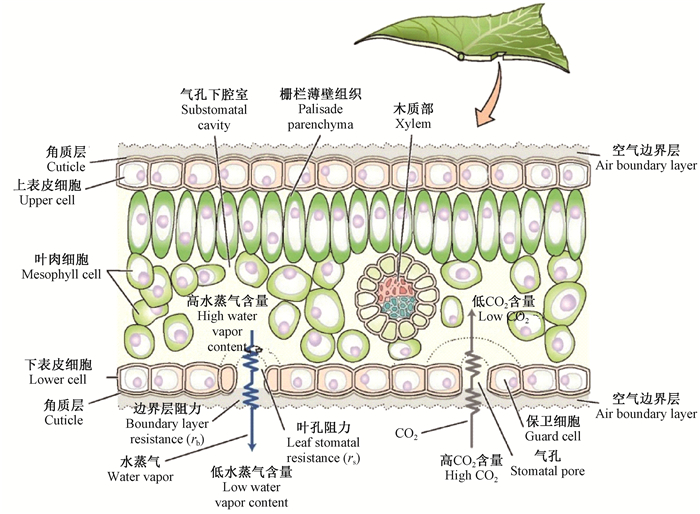
|
图 3 叶片内部结构 Figure 3 Internal structure of leaf |
可见,叶内水分的蒸发位点可能有3种情况,即暴露在内部气体空间的所有叶肉细胞和表皮细胞、气孔下腔室周围大部分区域的叶肉细胞和表皮细胞以及气孔下腔室周围其他区域的叶肉细胞和表皮细胞。
3.2 植物体内水分的传输 3.2.1 叶内水分的传输基于拓展的内聚力-张力学说(cohesion-tension theory,CT or CTT),人们一般认为水分沿细胞壁从木质部(xylem)进入叶肉细胞(mesophyll),即质外体传输途径(apoplastic pathway)(图 4)。叶肉细胞虽然浸润在水中,水分一般不通过质膜(plasma membrane)进行传输,除非需要调整压力时水分才以扩散形式通过质膜进行传递,但是试验得到的扩散系数却非常高。Canny(1986)采用荧光染料染色方法证实了水分的质外体传输途径,发现水分沿着束内鞘状细胞壁(mestome sheath cell,紧邻木质部导管的最外层小细胞)中的纳米级通道传向薄壁鞘状细胞壁(parenchyma sheath cell, 包裹维管组织和束内鞘状细胞的细胞),但是水分并没有继续传导,其假设这可能是水分在束内鞘状细胞和薄壁鞘状细胞交接处通过质膜进入了共质体(symplasm),束内鞘状细胞上大量液泡膜水孔蛋白(aquaporin)的发现支持了该观点(Frangne et al., 2001)。
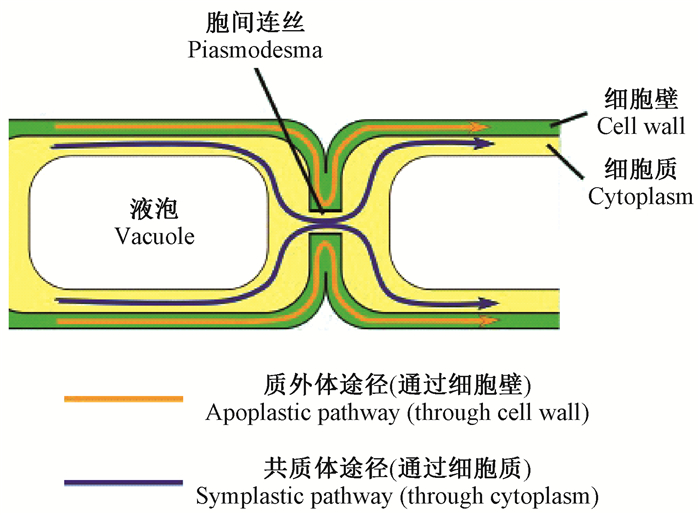
|
图 4 水分在细胞间的传输 Figure 4 Water movement between cells |
水分在磷脂双分子层(lipid bilayer)中通过水孔蛋白传输只需要较低的阿累尼厄斯活化能(Arrhenius activation energy, Ea=17~25 kJ·mol-1),与在自由水中移动相似,而无水孔蛋白时,Ea=46~63 kJ·mol-1,且具有水孔蛋白的磷脂双分子层的渗透速率很高,为10-4~10-3 m·s-1(无水孔蛋白时,一般为10-5 m·s-1)(Tyerman et al., 1999)。有的学者认为水分是以单分子形式依次(Schaffner,1998)通过水孔蛋白的,而在干旱或水分过多条件下会关闭(Tornroth-Horsefield et al., 2006)以调节水分平衡(图 5),也有可能以努森扩散(Knudsen diffusion)的形式进行传导(Reinecke et al., 2002),即在密度(浓度)梯度作用下进行传导。
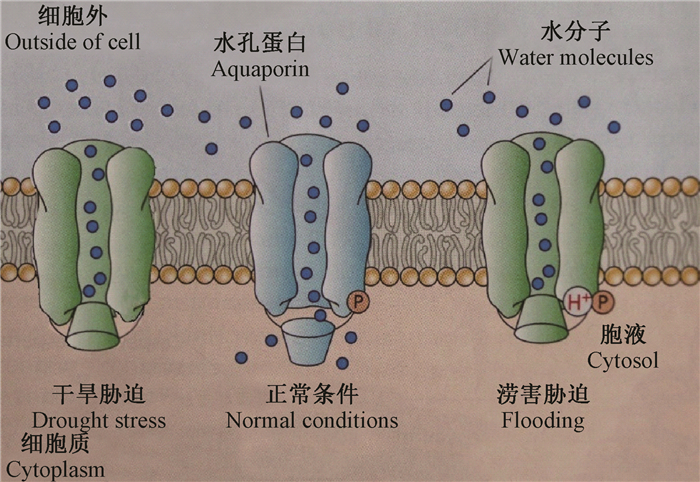
|
图 5 水分在水孔蛋白中的传导(Taiz et al., 2006) Figure 5 Water movement through aquaporin |
水分在细胞间传导的另一可能途径是通过细胞间连接原生质的胞间连丝(piasmodesma)进行传导。有学者发现在胞间连丝中有一些裂隙通道,通道直径约为4 nm,每个胞间连丝中有8~10个这样的通道(Ding et al., 1992)。然而,水分是否能够通过如此细小的通道在细胞间传输0.4 μm的距离存在争议,有学者指出与该通道直径相比,水分子直径(约0.26 nm)显得很大,对扩散和对流的传统处理方法是否适用将成为问题,如泊肃叶定律(Poiseuille’s law)处理管道中层流问题的方法,从而认为水分通过胞间连丝的共质体传输是微不足道的(Fricke,2000)。
因此,水分在叶内可能的传输途径有3种:通过胞间连丝的共质体传输途径、通过水孔蛋白的跨细胞传输途径以及通过未栓化细胞壁的质外体传输途径。关于哪种是水分在叶内的主要传输途径一直存在争论,而且这3种可能的传输途径会因树种或组织的不同而有所差异。
3.2.2 木质部内水分的长距离传输对大多数植物而言,木质部所占比例最大,组成了水分从根部向叶子传输的重要通道,尤其对于高大的树木而言,水分在木质部的传输显得尤为重要。因此,国内外学者对植物体内水分的长距离传输机制进行了大量研究,但目前仍没有一个完美的理论。
相对于水分在活细胞内的传输,木质部中的水分传输相对比较简单,但其对植物水分平衡、调节光合作用、适应环境变化以及树高极限(Ryan et al., 2006)都具有重要影响。在木质部中,传导水分的组织主要有2种,即管胞和导管。管胞和导管独特的解剖结构,使其具有传输大量水分的能力,且具有较高的效率(Taiz et al., 2006)。目前,内聚力-张力学说是被广泛接受的用于解释植物体中水分的长距离传输机制。
内聚力-张力学说是基于水特有的物理性质而建立的。水分从叶片气孔下腔室细胞壁形成的水膜上蒸发(图 6B),内聚力会使水分产生一个向细胞壁弯曲的水分/空气界面(图 6D、E),由于水分具有较高的表面张力,因此水分/空气界面会产生一个张力或负压,在此负压(蒸腾拉力)驱动下,使水分从根部沿木质部维管系统传输到叶片,就像一个精密的毛细吸液芯系统(Kim et al., 2014)。其主要的几个假设为:根部到叶子的木质部导管中的水柱是连续的;叶肉细胞细胞壁上水分/空气界面产生的负压或张力和水分子之间的内聚力使水柱得以固定;树叶蒸腾使木质部中的水分散失,进而促使根部吸收水分,即蒸腾产生的拉力或张力是沿连续水柱传递到根部的(Cochard et al., 2000)。
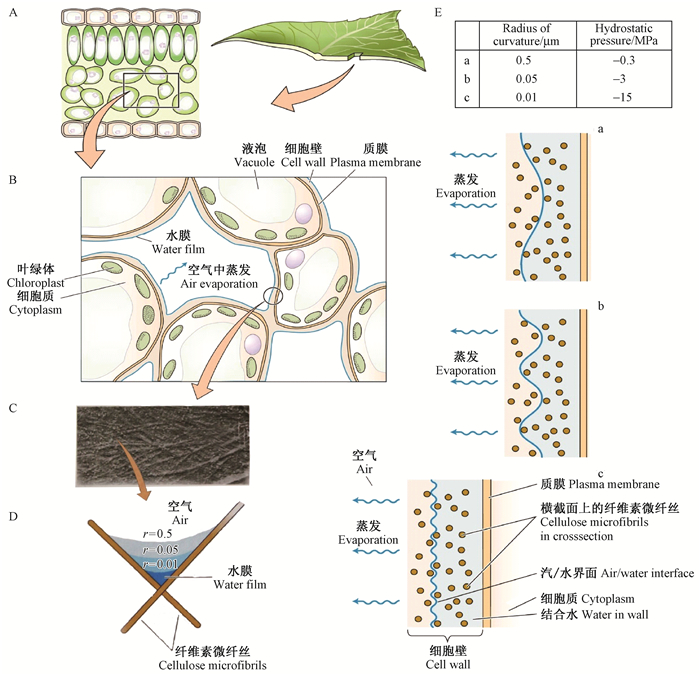
|
图 6 叶片内水分蒸发而产生的驱动力(Taiz et al., 2006b) Figure 6 Driving force from evaporation of water in leaf |
内聚力-张力学说虽然被广泛采纳,但也存在很多争论。根据该学说,木质部需要承受很大的负压(几个MPa)才能完成传输。木质部中是否存在如此巨大的负压一直备受争议,早期人们采用蒸腾计和真空泵模拟蒸腾的方法及改良的压力室技术等证明木质部中存在内聚力-张力学说预测的负压(Scholander et al., 1965),因此该学说被广泛接受;而近年来发展的木质部压力探针技术(xylem pressure probe, XPP)所测得的压力一般为-0.6~0.7 MPa,并没有测到很大的负压(Balling et al., 1990;Wei et al., 1999)。此外,关于水柱连续的假设也备受质疑,Preston(1952)的“交叉切割”试验证实木质部中的水分传输并不需要连续的水柱,周志新(2014)、周志新等(2016)研究表明,切断水分来源后,在叶子干枯之前,树干的含水率快速下降,也说明木质部中的水分传输并不需要连续的水柱。因此,Canny(1998)提出了“补偿压学说”(compensating-pressure theory),认为木质部周围活细胞内的膨压产生了对木质部的组织压(tissue pressure),将这些组织压的和称为补偿压,这样就可以使内聚力-张力学说在较低的负压下进行。然而,该学说也面临一些质疑。Zimmermann等(2004)认为木质部中并不存在很大的负压,但对补偿压学说也有一些热力学问题上的质疑,并提出了“多驱动力学说”(multi-force theory)或“水门学说”(watergate theory),即木质部中的水分在蒸腾拉力、细胞渗透压、压力流假说(münch flow)、木质部渗透压、蛋白质和黏液等物质形成的稳定的液体静压、反向蒸腾(reverse transpiration)、界面张力、电动力、菌根力和毛细管力共同作用下逐级向上传输。
3.2.3 木质部中水分的空穴化、栓塞及修复任何处于过热(superheat)或低于饱和蒸汽压状态的液体都处于亚稳定状态,最终都会通过气泡成核(空穴化,cavitation)达到平衡状态(Caupin et al., 2006)。根据内聚力-张力学说,木质部中水分在很大的负压或张力(>2 MPa,室温下水的饱和蒸汽压为2 kPa)(Zimmermann et al., 2004)作用下传输,因此水分处于亚稳定状态,尤其在水分胁迫或冻融过程中(Meinzer et al., 2001),很容易在木质部导管内形成空穴,即形成一个快速扩张的真空区域(气泡)。如果这些区域很快被水蒸气或空气填充,就会形成栓塞(embolism),破坏连续水柱的完整性,影响木质部水分的传输(Cochard et al., 2013),其中,叶柄木质部更容易受到空穴化的影响(Bucci et al., 2012)。
木质部虽然经常呈现一定的空穴化,但其并不影响水分的传输(Wagner et al., 2000),只有在空穴比较严重或发展为栓塞时才会影响水分的传输,而且在一定程度上植物是可以自行修复的,如白天造成的传导率降低可以在晚间得到恢复(Zufferey et al., 2011)。很多学者认为根压、木质部产生的正压和韧皮部产生的正压是使栓塞恢复的动力(Tyree et al., 2002),但是根压是有限的,一般为0.1 ~0.2 MPa(Fisher et al., 1997),因此,用其来解释晚间小型植物在土壤水分充足条件下的栓塞修复是可行的,但对于高大的乔木而言似乎作用并不大。近些年,核磁共振成像技术以及X-射线断层扫描技术的发展,可以使人们更加直观地研究木质部空穴或栓塞现象。研究结果表明,在没有蒸腾作用时,木质部水分也可能处于亚稳定状态(Stroock et al., 2014);木质部中的活细胞(轴向薄壁组织)在栓塞修复过程中具有关键作用(Brodersen et al., 2010),尤其是被子植物中的轴向环管薄壁组织(Sun et al., 2008);甚至可以在张力存在情况下进行修复(Brodersen et al., 2010)。
如果修复是在负压下完成的,那么可能需要解释以下2方面内容:一是引入将液体局部注入栓塞导管或管胞的能量耗散过程(energy-dissipating process)(Holbrook et al., 1999)或者降低栓塞导管或管胞中水势(如随着溶质分泌到栓塞的导管或管胞中,图 7a)的能量耗散过程,这样水分就可以被自发地引入栓塞的导管或管胞中(Zwieniecki et al., 2009)。目前,很多研究结果(Canny,1997;Nardini et al., 2011;Salleo et al., 2004;2009;Secchi et al., 2010;2011)表明,植物可能利用溶质传输来引发局部栓塞导管或管胞的修复,分泌到栓塞导管或管胞中的溶质,其水势(ψw, f)低于周围导管或管胞中仍处于亚稳定状态水的水势(ψw, X=PX -P0<0),在水势梯度下使溶质液滴长大充满栓塞的导管或管胞,该过程中假设气体的压力(Pg)达到大气压力(P0),而溶质内的压力(Pr)必须大于大气压力,即Pr<P0(图 7a、b)(Stroock et al., 2014)。二是在张力作用下,重新充满水的导管和管胞同相邻水柱的连通机制,然而,用流体力学知识来解释该机制是充满挑战的(Holbrook et al., 1999),当栓塞的导管或管胞接近充满时,填充溶质仍处于负压状态,与剩余的气体保持力学平衡(图 7b),一旦填充溶质进入某个纹孔接触到纹孔膜(图 7c上方纹孔),在外部液体更低的压力作用下,将使刚充满溶质的部分再次变空,这似乎变成一个永无休止的过程。因此,要使该过程顺利进行,似乎需要水/气弯月面几乎同时进入每个纹孔,否则第一个与外部液体连通的纹孔将使该过程重复进行(Stroock et al., 2014)。有学者认为纹孔形状的可变性和润湿性能,使其具有固定弯月面的能力,这样就可使各个弯月面几乎同时与各纹孔膜接触,进而完成与周围液体的连通过程(Holbrook et al., 1999;Konrad et al., 2003)。
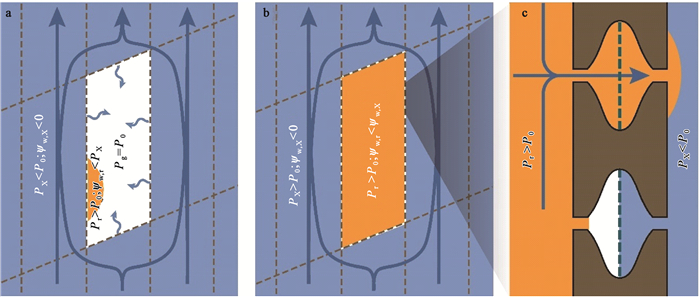
|
图 7 栓塞导管的修复过程(Stroock et al., 2014) Figure 7 Refilling embolized vessels |
空穴化和栓塞是造成木质部传导率下降的主要原因,但二者又有很大区别,空穴仅形成了一个真空区域,只含有少量气体,而栓塞则是充满气体的气泡,气体压力应当接近大气压。因此,二者在水分传输过程中可能发挥完全不同的作用,栓塞确实严重阻碍水分的传输,其形成和修复机制仍需进一步研究,以更合理地进行描述;而空穴很有可能是水分长距离运输过程的一个必备条件,与纹孔或穿孔共同作用,形成所谓的“门”,将水分自上而下、一级一级从根部传输至树冠。
4 结论与展望蒸腾作用作为植物生理过程中水分长距离传输和散失的主要动力,从理论和实践角度都可以用于活立木干燥。然而,水分在叶内的传输路径和蒸发位点等散失机制、水分在木质部的长距离运输机制,尤其是水分胁迫状态下木质部的空穴化和栓塞现象的产生、作用及其恢复机制,都存在很多争论,亟待完善。
因此,在活立木生理干燥可行性探讨的基础上,应重点从以下几个方面研究活立木生理干燥过程中水分的传输和散失机制:
1) 探讨生理干燥过程中处于水分胁迫状态下树叶叶孔蒸腾和角质层蒸腾之间的关系;
2) 探讨生理干燥过程中处于严重水分胁迫状态下树木叶内水分传输途径和蒸发位点;
3) 探讨纹孔等微观构造在木质部水分长距离传输中的作用以及在空穴和栓塞的产生与恢复过程中的作用;
4) 探讨生理干燥过程中木质部空穴和栓塞的产生和恢复机制及其对水分长距离传输的作用和影响。
李合生. 2012. 现代植物生理学[M]. 3版. 北京: 高等教育出版社: 29-61. (Li H S. 2012. Modern plant physiology[M]. 3rd edition. Beijing: Higher Education Press: 29-61. [in Chinese]) |
张璧光. 2001. 我国木材干燥技术的创新途径与发展前景[J]. 中国林业, (9): 15-17. (Zhang B G. 2001. The future development and inovation approach of wood drying technology in China[J]. Forestry of China, (9): 15-17. [in Chinese]) |
周志新. 2014. 人工林杨树活立木生理干燥特性与工艺研究. 呼和浩特: 内蒙古农业大学硕士学位论文. (Zhou Z X. 2014. Study on property and technology of physiological drying of living poplar plantation. Hohhot: MS thesis of Inner Mongolia Agricultural University. [in Chinese]) http://cdmd.cnki.com.cn/Article/CDMD-10129-1014374038.htm |
周志新, 王喜明. 2016. 基于叶蒸腾作用的立木生理干燥效果[J]. 科技导报, 34(19): 54-58. (Zhou Z X, Wang X M. 2016. Physiological drying of standing trunk based on transpiration[J]. Science & Technology Review, 34(19): 54-58. [in Chinese]) |
Appleby R F, Davies W J. 1983. A possible evaporation site in the guard cell wall and the influence of leaf structure on the humidity response by stomata of woody plants[J]. Oecologia, 56(1): 30-40. DOI:10.1007/BF00378214 |
Balling A, Zimmermann U. 1990. Comparative measurements of the xylem pressure ofnicotiana plants by means of the pressure bomb and pressure probe[J]. Planta, 182(3): 325-338. DOI:10.1007/BF02411382 |
Bergman R. 2010. Drying and control of moisture content and dimensional changes//Wood handbook-wood as an engineering material. United States Government Printing, 1-20.
|
Boyer J S. 1985. Water transport[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 36: 473-516. DOI:10.1146/annurev.pp.36.060185.002353 |
Brodersen C R, McElrone A J, Choat B, et al. 2010. The dynamics of embolism repair in xylem:in vivo visualizations using high-resolution computed tomography[J]. Plant Physiology, 154(3): 1088-1095. DOI:10.1104/pp.110.162396 |
Bucci S J, Scholz F G, Campanello P I, et al. 2012. Hydraulic differences along the water transport system of south american nothofagus species:do leaves protect the stem functionality?[J]. Tree Physiology, 32(7): 880-893. DOI:10.1093/treephys/tps054 |
Canny M J. 1986. Water pathways in wheat leaves.Ⅲ. The passage of the mestome sheath and the function of the suberised lamellae[J]. Physiologia Plantarum, 66(4): 637-647. DOI:10.1111/ppl.1986.66.issue-4 |
Canny M J. 1997. Vessel contents during transpiration-embolisms and refilling[J]. American Journal of Botany, 84(9): 1223-1230. DOI:10.2307/2446046 |
Canny M J. 1998. Transporting water in plants:evaporation from the leaves pulls water to the top of a tree, but living cells make that possible by protecting the stretched water and repairing it when it breaks[J]. American Scientist, 86(2): 152-159. DOI:10.1511/1998.2.152 |
Caupin F, Herbert E. 2006. Cavitation in water:a review[J]. Comptes Rendus Physique, 7(9/10): 1000-1017. |
Cochard H, Badel E, Herbette S, et al. 2013. Methods for measuring plant vulnerability to cavitation:a critical review[J]. Journal of Experimental Botany, 64(15): 4779-4791. DOI:10.1093/jxb/ert193 |
Cochard H, Bodet C, Ameglio T, et al. 2000. Cryo-scanning electron microscopy observations of vessel content during transpiration in walnut petioles[J]. Facts or artifacts? Plant Physiology, 124(3): 1191-1202. DOI:10.1104/pp.124.3.1191 |
Cowan I R. 1977. Stomatal behavior and environment[J]. Advances in Botanical Research, 4: 117-228. |
Cutshall J B, Greene W D, Baker S A. 2013. Transpirational drying effects on energy and ash content from whole-tree southern pine plantation chipping operations[J]. Southern Journal of Applied Forestry, 37(3): 133-139. DOI:10.5849/sjaf.11-046 |
Ding B, Turgeon R, Parthasarathy M V. 1992. Substructure of freeze-substituted plasmodesmata[J]. Protoplasma, 169(1/2): 28-41. |
Fisher J B, Angeles G, Ewers F W, et al. 1997. Survey of root pressure in tropical vines and woody species[J]. International Journal of Plant Sciences, 158(1): 44-50. DOI:10.1086/297412 |
Frangne N, Maeshima M, Schaffner A R, et al. 2001. Expression and distribution of a vacuolar aquaporin in young and mature leaf tissues of brassica napus in relation to water fluxes[J]. Planta, 212(2): 270-278. DOI:10.1007/s004250000390 |
Fricke W. 2000. Water movement between epidermal cells of barley leaves-a symplastic connection?[J]. Plant, Cell & Environment, 23(9): 991-997. |
Greene W D, Cutshall J B, Dukes C C, et al. 2014. Improving woody biomass feedstock logistics by reducing ash and moisture content[J]. Bioenergy Research, 7(3): 816-823. DOI:10.1007/s12155-013-9404-6 |
Holbrook N M, Zwieniecki M A. 1999. Embolism repair and xylem tension:do we need a miracle?[J]. Plant Physiology, 120(1): 7-10. DOI:10.1104/pp.120.1.7 |
Hopkins W G, Hüner N P. 2008. Introduction to plant physiology. 3rd edition. New York: Wiley.
|
Jankowsky I P, Luiz M G. 2006. Review of wood drying research in brazil:1984-2004[J]. Drying Technology, 24(4): 447-455. DOI:10.1080/07373930600611893 |
Kim H K, Park J, Hwang I. 2014. Investigating water transport through the xylem network in vascular plants[J]. Journal of Experimental Botany, 65(7): 1895-1904. DOI:10.1093/jxb/eru075 |
Klepac J, Mitchell D. 2014. The effect of pile size on moisture content of loblolly pine while field drying. 37th Council on Forest Engineering Annual Meeting, Moline, IL, USA, 1-9.
|
Klepac J, Rummer B, Seixas F. 2008. Seasonal effects on moisture loss of loblolly pine. Council on Forest Engineering Conference Proceedings, Charleston, SC, USA, 1-9.
|
Konrad W, Roth-Nebelsick A. 2003. The dynamics of gas bubbles in conduits of vascular plants and implications for embolism repair[J]. Journal of Theoretical Biology, 224(1): 43-61. DOI:10.1016/S0022-5193(03)00138-3 |
Laurila J, Havimo M, Lauhanen R. 2014. Compression drying of energy wood[J]. Fuel Processing Technology, 124: 286-289. DOI:10.1016/j.fuproc.2014.03.016 |
Meidner H. 1976. Water vapour loss from a physical model of a substomatal cavity[J]. Journal of Experimental Botany, 27(4): 691-694. DOI:10.1093/jxb/27.4.691 |
Meinzer F C, Clearwater M J, Goldstein G. 2001. Water transport in trees:current perspectives, new insights and some controversies[J]. Environmental and Experimental Botany, 45(3): 239-262. DOI:10.1016/S0098-8472(01)00074-0 |
Nardini A, Lo Gullo M A, Salleo S. 2011. Refilling embolized xylem conduits:is it a matter of phloem unloading?[J]. Plant Science, 180(4): 604-611. DOI:10.1016/j.plantsci.2010.12.011 |
Norris R F, Bukovac M J. 1968. Structure of the pear leaf cuticle with special reference to cuticular penetration[J]. American Journal of Botany, 55(8): 975-983. DOI:10.1002/ajb2.1968.55.issue-8 |
Pallardy S G. 2008. Physiology of woody plants[M]. 3rd edition. San Diego: Academic Press: 287-323.
|
Pesacreta T C, Hasenstein K H. 1999. The internal cuticle of Cirsium horridulum(Asteraceae)leaves[J]. American Journal of Botany, 86(7): 923-928. DOI:10.2307/2656608 |
Preston R. 1952. Movement of water in higher plants//Frey-Wyssling A. Deformation and flow in biological system. Amsterdam, the Netherlands: North Holland Publishing Co., 257-321.
|
Reinecke S A, Sleep B E. 2002. Knudsen diffusion, gas permeability, and water content in an unconsolidated porous medium[J]. Water Resources Research, 38(12): 16-1-16-15. DOI:10.1029/2002WR001278 |
Ryan M G, Phillips N, Bond B J. 2006. The hydraulic limitation hypothesis revisited[J]. Plant, Cell & Environment, 29(3): 367-381. |
Salleo S, Lo Gullo M A, Trifilo P, et al. 2004. New evidence for a role of vessel-associated cells and phloem in the rapid xylem refilling of cavitated stems of Laurus nobilis L[J]. Plant Cell and Environment, 27(8): 1065-1076. DOI:10.1111/pce.2004.27.issue-8 |
Salleo S, Trifilo P, Esposito S, et al. 2009. Starch-to-sugar conversion in wood parenchyma of field-growing Laurus nobilis plants:a component of the signal pathway for embolism repair?[J]. Functional Plant Biology, 36(9): 815-825. DOI:10.1071/FP09103 |
Schaffner A R. 1998. Aquaporin function, structure, and expression:are there more surprises to surface in water relations?[J]. Planta, 204(2): 131-139. DOI:10.1007/s004250050239 |
Scholander P F, Hammel H T, Bradstreet E D, et al. 1965. Sap pressure in vascular plants[J]. Science, 148(3668): 339-346. DOI:10.1126/science.148.3668.339 |
Secchi F, Zwieniecki M A. 2010. Patterns of PIP gene expression in Populus trichocarpa during recovery from xylem embolism suggest a major role for the PIP1 aquaporin subfamily as moderators of refilling process[J]. Plant Cell and Environment, 33(8): 1285-1297. DOI:10.1111/j.1365-3040.2010.02147.x |
Secchi F, Zwieniecki M A. 2011. Sensing embolism in xylem vessels:the role of sucrose as a trigger for refilling[J]. Plant Cell and Environment, 34(3): 514-524. DOI:10.1111/pce.2011.34.issue-3 |
Shmulsky R, Jones P D. 2011. Forest products and wood science: an introduction. Hoboken, NJ: Wiley-Blackwell, 141-174.
|
Stroock A D, Pagay V V, Zwieniecki M A, et al. 2014. The physicochemical hydrodynamics of vascular plants[J]. Annual Review of Fluid Mechanics, 46: 615-642. DOI:10.1146/annurev-fluid-010313-141411 |
Sun Q, Rost T L, Matthews M A. 2008. Wound-induced vascular occlusions in Vitis vinifera(Vitaceae):tyloses in summer and gels in winter[J]. American Journal of Botany, 95(12): 1498-1505. DOI:10.3732/ajb.0800061 |
Taiz L, Zeiger E. 2006. Plant physiology. Sunderland, MA: Sinauer Associates, 37-71.
|
Tanton T W, Crowdy S H. 1972. Water pathways in higher plants:Ⅲ.The transpiration stream within leaves[J]. Journal of Experimental Botany, 23(3): 619-625. DOI:10.1093/jxb/23.3.619 |
Tornroth-Horsefield S, Wang Y, Hedfalk K, et al. 2006. Structural mechanism of plant aquaporin gating[J]. Nature, 439(7077): 688-694. DOI:10.1038/nature04316 |
Tyerman S D, Bohnert H J, Maurel C, et al. 1999. Plant aquaporins:their molecular biology, biophysics and significance for plant water relations[J]. Journal of Experimental Botany, 50: 1055-1071. |
Tyree M T, Yianoulis P. 1980. The site of water evaporation from sub-stomatal cavities, liquid path resistances and hydroactive stomatal closure[J]. Annals of Botany, 46(2): 175-193. DOI:10.1093/oxfordjournals.aob.a085906 |
Tyree M T, Zimmermann M H. 2002. Xylem structure and the ascent of sap. 2nd editon. New York, NY: Springer Science & Business Media.
|
Visser J, Vermaas H. 1986. Biological-drying of Pinus radiata and Eucalyptus cladocalyx trees[J]. Journal of the Institute of Wood Science, 10(5): 197-201. |
Wagner H J, Schneider H, Mimietz S, et al. 2000. Xylem conduits of a resurrection plant contain a unique lipid lining and refill following a distinct pattern after desiccation[J]. New Phytologist, 148(2): 239-255. DOI:10.1046/j.1469-8137.2000.00755.x |
Wei C, Tyree M T, Steudle E. 1999. Direct measurement of xylem pressure in leaves of intact maize plants.a test of the cohesion-tension theory taking hydraulic architecture into consideration[J]. Plant Physiology, 121(4): 1191-1205. DOI:10.1104/pp.121.4.1191 |
Wullschleger S D, Oosterhuis D M. 1989. The occurrence of an internal cuticle in cotton(Gossypium hirsutum L[J]. )leaf stomates. Environmental and Experimental Botany, 29(2): 229-235. DOI:10.1016/0098-8472(89)90054-3 |
Zimmermann U, Schneider H, Wegner L H, et al. 2004. Water ascent in tall trees:does evolution of land plants rely on a highly metastable state?[J]. New Phytologist, 162(3): 575-615. DOI:10.1111/nph.2004.162.issue-3 |
Zufferey V, Cochard H, Ameglio T, et al. 2011. Diurnal cycles of embolism formation and repair in petioles of grapevine(Vitis vinifera cv.chasselas)[J]. Journal of Experimental Botany, 62(11): 3885-3894. DOI:10.1093/jxb/err081 |
Zwieniecki M A, Holbrook N M. 2009. Confronting maxwell's demon:biophysics of xylem embolism repair[J]. Trends in Plant Science, 14(10): 530-534. DOI:10.1016/j.tplants.2009.07.002 |
 2018, Vol. 54
2018, Vol. 54

