文章信息
- 黄曹兴, 何娟, 赖晨欢, NarronRobert, ChangHoumin, 勇强
- Huang Caoxing, He Juan, Lai Chenhuan, Narron Robert, Chang Houmin, Yong Qiang
- 毛竹预处理黑液木质素和酶解木质素的结构与热学性质
- Structure Characteristics and Thermal Properties of Black Liquor Lignin and Enzymatic Hydrolysis Lignin from Moso Bamboo Pretreated by Kraft Pulping
- 林业科学, 2018, 54(3): 108-116.
- Scientia Silvae Sinicae, 2018, 54(3): 108-116.
- DOI: 10.11707/j.1001-7488.20180311
-
文章历史
- 收稿日期:2016-06-20
- 修回日期:2016-08-02
-
作者相关文章
2. 美国北卡罗来纳州立大学森林材料系 罗利 27695
2. Forest Biomaterial Department, North Carolina State University Raleigh 27695
木质素是植物纤维原料中除了纤维素之外的第二大有机资源,是自然界中最丰富的天然芳香族化合物。木质素可以看作是苯丙烷结构的高分子酚类聚合物,主体结构由键能较高的碳-碳键和醚键连接而成,并具有酚羟基、醇羟基、羧基和甲氧基等多种官能团(秦特夫,1999;李忠正,2012)。改性之后的木质素应用范围较广,可用作水泥减水剂、表面活性剂和制备酚醛树脂、分散剂、活性炭等(Tejado et al., 2007;闫伟等,2011;季栋等,2013;He et al., 2015)。同时,木质素在聚合物-木质素基热塑性产品中也得到了广泛研究,主要与聚乙烯、聚环氧乙烷、聚对苯二酸酯和聚苯乙烯等混合制备热塑性材料(Mohanty et al., 2002;Alekhina et al., 2015)。据统计,我国竹材制浆企业排出的绝大部分工业木质素通过碱回收系统作为热源烧掉,仅10%左右作为化工原料被再利用,因此,高效利用竹材工业木质素成为了近年来的研究热点。
黄曹兴等(2015)研究发现,低用碱量(10% ~12%)硫酸盐蒸煮可作为毛竹(Phyllostachys edulis)纤维糖化生产可发酵性单糖的预处理方法。在蒸煮过程中,60% ~75%的木质素通过碎片化溶解在黑液中,25% ~40%的木质素残留在预处理浆料中。黑液中溶解的木质素可通过酸化、分离和洗涤等步骤得到纯度高的硫酸盐木质素;预处理竹材中高聚糖经过纤维素酶糖化后以可发酵性单糖形式溶解在水解液中,剩余部分主要为高木质素含量的酶解残渣。在生物炼制过程中,可发酵性单糖可用于生产燃料乙醇、乳酸和糖酸等化工产品,而酶解残渣的有效利用也是一个待解决问题(陈介南等,2007;Zhang et al., 2015)。由于木质素来源和制备方法不同会导致其结构和性能存在一定差异,进而影响应用效果(Mohanty et al., 2002),因此研究竹材硫酸盐木质素和酶解木质素的结构和性能是解决其在工业上应用的首要任务。本研究利用低用碱量硫酸盐法处理毛竹竹屑,通过酸化和酶解得到硫酸盐木质素和酶解木质素,并对2种木质素分子质量、键型连接、官能团含量以及热学性能(热稳定性和玻璃化转变温度)进行研究,以期为竹材工业木质素利用提供理论参考。
1 材料与方法 1.1 原料与试剂竹屑,毛竹工业加工剩余物,由福建何其昌竹业有限公司提供,化学成分(干基)为:葡聚糖40.43%、木聚糖19.18%、木质素30.43%、苯-醇抽出物5.01%。
硫酸、硫化钠、氢氧化钠、二氧六环等购于南京化学试剂有限公司,均为化学纯;苯乙烯、氘代吡啶、氘代氯仿、N-羟基-5-降冰片烯-2, 3-二酰亚胺溶液、三价乙酰丙酮化铬、2-氯-1, 3, 2-二噁磷杂戊环和DMSO-d6购于Sigma-Aldrich,均为分析纯。
纤维素酶(C2730),滤纸酶活力117 FPU·g-1,β-葡萄糖苷酶活力22.50 U·g-1;β-葡萄糖苷酶(NZ188),β-葡萄糖苷酶酶活力323 U·g-1;木聚糖酶(X2753),木聚糖酶酶活力174.5 U·g-1,购于Sigma公司。
1.2 试验方法 1.2.1 低用碱量硫酸盐法预处理1 000 g绝干竹屑装入15 L立式电加热蒸煮锅中,按固液比1:5加入含NaOH和Na2S的蒸煮液,其中硫化度为20%、碱用量为10%(指NaOH+Na2S含量,以Na2O计)。80 ℃空转20 min后,以2 ℃·min-1的速率升温至150 ℃,保温1 h。反应结束后用布袋过滤蒸煮物料,得到竹屑黑液和预处理竹屑。黑液用布氏漏斗再次过滤,除去细小的纤维颗粒。用稀硫酸调节黑液pH到2~3沉淀出木质素,用水洗涤木质素至pH5~6,所得到的硫酸盐木质素在室温下风干备用。预处理竹屑用水洗净,离心脱水后取部分样品用于成分分析,剩余部分用双圆盘磨浆机(磨盘直径300 mm,磨片间距0.04 mm,转速3 000 r·min-1)疏解成浆,重复磨浆2次,所得浆料经离心脱水、撕碎后置于密封袋中平衡水分备用。
1.2.2 酶解木质素制备预处理竹屑酶解体系为1 L,酶解条件为底物浓度5%(W/V)、纤维素酶用量20 FPU·g-1葡聚糖、β-葡萄糖苷酶用量20 IU·g-1葡聚糖、木聚糖酶用量120 IU·g-1葡聚糖、pH 4.8、150 r·min-1、50 ℃、72 h。酶解结束后将酶水解液和残渣混合物移至离心瓶中,5 000 r·min-1离心20 min,弃上清液得到酶解残渣。残渣用水清洗,室温下风干备用。取5 g酶解残渣,按固液比1:10(g:mL)加入二氧六环/水(96:4,V/V)溶剂于30 ℃搅拌提取。提取24 h后,离心分离出上清,残渣加入新鲜的二氧六环/水(96:4,V/V)溶剂搅拌24 h,提取3次。合并3次提取液,用旋转蒸发仪旋蒸出溶剂即得到粗酶解木质素。
1.2.3 木质素纯化硫酸盐木质素和粗酶解木质素纯化依据Björkman(1954)方法操作。按照每克木质素20 mL比例加入90%乙酸(V/V)溶解粗木质素,将溶解液逐滴加入到100 mL蒸馏水中,沉淀出木质素。过滤分离出沉淀的木质素,按照每克木质素10 mL比例加入二氯乙烷/乙醇(2:1,V/V)溶解木质素。离心除去不溶物后,木质素溶液逐滴加入到100 mL乙醚中,沉淀出木质素;用200 mL乙醚洗涤、过滤沉淀木质素3次,然后用200 mL石油醚洗涤、过滤1次。沉淀物自然风干后即得到纯化的硫酸盐木质素(KL)和酶解木质素(EHL)。
1.3 分析方法 1.3.1 化学组成分析竹屑原料、预处理物料及纯化的硫酸盐木质素和酶解木质素中葡聚糖、木聚糖、木质素含量分析均按美国能源部可再生能源实验室(NREL)的方法(Sluiter et al., 2005)进行测定。
1.3.2 中性糖的测定竹屑原料、预处理物料和2种木质素经NREL方法酸水解后,水解液中的葡萄糖和木糖定量分析在美国Agillent 1260型高效液相色谱仪上进行。采用Bio-Rad HPX-87H柱(7.8 mm × 300 mm),柱温55 ℃,流动相为5 mmol·L-1的硫酸,流速0.6 mL·min-1,上样量10 μL,示差折光检测器,采用外标法测定。
1.3.3 木质素分子质量测定采用凝胶渗透色谱分析仪(GPC)测定硫酸盐木质素和酶解木质素的分子质量。色谱仪:Waters高效液相色谱仪;色谱柱:Styragel HR-1、Styragel HR-2两根柱子串联;流动相:四氢呋喃,流速1 mL·min-1;柱温:35 ℃;示差检测器检测;标准样品:苯乙烯(分子质量为580~19 000 g·mol-1)。
1.3.4 木质素碳谱(13C谱)和二维碳氢相关谱(2D-HSQC)分析木质素样品的定量13C谱和2D-HSQC核磁共振谱均采用布鲁克(德国)600兆超导核磁共振仪在30 ℃进行采集,用DMSO-d6作为溶剂。定量13C谱样品制备:称取160 mg木质素样品溶解于0.5 mL DMSO-d6中,并加入20 μL 0.01 mol·L1三价乙酰丙酮化铬的DMSO-d6溶液作为驰豫剂。采样条件为:30°脉冲,驰豫时间2 s,采样点数64 000点,采样次数30 000次。2D-HSQC谱样品制备:称取20 mg木质素样品溶解在DMSO-d6中。采样条件为:1H和13C谱宽分别为3 497和18 750 Hz,采样点数分别为1 024和256点,1H弛豫时间为1.5 s,扫描次数分别为128和257次(黄曹兴等,2016)。
1.3.5 木质素定量磷谱(31P谱)分析准确称取40 mg绝干木质素于核磁管中,加入0.5 mL氘代吡啶/氘代氯仿(1.6:1,V/V)溶液溶解木质素。加入0.2 mL内标试剂N-羟基-5-降冰片烯-2, 3-二酰亚胺溶液(e-NHI,9.23 mg·mL-1)和0.05 mL驰豫试剂三价乙酰丙酮化铬溶液(5.6 mg·mL-1),充分混合后加入0.1 mL磷化试剂2-氯-1, 3, 2-二噁磷杂戊环进行磷化处理,15 min后分析(Cui et al., 2014)。
1.3.6 木质素热重分析木质素样品热重(TG)采用热重分析仪(TA-Q500,美国TA公司)进行检测。测试前木质素样品在105 ℃下干燥2 h。测试时取10 mg样品于铂金盘中,在氮气保护下由室温加热到800 ℃,氮气流速为40 mL·min-1,加热速率为10 ℃·min-1。
1.3.7 木质素玻璃化转变温度分析木质素样品的玻璃化转变温度(Tg)采用差示扫描量热仪(TA-Q2000,美国TA公司)进行检测。测试时取10 mg样品于铝盘中,在流速为50 mL·min-1氮气保护下加热2个循环。第1循环:以10 ℃·min-1加热速率升温至105 ℃保持20 min后,以10 ℃·min-1降温速率降温至40 ℃;第2循环:以10 ℃·min-1加热速率升温至195 ℃保持5 min后,以10 ℃·min-1降温速率降温至40 ℃。采用第2循环数据进行分析。
2 结果与分析 2.1 木质素成分分析及分子质量分布由表 1可知,硫酸盐木质素(KL)和酶解木质素(EHL)经过有机溶剂纯化后仍有部分中性糖残留在木质素样品中,KL和EHL碳水化合物含量分别为1.88%和4.05%。残留的碳水化合物可能以苯苷键、苯醚键和酯键等形式与木质素相连,称为木质素-碳水化合物复合物(LCCs)(Balakshin et al., 2011)。通过纯化后,KL和EHL木质素含量分别为97.21%和94.03%,高纯度木质素有利于后续的结构表征和分析。从表 1可以看出,KL的重均分子质量为5 414 g·mol-1,低于EHL的重均分子质量(7 673 g·mol-1)。2种木质素样品分子质量分布均比较宽(>2),KL和EHL的多分散性系数分别为2.95和4.66。
|
|
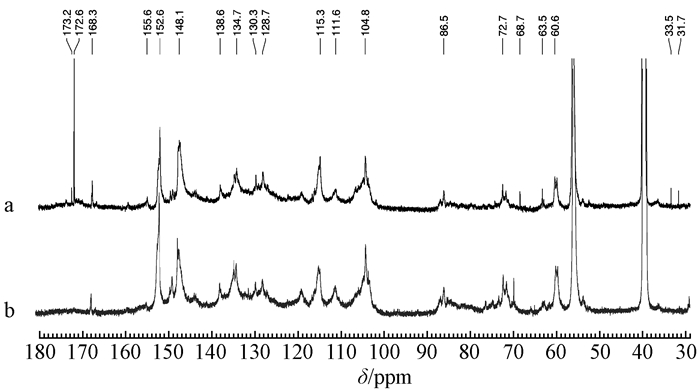
采用核磁共振13C谱研究硫酸盐木质素(KL)和酶解木质素(EHL)的结构特征。KL和EHL的定量13C谱如图 1所示,谱图中大部分信号参考现有文献(Villaverde et al., 2009;Kim et al., 2010;Wen et al., 2013a;Huang et al., 2016)进行归属。为了便于比较木质素各个信号峰的变化,处理谱图时2个谱图峰强比例保持一致。
|
图 1 KL(a)和EHL(b)定量13C谱 Figure 1 The quantitative 13C spectra of KL (a) and EHL (b) |
在KL的13C谱中,木质素的吸收峰与EHL的13C谱基本相似,但部分峰强度不同。KL在173.01 ppm处有一个强烈的羧基信号峰,而在EHL中几乎没有,说明KL中含有较多的羧基。在KL和EHL的13C谱的芳环区(160~100 ppm)出现明显的木质素3个基本单元结构信号,为紫丁香基单元(S)、愈创木基单元(G)和对羟基苯基单元(H)信号峰。S型结构单元的信号峰分别为152.3(C-3/C-5,醚化的)、147.7(C-3/C-5,非醚化的)、138.3(C-4,醚化的)、134.5(C-1,醚化的)和104.4 ppm(C-2/C-6);G型结构单元的信号峰分别为149.3(C-3,醚化的)、147.7(C-4,醚化的)、145.4(C-4,非醚化的)、134.5(C-l,醚化的)、119.5(C-6)、115.3(C-5)和111.2 ppm(C-2);H型结构单元C-2/C-6位2个弱的信号峰在128.1 ppm。位于86.1、72.2和71.4 ppm的信号属于β—O—4芳基醚键信号。在EHL的13C谱中这些信号强度均大于KL,说明KL中β—O—4芳基醚键含量低于EHL中的含量,这是由于溶出的木质素不断发生碎片化导致的。
依据Capanema等(2004)积分方法对2种木质素定量13C谱的芳环3个区域进行定量分析,即160~140(氧化的芳基碳区域,C—O键)、140~123(芳环碳碳区域,C—C键)和123~103 ppm(芳环亚甲基碳,C—H键),积分结果如表 2所示。由表 2可知,KL中的芳环C—C键含量高于EHL中的芳环C—C键含量,而芳环C—H键含量低于EHL中的芳环C—H键含量,即KL的缩合程度比EHL高。这是由于经过碎片化后的木质素之间会通过Cα—C5和Cα—C1连接键发生缩合反应,同时碎片化的木质素也会与黑液中的甲醛发生缩合反应(Robert et al., 1984)。
|
|
为了更深层次分析2种木质素的结构特点和内部基本连接键含量,采用二维核磁共振(2D-HSQC)对KL和EHL进行检测,谱图如图 2所示;结合定量13C谱和2D-HSQC谱β—O—4芳基醚键、β—β、β—5、β—1等连接键进行定量分析,结果如表 2所示。二维谱图分为侧链区域(δC/δH 50~90/2.5~6.0 ppm)和芳香环区(δC/δH 90~160/6.0~8.0 ppm), 图中大部分信号参考现有文献(Villaverde et al., 2009;Kim et al., 2010;Wen et al., 2013a;Huang et al., 2016)进行归属。
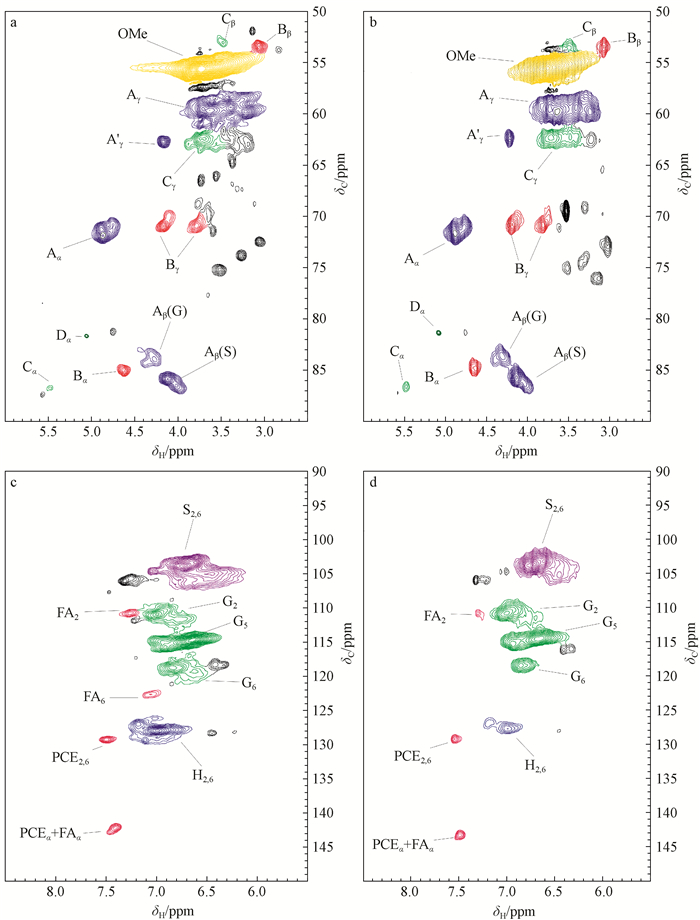
|
图 2 KL(a、c)和EHL(b、d)2D-HSQC谱 Figure 2 The 2D-HSQC spectra of KL(a, c) and EHL(b, d) A.β—O—4芳基醚键β—O—4 aryl ether bond;B. β—β连接键β—β linkage;C. β—5连接键β—5 linkage;D. β—1连接键β—1 linkage. H.对羟苯基单元p-hydroxyphenyl units;G.愈创木基结构Guaiacyl units;S.紫丁香基结构Syringyl units;PCE.对香豆酯p-coumarates ester;FA.阿魏酸Ferulic acid; X.木聚糖Xylan. |
在KL和EHL二维谱图的侧链区域(图 2a、b),显示出β—O—4醚键(A和A′)、β—β连接键(B)、β—5连接键(C)和β—1连接键(D)的吸收峰。化学位移59.6~60.8/3.37~3.72 ppm为γ位未酰化的β—O—4醚键(A)的信号;83.9/4.30 ppm为β—O—4醚键与木质素愈创木基相连的β位的信号(A);86.0/4.11 ppm为β—O—4醚键与木质紫丁香基(S)相连的β位的信号(A)。同时,在2个谱图中均发现β—O—4醚键结构γ位酯化的信号(A′,63.6/4.36 ppm),主要为对香豆酸酯化在木质素的该位置(Wen et al., 2013b)。这说明在低用碱量硫酸盐法蒸煮过程中,部分酯化的对香豆酸会随着木质素碎片化而被脱除,有一部分对香豆酸仍以酯化形式存在于浆料中。β—β连接键(B)的α、β和γ位的相关信号峰分别在84.9/4.69、53.7/3.05和71.3/4.18、3.82 ppm位置可以识别。在2个谱图中也可以清晰看到β—5(C)和β—1(D)连接键的信号,其α位的化学位移在86.8/5.49和81.2/5.09 ppm位置,β的化学位移在53.1/3.49和59.8/2.78 ppm位置。
在KL和EHL二维谱图的芳环区域(图 2c、d),可以清晰看到紫丁香基(S)、愈创木基(G)和对羟基苯基(H)3种木质素结构单元。S型结构单元2、6位的相关信号在104.1/6.74 ppm位置;G型结构单元2、5、6位的相关信号在111.0/7.01、114.4/6.73和119.0/6.82 ppm位置;H型结构单元2、6位的相关信号在127.8/7.22 ppm位置。另外,在木质素谱图中还发现106.6/7.32 ppm位置的信号,为α位为酮基的S型单元(S′)2、6位的信号。除上述基本结构单元外,在KL和EHL的2D-HSQC谱的芳环区域还检测到对香豆酸酯(PCE)和阿魏酸(FA)2种物质。对香豆酸酯的2、6和α位的相关信号分别在δC/δH 130.1/7.48和113.8/6.29 ppm位置,阿魏酸的2、6位的信号分别在δC/δH 111.1/7.34和123.1/7.19 ppm位置。该结果表明,竹屑经过低用碱量硫酸盐法预处理后,仍有一部分对香豆酸和阿魏酸存在于浆料中。
2.2.3 定量31P谱分析定量核磁共振31P谱是一种有效的木质素官能团测定方法,能测定木质素脂肪族羟基、酚羟基和羧基的绝对含量(mmol·g-1)。木质素分子中官能团含量多少是衡量其溶解性能和反应能力的指标之一,直接影响木质素的应用和化学改性(秦特夫,1999;李忠正,2012),因此,本文对低用碱量硫酸盐法预处理竹屑的硫酸盐木质素(KL)和酶解木质素(EHL)进行定量核共振31P谱分析。如图 3所示,其中152 ppm为内标信号峰,150.8~145.0 ppm为脂肪族羟基信号峰,144.3~140.3和140.3~137.2 ppm分别为缩合型和非缩合型酚羟基信号峰,135.6~134.0 ppm为羧基信号峰(Argyropoulo et al., 2002; Cui et al., 2014)。通过31P谱积分计算得到的官能团含量如表 3所示。
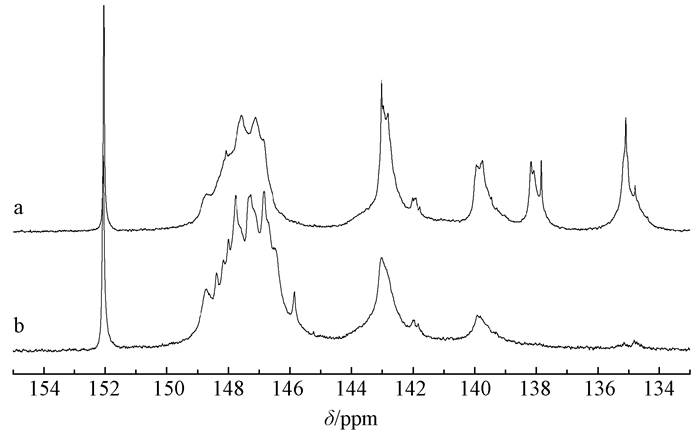
|
图 3 KL(a)和EHL(b)定量31P谱 Figure 3 The quantitative 31P spectra of KL(a) and EHL(b) |
|
|
由表 3可知,KL的脂肪族羟基含量(3.13 mmol·g-1)略低于EHL的脂肪族羟基含量(4.87 mmol·g-1),而羧基含量为EHL的4.27倍。KL中脂肪族羟基含量低可能是脂肪族羟基在碱性条件下能被氧化为羧基,而相应的羧基含量增加。这与刘玉等(2006)对三倍体毛白杨(Polulus tomentosa)硫酸盐蒸煮(KP)过程中木质素结构变化研究结果相一致,即黑液溶出木质素中脂肪族羟基的含量比KP纸浆残余木质素的含量略低,而羧基含量明显提高,为4倍左右。如表 3所示,KL中缩合型酚羟基和非缩合型酚羟基含量分别为1.76和1.33 mmol·g-1,EHL含有0.97 mmol·g-1的缩合型酚羟基和0.61 mmol·g-1的非缩合型酚羟基,KL的总酚羟基含量明显高于EHL中的总酚羟基含量。
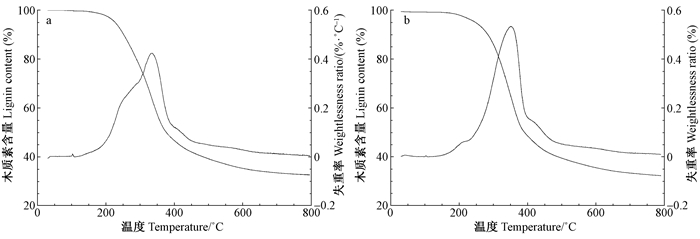
2.3 木质素热学性质热重分析仪(TGA)能检测出木质素热降解速率和热稳定性;差示扫描量热仪(DSC)能反映出木质素无定形部分从冻结状态(玻璃态)到解冻状态(高弹态)的变化过程,其中玻璃化转变温度(Tg)是高聚物应用的重要工艺指标之一(Sameni et al., 2013;Alekhina et al., 2015)。本文为了进一步了解低用碱量硫酸盐蒸煮得到的KL和EHL的热学性质,利用TGA和DSC对KL和EHL的热稳定性和玻璃化转变温度进行研究,结果如图 4、5所示。
|
图 4 KL(a)和EHL(b)DTG曲线 Figure 4 The DTG curves of KL (a) and EHL (b) |
|
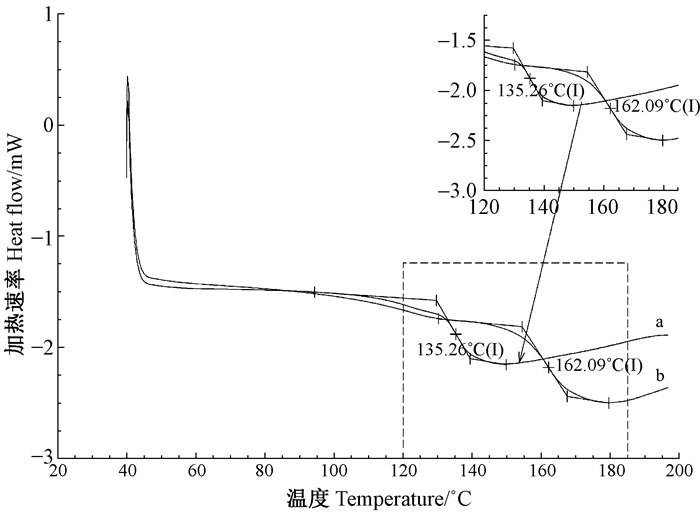
图 5 KL(a)和EHL(b)DSC曲线 Figure 5 The DSC curves of KL (a) and EHL (b) |
从KL和EHL的失重率曲线(DTG)(图 4)可知,木质素发生降解的温度主要在200~600 ℃之间。当温度从200 ℃升到339 ℃时,KL热降解率呈现快速上升趋势,达到最大值0.43 %·℃-1;当温度超过339 ℃时,KL热降解率呈现下降趋势;对于EHL而言,当温度从200 ℃升到361 ℃时,热降解率达到最大值0.54 %·℃-1,而后随着温度升高逐渐降低。因此可以看出,KL和EHL 2种木质素最大失重率温度分别为339 ℃和361 ℃。由于木质素的热稳定性可以通过木质素的最大失重率来表示,因此可推断出EHL的热稳定性高于KL。对图 5的DSC曲线分析可知,KL和EHL的Tg分别为135 ℃和162 ℃,该结果与文献(Sameni et al., 2013;Alekhina et al., 2015)所报道的木质素玻璃化转变温度相一致,即在90~180 ℃之间。
3 讨论在硫酸盐预处理过程中,蒸煮液中的亲核离子(OH-和SH-)会与木质素β—O—4芳基醚键发生亲核断裂反应使木质素碎片化,小分子质量的木质素溶解在黑液中,而大分子质量的木质素仍残留在浆料中,因此本研究中黑液木质素(KL)的重均分子质量(5 414 g·mol-1)低于酶解木质素(EHL)的重均分子质量(7 673 g·mol-1)。除了β—O—4芳基醚键外,木质素内部连接键β—β、β—5和β—1在碎片化过程中也会发生断裂,如表 2定量分析所示,EHL中这些连接键的含量均高于KL中连接键的含量。残留在浆料中酶解木质素(EHL)β—O—4芳基醚键含量为30.85/100C9,而黑液木质素(KL)β—O—4芳基醚键含量仅为11.75/100 C9。KL中β—β、β—5和β—1连接键含量仅为2.35/100 C9、0.71/100 C9和0.09/100C9,远低于EHL中这3种连接键含量。从定量31P谱分析结果可知,经过碎片化后KL中的总酚羟基含量明显高于EHL中的总酚羟基含量,这是因为在硫酸盐蒸煮过程中,木质素结构α-和β-芳基醚键的大量断裂,会导致溶出木质素的酚羟基含量升高。此外,硫酸盐预处理浆料中木质素和碳水化合物会以醚键形式连接(LCC结构),这种醚键的存在会使木质素羟基结构减少(刘玉等,2006)。同时,从预处理竹屑中得到的EHL非缩合酚羟基含量明显低于KL中的非缩合酚羟基含量。与其他木质纤维原料的黑液木质素相比,本研究EHL中的非缩合酚羟基含量也较低。据报道,大麦(Hordeum vulgare)秸秆黑液木质素(Yang et al., 2014)、南方松(Pinus spp.)黑液木质素(Cui et al., 2014)、挪威云杉(Picea abies)黑液木质素(Cui et al., 2014)和三倍体毛白杨黑液木质素(刘玉等,2006)通过定量31P谱测得的非缩合酚羟基含量分别为1.19、1.99~2.10、1.93和2.61 mmol·g-1。对于木质素的应用,孙润仓等(2014)已经实现了木质素基酚醛树脂胶黏剂的工业应用,其中,木质素非缩合酚羟基含量是影响胶黏剂合成反应位点的重要因素之一。因此,要实现竹屑酶解木质素在胶黏剂领域的应用,需利用改性技术增加木质素的反应活性。
由于木质素的热稳定性可以通过其最大失重率来表示,因此从热重分析结果可推断出EHL的热稳定性高于KL,即KL在加热过程中发生解聚所需温度低于EHL解聚所需温度。对2种木质素的DTG曲线分析可知,在木质素的热降解最初阶段(200~360 ℃),EHL的热降解率比KL大,这是由于在该阶段主要为木质素β—O—4芳基醚键的降解,EHL的β—O—4芳基醚键含量(30.85/100C9)高于KL(11.75/100C9)。当温度升高到600 ℃后,2种木质素的热降解率趋于零,此时KL和EHL的残炭率分别为37.51%和36.01%,2种木质素残碳率不同可能与木质素结构中C—C键含量和分子质量大小有关(Sameni et al., 2013)。DSC分析结果表明,KL在发生木质素玻璃化转变时,所需温度低于EHL所需温度。Alekhina等(2015)对多种木质素进行研究发现,木质素玻璃化转变温度与其分子质量大小呈正相关关系,而与非缩合酚羟基含量呈负相关关系。Hatakeyama等(2004)也指出,由于分子间距的原因,木质素结构中非缩合酚羟基含量增加会使其玻璃化转变温度向低温转移。因此可以推断出,本研究中EHL的玻璃化转变温度比KL高可能是由于EHL的分子质量(7 673 g·mol-1)大于KL的分子质量(5 414 g·mol-1)、EHL的非缩合酚羟基含量(0.66 mmol·g-1)低于KL的非综合酚羟基含量(1.33 mmol·g-1)所导致的。Ibrahim等(2011)指出,当木质素与其他高聚物混合制备热塑性材料时,高玻璃化转变温度的木质素需要更多能量来使其主链发生旋转和产生更多的自由体积,因此,当KL和EHL用于制备聚合物-木质素基热塑性材料时,EHL可能需要更多的能量才能实现木质素无定形部分从玻璃态到高弹态转变。从TGA和DSC分析结果可以推断,KL可能比EHL更有优势用来制备热塑性材料,因为其具有更低热稳定性和低玻璃化转变温度的特性。
4 结论1) 竹屑经低用碱量硫酸盐法预处理后,溶解在黑液中的木质素分子质量大小、内部连接键含量均低于残留在浆料中木质素的含量。
2) 与残留在浆料中的木质素相比,黑液木质素具有更多的酚羟基和羧基,而脂肪族羟基含量较少。
3) 黑液木质素可能比残留在浆料中的木质素更有优势用来制备热塑性材料,因为具有更低热稳定性和低玻璃化转变温度的特性。
陈介南, 王义强, 何钢, 等. 2007. 木质纤维生产燃料乙醇的生物转化技术[J]. 林业科学, 43(5): 99-105. (Chen J N, Wang Y Q, He G, et al. 2007. Bioconversion of lignocellulose to ethanol[J]. Scientia Silvae Sinicae, 43(5): 99-105. [in Chinese]) |
黄曹兴, 谢益晖, 李鑫, 等. 2015. 蒸煮助剂对低用碱量硫酸盐法预处理毛竹竹屑的影响[J]. 生物质化学工程, 49(1): 33-38. (Huang C X, Xie Y H, Li X, et al. 2015. Effect of cooking additives on moso bamboo residues pretreated by kraft pulping with low alkali dosage[J]. Biomass Chemical Engineering, 49(1): 33-38. [in Chinese]) |
黄曹兴, 何娟, 闵斗勇, 等. 2016. 稀酸预处理对毛竹竹黄木质素结构的影响[J]. 林业工程学报, 1(1): 55-60. (Huang C X, He J, Min D Y, et al. 2016. Effect of dilute acid pretreatment on the lignin structure of moso bamboo inner skin[J]. Journal of Forestry Engineering, 1(1): 55-60. [in Chinese]) |
季栋, 马宏明, 史以俊, 等. 2013. 造纸黑液磺化及其改性氨基系减水剂的研究[J]. 林业工程学报, 27(1): 78-81. (Ji D, Ma H M, Shi Y J, et al. 2013. Sulphonation of black liquor and its modification on sulphanilic acid phenol formaldehyde condensates[J]. Journal of Forestry Engineering, 27(1): 78-81. [in Chinese]) |
李忠正. 2012. 可再生生物质资源——木质素的研究[J]. 南京林业大学学报:自然科学版, 36(1): 1-7. (Li Z Z. 2012. Research on renewable biomass resource-lignin[J]. Journal of Nanjing Forestry University:Natural Science Edition, 36(1): 1-7. [in Chinese]) |
刘玉, 詹怀宇, 陈嘉川, 等. 2006. 三倍体毛白杨KP法蒸煮中木素结构的变化[J]. 中国造纸学报, 21(4): 14-18. (Liu Y, Zhan H Y, Chen J C, et al. 2006. The change of lignin structure of the triploid of Populus tomentosa during kraft pulping[J]. Transactions of China Pulp and Paper, 21(4): 14-18. [in Chinese]) |
秦特夫. 1999. 杉木和"三北"一号杨磨木木质素化学官能团特征的研究[J]. 林业科学, 35(3): 69-75. (Qin T F. 1999. The chemical structures and characteristics of the MWLs of Chinese Fir (Cunninghamia lanceolata) and poplar "Sanbei" No.1 (Populus nigra×P.simonii) wood[J]. Scientia Silvae Sinicae, 35(3): 69-75. [in Chinese]) |
孙润仓, 袁同琦, 杨昇, 等. 2014. 一种木质素基环保酚醛树脂胶黏剂的制备方法. 中国专利, 公开号: CN 201410018573. (Sun R C, Yuan T Q, Yang S, et al. 2014. Preparation method of lignin-based environmental phenolic resin adhesive. Chinese Patent, Application number: CN 201410018573. [in Chinese]) |
闫伟, 张艳, 杨建华, 等. 2011. 磷酸活化草浆黑液木质素制备活性炭的研究[J]. 林产化学与工业, 31(5): 81-84. (Yan W, Zhang Y, Yang J H, et al. 2011. Preparation of activated carbon from straw black liquor lignin impregnated by phosphoric acid[J]. Chemistry and Industry of Forest Product, 31(5): 81-84. [in Chinese]) |
Alekhina M, Erdmann J, Ebert A, et al. 2015. Physico-chemical properties of fractionated softwood kraft lignin and its potential use as a bio-based component in blends with polyethylene[J]. Journal of Materials Science, 50(19): 6395-6406. DOI:10.1007/s10853-015-9192-9 |
Argyropoulos D S, Sun Y, Palus E. 2002. Isolation of residual kraft lignin in high yield and purity[J]. Journal of Pulp and Paper Science, 28(2): 50-54. |
Balakshin M, Capanema E, Gracz H, et al. 2011. Quantification of lignin-carbohydrate linkages with high-resolution NMR spectroscopy[J]. Planta, 233(6): 1097-1110. DOI:10.1007/s00425-011-1359-2 |
Björkman A. 1954. Isolation of lignin from finely divided wood with neutral solvents[J]. Nature, 174: 1057-1058. DOI:10.1038/1741057a0 |
Capanema E A, Balakshin M Y, Kadla J F. 2004. A comprehensive approach for quantitative lignin characterization by NMR spectroscopy[J]. Journal of agricultural and food chemistry, 52(7): 1850-1860. DOI:10.1021/jf035282b |
Cui C, Sun R, Argyropoulos D S. 2014. Fractional precipitation of softwood kraft lignin:isolation of narrow fractions common to a variety of lignins[J]. ACS Sustainable Chemistry & Engineering, 2(4): 959-968. |
Hatakeyama T, Hatakeyama H. 2004. Lignin. Thermal properties of green polymers and biocomposites. Kluwer Academic Publishers, Netherlands, 171-215.
|
He W, Fatehi P. 2015. Preparation of sulfomethylated softwood kraft lignin as a dispersant for cement admixture[J]. RSC Advances, 5(58): 47031-47039. DOI:10.1039/C5RA04526F |
Huang C, He J, Du L, et al. 2016. Structural characterization of the lignins from the green and yellow bamboo of bamboo culm (Phyllostachys pubescens)[J]. Journal of Wood Chemistry and Technology, 36(3): 157-172. DOI:10.1080/02773813.2015.1104544 |
Ibrahim M N M, Zakaria N, Sipaut C S, et al. 2011. Chemical and thermal properties of lignins from oil palm biomass as a substitute for phenol in a phenol formaldehyde resin production[J]. Carbohydrate polymers, 86(1): 112-119. DOI:10.1016/j.carbpol.2011.04.018 |
Kim H, Ralph J. 2010. Solution-state 2D NMR of ball-milled plant cell wall gels in DMSO-d6/pyridine-d5[J]. Organic & Biomolecular Chemistry, 8(3): 576-591. |
Mohanty A K, Misra M, Drzal L T. 2002. Sustainable bio-composites from renewable resources:opportunities and challenges in the green materials world[J]. Journal of Polymers and the Environment, 10(1/2): 19-26. DOI:10.1023/A:1021013921916 |
Robert D R, Bardet M, Gellerstedt G, et al. 1984. Structural changes in lignin during kraft cooking part 3[J]. On the structure of dissolved lignins. Journal of Wood Chemistry and Technology, 4(3): 239-263. DOI:10.1080/02773818408070647 |
Sameni J, Krigstin S, dos Santos Rosa D, et al. 2013. Thermal characteristics of lignin residue from industrial processes[J]. BioResources, 9(1): 725-737. |
Sluiter A, Ruiz R, Scarlata C, et al. 2005. Determination of extractives in biomass. Laboratory Analytical Procedure(LAP)(issue date: 07/17/2005). United States: National Renewable Energy Laboratory Golden, CO.
|
Tejado A, Pena C, Labidi J, et al. 2007. Physico-chemical characterization of lignins from different sources for use in phenol-formaldehyde resin synthesis[J]. Bioresource Technology, 98(8): 1655-1663. DOI:10.1016/j.biortech.2006.05.042 |
Villaverde J J, Li J, Ek M, et al. 2009. Native lignin structure of Miscanthus×giganteus and its changes during acetic and formic acid fractionation[J]. Journal of Agricultural and Food Chemistry, 57(14): 6262-6270. DOI:10.1021/jf900483t |
Wen J L, Sun S L, Xue B L, et al. 2013a. Quantitative structural characterization of the lignins from the stem and pith of bamboo (Phyllostachys pubescens)[J]. Holzforschung, 67(6): 613-627. |
Wen J L, Xue B L, Xu F, et al. 2013b. Unmasking the structural features and property of lignin from bamboo[J]. Industrial Crops and Products, 42: 332-343. DOI:10.1016/j.indcrop.2012.05.041 |
Yang S, Wen J L, Yuan T Q, et al. 2014. Characterization and phenolation of biorefinery technical lignins for lignin-phenol-formaldehyde resin adhesive synthesis[J]. RSC Advances, 4(101): 57996-58004. DOI:10.1039/C4RA09595B |
Zhang L, Li X, Yong Q, et al. 2015. Simultaneous saccharification and fermentation of xylo-oligosaccharides manufacturing waste residue for L-lactic acid production by Rhizopus oryzae[J]. Biochemical Engineering Journal, 94: 92-99. DOI:10.1016/j.bej.2014.11.020 |
 2018, Vol. 54
2018, Vol. 54

