文章信息
- 陆梅, 田昆, 孙向阳, 任玉连, 王行, 彭淑娴
- Lu Mei, Tian Kun, Sun Xiangyang, Ren Yulian, Wang Hang, Peng Shuxian
- 纳帕海典型湿地土壤真菌群落特征的积水条件和干湿季节变化
- Variation of Soil Fungal Community Characteristics of Typical Wetland in Napahai between Dry Wet Seasons under Different Waterlogging Conditions
- 林业科学, 2018, 54(2): 98-109.
- Scientia Silvae Sinicae, 2018, 54(2): 98-109.
- DOI: 10.11707/j.1001-7488.20180211
-
文章历史
- 收稿日期:2017-08-09
- 修回日期:2018-01-10
-
作者相关文章
2. 西南林业大学生态与水土保持学院 昆明 650224;
3. 国家高原湿地研究中心 昆明 650224
2. College of Ecology and Soil & Water Conservation, Southwest Forestry University Kunming 650224;
3. National Plateau Wetlands Research Center Kunming 650224
地表水文条件是湿地生态系统区别于陆地生态系统和深水生态系统的独持属性, 决定了湿地生态系统的结构和功能。目前, 湿地开发利用以及工农业耗水等人类活动深刻改变着湿地水文状况, 影响湿地土壤水分的时空异质性, 引起湿地土壤理化性质和土壤生物群落结构的改变, 从而导致湿地生态系统的结构与功能严重退化(Yang et al., 2009)。真菌是重要的土壤微生物之一, 其通过分解动植物残体和排泄物等对土壤系统的物质循环和能量流动起着至关重要的作用, 并直接或间接影响土壤的生物化学过程(冷东, 2015); 同时, 真菌在改善土壤结构方面也具有重要作用(牛佳等, 2011; 王艳云等, 2016)。大量研究表明, 在湿地生态系统中, 季节变化和土壤水分含量变化都会对湿地土壤真菌产生影响(Tang et al., 2011; 隋心等, 2016; 陈为峰等, 2010; 徐惠风等, 2004; 凌云等, 2009)。目前, 关于湿地水分条件与土壤真菌群落相关性的研究主要集中于土壤水分条件的改变对湿地土壤真菌群落的影响, 鲜见针对不同积水条件下湿地土壤真菌群落结构及其季节动态的报道, 因此, 揭示不同积水条件下湿地土壤真菌群落组成、结构与多样性的干湿季节动态特征, 探明不同积水条件引起的土壤理化性质改变对土壤真菌群落的影响, 对理解湿地土壤真菌群落响应湿地水文条件改变的机制具有重要科学意义。
本研究选择纳帕海高原湿地不同积水条件下的3种典型湿地(沼泽湿地、沼泽化草甸和草甸), 运用Illumina高通量测序技术, 研究不同积水条件下纳帕海典型湿地土壤真菌群落多样性的干湿季节动态特征及其与土壤理化因子间的关系, 探讨土壤真菌群落结构对湿地水文变化和干湿季节变化的响应规律, 以期为高原湿地的保护与恢复提供数据和理论支持。
1 材料与方法 1.1 研究地概况与样点布设研究地位于青藏高原东南缘横断山区香格里拉县境内的纳帕海高原湿地(27°49′—27°55′N, 99°37′—99°43′E), 海拔3 260 m, 为石灰岩上发育而成的喀斯特型季节性高原湖泊湿地。该湿地地处青藏高原与亚热带季风气候区和中南半岛热带季风区的结合部, 具有高寒、低温、霜期长、降水量少、干湿季节分明及冬春季干旱突出等特点, 年均温5.4 ℃, 最冷月平均温度-3.8 ℃, 最热月平均温度13.2 ℃(唐明艳等, 2013); 湿地水量补给主要依靠降水, 年均降水量619.9 mm, 其中雨季(5—10月)495.9 mm(占全年的80%), 干季(11月至次年4月) 123.9 mm(占全年的20%)。土壤类型主要为沼泽土、沼泽化草甸土和草甸土(田昆等, 2004a; 2004b)。特殊的闭合-半闭合地形特征孕育了纳帕海高原湿地丰富的生物多样性, 是全球生物多样性保护的热点地区之一。随着人口不断增加和经济快速发展, 人们对纳帕海高原湿地进行了大规模的挖沟排水, 改变了水文循环过程, 从湖心至湖岸依次分布常年积水沼泽湿地(swamp wetland, SW)、季节性积水沼泽化草甸(swamp meadow, SM)和无积水草甸(meadow, M)3种典型湿地, 其土壤积水条件差异明显。本研究在各湿地均设置研究样带, 每个样带内分别随机布设3个采样点。样地基本情况见表 1。
|
|
于2015年1月(干季)和8月(湿季)采样。运用5点混合取样法采集土壤, 即在不同类型湿地样地中分别随机布设3个样方(10 m×10 m), 每个样方利用对角线法选取5个取样点(4个角+中心点)。首先去除地表约2 cm厚的植被和覆盖物, 再用土钻钻取0~20 cm土层的土壤样品, 剔除石砾和植物残根等杂物后将5个取样点的土壤混合[沼泽湿地因常年淹水, 直接用特制采样器(田昆等, 2004a; 2004b)采集0~20 cm土层土样], 用四分法取适量土壤装入无菌自封袋, 置于冰盒中尽快带回实验室, 共采集18份土壤样品。将上述土样进行如下处理:约100 g用于测定土壤含水量; 约1 kg室内自然风干、磨细过100目和10目筛, 用于土壤基本性质测定(鲍士旦, 2013); 约200 g置于-70 ℃下冷冻保存, 用于土壤DNA提取和高通量测序。
1.3 分析方法 1.3.1 土壤基本特性分析含水量采用烘干称量法(105±2 ℃, 24 h)测定; 有机质采用重铬酸钾氧化-外加热法测定; 全氮采用硫酸-高氯酸消化开氏定氮法测定; pH按土:水=1:2.5浸提, 电位法测定; 有效磷采用0.5 mol·L-1的NaHCO3浸提紫外分光光度法测定; 速效钾采用1 mol·L-1的醋酸铵浸提, 火焰光度法测定; 水解性氮采用碱解扩散法测定; 全磷采用H2SO4-HCLO4消煮-钼锑抗比色法测定; 全钾采用NaOH熔融-火焰光度法(鲍士旦, 2013)。所有指标每份土样至少测定3个平行样(表 4)。
|
|
分别称取各样地的土壤样品0.5 g, 各3次重复, 首先参照李靖宇等(2010)所述方法去除腐殖酸, 之后采用美国OMEGA公司Soil DNA KIT试剂盒提取土壤总DNA。将提取到的土壤总DNA溶于100 μL无菌水后, 通过微量紫外分光光度计测定DNA的浓度和纯度(OD260/OD280和OD260/OD230)。利用1.2%的琼脂糖凝胶电泳分离, 将每份混合土样提取出的3个DNA样品充分混合后送上海生工生物科技有限公司进行高通量测序。基于Illumina Miseq测序平台利用引物R_ITS1 (CCTACACGACGCTCTTCCGATC TCG(Barcode)CTTGGTCATTTAGAGGAAGTAA)和F_5.8S (CTGG AGTTCCTTGGCACCCGAGAATTCCAA GCGCTGCGTT CTTCATCG)(魏魏等, 2013)对真菌ITS区进行测序。进行2轮PCR扩增, 第1轮扩增, 反应体系50 μL:10×PCR buffer缓冲液5 μL, dNTP(10 mmol·L-1 each)0.5 μL, DNA模板10 ng, Bar-PCR引物F(50 μmol·L-1)0.5 μL, 引物R(50 μmol·L-1)0.5 μL, Plantium Taq(5 U·μL-1)0.5 μL, 补充ddH2O至50 μL。PCR扩增反应条件为:94 ℃预变性3 min; 94 ℃变性30 s、45 ℃退火20 s、65 ℃延伸30 s, 5个循环; 94 ℃变性20 s、55 ℃退火20 s、72 ℃延伸30 s, 20个循环; 最后于72 ℃延伸5 min; 温度降至10 ℃左右, 第1轮PCR结束。第2轮扩增, 引入Illumina桥式PCR兼容引物, 反应体系也是50 μL:10×PCR buffer 5 μL, dNTP(10 mmol·L-1 each)0.5 μL, DNA 20 ng, 引物F(50 μmol·L-1)0.5 μL, 引物R(50 μmol·L-1)0.5 μL, Plantium Taq(5 U·μL-1)0.5 μL, 补充ddH2O至50 μL。PCR扩增反应条件为:95 ℃预变性30 s; 95 ℃变性15 s、55 ℃退火15 s、72 ℃延伸30 s, 5个循环; 最后于72 ℃延伸5 min。PCR扩增结束后, 将纯化质检合格的扩增产物1:1等量混合, 利用Miseq台式测序仪2×300 bp双端测序(paired-end)。
1.4 数据分析采用SPSS17.0和Excel 2013软件进行数据分析, 显著性水平设为P < 0.05。各样地变量之间的显著性差异采用单因素方差分析(one-way analysis), 土壤理化性质和真菌群落结构之间的相关性采用Pearson相关性分析。利用Mothur软件, 将相似性大于97%的序列归为同一种可操作分类单元(OTU), 并进行Alpha多样性分析, 计算土壤真菌群落的Alpha多样性指数:丰富度(Richness)指数、香侬(Shannon)指数、赵氏(Chao1)指数、艾斯(ACE)指数和覆盖率(Covergae)。采用RDA(Canoco for Windows 4.5)软件分析理化性质对微生物群落结构的影响, 其中, 土壤理化数据作为环境变量, 微生物群落在门水平的相对丰度作为物种数据。
2 结果与分析 2.1 土壤样本测序结果高通量测序结果经过低质量序列过滤后, 共获得157 230条有效序列, 序列长度大部分分布于240~280 bp之间, 平均长度240 bp以上, 满足进一步分析的质量要求。157 230条有效序列中, 干季沼泽湿地为18 240条、沼泽化草甸为32 084条、草甸为27 124条, 湿季的沼泽湿地为20 610条、沼泽化草甸为26 088条、草甸为33 084条。在97%相似度下将其聚类为用于物种分类的OTU, 共产生3 122个OTU, 统计结果如表 2所示。
|
|
由表 2可知, 土壤样品真菌覆盖率为99.7%~99.8%, 表明测序深度合理, 能够反映样品菌群的基本情况。对测序获得的序列进行随机抽样, 用抽到的序列数所代表的OTU数构建稀释性曲线(图 1), 可以看出样品的稀释性曲线均趋于平缓, 表明测序数据合理, 更多的测序数据只会产生少量新的OTU。
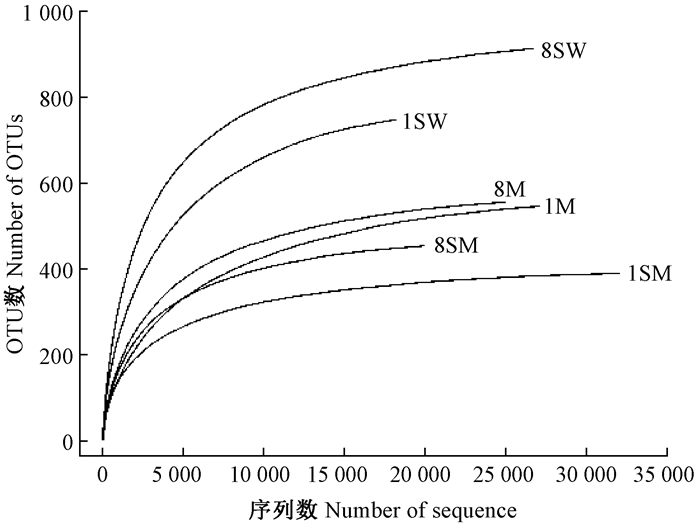
|
图 1 土壤样品稀释性曲线(相似度为97%) Figure 1 Rarefaction curves of each soil sample at cutoff level of 3% 1:干季 Dry season, 8:湿季 Wet season; SW:沼泽湿地 Swamp wetland; SM:沼泽化草甸湿地 Swamp meadow; M:草甸 Meadow.下同 The same below. |
Chao1和ACE指数可用于估算样品所含OTU总数, 反映菌群丰度, Chao1和ACE指数越大, 说明真菌群落丰度越高。Shannon指数反映真菌群落Alpha多样性指数, Shannon指数越大, 说明真菌群落多样性越高。Simpson指数也反映真菌群落多样性, Simpson指数越大, 说明群落多样性越低。由表 2可知, 在干季, 不同类型湿地土壤真菌群落多样性指数差异显著(P < 0.05), 草甸Shannon、ACE、Chao1和Richness指数最大(3.58、534.22、522.25和513), 故在该季节草甸土壤真菌群落多样性最大, 其次为沼泽化草甸(3.48、391.37、387.80和380)和沼泽湿地(3.12、380.56、379.17和364), 沼泽湿地土壤真菌群落多样性最小, 草甸Simpson指数最小(0.081);在湿季, 不同类型湿地土壤真菌群落多样性指数差异显著(P < 0.05), 沼泽化草甸Shannon、ACE、Chao1和Richness指数最大(4.97、917.04、912.36和887), 故在该季节沼泽化草甸土壤真菌群落多样性最大, 其次为草甸(3.90、545.65、538.63和529)和沼泽湿地(3.70、474.47、471.86和449), 沼泽化草甸Simpson指数最小(0.047)。综上可知, 在干季和湿季, 不同积水条件的典型湿地土壤真菌群落多样性差异显著(P < 0.05), 这充分表明改变水分条件能显著影响纳帕海湿地的土壤真菌群落多样性和丰富度, 且在干湿季节的影响程度各不相同。
不同积水条件的典型湿地土壤真菌群落多样性在季节变化上存在差异, 表现为湿季>干季, 其中沼泽化草甸的季节差异显著(P < 0.05), 说明沼泽化草甸土壤真菌群落多样性和丰富度受季节变化影响最明显, 沼泽湿地次之, 草甸季节差异最不明显。沼泽化草甸的Richness、Shannon、ACE和Chao1指数在湿季分别为887、4.97、917.04和912.36, 为干季的2.33、1.43、2.34和2.35倍; 沼泽湿地的Richness、Shannon、ACE和Chao1指数在湿季分别为449、3.70、474.47和471.86, 为干季的1.23、1.19、1.25和1.24倍; 草甸的Richness、Shannon、ACE和Chao1指数在湿季分别为529、3.90、545.65和538.63, 为干季的1.03、1.09、1.02和1.03倍(表 2)。
2.3 不同积水条件的典型湿地土壤真菌群落结构组成及季节特征高通量测序发现, 在干湿季节和不同积水条件下, 纳帕海典型湿地土壤中检测到的主要真菌门有子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、接合菌门(Zygomycota)、壶菌门(Chytridiomycota)和未分类真菌(Fungi_unclassified), 其中子囊菌门、未分类真菌和担子菌门是占主导地位的微生物, 占所有微生物总数的20.63%~85.26%。
在门分类水平上, 干季不同积水条件的典型湿地土壤真菌群落组成不同。沼泽湿地土壤优势种群为未分类真菌(相对丰度为85.26%), 次优势种群为子囊菌(9.9%), 其余菌门相对丰度较低; 沼泽化草甸土壤优势种群与沼泽湿地一样同为未分类真菌, 但相对丰度大幅下降, 仅为36.43%, 次优势种群为子囊菌(33.41%)和担子菌(26.8%); 草甸土壤优势种群为子囊菌(71.11%), 次优势种群为担子菌(20.63%), 其余相对丰度大于1%的还包括未分类真菌(5.63%)和接合菌(2.4%)(图 2a)。湿季不同积水条件典型湿地土壤真菌群落组成不同。沼泽湿地土壤优势种群为未分类真菌(66.27%), 次优势种群为壶菌(20.63%), 其余相对丰度大于1%的还有担子菌(2.06%); 沼泽化草甸土壤优势种群为担子菌(32.80%), 次优势种群为子囊菌(32.57%), 其余相对丰度大于1%的还包括未分类真菌(29.74%)和接合菌(4.60%); 草甸土壤优势种群为子囊菌(52.07%), 次优势种群为担子菌(36.45%), 其余相对丰度大于1%的还有接合菌(4.81%)(图 2b)。综上可知, 无论在干季还是湿季, 不同积水条件的典型湿地土壤真菌群落组成均从以未分类真菌为优势菌群逐渐转向子囊菌和担子菌。
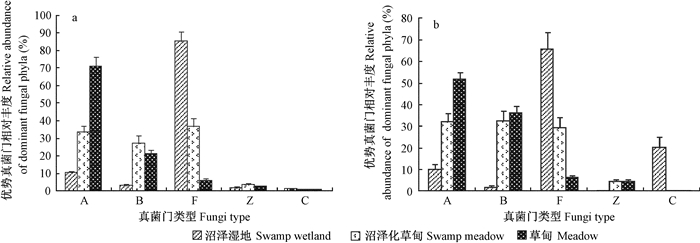
|
图 2 纳帕海不同积水条件典型湿地优势真菌门干季(a)和湿季(b)群落组成 Figure 2 Relative abundance of dominant fungal community at phylum levels in dry(a) and wet (b) season in a typical wetland Napahai under different water conditions A.子囊菌门 Ascomycota; B.担子菌门 Basidiomycota; F.未分类真菌 Fungi_unclassified; Z.接合菌门 Zygomycota; C.壶菌门 Chytridiomycota. |
随着干湿季节变化, 各优势真菌门在不同积水条件典型湿地的相对丰度存在差异(表 3)。壶菌门在沼泽湿地中差异显著(P < 0.05), 相对丰度从干季的0.78%激增至湿季的20.63%, 在沼泽化草甸中也差异显著(P < 0.05), 但相对丰度较低, 在草甸中差异不显著; 担子菌门在沼泽化草甸和草甸中差异显著(P < 0.05), 从干季的26.80%和20.63%分别增至湿季的32.80%和36.45%, 在沼泽湿地中差异不显著; 子囊菌门在草甸中差异显著(P < 0.05), 趋势与担子菌门相反, 从干季的71.11%降至湿季的52.07%, 在沼泽湿地和沼泽化草甸中差异不显著; 接合菌门在3种典型湿地中差异显著(P < 0.05), 在沼泽湿地中从干季的1.39%降至湿季的0.48%, 在沼泽化草甸中从干季的3.12%和2.40%分别增至湿季的4.69和4.81;未分类真菌在沼泽湿地和沼泽化草甸中差异显著(P < 0.05), 从干季的85.26%和36.43%分别降至66.27%和29.74%, 在草甸中差异不显著。
|
|
如图 3a所示, 在纲分类水平上, 干季的沼泽湿地、沼泽化草甸和草甸土壤真菌群落组成中丰度大于5%的纲共有6个, 分别是粪壳菌纲(Sordariomycetes) (2.11%、6.47%和6.58%)、担子菌纲(Basidiomycota) (0.03%、1.67%和16.65%)、散囊菌纲(Eurotiomycetes) (3.52%、11.73%和24.96%)、座囊菌纲(Dothideomycetes) (1.88%、3.18%和5.56%)、银耳纲(Tremellomycetes) (0.55%、17.29%和0.31%)以及古菌根菌纲(Archaeorhizomycetes) (0.13%、1.46%和28.47%)。其中, 古菌根菌纲(28.47%)、散囊菌纲(24.96%)和担子菌纲(16.65%)在草甸样地中占优势, 银耳纲(17.29%)和散囊菌纲(11.73%)在沼泽化草甸样地中占优势。
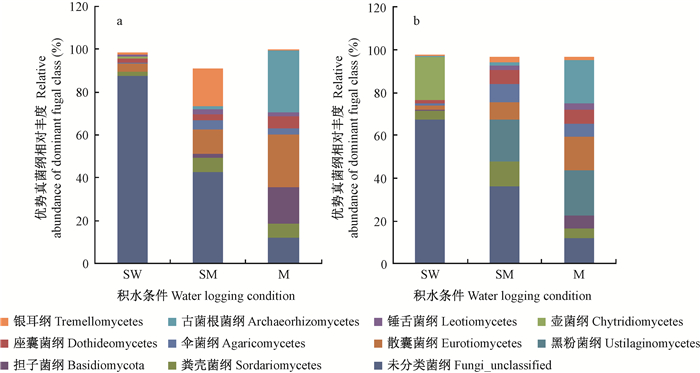
|
图 3 纳帕海不同积水条件典型湿地土壤优势真菌纲干季(a)和湿季(b)群落组成 Figure 3 Relative richness of soil fugal community at class levels in dry(a) and wet (b) season in a typical wetland Napahai under different water conditions |
如图 3b所示, 在纲分类水平上, 湿季的沼泽湿地、沼泽化草甸和草甸土壤真菌群落组成中丰度大于5%的纲共有8个, 分别是粪壳菌纲(4.32%、11.45%和4.90%)、担子菌纲(0.4%、0.34%和5.84%)、黑粉菌纲(Ustilaginomycetes) (0.2%、19.61%和21.04%)、散囊菌纲(2.03%、7.77%和15.58%)、伞菌纲(Agaricomycetes) (1.1%、8.68%和6.16%)、座囊菌纲(1.23%、6.46%和6.57%)、壶菌纲(Chytridiomycetes) (20.63%、0.16%和0.06%)以及古菌根菌纲(0.32%、1.83%和20.11%)。其中, 黑粉菌纲(21.04%)和古菌根菌纲(20.11%)在草甸样地中占优势, 壶菌纲(20.63%)在沼泽湿地中占优势。
从干季到湿季, 不同积水条件的典型湿地土壤真菌优势菌纲从6个增加至8个, 湿季增加了黑粉菌纲、伞菌纲和壶菌纲, 减少了银耳纲。在湿季, 黑粉菌纲在沼泽化草甸和草甸中大幅增加, 相对丰度分别从干季的0.01%和0.02%激增至湿季的19.60%和21.04%;壶菌纲在沼泽湿地中大幅增加, 相对丰度从干季的0.76%增至湿季的20.63%。银耳纲在干季的沼泽化草甸中相对丰度高(17.29%), 为优势菌纲。
2.4 土壤真菌优势类群与主要理化性质的关系 2.4.1 土壤主要理化性质特征由表 4可知, 干湿季节不同积水条件典型湿地的土壤含水量及有机质、全氮、水解性氮和全钾含量的变化规律一致, 均为沼泽湿地>沼泽化草甸>草甸, 且沼泽湿地显著高于草甸(P < 0.05);土壤有效磷和速效钾同为沼泽化草甸>沼泽湿地>草甸; 土壤全磷为沼泽化草甸>草甸>沼泽湿地; 碳氮比在干湿季的变化趋势略有不同, 干季为草甸>沼泽化草甸>沼泽湿地, 湿季为沼泽湿地>草甸>沼泽化草甸; 草甸土壤呈酸性, 沼泽化草甸和沼泽湿地呈中偏碱性。
从季节变化上看, 不同积水条件典型湿地的土壤含水量及有机质、全氮、有效磷和速效钾含量均为湿季>干季; 全磷为干季>湿季。全钾在沼泽湿地和沼泽化草甸为干季>湿季, 草甸为湿季>干季; 碳氮比在沼泽湿地为湿季>干季, 沼泽化草甸和草甸为干季>湿季; 水解性氮在沼泽湿地和草甸为干季>湿季, 沼泽化草甸为湿季>干季。
2.4.2 真菌优势类群与主要理化因子的相关性对干湿季土壤优势菌门相对丰度与主要理化因子进行冗余分析(图 4), 结果显示第1轴和第2轴累计解释变异量分别达到96.8%和97.4%, 说明土壤主要理化因子对不同积水条件典型湿地土壤真菌群落结构具有较大影响。在干季(图 4A), 土壤含水量(r=0.911 2)、有机质(r=0.995 9)、全氮(r=0.999 7)、pH (r=0.995 7)、水解性氮(r=0.992 0)和碳氮比(r=0.864 4)与轴1的相关性较大, 第1轴解释率达94.32%。在湿季(图 4B), 土壤含水量(r=0.957 6)、有机质(r=0.954 6)、全氮(r=0.997 9)、pH(r=0.769 3)、水解性氮(r=0.858 5)、碳氮比C/N(r=0.0.7341)、全磷(r=0.755 0)和全钾(r=0.944 9)与轴1相关性较大, 第1轴解释率达92.36%。由此可见, 干湿季影响不同积水条件典型湿地土壤真菌群落多样性的主要土壤理化因子既有相似之处, 又有所不同, 干季起主导作用的是含水量、有机质、全氮、pH、水解性氮和碳氮比, 湿季除上述因子外还包括全磷和全钾。
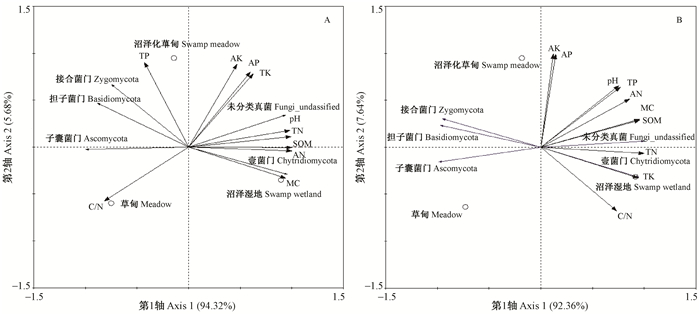
|
图 4 纳帕海不同积水条件典型湿地土壤优势真菌门干季(A)和湿季(B)与土壤主要理化因子冗余分析 Figure 4 Redundancy analysis (RDA) on soil dominant fungal phyla in dry(A) and wet (B)season in a typical wetland Napahai under different water conditions |
对优势真菌门相对丰度与土壤主要理化因子进行Pearson相关性分析, 结果如表 5所示。在干季, 子囊菌门相对丰度与含水量(-0.813**)、有机质(-0.959 **)、全氮(-0.985**)、全钾(-0.819**)、水解性氮(-0.948**)和pH (-0.995**)呈极显著负相关, 与有效磷(-0.798*)和速效钾(-0.697*)呈显著负相关, 与碳氮比(0.946**)呈极显著正相关; 未分类真菌相对丰度与含水量(0.936**)、有机质(0.998**)、全氮(0.996**)、水解性氮(0.998**)和pH(0.987**)呈极显著正相关, 与全钾(0.641*)和有效磷(0.614*)呈显著正相关, 与碳氮比(-0.830**)呈极显著负相关; 担子菌门相对丰度与含水量(-0.960**)、有机质(-0.816**)、全氮(-0.743*)、水解性氮(-0.836**)、pH(-0.697*)呈极显著和显著负相关, 与全磷(0.875**)呈极显著正相关; 接合菌门相对丰度与含水量(-0.895**)呈极显著负相关, 与有机质(-0.700*)、全氮(-0.612*)、水解性氮(-0.725*)呈显著负相关, 与全磷(0.947**)呈极显著正相关; 壶菌门相对丰度与含水量(0.998**)、有机质(0.953**)、全氮(0.911**)、水解性氮(0.963**)和pH(0.881**)呈极显著正相关, 与全磷(-0.687*)呈显著负相关。
|
|
在湿季, 子囊菌门相对丰度与含水量(-0.991**)、有机质(-0.989**)、全氮(-0.976**)、全磷(-0.848**)、全钾(-0.882**)、水解性氮(0.928**)和pH(-0.860**)呈极显著负相关, 与碳氮比(-0.619*)呈显著负相关; 未分类真菌相对丰度与含水量(0.998**)、有机质(0.972**)、全氮(0.992**)、全钾(0.922**)、水解性氮(0.890**)和pH(0.809**)呈极显著正相关, 与碳氮比(0.689*)和全磷(0.796*)呈显著正相关; 担子菌门和接合菌门相对丰度与含水量(-0.864**, -0.825**)、有机质(-0.859**, -0.820**)、全氮(-0.986**, -0.971**)、碳氮比(-0.872**, -0.905**)和全钾(-0.995**, -0.998**)呈极显著负相关, 与水解性氮(-0.715*, -0.663*)呈显著负相关; 壶菌门相对丰度与含水量(0.815**)、有机质(0.809**)、全氮(0.966**)、碳氮比(0.913**)和全钾(0.998**)呈极显著正相关, 与水解性氮(0.649*)呈显著正相关。由此可见, 土壤含水量、有机质、全氮和水解性氮在干湿季与各优势真菌门丰度的相关关系一致, 是影响不同积水条件下典型湿地真菌群落结构的主要因子, 而碳氮比、全磷、全钾、有效磷、速效钾和pH则在不同季节表现出不尽相同的相关性。
3 讨论 3.1 不同积水条件和季节对土壤真菌群落结构的影响土壤是微生物的主要活动场所, 受土壤条件、植物群落和气候条件等影响, 微生物的种类、数量和动态分布会按照一定的生态规律产生各种差异(张薇等, 2005)。本研究发现, 纳帕海不同积水条件典型湿地在不同季节土壤真菌群落结构组成不同。干季沼泽湿地和沼泽化草甸的优势门、纲均为未分类真菌, 草甸为子囊菌门和古菌根菌纲; 湿季沼泽湿地优势门、纲均为未分类真菌, 沼泽化草甸为担子菌门和未分类真菌, 草甸为子囊菌门和黑粉菌纲。沼泽湿地常年积水, 土壤通气性差, 养分含量高, 存在大量未分类真菌, 说明这些真菌耐氧胁迫作用强, 且在沼泽湿地中还有许多潜在新种待挖掘。沼泽化草甸在湿季土壤过湿, 土壤通气性差, 同样存在大量未分类真菌。在干季沼泽化草甸和干湿季的草甸土壤含水量降低, 通气性得到改善, 适应子囊菌和担子菌的繁殖。子囊菌和担子菌均是陆生的高等菌物, 是土壤中主要的真菌分解者(Yille et al., 2008)。子囊菌门大多数为腐生菌, 可以分解难降解性有机质, 在养分循环中起着重要作用(Beimforde et al., 2014)。担子菌门腐生或寄生, 在潮湿的土壤中, 可以分解木质纤维素。隋心等(2016)研究发现子囊菌和担子菌喜欢通气性较好的土壤条件。另外, 随着土壤含水量减少, 沼泽化草甸和草甸的土壤环境发生变化, 植物类型由湿生向中生和旱生植被转变(肖德荣等, 2008), 植物种类增加且土壤通气性得到改善, 凋落物种类增多且分解迅速, 陆生型的子囊菌和担子菌大量繁殖(Heinemeye et al., 2004)。
季节是影响土壤真菌群落结构和功能的重要因素, 土壤温度和湿度变化都有可能改变土壤真菌群落结构(Hannula et al., 2012)。本研究发现, 湿季壶菌门、壶菌纲在沼泽湿地中大幅增加, 这可能与壶菌的繁殖特性和生活习性有关, 壶菌纲真菌具后生单鞭毛游动孢子或能动配子, 繁殖时需要凝结水, 且多数生活在水中, 少数生活在潮湿土壤中。同时, 适宜的碳氮比也有可能是促进其大量繁殖的原因, 冗余分析表明壶菌门与土壤含水量和碳氮比呈极显正相关(表 5)。从干季到湿季, 沼泽化草甸和草甸土壤中担子菌门呈增加趋势, 子囊菌门呈减少趋势, 这是因为子囊菌在群落演替中主要处于演替前期, 子囊菌等先驱微生物入侵枯枝落叶, 接着草本对策的腐朽菌开始出现, 然后竞争对策或忍耐对策的担子菌门的木腐菌取代腐朽菌, 最后使枯枝落叶分解(何苑皞等, 2014)。从干季到湿季, 黑粉菌纲在沼泽化草甸和草甸中大幅增加, 这是由于担子菌门黑粉菌纲是最为典型的内寄生真菌, 主要寄生在禾本科(Poaceae)、十字花科(Brassicaceae)、毛茛科(Rammculaceae)、莎草科(Cyperaceae)等植物的根、茎、叶和花上, 纳帕海湿季正是禾本科等植物生长的旺盛季节, 有利于黑粉菌寄生。有研究认为, 植物群落类型能够初步决定微生物群落的组成(张薇等, 2005)。银耳纲在湿季沼泽化草甸土壤中大幅下降, 其原因可能是银耳纲更适宜干季沼泽化草甸的土壤环境。
3.2 不同积水条件和季节对土壤真菌群落多样性的影响土壤水分状况会对土壤微生物多样性及其季节动态产生重要影响(秦红等, 2017)。本研究发现, 随着湿地土壤含水量降低, 土壤真菌群落多样性总体呈增加趋势, 表明土壤水分条件是影响纳帕海高原湿地土壤真菌群落多样性的重要因素之一。高含水量会抑制湿地真菌群落的多样性(陈会海等, 2012; 徐惠风等, 2004), 而当土壤含水量低时真菌细胞的数量将增多(Ma et al., 2012)。常年积水沼泽湿地, 土壤含水量高, 通气性差, 虽能为真菌提供丰富的碳源, 但好氧的真菌仍被抑制导致其多样性最低。随着湿地含水量下降, 土壤通气条件改善, 草甸土壤真菌群落多样性增加。
本研究发现, 不同积水条件典型湿地土壤真菌群落多样性均表现为湿季>干季的季节变化趋势, 其中沼泽化草甸季节差异最明显, 其次为沼泽湿地和草甸。原因有以下几方面:一是在湿季大量携带湖周耕地施肥和湖盆面山森林生态系统中养分的地表径流汇入湖盆中, 为土壤提供了更加丰富的营养物质, 促进了微生物增殖(曹萍麟等, 2014); 二是湿季正值当地温度比较适宜的季节, 适宜的温度有利于地上植被生长和地下土壤微生物活动(Beniari et al., 2005; 王轶等, 2014); 三是土壤水分变化会引起土壤水势、pH和氧化还原电位发生变化, 而这些变化又影响着微生物的活性和群落组成(王健波等, 2013)。在湿季, 沼泽化草甸真菌群落多样性表现出与干季不同的特征, 显著高于沼泽湿地和草甸, 这可能是因为在湿季沼泽化草甸的积水状况随大气降水而交替变化, 干湿交替的土壤条件为真菌大量繁殖提供条件, 土壤干燥后湿润, 能迅速提高土壤中微生物的活性(Gutknecht et al., 2006), 且降水可以通过影响土壤中其他动植物或非生物因素而间接影响微生物组成及多样性(张静茹等, 2014)。Rinklebe等(2006)研究也发现短期积水的土壤条件能够促进微生物对土壤碳的利用, 增强土壤微生物活性, 而地表长期淹水则对真菌生活不利。
3.3 土壤真菌与主要理化性质的关系土壤微生物群落结构和多样性在很大程度上可归因于土壤微生物栖息的土壤理化性质及其变化, 并且土壤理化性质影响土壤微生物群落的时空尺度可能存在差异(杜瑞芳等, 2014), 土壤理化性质对微生物群落具有多尺度效应(Krause et al., 2013)。本研究发现, 无论在干季还是湿季, 土壤含水量和有机质、全氮、水解性氮含量及pH、碳氮比都与真菌群落结构和多样性之间存在极显著相关。土壤基质的性质是真菌群落结构组成和多样性的主要驱动因子, 其中水分是影响真菌群落多样性的重要因素(Peralta et al., 2012)。淹水导致土壤通气条件变差, 而大多数真菌是严格的好气菌, 其必须有氧气才能生长, 导致土壤真菌群落结构和多样性发生显著变化(隋心等, 2016)。真菌参与土壤有机质分解, 直接影响土壤有机质的含量, 反之土壤有机质的增减也能改变土壤真菌的数量和组成(Billings et al., 2005)。有机质和全氮是真菌重要的碳源和氮源(Hedlund, 2002), 但在本研究中有机质和全氮含量较高的常年积水沼泽湿地, 其真菌的多样性却最少, 这主要是由于沼泽湿地常年积水, 好氧的真菌生长繁殖受限, 从而影响土壤真菌群落结构和多样性。土壤pH对腐生性真菌影响最大(Kivlin et al., 2016), 且土壤真菌在偏酸性土壤中占据优势地位(Ogilvie et al., 2008), 在酸性环境中能够提高对水分的利用, 从而促进自身生长, 使其数量增殖(Nevarezl et al., 2009)。在干季, 碳氮比与子囊菌门和未分类真菌分别呈极显著正相关和负相关, 与其他优势菌相关性显著, 但在湿季, 碳氮比与担子菌门、接合菌门和子囊菌门呈极显著或显著负相关, 与壶菌门和未分类真菌呈极显著或显著正相关。有研究表明, 土壤碳氮比是影响土壤微生群落结构变化的重要因子之一, 适宜的碳氮比能促进真菌生长(高利等, 2009)。真菌对有机底物的利用率更高, 在偏酸性、养分有效性低、难分解底物和碳氮比较高的土壤中, 真菌生长更加旺盛(韩世忠等, 2015)。
4 结论1) 不同积水条件的纳帕海典型湿地土壤真菌群落多样性在不同季节均存在显著差异(P < 0.05), 在干季草甸>沼泽化草甸>沼泽湿地; 在湿季沼泽化草甸>草甸>沼泽湿地。同时在季节变化上湿季>干季, 其中沼泽化草甸的季节差异最明显。
2) 不同积水条件的纳帕海典型湿地土壤真菌群落结构不同, 且存在季节变化。随湿地表面积水减少, 土壤真菌群落结构组成从未知菌群转变为子囊菌。
3) RDA和Pearson相关性分析表明, 无论在干季还是湿季, 土壤含水量和有机质、全氮、水解性氮含量及pH、碳氮比都与真菌群落结构和多样性存在极显著相关。
鲍士旦. 2013. 土壤农化分析[M]. 北京: 中国农业出版社: 22-113. (Bao S D. 2013. Analysis of soil aggregation[M]. Beijing: China Agricultural Publishing House: 22-113. [in Chinese]) |
曹萍麟, 陆梅, 田昆, 等. 2014. 纳帕海高原湿地不同干扰强度下土壤真菌的分布格局[J]. 植物生态学报, 38(11): 1166-1173. (Cao P L, Lu M, Tian K, et al. 2014. Soil fungi distribution patterns under different levels of disturbance in the wetland of Napahai Plateau[J]. Chinese Journal of Plant Ecology, 38(11): 1166-1173. [in Chinese]) |
陈为峰, 史衍玺. 2010. 黄河三角洲新生湿地不同植被类型土壤的微生物分布特征[J]. 草地学报, 18(6): 859-864. (Chen W F, Shi Y X. 2010. Distribution characteristics of microbes in new-born wetlands of the Yellow River delta[J]. Journal of Grassland Science, 18(6): 859-864. DOI:10.11733/j.issn.1007-0435.2010.06.020 [in Chinese]) |
陈会海, 许修宏, 李洪涛. 2012. 应用PCR-DGGE分析三江湿地土壤真菌群落结构的多样性[J]. 环境科学研究, 25(11): 1272-1278. (Chen H H, Xu X H, Li H T. 2012. Diversity analysis of soil fungal community structure in Sanjiang wetland by PCR-DGGE[J]. Research of Environmental Sciences, 25(11): 1272-1278. [in Chinese]) |
杜瑞芳, 李靖宇, 赵吉. 2014. 乌梁素海湖滨湿地细菌群落结构多样性[J]. 微生物学报, 54(10): 1116-1128. (Du R F, Li J Y, Zhao J. 2014. Bacterial diversity in littoral wetland of Wuliangsuhai lake[J]. Actor Microbiologica Sinica, 54(10): 1116-1128. [in Chinese]) |
高利, 刘杏忠, 宗兆锋. 2009. 碳浓度及碳氮比对几种生防真菌孢子萌发的作用[J]. 植物保护学报, 36(1): 93-94. (Gao L, Liu X Z, Zong Z F. 2009. Effects of carbon concentration and carbon-to-nitrogen ratio on spore germination of several biocontrol fungi[J]. Acta Phytophylac Sinica, 36(1): 93-94. [in Chinese]) |
韩世忠, 高人, 马红亮, 等. 2015. 中亚热带森林土壤真菌多样性的案例研究[J]. 热带亚热带植物学报, 23(3): 343-352. (Han S Z, Gao R, Ma H L, et al. 2015. Soil fungal diversities of Castanopsis carlesii nature forests in mid-subtropical China[J]. Journal of Tropical and Subtropical Botany, 23(3): 343-352. DOI:10.11926/j.issn.1005-3395.2015.03.017 [in Chinese]) |
何苑皞, 周国英, 王圣洁, 等. 2014. 杉木人工林土壤真菌遗传多样性[J]. 生态学报, 34(10): 2725-2736. (He Y H, Zhou G Y, Wang S J, et al. 2014. Fungal diversity in Cunninghamia lanceolata plantation soil[J]. Acta Ecologica Sinica, 34(10): 2725-2736. [in Chinese]) |
冷东. 2015. 丛枝菌根真菌对土壤有机物降解的影响. 浙江大学硕士学位论文. (Leng D. 2015. Effects of arbuscular mycorrhizal fungi on the decomposition of organic matter. Hangzhou: MS thesis of Zhejiang University. [in Chinese]) |
李靖宇, 赵吉, 边玉, 等. 2010. 湿地土壤微生物DNA提取及其脱腐技术[J]. 微生物学通报, 37(8): 1130-1137. (Li J Y, Zhao J, Bian Y, et al. 2010. DNA extraction and removing humic substance from wetland soil[J]. Microbiology Bulletin, 37(8): 1130-1137. [in Chinese]) |
凌云, 林静, 徐亚同. 2009. 景观人工湿地微生物群落结构的季节变化[J]. 城市环境与城市生态, 22(4): 8-10. (Ling Y, Lin J, Xu Y T. 2009. Microbial community changes in reed constructed wetland in different seasons[J]. Urban Environment and Urban Ecology, 22(4): 8-10. [in Chinese]) |
牛佳, 周小奇, 蒋娜, 等. 2011. 若尔盖高寒湿地干湿土壤条件下微生物群落结构特征[J]. 生态学报, 31(2): 474-482. (Niu J, Zhou X Q, Jiang N, et al. 2011. Characteristics of soil microbial communities under dry and wet condition in Zoige alpine wetland[J]. Acta Ecologica Sinica, 31(2): 474-482. [in Chinese]) |
秦红, 李昌晓, 任庆水. 2017. 不同土地利用方式对三峡库区消落带土壤细菌和真菌多样性的影响[J]. 生态学报, 37(10): 2-12. (Qin H, Li C X, Ren Q S. 2017. Effects of different land use patterns on soil bacterial and fungal biodiversity in the hydro-fluctuation zone of the Three Gorges Reservoir region[J]. Acta Ecologica Sinica, 37(10): 2-12. [in Chinese]) |
隋心, 张荣涛, 许楠, 等. 2016. 三江平原不同退化阶段小叶章湿地土壤真菌群落结构组成变化[J]. 环境科学, 37(9): 3598-3605. (Sui X, Zhang R T, Xu N, et al. 2016. Fungal community structure of different degeneration Deyeuxia angustifolia wetlands in Sanjiang Plain[J]. Environmental Science, 37(9): 3598-3605. [in Chinese]) |
田昆, 常凤来, 陆梅, 等. 2004a. 人为活动对云南纳帕海湿地土壤碳氮变化的影响[J]. 土壤学报, 41(5): 681-686. (Tian K, Chang F L, Lu M, et al. 2004a. Impacts of human disturbances on organic carbon and nitrogen in Napahai wetland, northwest Yunnan[J]. Acta Pedologica Sinica, 41(5): 681-686. [in Chinese]) |
田昆, 陆梅, 常凤来, 等. 2004b. 云南纳帕海岩溶湿地生态环境变化及驱动机制[J]. 湖泊科学, 16(1): 35-42. (Tian K, Lu M, Chang F L, et al. 2004b. The ecological environmental change and driving mechanism of Napahai Karst Wetland in southwestern Yunnan Plateau[J]. Journey of Lake Science, 16(1): 35-42. [in Chinese]) |
唐明艳, 杨永兴. 2013. 不同人为干扰下纳帕海湖滨湿地植被及土壤退化特征[J]. 生态学报, 33(20): 6681-6693. (Tang M Y, Yang Y X. 2013. Analysis of vegetation and soil degradation characteristics under different human disturbance in lakeside wetland, Napahai[J]. Acta Ecologica Sinica, 33(20): 6681-6693. [in Chinese]) |
王健波, 张燕卿, 严昌荣, 等. 2013. 干湿交替条件下土壤有机碳转化及影响机制研究进展[J]. 土壤通报, 44(4): 998-1001. (Wang J B, Zhang Y Q, Yan C R, et al. 2013. Research advances in soil organic carbon transformation as related to drying and wetting cycles[J]. Chinese Journal of Soil Science, 44(4): 998-1001. [in Chinese]) |
王艳云, 郭笃发. 2016. 黄河三角洲盐碱地土壤真菌多样性及其与土壤理化性质的关系[J]. 浙江农业学报, 28(11): 1901-1907. (Wang Y Y, Guo D F. 2016. Soil fungal diversity and its relationship with soil physical and chemical properties in saline alkali soil of Yellow River Delta[J]. Acta Agriculturae Zhejiangensis, 28(11): 1901-1907. DOI:10.3969/j.issn.1004-1524.2016.11.15 [in Chinese]) |
王轶, 李季, 曹志平, 等. 2014. 长期施肥对农田土壤真菌的影响[J]. 中国生态农业学报, 22(11): 1267-1273. (Wang Y, Li J, Cao Z P, et al. 2014. Effects of long-term fertilization on soil fungi[J]. Chinese Journal of Eco-Agriculture, 22(11): 1267-1273. [in Chinese]) |
魏魏, 许艳丽, 朱琳, 等. 2013. 长期施肥对黑土农田土壤微生物群落的影响[J]. 土壤学报, 50(2): 372-378. (Wei W, Xu Y L, Zhu L, et al. 2013. Effect of long-them fertilization on soil microbial communities in farm land of black soil[J]. Acta Pedologica Sinica, 50(2): 372-378. DOI:10.11766/trxb201202290053 [in Chinese]) |
肖德荣, 田昆, 张利权. 2008. 滇西北高原纳帕海湿地植物多样性与土壤肥力的关系[J]. 生态学报, 28(7): 3116-3124. (Xiao D R, Tian K, Zhang L Q. 2008. Relationship between plant diversity and soil fertility in Napahai wetland of northwestern Yunnan Plateau[J]. Acta Ecologica Sinica, 28(7): 3116-3124. [in Chinese]) |
徐惠风, 刘兴土, 白军红. 2004. 长白山沟谷湿地乌拉苔草沼泽湿地土壤微生物动态及环境效应研究[J]. 水土保持学报, 18(3): 115-122. (Xu H F, Liu X T, Bai J H. 2004. Dynamic change and environmental effects of soil microorganism in marsh soils from Carex meyeriana wetlands in Changbai Mountain[J]. Journal of Soil and Water Conservation, 18(3): 115-122. [in Chinese]) |
张静茹, 张雷一, 刘方, 等. 2014. 降雨对干旱半干旱地区土壤微生物影响研究进展[J]. 世界林业研究, 27(4): 6-12. (Zhang J R, Zhang L Y, Liu F, et al. 2014. Research progress in effect of rainfall on soil microbe in arid and semi-arid area[J]. World Forestry Research, 27(4): 6-12. [in Chinese]) |
张薇, 魏海雷, 高洪文, 等. 2005. 土壤微生物多样性及其环境影响因子研究进展[J]. 生态学杂志, 24(1): 48-52. (Zhang W, Wei H L, Gao H W, et al. 2005. Advances of studies on soil microbial diversity and environmental impact factors[J]. Chinese Journal of Ecology, 24(1): 48-52. [in Chinese]) |
Beimforde C, Feldberg K, Nylinder S, et al. 2014. Estimating the Phanerozoic history of the Ascomycota lineages:combining fossil and molecular data[J]. Molecular Phylogenetics and Evolution, 78: 386-389. DOI:10.1016/j.ympev.2014.04.024 |
Billings S A, Ziegler S E. 2005. Linking microbial activity and soil organic matter transformations in forest soils under elevated CO2[J]. Global Change Biology, 11(2): 203-212. DOI:10.1111/gcb.2005.11.issue-2 |
Beniari E, Amiaud B. 2005. Relationship between plants and soil microbial communities in fertilized grasslands[J]. Soil Biology and Biochemistry, 37(11): 2055-2064. DOI:10.1016/j.soilbio.2005.03.008 |
Gutknecht J L M, Goodman R M, Balser T C. 2006. Linking soil process and microbial ecology in freshwater wetland ecosystems[J]. Plant and Soil, 289(1/2): 17-34. |
Hannula S E, de Boer W, Van Veen J. 2012. A 3-year study reveals that plant growth stage, season and field site affect soil fungal communities while cultivar and GM-Trait have minor efficts[J]. Plos One, 7(4): 833-819. |
Heinemeyer A, Ridgway K P, Edwards E J, et al. 2004. Impact of soil warming and shading on colonization and community structure of arbuscular mycorrhizal fungi in roots of a native grassland community[J]. Global Change Biology, 10(1): 52-64. DOI:10.1111/gcb.2004.10.issue-1 |
Hedlund K. 2002. Soil microbial community structure in relation to vegetation management on former agricultural land[J]. Soil Biology and Biochemistry, 34(9): 1299-1307. DOI:10.1016/S0038-0717(02)00073-1 |
Krause S, Meima F M, He F M, et al. 2013. Spatial patterns of methanotrophic communities along a hydrological gradient in a riparian wetland[J]. FEMS Micobiology Ecology, 86(1): 59-70. DOI:10.1111/fem.2013.86.issue-1 |
Kivlin S N, Hawkes C V. 2016. Tree species, spatial heterogeneity, and seasonality drive soil fungal abundance, richness, and composition in Neotropical rainforests[J]. Environmental Microbiology, 18: 4662-4673. DOI:10.1111/1462-2920.13342 |
Ma L, Huang W, Guo G, et al. 2012. Siol microbial properties and plant growth responses to carbon and water addition in a temperate steppe:the importance of nutrient availabity[J]. PloS One, 7(4): e35165. DOI:10.1371/journal.Pone.0035165 |
Nevarea L, Vasseur V, Lemadec A, et al. 2009. Physiological traits of penicillium glabrum strain afilamentous fungus isolated from bottled aromatized mineral water[J]. International Journal of Food Microbiology, 130(3): 166-171. DOI:10.1016/j.ijfoodmicro.2009.01.013 |
Ogilvie L A, Hirsch P R, Johnston A W B. 2008. Bacterial diversity of the broadbalk 'classical' winter wheat experiment in relation to long-term fertilizer inputs[J]. Microbial Ecology, 56(3): 525-537. DOI:10.1007/s00248-008-9372-0 |
Peralta A L, Matthews J W, Flanagan D N, et al. 2012. Environmental factors at dissimilar spatial scales influence plant and microbial communities in restored[J]. Wetlands, 32(6): 1125-1134. DOI:10.1007/s13157-012-0343-3 |
Rinklebe J, Langer U. 2006. Microbial diversity in three floodplain soils at the Elbe River (Germany)[J]. Soil Biology & Biochemistry, 38(8): 2144-2151. |
Tang Y S, Wang L, Jia J W, et al. 2011. Response of soil microbial community in Jiuduansha wetland to different successional stages and its implications for soil microbial respiration and carbon turnover[J]. Soil Bilolgy and Biochemistry, 43(3): 638-646. DOI:10.1016/j.soilbio.2010.11.035 |
Yang C L, Xiao H A, Wu J S. 2009. Effects of water content on redox potential land carbon mineralization of wetland sediments[J]. Environmental Science, 30(8): 2382-2386. |
Yille D J, Ralph J, Lu F C, et al. 2008. Evidence for cleavage of lignin by a brown rot basidiomycete[J]. Environmental Microbiology, 10(7): 1844-1849. DOI:10.1111/j.1462-2920.2008.01605.x |
 2018, Vol. 54
2018, Vol. 54

