文章信息
- 毛金梅, 翟飞飞, 刘俊祥, 彭向永, 孙振元
- Mao Jinmei, Zhai Feifei, Liu Junxiang, Peng Xiangyong, Sun Zhenyuan
- 硅对蒿柳铅胁迫的调控
- The Regulation of Silicon to Lead Stress in Salix viminalis
- 林业科学, 2018, 54(2): 60-67.
- Scientia Silvae Sinicae, 2018, 54(2): 60-67.
- DOI: 10.11707/j.1001-7488.20180207
-
文章历史
- 收稿日期:2017-11-03
- 修回日期:2017-12-03
-
作者相关文章
2. 新疆林业科学院经济林研究所 乌鲁木齐 830063;
3. 河南理工大学建筑与艺术设计学院 焦作 454000
2. Economic Forest Research Institute Xinjiang Academy of Forestry Urumqi 830063;
3. School of Architectural and Artistic Design, Henan Polytechnic University Jiaozuo 454000
铅(Pb)是环境中普遍存在且危害性较强的重金属之一。近年来,随着经济迅速发展,矿业、农业和废金属再利用等使土壤中Pb浓度明显升高,Pb污染对环境的危害逐渐加剧,对人体健康的影响已成为当前人们关注的热点(Piechalak et al., 2002)。大部分Pb是通过土壤-植物体-人体这一途径进入人体造成危害,土壤中Pb至一定程度会对植物生理代谢产生一系列不利影响,如细胞膜渗透性增加、活性氧积累、膜脂过氧化程度加剧等,严重时甚至会导致植物死亡(Wierzbicka, 1995; Singh et al., 1997; 王焕校, 1999; Reddy et al., 2005)。因此,Pb污染治理已越来越受到国内外学者的关注。传统治理Pb污染的方法一般成本较高、工作量较大,需要设备复杂,而且还会导致土壤结构破坏、生物活性下降和肥力退化等。硅(Si)是地壳中含量第二丰富的元素,对植物的生长发育有益,其不仅可以提高农产品产量和品质,而且还可通过调节植物的生理代谢过程和增强植物体内抗氧化酶系统清除自由基的能力,抑制重金属从植物根系向地上部转移,通过与重金属结合或促使金属与酚类物质螯合,减轻重金属镉(Cd)、铬(Cr)和Pb等对植物体造成的伤害(Liang et al., 2001;2005;2007; Shi et al., 2005a;2005b)。目前,关于Si减轻重金属对植物毒害方面的应用多见于水稻(Oryza sativa)(Shi et al., 2005b; Gu et al., 2011)、大麦(Hordeum vulgare)(Horiguchi et al., 1987; Hodson et al., 1995; Liang et al., 2001)、玉米(Zea mays)(Liang et al., 2005; Cunha et al., 2008; Vaculík et al., 2012)、黄瓜(Cucumis sativus)(Rogalla et al., 2002; Shi et al., 2005a; Feng et al., 2010)、向日葵(Helianthus annuus)和大豆(Glycine max)(Horst et al., 1978; Liang et al., 2007)等大田作物及黑麦草(Lolium perenne)(Jarvis, 1987; 王晨等, 2008)等草本植物,其在减轻重金属对林木伤害中的作用研究较少。
蒿柳(Salix viminalis)为杨柳科柳属(Salix)植物,其生长迅速、生物量大、对重金属累积能力强(Klang-Westin et al., 2003; Mleczek et al., 2010),被广泛用于土壤重金属污染地区的植物修复和生物质能源开发,具有一定的生态和经济价值(周晓星, 2012; Verwijst et al., 2013)。本研究以蒿柳为试材,通过研究Pb胁迫下Si对蒿柳生长及体内Pb分配和转运、膜脂过氧化及渗透调节响应Pb胁迫中的作用,揭示Si缓解蒿柳Pb胁迫的生理机制,为Si在重金属污染土壤的治理方面提供理论依据。
1 材料与方法 1.1 试验材料选取中国林业科学研究院实验基地的蒿柳枝条作插穗,扦插于5 cm×15 cm(直径×高)的营养钵中,栽培基质为石英砂(16~18目)。蒿柳扦插第12天,保留1个枝芽,继续培养。在蒿柳扦插第60天,选取健壮、无病虫害、长势一致的扦插苗,开始以1/2Hoagland营养液(pH 6.0)培养,在营养液培养的第7天进行Pb胁迫处理。期间每2天浇1次营养液,每次至盆底有营养液渗出。营养液配置参照Islam等(2011)方法,组成为:Ca(NO3)2·4H2O 0.5 mmol·L-1,KNO3 2.0 mmol·L-1,NH4NO3 0.1 mmol·L-1,MgSO4 0.2 mmol·L-1,KH2PO4 0.01 mmol·L-1,Fe-EDTA 0.02 mmol·L-1,MnSO4 2.0 μmol·L-1,H3BO3 12 μmol·L-1,ZnSO4 0.5 μmol·L-1,CuSO4 0.2 μmol·L-1,Na2MoO4 0.1 μmol·L-1。每次用0.1 mol·L-1 HCl或0.1 mol·L-1 NaOH调节pH至为6.0。
1.2 试验设计本试验对蒿柳扦插苗(扦插67天)先进行Pb处理,在Pb处理的第10天,换为Si处理30天。Pb浓度设置为0和1.8 mmol·L-1 2个水平,Si浓度设置为0、1.5和5.0 mmol·L-1 3个水平,共设6个处理(表 1)。每处理10盆,每盆1株,完全随机区组试验设计,4次重复。Pb和Si分别以Pb(NO3)2(分析纯)和Na2SiO3·9H2O(分析纯)形式加入营养液中。
|
|
在处理前1天及处理第40天, 用直尺测定株高、用游标卡尺测定地径。
1.3.2 样品采集处理结束后采收,根部和地上部先用自来水冲洗;然后将根部浸于10 mmol·L-1乙二胺四乙酸二钠(Na2-EDTA)溶液中15~ 20 min,以去除根系表面Pb2+;最后用蒸馏水清洗地上部和根部,滤纸吸干多余水分。分开根、茎、叶,一部分鲜样在冰浴上剪碎,称好后液氮速冻,于-20 ℃冰箱保存备用;一部分样品称鲜质量后,于105 ℃烘箱杀青30 min, 再70 ℃烘干至恒质量,对各部分分别称干质量,备用。
1.3.3 植株中Pb含量测定取烘干样品0.500 g于微波马弗炉(CEM phoenix)中充分灰化后,灰分用10 mL王水(VHCL:VHNO3=3:1)消煮至澄清,过滤,去离子水定容至50 mL容量瓶,用原子吸收分光光度计(东西AA-7000)火焰法测定(张晓丽, 2014)。
1.3.4 生理指标测定细胞膜透性测定采用电导率法;丙二醛(MDA)含量测定采用硫代巴比妥酸(TBA)法;超氧阴离子自由基(O2·-)产生速率测定采用羟胺氧化法;脯氨酸(Pro)含量测定采用磺基水杨酸法;可溶性蛋白(SP)含量测定用考马斯亮蓝G-250法(高俊凤,2006)。
1.4 数据处理数据采用Excel 2003软件;将试验数据进行平均值和标准差统计分析,统计检验采用SPSS 19.0软件,显著性差异水平为P≤0.05;制图采用Sigmaplot 12.5软件。
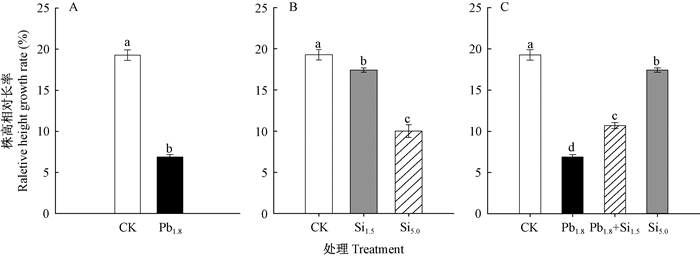
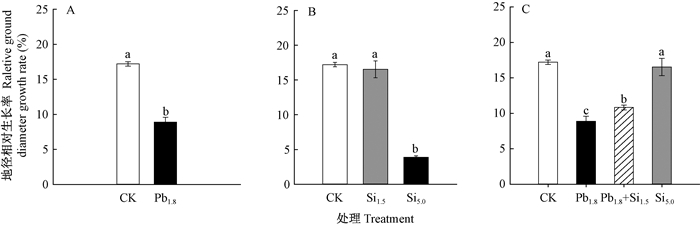
2 结果与分析 2.1 Pb胁迫下Si对蒿柳生长的影响Pb胁迫下Si对蒿柳株高相对生长率影响见图 1。CK株高相对生长率为19.28%,Pb1.8处理为6.89%,二者相比,Pb1.8处理蒿柳株高相对生长率降低了64.29%,差异显著(P < 0.05)(图 1A)。通过比较1.5和5.0 mmol·L-12种Si浓度下蒿柳株高相对生长率可知,Si1.5和Si5.0处理蒿柳株高相对生长率分别为17.43%和10.01%,比CK分别减少9.61%和48.09%,且差异显著(P < 0.05)(图 1B)。与Pb1.8处理相比,Pb1.8+Si1.5处理(1.8 mmol·L-1 Pb胁迫10天后再施用1.5 mmol·L-1 Si处理30天)蒿柳株高相对生长率上升为10.70%,增长了55.42%,差异显著(P < 0.05)(图 1C)。各处理蒿柳地径相对生长率的变化与株高变化相同。Pb1.8处理蒿柳地径相对生长率降低为8.90%,与CK(17.20%)相比,降低了48.28%,差异显著(P < 0.05) (图 2A);而Pb1.8+Si1.5处理蒿柳地径相对生长率为10.39%,与Pb 1.8处理(8.90%)相比,差异显著(P < 0.05)(图 2C);与CK相比,Si1.5处理地径相对生长率无显著差异(P < 0.05),而Si5.0处理蒿柳地径相对生长率远远低于CK,降低了77.36%,差异显著(P < 0.05)(图 2B)。
|
图 1 Pb胁迫10天后Si处理下蒿柳株高相对生长率的变化 Figure 1 The change of relative height growth rate in S. viminalis under Si cultivation after Pb stress for 10 days 数据为4次重复的平均值±标准误。小写字母相同,表示各处理间无显著差异(P > 0.05)。小写字母不同,表示各处理间有显著差异(P < 0.05);下同。 Data are the mean ± stand error of 4 replicates. Identical small letters indicate no significant difference in treatments(P > 0.05); different small letters indicate significant difference between treatments(P < 0.05). The same below. |
|
图 2 Pb胁迫10天后Si处理下蒿柳地径相对生长率的变化 Figure 2 The change of relative ground diameter growth rate in S. viminalis under Si cultivation after Pb stress for 10 days |
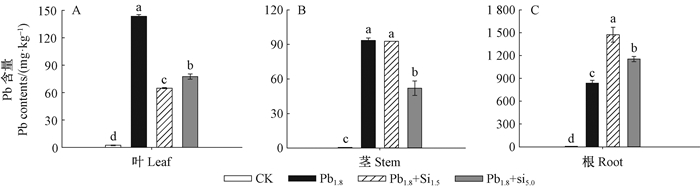
各处理蒿柳体内Pb含量的变化如图 3。从组织器官分析,Pb在蒿柳体内的分布按含量多少依次为根﹥叶﹥茎,且根Pb含量是地上部的3.56~8.33倍。与Pb1.8处理相比,Pb 1.8 +Si1.5和Pb1.8+Si5.0处理蒿柳叶部Pb含量大大降低(图 3A),分别减少90.92%和71.03%;而根Pb含量显著增高(图 3C),分别增大63.93%和28.68%(P < 0.05);茎部Pb含量表现略有不同(图 3B)。从各处理蒿柳总Pb含量分析,Pb 1.8处理蒿柳总Pb含量为1 163.10 mg·kg-1,与之相比,Pb1.8+Si1.5和Pb1.8+Si5.0处理分别为1 667.36和1 316.15 mg·kg-1,总Pb含量提高了43.36%和13.16%。
|
图 3 Pb胁迫10天后Si处理下蒿柳叶、茎、根Pb含量的变化 Figure 3 The change of Pb contents in S. viminalis leaf, stem and root under Si cultivation after Pb stress for 10 days |
由表 2可知,植物具有自身的解毒机制,Pb1.8处理蒿柳Pb含量82.92%分布在根部,17.08%分布在地上部。Pb胁迫后施用Si可降低蒿柳地上部Pb分布比例,显著增加根Pb分布比例。如Pb1.8+Si1.5和Pb1.8+Si5.0处理,蒿柳根Pb分布比例分别为91.81%和90.78%,而地上部仅为8.19%和9.22%,Pb胁迫后施用Si降低了Pb向地上部的转运能力。Pb1.8处理蒿柳叶和茎Pb转运系数分别为0.19和0.11,与之相比,Pb1.8+Si1.5处理(Pb1.8+Si5.0处理)蒿柳Pb转运系数显著降低68.42%(63.16%)和54.55%(45.45%)。
|
|
Pb胁迫10天后Si处理下蒿柳叶、根相对电导率的变化见表 3。各处理蒿柳叶、根相对电导率的变化趋势相近,且根相对电导率略大。Pb1.8处理蒿柳叶相对电导率为32.32%,CK为27.60% (P < 0.05);与Pb1.8处理相比,Pb1.8+Si1.5处理叶相对电导率显著降低为28.53%(P < 0.05);Pb1.8+Si5.0处理则无显著差异(P > 0.05)。Pb1.8处理蒿柳根相对电导率升高为44.83%,CK为38.86% (P < 0.05);与Pb1.8处理相比,Pb1.8+Si1.5处理显著降低了根相对电导率,降为36.92%(P < 0.05);Pb1.8+Si5.0处理根相对电导率无显著差异(P > 0.05)。与CK相比,Si5.0处理显著增大了蒿柳叶、根相对电导率(29.04%和40.66%)(P < 0.05)。
|
|
由表 4可知,Pb1.8处理叶O2·-产生速率为85.96 μg·g-1 FW,与CK相比升高了77.46%(P < 0.05);与Pb 1.8处理相比,Pb1.8+Si1.5处理叶O2·-产生速率降低为50.47 μg·g-1 FW(P < 0.05);Pb1.8+Si5.0处理O2·-产生速率则无显著差异。与CK相比,Si5.0处理O2·-产生速率升高了66.97%(P < 0.05)。Pb 1.8处理蒿柳根O2·-产生速率为67.68 μg·g-1 FW,与CK相比升高了62.73%(P < 0.05)。与Pb1.8处理相比,Pb1.8+Si1.5处理与Pb1.8+Si5.0处理蒿柳根O2·-产生速率无显著差异(P > 0.05)。
|
|
Pb胁迫10天后Si处理下蒿柳叶MDA含量处理间存在差异,但不显著。各处理蒿柳根MDA含量变化结果显示,Pb1.8处理下,根MDA含量为14.36 nmol·g-1 FW,与CK相比升高了89.20% (P < 0.05)。与Pb1.8相比,Pb1.8+Si1.5处理根MDA含量降低,且差异显著(P < 0.05);Pb1.8+Si5.0处理也表现降低,差异显著(P < 0.05)。与CK相比,Si5.0处理根MDA含量无显著差异(P > 0.05)。
2.5 Pb胁迫下Si对蒿柳渗透调节物质含量的影响由表 5可知,Pb 1.8处理大大增加了蒿柳叶Pro含量,与CK相比升高了114.2%(P < 0.05);与Pb1.8相比,Pb 1.8+Si1.5处理与Pb1.8+Si5.0处理叶Pro含量降低,但无显著差异(P > 0.05)。与CK相比,Si5.0处理Pro含量升高了85.18%(P < 0.05)。Pb 1.8处理蒿柳根Pro含量与CK相比,升高了107.11%(P < 0.05)。与Pb1.8相比,Pb 1.8 +Si1.5处理根Pro含量降低(P < 0.05),Pb1.8+Si5.0处理根Pro含量无显著差异(P > 0.05)。Si5.0处理与CK相比,根Pro含量无显著差异(P > 0.05)。
|
|
Pb1.8处理叶SP含量为6.70 mg·g-1 FW,与CK相比升高了70.48%(P < 0.05);与Pb 1.8相比,Pb1.8+Si1.5处理根SP含量虽有降低,但差异不显著(P > 0.05);Pb1.8+Si5.0处理根SP含量降低且差异显著(P < 0.05)。与CK相比,Si处理中SP含量无显著差异(P > 0.05)。各处理蒿柳根SP含量无显著差异。
3 讨论 3.1 Si缓解Pb对蒿柳的生长抑制Pb是植物生长的一种非必需元素,进入到植物体内对不同植物产生的效应不同。许多研究表明,低浓度的Pb能刺激植物生长,中浓度的Pb可引起植物代谢失调,抑制生长, 重浓度的Pb则会造成植物死亡(闵焕等, 2010; 房娟;2011),而Si可以减轻重金属对植物的生长抑制(白宝璋等, 1994; 陈怀满, 1996;宋阿琳, 2009)。本研究中,Pb显著降低了蒿柳株高和地径的相对生长速率;Pb胁迫后施用Si可减轻Pb对蒿柳株高和地径生长的抑制作用,这与前人研究结果一致。李云(2011)通过盆栽试验得出,当土壤Pb含量低于250 mg·kg-1时,对生姜(Zingiber officinale)生长无显著影响,而当Pb含量达500和1 000 mg·kg-1时,生姜单株产量分别比对照降低18.06%和33.25%;土壤施Si肥后,明显促进生姜生长,提高产量,降低Pb在生姜根茎中的积累。Vaculík等(2012)研究表明,Si可促进Cd处理下玉米幼苗的生长。
3.2 Si抑制Pb向蒿柳地上部转运本研究Pb处理和Pb+Si处理,外源Pb加入的浓度和体积相同,但Pb+Si处理蒿柳总Pb量比Pb处理增大13.16%~43.36%,表明Si提高了蒿柳体内的总Pb量,使更多的Pb滞留在蒿柳体内,抑制了Pb向蒿柳体外排放,这与李云(2011)研究的生姜、Li等(2012)研究的香蕉(Musa paradisiaca)结果不同;同时,Si显著降低了蒿柳地上部Pb含量,增大了根Pb含量(增加28.68%~ 63.93%),说明Si抑制了Pb向地上部转移(Shi et al., 2005b; Liang et al., 2007)。这可能是Si减轻Pb胁迫的机制之一。Vaculík等(2012)研究认为,Si影响玉米根部凯氏带和木栓质片层以及维管组织的形成。Liang等(2007)发现,在Cd胁迫下,与不施用Si植物相比,施用Si植物的更多Cd被绑定到根系细胞壁,少量的Cd分布在细胞液或共质体中,这表明Si的解毒作用使大量Cd进入根系质外体。Shi等(2005b)认为,Si能减少Cd由水稻地下部向地上部迁移,解毒原因可能是水稻体内Si结合蛋白通过诱导Si在水稻根的内皮层和纤维层细胞附近沉积,进而阻塞细胞壁孔隙度,影响Cd向地上部的质外体运输。产生这种解毒机制的原因因不同的植物种类,甚至同一品种不同基因型,Si缓解重金属毒害的机制而各有不同。
3.3 Si调控蒿柳生理代谢过程在正常情况下,细胞内自由基的产生与清除处于动态平衡状态,外源Pb2+进入植物体后,浓度达到一定程度时,则会打破这种动态平衡,造成膜脂过氧化和渗透胁迫(Hodson et al., 1995)。研究表明,Si参与植物的新陈代谢、生理过程或结构组成,影响植物抗氧化酶活性,提高植物对金属的耐性(Iwasaki et al., 2002a; 2002b)。本研究结果也显示, Pb胁迫下,蒿柳叶、根中细胞膜相对透性增大,O2·-产生速率和MDA含量升高,造成了蒿柳体内膜脂过氧化。Pb1.8+Si1.5处理蒿柳相对电导率、叶O2·-产生速率及根系MDA含量和Pro含量降低,1.5 mmol·L-1 Si一定程度上缓解了Pb胁迫对蒿柳造成的膜脂过氧化伤害;Pb胁迫后,施入5.0 mmol·L-1 Si减轻Pb伤害作用不显著。分析其原因,一方面可能由于Si浓度较高引起(李淑仪等, 2008; 刘缓, 2014; 苟梓希等, 2015),另一方面也可能由于砂培对矿质元素的吸附和缓冲能力弱于土壤所致。这表明Si可减轻Pb对蒿柳的毒害,但Si的调节作用有一定的阈值范围。
4 结论本研究通过对Si调控下受Pb胁迫的蒿柳生长指标、膜脂过氧化指标及体内Pb分布和转运变化等分析,得出Si缓解Pb毒害的主要原因是Si可降低蒿柳体内的膜脂过氧化,减少Pb从根向地上部转移,同时,Si可提高蒿柳体内的总Pb量,抑制Pb向蒿柳体外排放,这些特性为Si在重金属污染土壤的治理方面提供了理论依据。但由于本研究采用砂培试验,砂砾的吸附作用及对扩散的阻挡作用与土壤介质有很大不同,加上Si浓度在不同植物不同土壤条件下反应会有所不同,因此,在重金属污染土壤的治理方面还需要对Si做进一步研究与实践检验。
白宝璋, 张宪政. 1994. 植物生理学[J]. 北京:中国科学技术出版社, 43. (Bai B Z, Zhang X Z. 1994. Plant physiology[J]. Beijing:Science and Technology of China Press, 43. [in Chinese]) |
陈怀满. 1996. 土壤-植物系统中的重金属污染[M]. 北京: 科学出版社. (Chen H M. 1996. Heavy metal pollution in the soil-plant system[M]. Beijing: Science Press. [in Chinese]) |
房娟. 2011. 柳树对铅污染的生理、生长响应及吸收特性. 南京: 南京林业大学硕士学位论文. (Fang J. 2011. Studies on the characteristics of uptake and physiological effeets of lead stress on Salix growth. Nanjing: MS thesis of Nanjing Forestry University. [in Chinese]) http://cdmd.cnki.com.cn/Article/CDMD-10298-1011401549.htm |
高俊凤. 2006. 植物生理学实验指导[M]. 北京: 高等教育出版社: 142-143, 208-231. (Gao J F. 2006. Plant physiology experiment instruction[M]. Beijing: Higher Education Press: 142-143, 208-231. [in Chinese]) |
苟梓希, 李云成, 谢采芸, 等. 2015. 工业酿酒酵母菌株KF-7对发酵抑制物的耐受性[J]. 应用与环境生物学报, 21(2): 248-255. (Gou Z X, Li Y C, Xie C Y, et al. 2015. Evaluation of the inhibitor-tolerance of industrial Saccharomyces cerevisiae strain KF-7[J]. Chinese Journal of Applied and Environmental Biology, 21(2): 248-255. [in Chinese]) |
李淑仪, 林翠兰, 许建光, 等. 2008. 施硅对污染土壤中铬形态及其生物有效性的影响[J]. 生态环境, 17(1): 227-231. (Li S Y, Lin C L, Xu J G, et al. 2008. The influence of silicon on chromium form and biological effectiveness in contaminated soil[J]. Ecology and Environment, 17(1): 227-231. [in Chinese]) |
李云. 2011. 生姜铅胁迫及硅缓解效应研究. 泰安: 山东农业大学硕士学位论文. (Li Y. 2011. Effect of lead stress and silicon alleviation on Ginger. Tai'an: MS thesis of Shandong Agricultural University. [in Chinese]) http://cdmd.cnki.com.cn/Article/CDMD-10434-1011097858.htm |
刘缓. 2014. 硅对水培黄瓜生理特性和营养品质的影响. 杨凌: 西北农林科技大学硕士学位论文. (Liu H. 2014. Effects of silicon nutrition on physiological characteristics and fruit quality of cucumber. Yangling: MS thesis of Northwest Agriculture & Forestry University. [in Chinese]) http://cdmd.cnki.com.cn/Article/CDMD-10712-1014420315.htm |
闵焕, 祖艳群, 李元. 2010. Pb胁迫对圆叶无心菜(Arenaria rotumdifolia Bieberstein)生长和生理特征的影响[J]. 农业环境科学学报, 29(Sup.): 15-19. (Min H, Zu Y Q, Li Y. 2010. Effects of Pb on the growth and physiological characteristics of Arenaria rotumdifolia Bieberstein[J]. Journal of Agro-Environment Science, 29(sup.): 15-19. [in Chinese]) |
宋阿琳. 2009. 小白菜对镉胁迫的响应及硅缓解镉毒害的机制. 南京: 南京农业大学博士学位论文. (Song A L. 2009. Responses of Brassica chinensis L. to cadmium stress and silicon-alleviated cadmium toxicity. Nanjing: PhD thesis of Nanjing Agricultural University. [in Chinese]) http://cdmd.cnki.com.cn/article/cdmd-10307-2010173938.htm |
王晨, 王海燕, 赵琨, 等. 2008. 硅对镉、锌、铅复合污染土壤中黑麦草生理生化性质的影响[J]. 生态环境, 17(6): 22-40. (Wang C, Wang H Y, Zhao K, et al. 2008. The influence of silicon on ryegrass physiological and biochemical properties in zinc, cadmium, lead compound contaminated soil[J]. Ecology and Environment, 17(06): 22-40. [in Chinese]) |
王焕校. 1999. 污染生态学[M]. 北京: 高等教育出版社: 44. (Wang H X. 1999. Pollution ecology[M]. Beijing: Higher Education Press: 44. [in Chinese]) |
周晓星. 2012. 柳属植物对重金属镉胁迫的生长与生理响应. 北京: 中国林业科学研究院博士学位论文. (Zhou X X. 2012. Growth and physiological responses of Salix to cadmium stress. Beijing: PhD thesis of Chinese Academy of Forestry. [in Chinese]) http://cdmd.cnki.com.cn/Article/CDMD-82201-1012423737.htm |
张晓丽. 2014. 柳树无性系对镉的吸收分配特性及其解毒机制. 北京: 中国林业科学研究院博士学位论文. (Zhang X L. 2014. The characteristic of absorption, accumulation and detoxification mechanism of Willow clones under Cd2+ stress. Beijing: PhD thesis of Chinese Academy of Forestry. [in Chinese]) http://cdmd.cnki.com.cn/Article/CDMD-82201-1014331868.htm |
Cunha K, Nascimento C, Silva A. 2008. Silicon alleviates the toxicity of cadmium and zinc for maize (Zea mays L.) grown on a contaminated soil[J]. Journal of Plant Nutrition and Soil Science, 171(6): 849-853. DOI:10.1002/jpln.v171:6 |
Feng J, Shi Q, Wang X, et al. 2010. Silicon supplementation ameliorated the inhibition of photosynthesis and nitrate metabolism by cadmium(Cd) toxicity in Cucumis sativus L[J]. Scientia Horticulturae, 123(4): 521-530. DOI:10.1016/j.scienta.2009.10.013 |
Gu H H, Qiu H, Tian T, et al. 2011. Mitigation effects of silicon rich amendments on heavy metal accumulation in rice (Oryza sativa L.) planted on multi-metal contaminated acidic soil[J]. Chemosphere, 83(9): 1234-1240. DOI:10.1016/j.chemosphere.2011.03.014 |
Hodson M J, Evans D E. 1995. Aluminium/silicon interactions in higher plants[J]. Journal of Experimental Botany, 46(2): 161-171. DOI:10.1093/jxb/46.2.161 |
Horiguchi T, Morita S. 1987. Mechanism of manganese toxicity and tolerance of plants Ⅵ. effect of silicon on alleviation of manganese toxicity of barley[J]. Journal of Plant Nutrition, 10(17): 2299-2310. DOI:10.1080/01904168709363778 |
Horst W J, Marschner H. 1978. Effect of silicon on manganese tolerance of bean plants (Phaseolus vulgaris L.)[J]. Plant and Soil, 50(1/3): 287-303. |
Islam E, Liu D, Li T, et al. 2011. Effect of Pb toxicity on the growth and physiology of two ecotypes of Elsholtzia argyi and its alleviation by Zn[J]. Environmental Toxicology, 26(4): 403-416. DOI:10.1002/tox.v26.4 |
Iwasaki K, Maier P, Fecht M, et al. 2002a. Effects of silicon supply on apoplastic manganese concentrations in leaves and their relation to manganese tolerance in cowpea (Vigna unguiculata (L.) Walp.)[J]. Plant and Soil, 238(2): 281-288. DOI:10.1023/A:1014482911196 |
Iwasaki K, Maier P, Fecht M, et al. 2002b. Leaf apoplastic silicon enhances manganese tolerance of cowpea (Vigna unguiculata)[J]. Journal of Plant Physiology, 159(2): 167-173. DOI:10.1078/0176-1617-00691 |
Jarvis S C. 1987. The uptake and transport of silicon by perennial ryegrass and wheat[J]. Plant and Soil, 97(3): 429-437. DOI:10.1007/BF02383233 |
Klang-Westin E, Eriksson J. 2003. Potential of Salix as phytoextractor for Cd on moderately contaminated soils[J]. Plant and Soil, 249: 127-137. DOI:10.1023/A:1022585404481 |
Li L, Zheng C, Fu Y, et al. 2012. Silicate-mediated alleviation of Pb toxicity in banana grown in Pb-contaminated soil[J]. Biological Trace Element Research, 145(1): 101-108. DOI:10.1007/s12011-011-9165-z |
Liang Y C, Sun W C, Zhu Y G, et al. 2007. Mechanisms of silicon-mediated alleviation of abiotic stresses in higher plants:a review[J]. Environment Pollution, 147(2): 422-428. DOI:10.1016/j.envpol.2006.06.008 |
Liang Y C, Wong J W C, Wei L. 2005. Silicon-mediated enhancement of cadmium tolerance in maize (Zea mays L.) grown in cadmium contaminated soil[J]. Chemosphere, 58(4): 475-483. DOI:10.1016/j.chemosphere.2004.09.034 |
Liang Y C, Yang C G, Shi H H. 2001. Effects of silicon on growth and mineral composition of barley grown under toxic levels of aluminum[J]. Journal of Plant Nutrion, 24(2): 229-243. DOI:10.1081/PLN-100001384 |
Mleczek M, Rutkowski P, Rissmann I, et al. 2010. Biomass productivity and phytoremediation potential of Salix alba and Salix viminalis[J]. Biomass and Bioenergy, 34(9): 1410-1418. DOI:10.1016/j.biombioe.2010.04.012 |
Piechalak A, Tomaszewska B, Baralkiewicz D, et al. 2002. Accumulation and detoxification of lead ions in legumes[J]. Phytochemistry, 60(2): 153-162. DOI:10.1016/S0031-9422(02)00067-5 |
Reddy A M, Kumar S G, Jyothsnakumari G, et al. 2005. Lead induced changes in antioxidant metabolism of Horsegram (Macrotyloma uniflorum (Lam.) Verdc.) and bengalgram (Cicer arietinum L.)[J]. Chemosphere, 60(1): 97-104. DOI:10.1016/j.chemosphere.2004.11.092 |
Rogalla H, Römheld V. 2002. Role of leaf apoplast in silicon-mediated manganese tolerance of Cucumis sativus L[J]. Plant, Cell & Environment, 25(4): 549-555. |
Shi Q H, Bao Z Y, Zhu Z J, et al. 2005a. Silicon-mediated alleviation of Mn toxicity in Cucumis sativus in relation to activities of superoxide dismutase and ascorbate peroxidase[J]. Phytochemistry, 66(13): 1551-1559. DOI:10.1016/j.phytochem.2005.05.006 |
Shi X H, Zhang C C, Wang H, et al. 2005b. Effect of Si on the distribution of Cd in rice seedlings[J]. Plant and Soil, 272(1/2): 53-60. |
Singh R P, Tripathi R D, Sinha S K, et al. 1997. Response of higher plants to lead contaminated environment[J]. Chemosphere, 34(1): 2467-2493. |
Vaculík M, Landberg T, Greger M, et al. 2012. Silicon modifies root anatomy, and uptake and subcellular distribution of cadmium in young maize plants[J]. Annals of Botany, 110(2): 433-443. DOI:10.1093/aob/mcs039 |
Verwijst T, Lundkvist A, Edelfeldt S, et al. 2013. Development of sustainable willow short rotation forestry in northern Europe. Biomass Now-Sustainable Growth and Use, 479-502.
|
Wierzbicka M. 1995. How lead loses its toxicity to plants[J]. Acta Societatis Botanicorum Poloniae, 64(1): 81-90. |
 2018, Vol. 54
2018, Vol. 54

