文章信息
- 李建波, 贾会霞, 张进, 刘伯斌, 胡建军, 王丽娟, 卢孟柱
- Li Jianbo, Jia Huixia, Zhang Jin, Liu Bobin, Hu Jianjun, Wang Lijuan, Lu Mengzhu
- 毛白杨PtoWOX4a基因过表达对次生生长的影响
- Effect of Overexpression of Populus tomentosa WUSCHEL-related homeobox 4 (PtoWOX4a) on the Secondary Growth of Poplar
- 林业科学, 2018, 54(2): 52-59.
- Scientia Silvae Sinicae, 2018, 54(2): 52-59.
- DOI: 10.11707/j.1001-7488.20180206
-
文章历史
- 收稿日期:2017-05-03
- 修回日期:2017-08-08
-
作者相关文章
2. 中国林业科学研究院华北林业实验中心 北京 102300
2. Experimental Center of Forestry in North China, Chinese Academy of Forestry Beijing 102300
WUSCHEL-related homeobox(WOX)转录因子家族是植物特有的一类转录因子,属于Homeobox(HB)超家族,其成员均含有同源异形结构域(Homeodomain,HD),典型HD由60个氨基酸组成(van der Graaff et al., 2009)。研究指出WOX基因在植物生长发育中起着重要的调控作用,主要参与侧生器官发育、离体组织器官的不定根再生以及植物干细胞的维持等过程(Dolzblasz et al., 2016; Liu et al., 2014a; Mayer et al., 1998; Richards et al., 2015)。
拟南芥(Arabidopsis thaliana)AtWOX家族含有15个成员,分别是WUS和WOX1-14。根据进化关系可将AtWOX成员分为3个进化分支:现代/WUS型分枝(Modern/WUS clade),包括AtWUS、AtWOX1-7;中间型分枝(Intermediate clade),包括AtWOX8-9、AtWOX11-12;古老型分枝(Ancient clade),包括AtWOX10、AtWOX13-14。现代/WUS型分枝进化出现相对较晚,其成员(除AtWOX7外)均含有完整WUS-box(TLxLFPxx)结构域(Lin et al., 2013; Tadege et al., 2011; van der Graaff et al., 2009)。其中,研究发现AtWOX4在拟南芥根、叶片和茎维管组织的形成层区域均有表达(Hirakawa et al., 2010)。AtWOX4在形成层细胞的维持中发挥作用,受到CLECLAVATA3/ESR LIKE(CLE)家族成员CLE41分泌蛋白TRACHEARY ELEMENT DIFFERENTIATION INHIBITORY FACTOR(TDIF)与PHLOEM INTERCALATED WITH XYLEM(PXY)蛋白复合体的正调控(Etchells et al., 2013; Hirakawa et al., 2010),且与AtWOX14存在功能冗余(Etchells et al., 2013)。AtWOX4-RNAi转基因植株变矮,维管组织中未分化的组织出现积累,分化产生的木质部、韧皮部以及纤维细胞减少(Ji et al., 2010)。而在过表达AtWOX4植株中,根伸长受到抑制且失去向地性,同时根顶端分生组织膨大(Hirakawa et al., 2010)。番茄(Solanum lycopersicum)SlWOX4具有与AtWOX4相似的表达模式,主要在维管系统中表达(Ji et al., 2010)。过表达SlWOX4导致了木质部和韧皮部细胞的大量积累,非维管组织细胞的排列出现混乱(Ji et al., 2010; Wang et al., 2013)。在水稻(Oryza sativa)中,OsWOX4在顶端分生组织、腋分生组织和叶原基中均有表达,受到CLE家族成员FLORAL ORGAN NUMBER1(FON1)和FON2的负调控(Ohmori et al., 2013)。OsWOX4表达量受到抑制时,植株茎顶端分生组织变小且分化提前终止;在高浓度细胞分裂素培养条件下,过表达OsWOX4抑制了愈伤组织向不定芽分化,说明了水稻OsWOX4在茎顶端分生组织干细胞的维持中发挥作用,且与细胞分裂素相互作用(Ohmori et al., 2013)。综上所述,WOX4基因在植物的生长发育中发挥了重要作用,然而,不同物种WOX4基因表达模式和功能上存在差异。
木本模式植物杨树(Populus)是我国广泛栽培的树种之一,是重要的用材、能源和防护树种(胡建军等,2010)。研究与杨树生长发育相关的基因功能对提高林木产量和品质有重要的理论意义和广阔的应用前景。研究发现毛白杨(Populus tomentosa)中含有18个WOX基因成员,其中PtoWOX4a(GenBank编号:KF982703)在根、茎和叶片中均有表达,在根中的表达主要集中在根中柱和根尖区域,不定根再生过程中PtoWOX4a表达量明显增加,过表达PtoWOX4a能够促进不定根发生,增加不定根数目(Liu et al., 2014b)。但是,过表达PtoWOX4a对不定根形态,以及茎和叶片发育的影响并不清楚。因此,本研究以PtoWOX4a为研究对象,对其表达模式和过表达植株的表型进行分析,揭示PtoWOX4a在杨树不定根、茎和叶片发育中的作用。
1 材料与方法 1.1 试验材料与药品试剂银腺杨无性系84 K(Populus alba×P. glandulosa),p35S∷PtoWOX4a和pPtoWOX4a∷GUS转基因植株由中国林业科学研究院林木遗传育种国家重点实验室保存并繁殖。p35S∷PtoWOX4a和pPtoWOX4a∷GUS分别得到34株和32株转基因株系;其中p35S∷PtoWOX4a转基因植株中,至少20个株系表型相似,选取其中PtoWOX4a表达量较高的株系(#6和#16)做进一步分析;pPtoWOX4a∷GUS转基因植株中,至少20个株系具有相同的染色结果。组培条件:温度23~25℃,光照周期为16 h/8 h(光照/黑暗)。毛白杨不同组织,包括茎顶端分生组织、幼叶、成熟叶、嫩茎、老茎和根,取自1年生毛白杨植株;木质部和韧皮部取自毛白杨成年树。
1.2 RNA提取、cDNA合成及定量表达分析采用RNeasy Plant Kit(QIAGEN)试剂盒进行RNA提取,SuperScript Ⅲ First-Strand Synthesis System(Invitrogen)反转录试剂盒进行cDNA合成,详细步骤参照试剂盒说明。定量PCR引物用在线Primer3软件(http://bioinfo.ut.ee/primer3-0.4.0/primer3/)进行设计,引物GC含量在45%~55%之间,退火温度在60~65 ℃,扩增片段长度在130~200 bp之间。引物在Invitrogen公司合成,引物序列见表 1。定量PCR试剂为SYBR Premix Ex TaqTM Ⅱ Kit,使用LightCycler 480(Roche,Germany)进行定量分析,反应体系20 μL:2×SYBR Premix 10 μL,正向引物0.8 μL,反向引物0.8 μL,cDNA模板2 μL,ddH2O 6.4 μL。定量程序:95 ℃ 5 min;扩增45个循环(95 ℃ 20 s,58 ℃ 4 s,72 ℃ 20 s);72 ℃ 5 min。试验进行了3次生物学重复和4次技术重复。选择肌动蛋白基因PtoACTIN作为内参用于计算检测基因的相对表达量。
|
|
对pPtoWOX4a∷GUS转基因组培苗进行染色(Liu et al., 2014b),具体步骤如下:将材料置于90%的预冷丙酮中固定30 min;固定后的材料用GUS缓冲液[50 mmol·L-1NaPO4(pH7.0), 2 mmol·L-1 K3 Fe(CN)6,2 mmol·L-1 K4Fe(CN)6,10 mmol·L-1 EDTA,0.1%(V/V)Triton X-100]浸洗数次,去除残留的丙酮;然后将材料转移到GUS染色液(GUS缓冲液+1 mmol·L-1 X-Gluc)中,真空抽气15 min,重复3次,每次停歇10 min,待材料全部沉入液体底部或者没有气泡产生为止;抽气结束后将材料置于温度为37 ℃、转速为80 r·min-1的培养箱中染色过夜;染色结束后,倒掉染色液并用75%乙醇进行脱色。
1.4 组织切片分析选取3周苗龄植株中距离根尖0.5 cm处的不定根、3月苗龄植株的第10节间茎段和第6片叶片中间主叶脉做解剖结构分析。将材料浸泡于FAA试剂中抽气固定。参照张利等(2016)的试验方法,对材料进行包埋聚合;聚合后的材料用徕卡Leica M205 FA超薄切片机进行切片,切片厚度为3 μm;展片结束后,用TBO(质量分数为0.05%)对切片于30 ℃染色3 min,染色结束后用去离子水进行多次冲洗;最后用蔡司Zeiss Axio Imager. A1显微镜进行切片的观察和拍照。
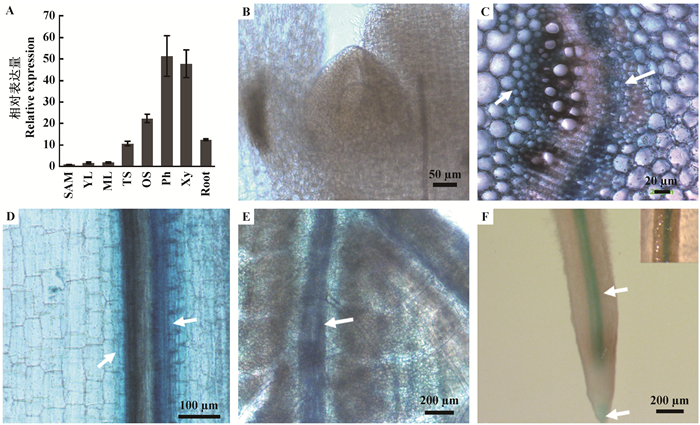
2 结果与分析 2.1 PtoWOX4a组织表达分析前期研究发现,PtoWOX4a在根、茎和叶片中都有表达(Liu et al., 2014b),但对其表达模式的研究并不全面。本研究对毛白杨茎顶端分生组织、幼叶、成熟叶、嫩茎、老茎、木质部、韧皮部和根等组织中PtoWOX4a的表达水平进行系统分析。qRT-PCR结果显示,PtoWOX4a基因在茎中高丰度表达,主要集中在韧皮部和木质部区域;其次在根中表达,在叶片和茎顶端分生组织中的表达较弱(图 1A)。选取pPtoWOX4a∷GUS转基因植株进行染色,检测转基因植株染色后的GUS信号,对PtoWOX4a的表达模式进行进一步研究。结果显示,pPtoWOX4a∷GUS转基因植株茎顶端分生组织区域无GUS信号(图 1B);茎段的横切片和纵切片都能观察到较强的GUS信号,且信号主要集中在木质部和韧皮部区域,而在形成层区域的表达较弱(图 1C,D);在叶片的叶脉中(图 1E)也能观察到较为明显的GUS信号;在根中GUS信号集中在根部中柱区域,在根尖区域也出现较弱的GUS信号(图 1F)。上述结果表明,PtoWOX4a主要在杨树根、茎和叶片的维管组织区域表达。
|
图 1 PtoWOX4a的表达模式 Figure 1 Expression patterns of PtoWOX4a A.定量检测PtoWOX4a在不同组织中的表达(SAM:茎顶端分生组织;YL:幼叶; ML:成熟叶; TS:嫩茎; OS:老茎; Ph:韧皮部; Xy:木质部; Root:根。PtoWOX4a在YL中的表达设为1);B.在茎尖顶端分生组织中的GUS活性;C, D.在茎横切面(C)和纵切面(D)中的GUS活性;E.在叶片中的GUS活性;F.在根中的GUS活性。箭头表示GUS信号。 A. Expression pattern of PtoWOX4a measured using qRT-PCR (SAM: Shoot apical meristem; YL: Young leaf; ML: Mature leaf; TS: Tender stem; OS: Old stem; Ph: Phloem; Xy: Xylem. The expression of PtoWOX4a in leaf was set to 1); B. GUS activity in shoot apical meristem; C, D. GUS activity in transverse section (C) and longitudinal (D) of stem; E. GUS activity in leaf; F. GUS activity in root. Arrows indicates the GUS signal. |
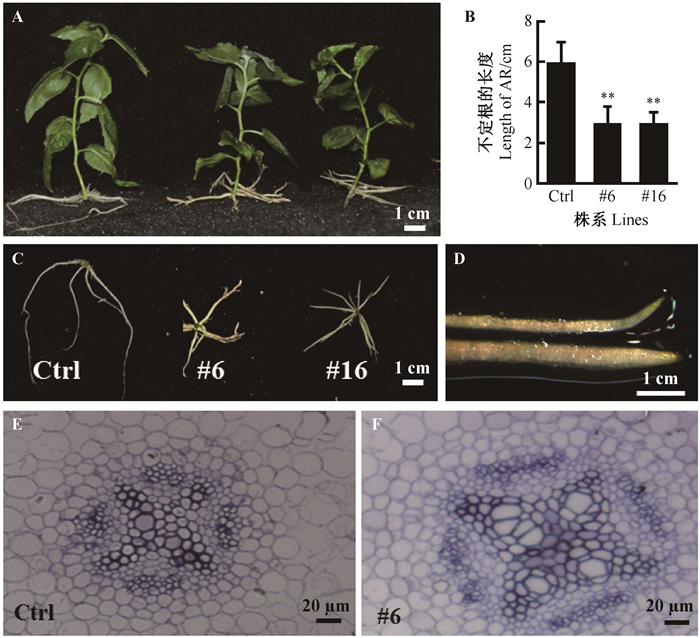
前期研究发现,过表达PtoWOX4a促进了杨树不定根的发生,但是没有对不定根的形态进行分析(Liu et al., 2014b)。因此,本研究对过表达PtoWOX4a转基因材料中表达丰度较高的2个转基因株系#6和#16做进一步表型观察(图 2)。对3周苗龄的过表达PtoWOX4a转基因植株和对照植株进行比较分析,结果显示过表达PtoWOX4a植株不定根的长度变短,长度约为3~4 cm,仅为对照植株的1/3~1/2(图 2B,C),但不定根粗度增加(图 2D)。选取距离根尖0.5 cm处的不定根做解剖结构分析,结果显示转基因植株的不定根维管组织明显发达,其中的木质部细胞变大,木质部区域增加(图 2E, F)。上述结果表明,过表达PtoWOX4a抑制了不定根伸长,但促进了不定根的径向生长。
|
图 2 过表达PtoWOX4a影响不定根的形态 Figure 2 Overexpression of PtoWOX4a affects the adventitious root (AR) morphology A. 3周苗龄对照植株(Ctrl)与过表达PtoWOX4a植株(#6,#16)的形态;B, C.不定根长度的比较;D.不定根的形态;E, F.距离根尖0.5 cm区域的不定根横向切片。t检验P值用星号表示:**,P < 0.01。 A. Comparison of 3-week-old seedlings between the control(Ctrl) and the PtoWOX4a-overexpression plants(#6, #16); B, C. Comparison of AR length between Ctrl and the PtoWOX4a-overexpression plants; D. Morphology of AR of Ctrl and PtoWOX4a-overexpression plants; E, F. Transverse sections of root which located 0.5 cm away from AR tip of Ctrl and transgenic plants. ** indicates significant differences using the Student's paired t-test (P < 0.01). |
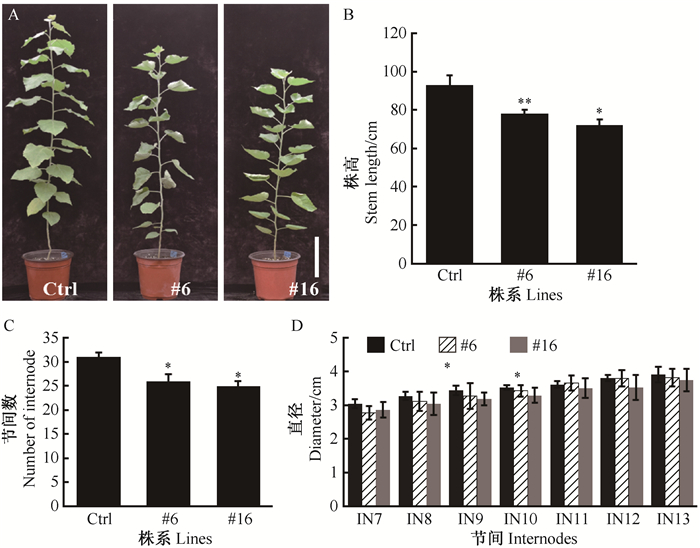
PtoWOX4a基因在杨树茎中木质部和韧皮部表达量最高,为研究PtoWOX4a在茎生长发育中的作用,对3月苗龄的过表达PtoWOX4a植株和对照植株的株高、节间数和第7-13节间的直径进行了统计比较,并对其第10节间进行了解剖结构分析。结果显示,3月苗龄的对照植株平均高度为93 cm,过表达PtoWOX4a植株的株高显著低于对照,为75~80 cm(图 3A,B),比对照株高减少了14%~20%;对照植株地上部分有31个节间,而过表达PtoWOX4a植株仅有24~26个节间,比对照植株节间数较少了16%~22%(图 3C);此外,过表达PtoWOX4a植株的节间粗度比对照植株略小,但未达到显著差异(图 3D)。
|
图 3 过表达PtoWOX4a植株的生长特征 Figure 3 Growth characteristics of PtoWOX4a-overexpressing plants A. 3月苗龄对照植株(Ctrl)与过表达PtoWOX4a植株(#6,#16)的形态(比例尺:15 cm);B-D.对照植株与过表达PtoWOX4a植株的株高(B)、节间数(C)和直径(D)分析。t检验P值用星号表示:*,P < 0.05;**,P < 0.01。 A. Phenotypes of 3-month-old control(Ctrl) and PtoWOX4a-overexpressing plants(#6, #16) (Scale bar:15 cm); B-D. The analysis of the height (B), the number of internode (C) and diameter (D) between the Ctrl and PtoWOX4a-overexpressing plants. **, P < 0.01; *, P < 0.05 (Student's paired t-test). |
选取对照植株和过表达PtoWOX4a植株的第10节间茎段进行解剖学分析。结果显示,对照植株的髓心平均宽度为1.9 mm,过表达PtoWOX4a植株为1.5~1.7 mm,说明髓心发育受到了明显抑制,相比于对照植株髓心宽度减少10%~20%(图 4D);过表达PtoWOX4a植株的木质部宽度为385~420 μm,相比对照植株增加24%~35%(图 4B,E),而形成层宽度没有明显变化(图 4C,F)。

|
图 4 过表达PtoWOX4a影响茎维管发育 Figure 4 Overexpression of PtoWOX4a affects stem vascular development 比例尺Scale bar A: 1 mm; B: 50 μm; C: 20 μm. A.第10节间横切图;B.第10节间的木质部区域,白线代表木质部(Xy)分布;C.第10节间的形成层区域,白线代表形成层(Ca)分布;D-F.过表达PtoWOX4a植株(#6, #16)和对照植株(Ctrl)髓心宽度(D)、木质部宽度(E)和形成层宽度(F)的比较。t检验P值用星号表示:*,P < 0.05;**,P < 0.01。 A. Transverse sections of the tenth internode; B. The xylem in the tenth internode(white lines represent the xylem (Xy) distribution); C. The cambium in the tenth internode(white lines represent the cambium (Ca) distribution); D-F. Comparison of the width of pith (D), xylem (E) and cambium (F) between the control(Ctrl) and PtoWOX4a-overexpressing plants(#6, #16). *, P < 0.05; **, P < 0.01 (Student's paired t-test). |
对PtoWOX4a过表达植株的叶片进行观察发现,叶片发育异常,转基因植株的叶片两侧向上弯曲(图 5A-C)。选取3月苗龄的对照植株和转基因植株的第6片叶片的中间主叶脉部位做切片分析,解剖结构显示,相比对照植株,转基因植株叶脉与两侧的叶片的夹角变大,说明过表达PtoWOX4a影响了叶片维管的发育,使其出现卷曲生长(图 5D-F)。

|
图 5 过表达PtoWOX4a影响叶片发育 Figure 5 Overexpression of PtoWOX4a affects the leaf development 比例尺Scale bar: 100 μm. A-C.对照植株(A)、PtoWOX4a过表达株系#6(B)和#16(C)的叶片形态;D-F.对照植株(D)、PtoWOX4a过表达株系#6(E)和#16(F)叶片的横切分析,弧线代表主叶脉与叶肉的夹角。 A-C. Morphology of leaves of the Ctrl (A) and the PtoWOX4a overexpression lines #6 (B) and #16 (C); D-F. Transverse sections of leaves of Ctrl (D) and the PtoWOX4a overexpression lines #6 (E) and #16 (F) (Arc lines represent the angle between main veins and mesophyll). |
毛白杨PtoWOX4a属于WUS进化分枝,含有HD和WUS-box结构域,与拟南芥AtWOX4和水稻OsWOX4为同源基因(Lin et al., 2013; Liu et al., 2014b)。不同物种中WOX4同源基因的表达模式差异较大,拟南芥AtWOX4主要集中在根、叶片和茎的维管以及形成层区域表达(Hirakawa et al., 2010),而水稻OsWOX4主要在顶端分生组织中表达(Ohmori et al., 2013)。本研究通过qRT-PCR和GUS染色对PtoWOX4a的表达模式进行观察,发现PtoWOX4a主要在根、叶脉和茎的维管组织中表达,而在茎顶端分生组织的表达较弱。在过表达PtoWOX4a转基因植株根部表型观察中发现,过表达PtoWOX4a能促进不定根的发生(Liu et al., 2014b),还能影响根的纵向和径向生长,导致不定根变短和直径增粗,不定根维管组织木质化程度明显增加,这与过表达AtWOX4拟南芥植株中根的发育表型相似(Hirakawa et al., 2010)。因此,根据表达模式和过表达植株根部表型的分析,推测PtoWOX4a与AtWOX4具有较强的功能同源性,而与OsWOX4功能差异较大。
研究发现,过表达PtoWOX4a还能抑制茎的伸长,并导致了茎中髓心部分宽度减少,木质部发育明显增强,而形成层细胞层数没有明显的变化。这可能是在形成层不断分化成木质部的过程中,过量表达的PtoWOX4a维持了形成层细胞的活性,保持形成层数目的不变,促进了木质部细胞的形成。这表明PtoWOX4a存在功能保守性,是植物形成层发育的重要调节者,维持形成层细胞的活性。在拟南芥、水稻等草本植物中,WOX4响应激素信号(Cheng et al., 2014; Suer et al., 2011)并受到CLE家族成员的调控(Etchells et al., 2013; Ohmori et al., 2013),进而在形成层的维持中发挥作用,但对于其下游基因的研究报道较少。在木本植物杨树中,PtoWOX4a是否受到CLE的调控,其作用的下游基因及其作用机制还有待更深入研究。
过表达PtoWOX4a导致了植株叶片两侧向上卷曲,影响叶片维管的正常发育。在水稻和拟南芥过表达WOX4基因的植株中均未见有关叶片发育变化的报道,推测PtoWOX4a与OsWOX4和AtWOX4在叶片发育上存在不同的作用。拟南芥中AtWOX1和AtWOX3参与叶片发育的调控且存在功能冗余,atwox1突变体植株没有表现出明显的变化,而atwox1atwox3的突变体中叶片卷曲,且叶片变小(Nakata et al., 2012)。然而,在毛白杨PtoWOX基因家族成员中并没有与AtWOX3相对应的同源基因(Liu et al., 2014b),PtoWOX4a和AtWOX3都属于WUS分枝,推测PtoWOX4a可能发挥部分WOX3在叶片发育中的功能,但需要进一步试验验证。
4 结论PtoWOX4a在毛白杨茎、根以及叶片的维管组织中均有表达,且在茎中木质部和韧皮部区域表达量最高。过表达PtoWOX4a抑制不定根的伸长,促进不定根的径向生长;植株矮化,茎中木质部区域变宽、髓心部分变窄,而形成层区域宽度无明显变化;叶片卷曲生长。推测过表达PtoWOX4a影响了形成层的活性以及木质部的发育,进而影响植物正常的生长发育。本研究揭示了PtoWOX4a在杨树根、茎和叶片维管组织发育中的作用,为深入了解PtoWOX4a基因的功能提供了线索,为全面研究不同物种中WOX基因的作用机制奠定了基础。
胡建军, 杨敏生, 卢孟柱. 2010. 我国抗虫转基因杨树生态安全性研究进展[J]. 生物多样性, 18(4): 336-345. (Hu J J, Yang M S, Lu M Z. 2010. Advances in biosafety studies on transgenic insect-resistant poplars in China[J]. Biodiversity Science, 18(4): 336-345. [in Chinese]) |
张利, 徐向东, 王丽娟, 等. 2016. 杨树蔗糖转运体基因PagSUT4的鉴定及功能分析[J]. 林业科学, 52(8): 21-28. (Zhang L, Xu X D, Wang L J, et al. 2016. Identification and functional analysis of the Populus sucrose transporter gene PagSUT4[J]. Scientia Silvae Sinicae, 52(8): 21-28. [in Chinese]) |
Cheng S, Huang Y, Zhu N, et al. 2014. The rice WUSCHEL-related homeobox genes are involved in reproductive organ development, hormone signaling and abiotic stress response[J]. Gene, 549(2): 266-274. DOI:10.1016/j.gene.2014.08.003 |
Dolzblasz A, Nardmann J, Clerici E, et al. 2016. Stem cell regulation by Arabidopsis WOX genes[J]. Molecular Plant, 7(9): 1028-1039. |
Etchells J P, Provost C M, Mishra L, et al. 2013. WOX4 and WOX14 act downstream of the PXY receptor kinase to regulate plant vascular proliferation independently of any role in vascular organisation[J]. Development, 140: 2224-2234. DOI:10.1242/dev.091314 |
Hirakawa Y, Kondo Y, Fukuda H. 2010. TDIF peptide signaling regulates vascular stem cell proliferation via the WOX4 homeobox gene in Arabidopsis[J]. Plant Cell, 22(8): 2618-2629. DOI:10.1105/tpc.110.076083 |
Ji J, Strable J, Shimizu R, et al. 2010. WOX4 promotes procambial development[J]. Plant Physiology, 152(3): 1346-1356. DOI:10.1104/pp.109.149641 |
Lin H, Niu L, McHale N A, et al. 2013. Evolutionarily conserved repressive activity of WOX proteins mediates leaf blade outgrowth and floral organ development in plants[J]. Proceedings of the National Academy of Sciences, 110(1): 366-371. DOI:10.1073/pnas.1215376110 |
Liu J, Sheng L, Xu Y, et al. 2014a. WOX11 and 12 are involved in the first-step cell fate transition during de novo root organogenesis in Arabidopsis[J]. Plant Cell, 26(3): 1081-1093. DOI:10.1105/tpc.114.122887 |
Liu B, Wang L, Zhang J, et al. 2014b. WUSCHEL-related homeobox genes in Populus tomentosa:diversified expression patterns and a functional similarity in adventitious root formation[J]. BMC Genomics, 15(1): 296. DOI:10.1186/1471-2164-15-296 |
Mayer K F, Schoof H, Haecker A, et al. 1998. Role of WUSCHEL in regulating stem cell fate in the Arabidopsis shoot meristem[J]. Cell, 95(6): 805-815. DOI:10.1016/S0092-8674(00)81703-1 |
Nakata M, Matsumoto N, Tsugeki R, et al. 2012. Roles of the middle domain-specific WUSCHEL-related homeobox genes in early development of leaves in Arabidopsis[J]. Plant Cell, 24(2): 519-535. DOI:10.1105/tpc.111.092858 |
Ohmori Y, Tanaka W, Kojima M, et al. 2013. WUSCHEL-related homeobox4 is involved in meristem maintenance and is negatively regulated by the CLE gene FCP1 in rice[J]. Plant Cell, 25(1): 229-241. DOI:10.1105/tpc.112.103432 |
Richards S, Wink R H, Simon R. 2015. Mathematical modelling of WOX5-and CLE40-mediated columella stem cell homeostasis in Arabidopsis[J]. Journal of Experimental Botany, 66(17): 5375-5384. DOI:10.1093/jxb/erv257 |
Suer S, Agusti J, Sanchez P, et al. 2011. WOX4 imparts auxin responsiveness to cambium cells in Arabidopsis[J]. Plant Cell, 23(9): 3247-3259. DOI:10.1105/tpc.111.087874 |
Tadege M, Lin H, Bedair M, et al. 2011. STENOFOLIA regulates blade outgrowth and leaf vascular patterning in Medicago truncatula and Nicotiana sylvestris[J]. Plant Cell, 23(6): 2125-2142. DOI:10.1105/tpc.111.085340 |
van der Graaff E, Laux T, Rensing S A. 2009. The WUS homeobox-containing (WOX) protein family[J]. Genome Biology, 10(12): 248. DOI:10.1186/gb-2009-10-12-248 |
Wang J, Kucukoglu M, Zhang L, et al. 2013. The Arabidopsis LRR-RLK, PXC1, is a regulator of secondary wall formation correlated with the TDIF-PXY/TDR-WOX4 signaling pathway[J]. BMC Plant Biology, 13(1): 94. DOI:10.1186/1471-2229-13-94 |
 2018, Vol. 54
2018, Vol. 54

