文章信息
- 辜夕容, 倪亚兰, 江亚男, 贾豪
- Gu Xirong, Ni Yalan, Jiang Yanan, Jia Hao
- 接种双色蜡蘑对酸性铝胁迫下马尾松幼苗生长、养分和铝吸收与分布的影响
- Effects of Laccaria bicolor on Growth, Uptake and Distribution of Nutrients and Aluminum of Pinus massoniana Seedlings under Acid Aluminum Exposure
- 林业科学, 2018, 54(2): 170-178.
- Scientia Silvae Sinicae, 2018, 54(2): 170-178.
- DOI: 10.11707/j.1001-7488.20180220
-
文章历史
- 收稿日期:2017-04-08
- 修回日期:2017-08-06
-
作者相关文章
铝毒是酸性土壤中植物生长发育的主要限制因子,损害根系,使根尖生长受阻、根系缩短,导致植物对养分的吸收和转运能力降低,从而影响植物的生长发育(Hirano et al., 2003)。铝活化后,常与土壤中的HPO42-、H2PO4-或PO43-结合,形成AlPO4沉淀,降低磷的有效性,使土壤有效磷浓度匮乏(韩官运等,2007);此外,Al3+也常与Ca2+、Mg2+等阳离子竞争吸附细胞膜上的结合位点,造成植物吸收的铝量增加,而钙、镁量减少(Moustaka et al., 2016;Poschenrieder et al., 2008)。研究表明,部分外生菌根(ectomycorrhizae,ECM)真菌如彩色豆马勃(Pitholithus tinctorius)、卷边桩菇(Paxillus involutus)和双色蜡蘑(Laccaria bicolor)等能够促进如桉树(Eucalyptus)、美洲黑杨(Populus deltoides)和马尾松(Pinus massoniana)等林木的生长(Egerton-Warburton, 2015;Khosla et al., 2009;辜夕容等,2005a),也可缓解金属毒害(陈保冬等,2015;Ray et al., 2005)。目前认为,ECM主要通过以下3种方式缓解铝毒,即:外延菌丝、菌索等扩大养分的吸收面积;分泌有机物质络合Al3+,使铝失活,释放出P;通过吸附形成菌套的物理阻碍作用阻止铝进入植物体内(辜夕容等,2005b)。因此,当ECM真菌与植物营养根系形成ECM后,能提高植物营养水平,进而促进植物生长发育,增强对铝毒的抗性(Schier et al., 1996)。
然而,并不是所有的ECM都对铝毒具有抗性,部分敏感,部分有抗性,即使同一种ECM,因菌株来源、生态型和寄主等的差异,也会有不同效应(Costa et al., 2015)。目前,多数研究结果都是在菌根真菌离体培养或者菌根苗木水培或砂培情况下获得的(陈保冬等,2015),难以真实预测菌根苗木在田间的抗铝性反应;且对菌根提高植物抗铝性的机制研究也多停留在菌根真菌或根际范围内,对养分或铝从菌根真菌进入植物体以及在植物体内的运转情况仍不甚清楚(Cairney, 2011)。笔者前期研究发现,双色蜡蘑可使富铝的酸性黄壤上生长的马尾松幼苗生物量至少提高30%(辜夕容等,2005a),但马尾松幼苗在离体培养下却对铝敏感,其生物量至少降低20%(辜夕容等,2010),这说明菌根真菌和菌根苗对铝的反应和机制可能存在差异。鉴于此,本研究选用双色蜡蘑3个株系分别接种马尾松,在取自马尾松林下的原生酸性土壤中培养,探索马尾松幼苗在不施或施铝条件下的生长和营养响应,并筛选出抗铝性强的菌株,以期为我国酸性土壤林区的造林和植被恢复提供实践和理论支持。
1 材料与方法 1.1 供试菌株选用双色蜡蘑的3个株系作为供试菌株,其中,Lb S238A和Lb S238N来源于法国火炬松(Pinus taeda)林下,Lb 270来源于北美花旗松(Pseudotsuga menziesii)林下。菌株分别接种于Pachlewski液体培养基中,培养21天后备用(辜夕容等,2005a)。
1.2 供试种子马尾松种子由重庆市林木种苗站提供。将其净种后先用0.3%甲醛溶液浸泡30 min,无菌水冲洗干净,然后在约25 ℃水中浸种24 h,捞出沥干,25 ℃左右保湿催芽,以露白后的种子播种。
1.3 供试土壤采集重庆市北碚区鸡公山(29°48'54"N,106°26'36"E)马尾松林下的山地冷砂黄壤为培养基质,去除石砾、草根、枯落物等,测得其基本化学性质见表 1。用2%甲醛水溶液消毒后装在1 m×1 m×0.5 m的水泥池中备用。
|
|
分别过滤菌丝体,用灭菌的去离子水洗去附着的培养基,打浆机低速打散,每菌种20个菌落和200粒马尾松种子拌匀后分别播种在1 m2的水泥池小区中,每天早晚2次浇水保湿。培养4周后,每周用pH3.8的不含A1 Hoagland营养液和的含0或1.0 mmol·L-1 Al[Al2(SO4)3·18H2O]的Hoagland营养液浇透1次,自然条件下培养。连续处理12周后, 获得3种菌根苗。以不接菌的马尾松幼苗,即非菌根苗(non-ectomycorrhizae,Non-ECM)为对照。试验小区随机区组排列,每菌种每处理3次重复,共24个小区。
1.5 试验方法铝处理12周后,在每小区近中心区域随机选取25株苗木。经显微镜检测发现,菌根真菌处理后的苗木均有真菌感染,而对照苗木无真菌感染。清水冲洗掉泥沙,分成根、茎、叶3部分,80 ℃烘干后称质量,25 000 r·min-1高速粉碎1 min后分别用HNO3-HClO4 (V: V=4: 1)消煮。消化液中磷浓度用钼锑抗比色法测定,钙和镁浓度用原子吸收分光光度计法测定,铝浓度用铝试剂比色法测定。
1.6 数据处理与分析所得数据用IBM SPSS Statistics 21.0软件包作方差分析,LSD法进行各水平间的多重比较。采用Graph Pad Prism 5软件制图,Microsoft Office Excel 2007软件制表。图中所有数据均为平均值±标准差,显著性水平为P<0.05。
2 结果与分析 2.1 接种双色蜡蘑对酸性铝胁迫下马尾松幼苗生长的影响由图 1可知,酸性铝胁迫促进Lb S238A菌根苗和Non-ECM的生长,但抑制Lb S238N和Lb 270菌根苗的生长,对Lb S238A菌根苗的促进作用(30.2%)显著强于Non-ECM(14.1%),对Lb 270菌根苗的抑制作用(17.4%)大于Lb S238N(10.2%)。促进或抑制的主要部位因苗木种类不同而异:对Lb S238A菌根苗主要是促进地上部生长,且对叶的作用大于茎;对Non-ECM主要是促进根生长,其次是叶,对茎则有抑制作用;Lb 270菌根苗受抑的最重的部位是茎,而Lb S238N菌根苗则是根。3种菌根苗的根系生长都因铝而显著受抑。
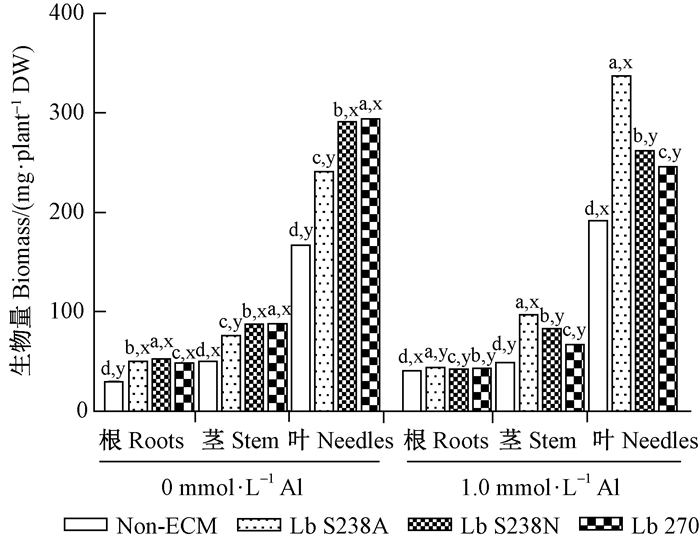
|
图 1 接种双色蜡蘑对酸性铝胁迫下马尾松幼苗生长的影响 Figure 1 Effect of Laccaria bicolor on the growth of masson pine seedlings under Al-exposure 图中不同字母表示差异显著(P<0.05。a-d为相同部位不同菌株间,x、y为相同部位不同铝处理间)。下同。 Different letters differed significantly at P < 0.05 (a-d for mycorrhizae in the same section; x, y for aluminum treatment in the same section). The same below. |
与Non-ECM相比,不论是否有酸性铝胁迫,接种双色蜡蘑均显著促进马尾松幼苗生长。在酸性铝胁迫下,接种Lb S238A使苗木生物量提高69.9%,显著高于接种Lb S238N(37.5%)和Lb 270(26.3%);3个菌株均对茎的促进作用最强,其次是叶,最差的是根。但无铝处理时,则是接种Lb S238N和Lb 270的促进作用显著强于Lb S238A;主要作用部位因菌株不同而异:Lb S238A主要在根,Lb S238N则对根、茎、叶的促进程度相当,Lb 270主要在茎和叶。可见,双色蜡蘑的3个菌株中,接种Lb S238A能增强马尾松对酸性铝毒的抗性,其菌根苗适于在铝浓度较高的酸性土壤上种植;而接种Lb S238N和Lb 270的菌根苗虽对铝敏感,但生长仍显著高于非菌根苗,适合在铝浓度较低的酸性土壤上生长。
2.2 接种双色蜡蘑对酸性铝胁迫下马尾松幼苗养分和铝浓度的影响1) 磷 除对Lb S238N菌根苗根和叶中的磷浓度无显著影响外,酸性铝均显著提高其余3种幼苗的根、茎、叶中及Lb S238N菌根苗茎中的磷浓度(图 2A),其中磷浓度增加最多的部位分别是Non-ECM的茎、Lb S238A菌根苗的叶和Lb 270菌根苗的根。与Non-ECM相比,除有铝时Lb S238A茎中磷浓度无显著改变外,接种双色蜡蘑3个株系均显著降低幼苗根而提高茎和叶中的磷浓度,且酸性铝胁迫下接种3个菌株对幼苗叶中磷浓度的提升幅度均显著高于茎中磷浓度,且酸性铝胁迫下3个菌株对幼苗叶中磷浓度的提升幅度均高于茎中磷浓度,即接种3个菌株均有利于磷根到茎和叶,尤其是到叶中的转运。
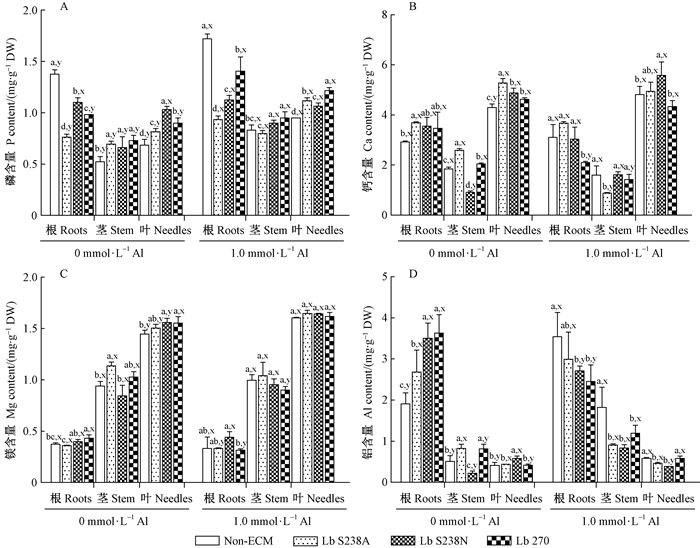
|
图 2 接种双色蜡蘑对酸性铝胁迫下马尾松幼苗养分和铝浓度的影响 Figure 2 Effect of Laccaria bicolor on the contents of P(A), Ca(B), Mg(C), and Al(D) in masson pine seedlings under Al-exposure |
2) 钙 酸性铝胁迫显著增加Non-ECM叶和Lb S238N菌根苗茎中的钙浓度,但却减少Lb S238A菌根苗茎、Lb 270根和茎中的钙浓度(图 2B),其中Lb S238N菌根苗茎中的钙浓度增加76.3%,显著高于Non-ECM叶中钙浓度的增量(12.1%)。与Non-ECM相比,酸性铝胁迫下仅接种Lb S238N显著提高幼苗叶中钙的浓度,而接种Lb S238A和Lb 270则分别降低幼苗茎钙和根中的钙浓度。但无铝时,接种Lb S238A显著提高幼苗根、茎和叶中的钙浓度,接种Lb S238N减少幼苗茎而提高叶中的钙浓度,接种Lb 270提高幼苗茎和叶中的钙浓度。
3) 镁 酸性铝胁迫显著提高Non-ECM、Lb S238A菌根苗和Lb S238N菌根苗3种幼苗叶中的镁浓度,但降低Lb S238A菌根苗根、Lb 270根和茎中的镁浓度(图 2C)。这说明酸性铝胁迫促进Non-ECM、Lb S238A菌根苗和Lb S238N菌根苗中镁从根到叶的上行运输,但抑制Lb 270菌根苗对镁的吸收。与Non-ECM相比,在酸性铝胁迫下接种3个菌株对幼苗镁的吸收和转运无显著影响,但在无铝时却显著促进且主要作用部位因菌不同而异:Lb S238A在茎镁,Lb S238N在叶,Lb 270在根和叶。
4) 铝 酸性铝处理显著提高Non-ECM幼苗根、茎、叶,Lb S238N菌根苗茎中Lb 270菌根苗茎和叶中的铝浓度,减少Lb S238N菌根苗根叶及Lb 270菌根苗根中的铝浓度(图 2d)。3个部位中茎中铝增量最高:Non-ECM高达257%,Lb S238N菌根苗高达278%,最低的Lb 270菌根苗也达到了46.0%。可见,酸性铝胁迫使Non-ECM、Lb S238N和菌根苗Lb 270菌根苗吸收的铝易向茎中转移。与Non-ECM相比,酸性铝胁迫除接种Lb S238A对根浓度、接种Lb 270对叶中的铝浓度无显著影响外,接种其他3个菌株均显著降低马尾松幼苗茎或根或叶中的铝浓度,其中使茎中铝浓度降低最多。但无铝时,除接种Lb S238N茎中的铝浓度减少和接种Lb S238A中的叶铝浓度不变外,接种其他3株真菌均显著提高铝浓度,增加最多的部位因株系不同而异:Lb S238A在茎中,Lb S238N和Lb 270在根中。可见,在酸性铝胁迫下接种3个菌株降低马尾松幼苗各部分特别是茎中的的铝浓度,但无铝时却提高铝浓度。
2.3 接种双色蜡蘑对酸性铝胁迫下马尾松幼苗养分和铝的积累与分布的影响以浓度乘以生物量,可得到养分和铝在马尾松幼苗体内的积累量及其在根、茎和叶中的分布,见图 3~6。
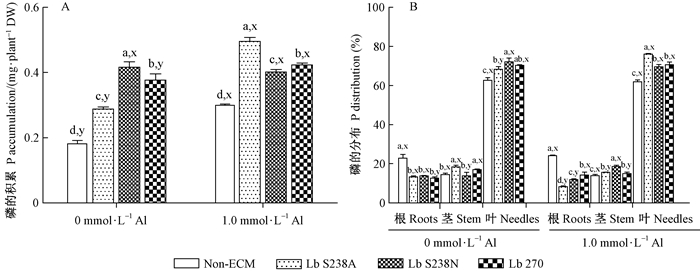
|
图 3 接种双色蜡蘑对酸性铝胁迫下马尾松幼苗磷的积累(A)和分布(B)的影响 Figure 3 Effect of Laccaria bicolor on the accumulation (A) and distribution (B) of P in masson pine seedlings under Al-exposure |
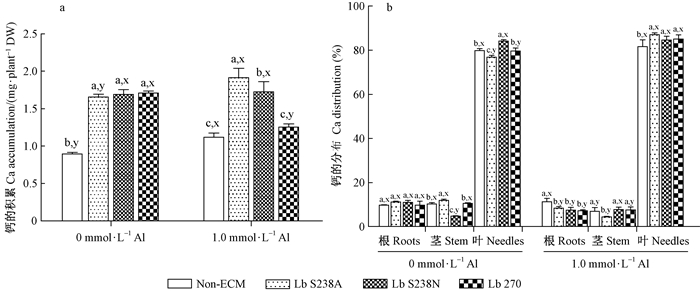
|
图 4 接种双色蜡蘑对酸性铝胁迫下马尾松幼苗钙的积累(A)和分布(B)的影响 Figure 4 Effect of Laccaria bicolor on the accumulation (A) and distribution (B) of Ca in masson pine seedlings under Al-exposure |
|
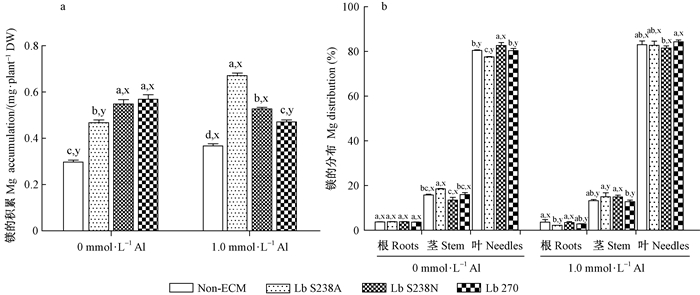
图 5 接种双色蜡蘑对酸性铝胁迫下马尾松幼苗镁的积累(A)和分布(B)的影响 Figure 5 Effect of Laccaria bicolor on the accumulation (A) and distribution (B) of Mg in masson pine seedlings under Al-exposure |
|
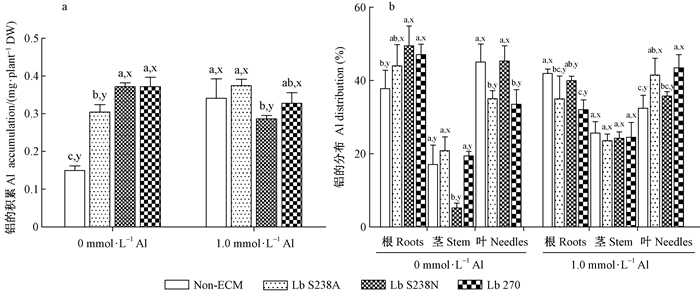
图 6 接种双色蜡蘑对酸性铝处理下马尾松苗木铝的积累(A)和分布(B)的影响 Figure 6 Effect of Laccaria bicolor on the accumulation (A) and distribution (B) of Al in masson pine seedlings under Al-exposure |
1) 磷 酸性铝胁迫显著促进磷在Non-ECM、Lb S238A菌根苗和Lb 270菌根苗中的积累(图 3A),使磷在Lb S238A菌根苗根和茎中的分布降低而叶中分布增加,在Lb S238N根中分布降低而茎中分布增加,在Lb 270菌根苗根中分布增加而茎中分布降低,对Non-ECM中磷的分布无显著影响(图 3B)。磷积累量和叶中分布量增加最多的均是Lb S238A菌根苗,分别比无铝时提高71.9%和7.79%。与Non-ECM相比,接种3株双色蜡蘑在有无铝时均能显著促进磷的积累,减少磷在根中的分布而增加其在茎和叶尤其是叶中的分布。在酸性铝胁迫下,接种Lb S238A使磷积累量和叶中分布量显著高出Non-ECM 68.7%和14.2%,也显著高于接种Lb S238N和Lb 270的增量,即接种Lb S238A比接种后二者更有利于磷的积累和向地上部转运;但无铝时则相反,接种Lb S238N和Lb 270比接种Lb S238A更有利于磷的积累和向地上部转运,此时前二者的磷积累量比Non-ECM分别增加129%和107%,而接种Lb S238A只增加58.6%。
2) 钙 酸性铝胁迫显著增加Non-ECM和Lb S238A菌根苗的钙积累,但减少Lb 270菌根苗的钙积累,对Lb S238N菌根苗无显著影响(图 4A),使钙在Non-ECM茎中的分布降低,在Lb S238菌根苗和Lb 270菌根苗根、茎中的分布降低而叶中分布增加,在Lb S238N菌根苗根中的分布降低而茎中分布增加(图 4B)。与Non-ECM相比,在酸性铝胁迫下除接种Lb 270对钙积累量无显著影响外,接种Lb S238A和Lb S238N均显著促进钙的积累,且前者增加量(69.7%)显著高于后者(52.8%);此时接种3个菌株均显著减少钙在根中的分布而增加叶中的分布,且接种Lb S238A使叶中分布量增加最多。无铝时接种3株真菌均有利于钙的积累,比Non-ECM高出84.7%~90.6%;此时接种Lb S238A增加茎中而减少叶中钙的分布,Lb S238N则与之相反,接种Lb 270不影响钙的分布。这说明接种Lb S238A更利于马尾松幼苗在酸铝胁迫下对钙的吸收,并促其向叶中分配。
3) 镁 酸性铝胁迫显著促进Non-ECM和Lb S238A菌根苗中镁的积累,但减少Lb 270中镁的积累(图 5A),使镁在Non-ECM茎中分布降低而叶中分布增加,在Lb S238A和Lb 270菌根苗的根和茎中尤其是茎中分布减少而叶中分布增加(图 5B)。铝使Lb S238A菌中的镁积累量和在叶中的分布量均显著高于Non-ECM。接种3个菌株均显著促进镁的积累,且酸性铝下除接种Lb S238A降低根中镁的分布外,其余则对镁的分布无显著影响;此时接种Lb S238A使镁的积累量增加81.5%,显著高于接种Lb S238N和Lb 270的增量。但无铝时则相反,接种Lb S238N和Lb 270使镁的积累量增加83.1%~89.8%,显著高于接种Lb S238A的增量(56.1%);此时接种Lb S238A使茎中镁的分布增加而叶中镁的分布减少,接种Lb S238N则与之相反。Lb 270不影响镁的分布。可见,Lb S238A更有利于酸性铝胁迫下马尾松幼苗对镁的吸收。
4) 铝 酸性铝胁迫显著促进Non-ECM和Lb S238A菌根苗但降低Lb S238N菌根苗对铝的积累,对Lb 270菌根苗中铝的积累无显著影响(图 6A)。使铝在Non-ECM根和茎尤其是茎中分布增加但叶中分布减少,在Lb S238A菌根苗和Lb 270根中的分布减少但在茎和叶尤其是叶中分布增加,在Lb S238N菌根苗根和叶中分布减少但在茎中分布增加(图 6B)。酸性铝胁迫使Non-ECM中铝积累量增加128%,显著高于Lb S238A菌根苗的增量(22.9%);Lb S238N菌根苗茎中分布量增加19.0%,显著高于其他苗木。与Non-ECM相比,酸性铝胁迫下接种Lb S238N使铝的积累量显著降低,而接种Lb S238A和Lb 270则对铝的积累无显著影响;此时接种Lb S238A和Lb 270使根中铝的分布显著减少而叶中的分布增加,且接种Lb 270使叶中铝分布量增加了11.0%,高于接种Lb S238A;Lb S238N对铝的分布无显著影响。无铝时接种3个菌株均促进铝的积累,比Non-ECM增加了100%~145%,且接种Lb S238A对铝的积累增加量显著少于另外2个株系。可见,接种双色蜡蘑降低或不影响酸性铝胁迫下马尾松幼苗对铝的吸收与积累,且接种Lb S238A和Lb 270促进铝从根向叶的分配。
3 讨论欧洲云杉(Picea abies)和桃(Prunus persica)的生长发育分别在0.5 mmol·L-1 Al和1.0 mmol·L-1 Al时受阻,而且桃的侧根长和侧根数均显著减少,但根生物量未降低(Heim et al., 2003;Graham, 2001)。而本研究中,1.0 mmol·L-1 Al未降低马尾松非菌根苗生物量,反而促进其生长,尤其是根生物量显著升高,这可能与马尾松长期生长于酸性富铝土壤中而具有较强耐铝性有关(吴若菁等,2009)。为适应有效养分匮乏的自然生境,有些植物根系特别发达甚至特异化,以吸收更多的养分供生长发育所需(Abrahão et al., 2014)。酸性土壤中铝的溶出,不仅增加了活性铝浓度,而且还减少了磷、钙和镁等养分的有效性(Poschenrieder et al., 2008),因此,马尾松形成了强大的根系进行应对。然而,在磷等养分进入植物体的同时,铝的吸收量也在同步增加,这可能导致体内养分利用受阻(Lux et al., 2001)。本研究发现,铝胁迫下非菌根苗吸收的磷、钙和镁的增量显著低于铝的增量,即使增量最多的磷仍不足铝增量的一半;而且根、茎、叶中磷和铝的浓度同步增长,铝浓度增量始终高于磷浓度增量,在茎中铝浓度甚至增加了2.6倍,达到磷增量的4.4倍。因此,进入植物体内的铝可能仍会限制磷等养分的利用,茎中大量富集的铝可能与磷沉积而引起茎干受损,这也可能是酸性富铝土壤上马尾松活立木蓄积量不高的主要原因。
一般认为,外生菌根真菌在离体培养中的结果与共生体一致,Egerton-Warburton(2015)也证实Pisolithus tinctorius菌株的抗铝型比敏感型更能提高桉树的抗铝性,离体培养和共生后的结果相似。而Thompson等(1984)却发现,P. tinctorius的3个菌株在纯培养和田间试验中对铝的抗性结果并不一致。本研究所用的3株双色蜡蘑在纯培养时均不抗铝,且Lb S238A最敏感(辜夕容等,2010)。但田间试验发现,3个菌株的菌根苗对酸性铝胁迫的响应截然不同,Lb S238A增强了马尾松的抗铝性,而Lb S238N和Lb 270仍对铝敏感,这可能与寄主植物与外生菌根真菌之间的相互作用有关。Bücking等(1999)认为菌根化后的植物会改变菌丝功能,且培养在不同水平磷时的尾叶桉(Eucalyptus urophylla)与菌根菌间也表现出相互促进效应(Costa et al., 2015)。因此Lb S238A与马尾松在应对铝毒时可能相互协作,马尾松供给Lb S238A更多的碳水化合物以利菌丝生长,菌丝增多则能吸收更多的养分反哺马尾松的生长发育。但Lb S238N和Lb 270却未有此作用,其与纯培养时表现相同,仍对铝敏感,共生并未增强这2个菌株对铝的抗性。这表明离体培养结果与共生体是否一致,还因菌种、株系或生态型以及所用寄主而异。
菌根菌丝可扩大养分的吸收面积、增加土壤中磷等养分的有效性,而且菌根植物的养分吸收量显著高于非菌根植物,因此,菌根真菌能提高植物对铝的抗性(辜夕容等,2005b;Plassard et al., 2011)。Schier等(1995)研究认为,菌根侵染可缓解铝毒,主要由于其提高了养分尤其是磷的吸收,而不是减少铝的吸收。而Yang等(2000)研究则认为,菌根减少铝的吸收起重要作用。本研究所用3个菌株菌不论抗铝还是敏感,与非菌根苗相比,在酸性铝胁迫时其吸收的磷、钙和镁的量均显著高于非菌根苗,但对铝的吸收量显著降低或不受影响,这说明3个菌株在应对酸性铝胁迫上存在差异:Lb S238A和Lb 270主要促进养分吸收,Lb S238N则不仅提高养分吸收,还阻止铝的吸收。因此笔者认为,接种双色蜡蘑能增强马尾松的抗铝能力,主要依赖于菌根能促进养分的吸收,但也不乏抑制铝的吸收,具体还因菌根种类而异。
酸性土壤中溶出的Al3+不仅在土壤溶液中与PO43-、HPO42-、H2PO4-结合生成沉淀,使磷有效性降低,而且在根质外体中也会发生同样的反应;同时根皮层中Al3+会竞争钙Ca2+、Mg2+的结合位点,减少钙和镁的上行运输(韩官运等,2007)。因此,铝毒不仅使土壤中有效养分浓度降低,而且还会影响植物体内养分的转运,使地上部分生长受损(Poschenrieder et al., 2008;Lux et al., 2001)。接种菌根真菌能提高土壤养分有效性,增加植物可利用养分浓度(辜夕容等,2005b)。接种双色蜡蘑的3个菌株后,马尾松地上生物量显著提高,分配给茎、叶的磷和钙量显著多于非菌根苗,说明接种菌根真菌还能通过促进养分的上行运输来增强寄主植物对铝毒的抗性。Jones等(1986)研究认为,接种菌根真菌Scleroderma flavidum可降低镍向茎内的转运而减轻纸皮桦(Betula papyrifera)的镍毒性; 但本研究在马尾松双色蜡蘑菌根苗中未发现此效应,反而出现铝在根内分布减少而叶中分布增多的现象。结合菌根苗根、茎、叶特别是茎中铝浓度均显著降低的情况,笔者认为,接种菌根真菌可促进铝的上行运输,但因茎和叶的快速生长又稀释了地上部分的铝浓度,将其限制在毒性阈值以下而缓解了铝毒性。虽然Becquer等(2014)猜测自由的无机磷可被ECMF通过特殊的磷酸转运蛋白吸收,并转运给植物,但目前关于菌根植物体内养分和铝的转运机制还不甚清楚,有待进一步研究。
4 结论双色蜡蘑菌根化苗对酸性铝胁迫的响应因菌株不同而异:Lb S238A增强了马尾松幼苗的抗性,Lb S238N和Lb 270敏感。但与非菌根苗相比,接种3个菌株在酸性铝胁迫下均能促进马尾松幼苗生长,且主要作用于茎和叶;提高磷、钙、镁的吸收,减少或不改变铝的吸收;降低根而增加叶中磷浓度,减少根、茎、叶中铝浓度;降低磷、钙、铝在根中的分布而增加叶中的分布。因此,接种双色蜡蘑能提高马尾松幼苗对酸性铝胁迫的抗性,主要通过促进磷、钙、镁等养分的吸收并促进其上行运输,以及抑制或不影响铝的吸收并稀释铝浓度来实现。供试苗木中,Lb S238A菌根苗的抗酸性铝胁迫能力最强,可应用于酸性富铝土壤中种植;而Lb S238N和Lb 270菌根苗则适于在铝浓度较低的酸性土壤上生长。
陈保冬, 孙玉青, 张莘, 等. 2015. 菌根真菌重金属耐性机制研究进展[J]. 环境科学, 36(3): 1123-1132. (Chen B D, Sun Y Q, Zhang X, et al. 2015. Underlying mechanism of the heavy metal tolerance of mycohhizal fungi[J]. Environmental Science, 36(3): 1123-1132. [in Chinese]) |
辜夕容, 黄建国. 2010. 铝对外生菌根真菌草酸分泌及磷、钾、铝吸收的影响[J]. 生态学报, 30(2): 357-363. (Gu X R, Huang J G. 2010. Effect of aluminum on growth, oxalate exudation, and uptake of aluminum, phosphorus and potassium by ectomycorrhizal fungi in vitro[J]. Acta Ecologica Sinica, 30(2): 357-363. [in Chinese]) |
辜夕容, 梁国仕, 杨水平, 等. 2005a. 接种双色蜡蘑对马尾松幼苗生长、养分和抗铝性的影响[J]. 林业科学, 41(4): 199-203. (Gu X R, Liang G S, Yang S P, et al. 2005a. Influences of Laccaria bicolor on the growth, nutrient uptake and aluminum resistance of Pinus massoniana seedlings[J]. Scientia Silvae Sinicae, 41(4): 199-203. [in Chinese]) |
辜夕容, 梁国仕, 黄建国. 2005b. 外生菌根提高植物抗铝性机理研究进展[J]. 中国农学通报, 21(9): 218-221. (Gu X R, Liang G S, Huang J G. 2005b. Mechanism on increasing plant aluminum resistance by ectomycorrhizae[J]. Chinese Agricultural Science Bulletin, 21(9): 218-221. [in Chinese]) |
韩官运, 邓先保, 蒋诚, 等. 2007. 植物铝毒害的产生及防治研究进展[J]. 福建林业科技, 34(2): 174-179. (Han G Y, Deng X B, Jiang C, et al. 2007. The research progress on the cause and control of aluminum toxicity to plants[J]. Journal of Fujian Forestry Science and Technology, 34(2): 174-179. [in Chinese]) |
吴若菁, 庄捷, 黄婧, 等. 2009. 马尾松幼苗对模拟酸雨与铝胁迫的响应及其抗性机制[J]. 林业科学, 45(12): 22-29. (Wu R J, Zhuang J, Huang J, et al. 2009. Response and resistance mechanism of Pinus massoniana under the stresses of simulated acid rain and aluminum[J]. Scientia Silvae Sinicae, 45(12): 22-29. [in Chinese]) |
Abrahão A, Lambers H, Sawaya A, et al. 2014. Convergence of a specialized root trait in plants from nutrient-impoverished soils:phosphorus-acquisition strategy in a nonmycorrhizal cactus[J]. Oecologia, 176(2): 345-355. DOI:10.1007/s00442-014-3033-4 |
Becquer A, Trap J, Irshad U, et al. 2014. From soil to plant, the journey of P through trophic relationships and ectomycorrhizal association[J]. Frontiers in Plant Science, 5(10): 1-7. |
Bücking H, Heyser W. 1999. Elemental composition and function of polyphosphates in ectomycorrhizal fungi-an X-ray microanalytical study[J]. Mycological Research, 103(1): 31-39. DOI:10.1017/S0953756298006935 |
Cairney J W G. 2011. Ectomycorrhizal fungi:the symbiotic route to the root for phosphorus in forest soils[J]. Plant Soil, 344(1): 51-71. |
Costa L S, Grazziotti P H, Grazziotti D C, et al. 2015. In vitro evaluation of Eucalyptus ectomycorrhizae on substrate with phosphorus doses for fungal pre-selection[J]. Revista Árvore, Vicosa-MG, 39(1): 127-136. DOI:10.1590/0100-67622015000100012 |
Egerton-Warburton L. 2015. Aluminum-tolerant Pisolithus ectomycorrhizas confer increased growth, mineral nutrition, and metal tolerance to Eucalyptus in acidic mine spoil[J]. Applied and Environmental Soil Science. DOI:10.1155/2015/803821 |
Graham C J. 2001. The Influence of nitrogen source and aluminum on growth and elemental composition of nemaguard peach seedlings[J]. Journal of Plant Nutrition, 24(3): 423-439. DOI:10.1081/PLN-100104970 |
Heim A, Brunner I, Frossard E, et al. 2003. Aluminum effects on Picea abies at low solution concentrations[J]. Soil Science Society of America Journal, 67(3): 895-898. DOI:10.2136/sssaj2003.0895 |
Hirano Y, Isomura A, Kaneko S. 2003. Root morphology and nutritional status of Japanese red cedar saplings subjected to in situ levels of aluminum in forest soil solution[J]. Journal of Forestry Research, 8(3): 209-214. DOI:10.1007/s10310-003-0027-1 |
Jones M D, Browning M H R, Hutchinson T C. 1986. The influence of mycorrhizal associations on paper birch and Jack pine seedlings when exposed to elevated copper, nickel or aluminum[J]. Water, Air, and Soil Pollution, 31(3): 441-448. |
Khosla B, Kaur H, Reddy M S. 2009. Influence of ectomycorrhizal colonization on the growth and mineral nutrition of Populus deltoides under Aluminum toxicity[J]. Journal of Plant Interactions, 4(2): 93-99. DOI:10.1080/17429140802382953 |
Lux H B, Cumming J R. 2001. Mycorrhizae confer aluminum resistance to tulip-poplar seedlings[J]. Canadian Journal of Forest Research, 31(4): 694-702. DOI:10.1139/x01-004 |
Moustaka J, Ouzounidou G, Baycu G, et al. 2016. Aluminum resistance in wheat involves maintenance of leaf Ca2+ and Mg2+ content, decreased lipid peroxidation and Al accumulation, and low photosystem Ⅱ excitation pressure[J]. BioMetals, 29(4): 611-623. DOI:10.1007/s10534-016-9938-0 |
Plassard C, Louche J, Ali M A, et al. 2011. Diversity in phosphorus mobilisation and uptake in ectomycorrhizal fungi[J]. Annals of Forest Science, 68(1): 33-43. DOI:10.1007/s13595-010-0005-7 |
Poschenrieder C, Gunsé B, Corrales I, et al. 2008. A glance into aluminum toxicity and resistance in plants[J]. Science of the Total Environment, 400(1): 356-368. |
Ray P, Tiwari R, Reddy U G, et al. 2005. Detecting the heavy metal tolerance level in ectomycorrhizal fungi in vitro[J]. World Journal of Microbiology & Biotechnology, 21(3): 309-315. |
Schier G A, McQuattie C J. 1995. Effect of aluminum on the growth, anatomy, and nutrient content of ectomycorrhizal and nonmycorrhizal eastern white pine seedlings[J]. Canadian Journal of Forest Research, 25(8): 1252-1262. DOI:10.1139/x95-138 |
Schier G A, McQuattie C J. 1996. Response of ectomycorrhizal and nonmycorrhizal pitch pine (Pinus rigida) seedlings to nutrient supply and aluminum growth and mineral nutrition[J]. Canadian Journal of Forest Research, 26(12): 2145-2152. DOI:10.1139/x26-243 |
Thompson G W, Medve R J. 1984. Effects of aluminum and manganese on the growth of ectomycorrhizal fungi[J]. Applied and Environmental Microbiology, 48(3): 556-560. |
Yang W Q, Goulart B L. 2000. Mycorrhizal infection reduces short-term aluminum uptake and increases root cation exchange capacity of highbush blueberry plants[J]. HortScience, 35(6): 1083-1086. |
 2018, Vol. 54
2018, Vol. 54
