文章信息
- 何凌仙子, 贾志清, 刘涛, 李清雪, 张友焱, 石坤, 冯莉莉, 杨凯悦, 赵雪彬
- He Lingxianzi, Jia Zhiqing, Liu Tao, Li Qingxue, Zhang Youyan, Shi Kun, Feng Lili, Yang Kaiyue, Zhao Xuebin
- 高寒沙地中间锦鸡儿和柠条锦鸡儿细根分解动态特征
- Dynamic Characteristics of Fine Root Decomposition of Two Caragana Species with in Alpine Sandy Land
- 林业科学, 2018, 54(2): 162-169.
- Scientia Silvae Sinicae, 2018, 54(2): 162-169.
- DOI: 10.11707/j.1001-7488.20180219
-
文章历史
- 收稿日期:2017-06-21
- 修回日期:2018-01-09
-
作者相关文章
2. 青海共和荒漠生态系统定位观测研究站 共和 813005;
3. 中国林业科学研究院林业研究所 北京 100091;
4. 北京林业大学水土保持学院 北京 100083
2. Qinghai Gonghe Desert Ecosystem Research Station Gonghe 813005;
3. Research Institute of Forestry, CAF Beijing 100091;
4. College of Soil and Water Conservation, Beijing Forestry University Beijing 100083
共和盆地是青海省荒漠化和沙化土地的典型代表,具有海拔较高、气温较低、积温较少和无霜期较短等特点(张登山等,2009),该区域的主要防风固沙造林树种为中间锦鸡儿(Caragana intermedia)和柠条锦鸡儿(Caragana korshinskii)。
对干旱半干旱区植被而言,细根(直径<2 mm)是植物吸收、运输水分和养分的重要通道(Ferguson et al., 2011; McCormack et al., 2013),同时因其生命周期短、周转快、新陈代谢旺盛、分解速率快(Pregitzer et al., 1993, Yuan et al., 2010),占死亡根系的主要部分。共和盆地根系研究主要集中于乌柳(Salix cheilophila)、北沙柳(Salix psammophila)、中间锦鸡儿、柠条锦鸡儿、小叶杨(Populus simonii)和小穗柳(Salix microstachya)等根系的分布特征(刘丽颖等,2012;石坤等,2016),而对细根分解特征的研究较为缺乏,尤其是锦鸡儿属植物的不同径级细根分解速率及影响因素方面的研究未见系统报道。
鉴于此,本研究以共和盆地1990年种植的中间锦鸡儿和柠条锦鸡儿人工灌丛为研究对象,分析其不同径级细根分解速率、元素累积释放率及其影响因素,讨论不同径级细根的分解规律及其对土壤碳循环和养分循环的影响机制,为长期研究高寒沙地土壤碳循环和养分循环规律提供理论依据。
1 研究区概况共和盆地位于青藏高原东北部祁连山与昆仑山的过渡带,研究区位于共和盆地青海共和荒漠生态系统定位研究站内(99°45'—100°30'E,36°03—36°40'N),地域上属高原高寒沙化土地类型区,气候上属高原温带半干旱草原和干旱荒漠草原的过渡带,海拔2 871~3 870 m,年均气温1.0~5.2 ℃,年均降水量311.1~402.1 mm,降水主要集中在5—9月(董光荣等,1993),年均蒸发量1 716.7 mm,全年大风日数平均50.6天,最多可达97天,风向主要为西、西北风,年均风速2.7 m·s-1,最大风速可达40 m·s-1,年均无霜期91天(Jia et al., 2012)。海拔高、气温低的环境条件决定了该地区高寒干旱的自然特征。在植被恢复区内沙丘与丘间地交错分布,主要地貌类型为流动沙丘、半流动沙丘、半固定沙丘、固定沙丘和丘间低地。该区地带性土壤类型有栗钙土和棕钙土,非地带性土壤有风沙土和草甸土等(Li et al., 2015)。研究区内的植被以人工植被为主,乔木有小叶杨和青杨(Populus cathayana),灌木有中间锦鸡儿、柠条锦鸡儿、黑沙蒿(Artemisia ordosica)、乌柳和北沙柳等。天然植被主要有川青锦鸡儿(Caragana tibetica)灌丛、唐古特白刺(Nitraria tangutorum)灌丛以及岌岌草(Achnatherum splendens)和针茅(Stipa spp.)等(张登山等,2009)。
2 研究方法 2.1 样方设置研究对象为1990年人工造林的半固定沙丘中间锦鸡儿和柠条锦鸡儿灌丛。1989年在流动沙丘上铺设1 m×1 m的黏土沙障,在沙障中心位置点播锦鸡儿种子。2015年6月,在2种锦鸡儿灌丛林内分别设置3个5 m×5 m样方(表 1)。
|
|
2015年6月10日,在样方内随机挖掘锦鸡儿表层(0~20 cm)土壤中细根样品,剔除直径大于2 mm的根系,并用清水冲洗细根样品,于80 ℃烘干至恒质量,一部分用于初始化学成分分析,另一部分按0~0.5、0.5~1和1~2 mm 3个径级区分细根。各径级细根均剪成2 cm长,将各径级样品各自充分混合后,称取2.000 g装入10 cm×15 cm孔径为0.5 mm的尼龙网袋中,封口并标记。每种锦鸡儿细根按照0~0.5、0.5~1和1~2 mm 3个径级分别装75个尼龙网袋,即每种锦鸡儿共有225个尼龙网袋,共450个尼龙网袋。
2.3 尼龙网袋埋置方法每种锦鸡儿均选取生长状况良好、长势基本一致的标准株5株。每种锦鸡儿尼龙网袋均埋置在相应标准株半径20 cm的圆上,垂直深度30 cm,每株标准株下设15组,每组包括0~0.5、0.5~1和1~2 mm径级细根网袋各1个,组内距离为10 cm,组间距离为20 cm。表层覆盖林地凋落物。每种锦鸡儿均埋置尼龙网袋225个,共450个尼龙网袋。
2.4 尼龙网袋取样方法及处理由于青海共和荒漠生态系统定位研究站海拔较高,11月至翌年4月气温较低,无法进行试验,因此延期至2016年6—10月取样。自细根埋入时起(2015-06-10),分别在2015-08-10、2015-10-10、2016-06-12、2016-08-12和2016-10-12各取1次尼龙网袋,每次分别随机抽取2种锦鸡儿各径级细根各15袋,共取90个尼龙网袋。随后拆开网袋,去除新长的根,清水冲洗根系,80 ℃下烘干至恒质量并测定干质量,同种锦鸡儿相同径级细根样品用粉碎机研磨、过筛,测定细根元素含量。
2.5 化学分析植物细根全C、全N含量采用元素分析仪法测定,全P、全K含量采用HNO3消解-ICP法测定。
2.6 数据处理采用Olson(1963)衰减模型拟合分析细根质量残留率y(%):
| $ y = a{{\rm{e}}^{ - kt}}。$ | (1) |
式中:a为拟合参数;k为细根分解系数(g·g-1a-1);t为时间(a)。元素累积释放率L(%)计算公式为:
| $ L = \left[ {\left({{X_0}{S_0} - {X_t}{S_t}} \right)/{X_0}{S_0}} \right] \times 100\% 。$ | (2) |
式中:Xt为该阶段细根残留干质量(g);X0为初始细根干质量(g);St为该阶段细根现存元素含量;S0为初始细根元素含量。
分解50%所需的时间T50%计算公式为:
| $ {T_{50\% }} = - \left[ {\ln \left({50/a} \right)} \right]/k。$ | (3) |
分解95%所需的时间T95%计算公式为:
| $ {T_{95\% }} = - \left[ {\ln \left({5/a} \right)} \right]/k。$ | (4) |
统计分析在SPSS 19. 0软件中完成,显著性水平为P<0.05,绘图使用Origin 8.0软件。采用单因素方差分析法(one-way ANOVA)和最小极差法(LSD)检验根系C、N、P、K初始浓度在树种和径级之间的差异。用单因素方差分析检验质量残留率和C、N、P、K释放率在同一立地条件不同径级间的差异;采用多因素方差分析(three-way ANOVA)检验立地条件、物种、径级和分解时间及各因子交互作用对根系质量损失及C、N、P、K释放率的影响;采用Pearson相关系数法分析不同径级细根质量残留率与初始元素含量的相关关系。
3 结果与分析 3.1 不同径级细根初始元素含量如表 2所示,同种锦鸡儿不同径级细根初始元素含量表现为0.5~1和1~2 mm差异不显著,0~0.5 mm与0.5~1和1~2 mm差异显著(P<0.05)。初始C、N含量和C/P、N/P均随细根直径增大而增大,P、K含量随细根直径增大而减小,而C/N表现为中间锦鸡儿随细根直径增大而减小,柠条锦鸡儿则相反。对于2种锦鸡儿同径级细根,各初始元素含量差异显著(P<0.05)。此外,中间锦鸡儿的C/N小于柠条锦鸡儿,C/P和N/P大于柠条锦鸡儿。
|
|
如图 1所示,2种锦鸡儿在分解期第1个生长季内,初始阶段(0~61天)细根分解最快,各径级细根质量残留率为53.28%~66.34%,61~122天,细根分解速率减慢;在非生长季内,中间阶段(122~367天)分解很慢,在分解期第2个生长季(367~420天)分解较慢。420天后2种锦鸡儿细根质量显著下降,残留率为39.94%~58.20%。2种锦鸡儿细根分解速率均随径级增大而增大,且柠条锦鸡儿各径级细根分解速率总体低于中间锦鸡儿。此外,不同种、径级和分解时间均对细根质量损失率有显著影响(P<0.001,表 3)。
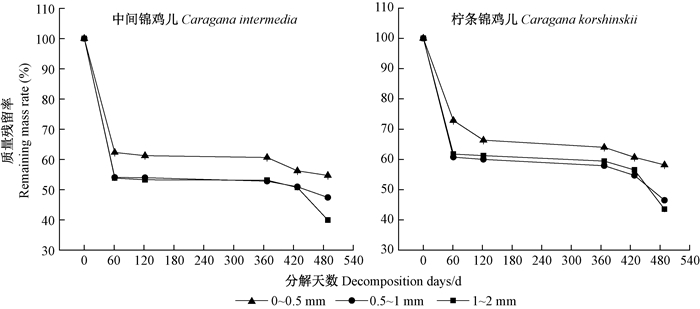
|
图 1 2种锦鸡儿不同径级细根分解残留率变化 Figure 1 Variation of remaining mass rate for two Caragana fine roots with different diameters |
|
|
如表 4所示,2种锦鸡儿分解速率随细根直径增大而增大,且中间锦鸡儿各径级分解速率明显高于柠条锦鸡儿。根据模型预测,中间锦鸡儿0~0.5、0.5~1和1~2 mm细根质量损失50%所需时间分别为2.51、1.20和0.79年,而柠条锦鸡儿分别为2.61、1.44和1.36年;中间锦鸡儿0~0.5、0.5~1和1~2 mm细根质量损失95%所需时间分别为17.18、14.96和12.57年,而柠条锦鸡儿分别为27.35、26.41和14.77年,中间锦鸡儿质量损失95%所需时间明显低于柠条锦鸡儿。此外,489天的细根质量残留率实测值略低于模型预估值。
|
|
如图 2所示,2种锦鸡儿细根在分解过程中元素累积释放率总体上随直径增大而减小。0~122天细根分解速率最快,C和N均表现为释放特征,同一径级中间锦鸡儿C和N释放率(34.64%~54.27%和43.70%~66.43%)均大于柠条锦鸡儿(21.87%~48.83%和35.86%~62.99%)。细根分解中期,C、N进入缓慢的富集和释放阶段。分解489天后,中间锦鸡儿和柠条锦鸡儿细根C分别释放了56.34%~79.70%和44.37%~87.39%,N分别释放了62.73~83.43%和54.41%~88.63%。2种锦鸡儿P总体上以释放为主,而K在前122天表现为释放,其余分解期释放速率缓慢且表现为不同程度的富集。此外,树种、径级和时间的两两交互对C、N、P和K释放率的影响不显著(表 3)。
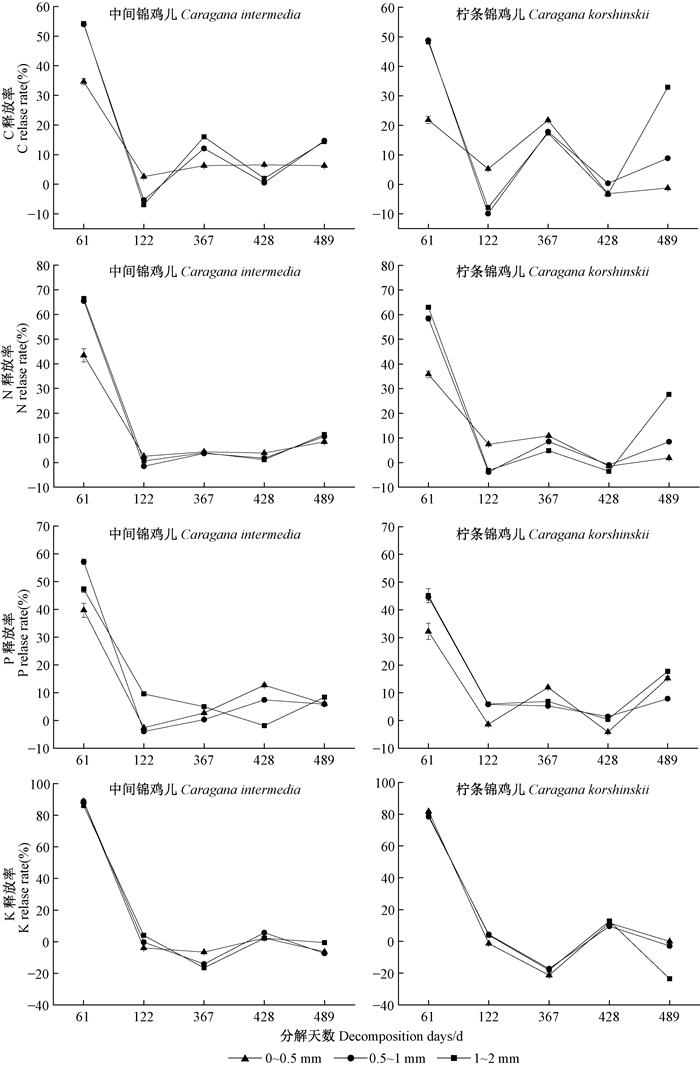
|
图 2 2种锦鸡儿不同径级细根分解过程中元素累积释放率变化 Figure 2 Element release rate of two Caragana fine roots with different diameters during decomposition process |
如表 5所示,细根质量损失率与初始P含量和初始C/N在分解367天呈显著负相关(P<0.05),在分解61、122、428和489天呈极显著负相关(P<0.01);细根质量损失率与初始K含量在分解61天呈极显著正相关(P<0.01),在分解122、367和428天呈显著正相关(P<0.05);细根质量损失率与初始C/P在分解367天呈显著正相关(P<0.05),在分解61、122、428和489天呈极显著正相关(P<0.01);细根质量损失率与初始N/P在0~489天的分解期内呈极显著正相关(P<0.01)。
|
|
2种锦鸡儿3个径级细根分解速率均表现为“快-慢-较慢”的变化特征,这与前人得到的细根分解变化规律(魏圆云等,2013;赵学春等,2014;Lai et al., 2016)相似。细根分解主要是在淋溶、破碎的物理作用下,伴随土壤生物代谢对化学元素的吸收和释放,不断与外界环境进行物质交换的过程(Burton et al., 2000)。分解初期,由于分解底物和环境因素等原因,碳水化合物等可溶解物质快速淋溶(温达志等,1998);分解中期,受生物作用影响,可溶性化合物被消耗殆尽,木质素、纤维素等难溶物质残留下来,由微生物缓慢降解;分解后期,土壤温度和含水量升高,分解速率缓慢升高(Tu et al., 2015)。
4.2 环境因素对细根分解速率指数衰减模型拟合的影响通过细根分解速率指数衰减模型拟合可知,中间锦鸡儿和柠条锦鸡儿细根达到95%质量损失率分别需要14和22年,该结果远远低于福建亚热带森林7种常绿阔叶和针叶树种(Lin et al., 2011)和新疆干旱区三工河流域2种琵琶柴(Reaumuria songonica)群落(赵学春等,2014)。这是因为本研究区域位于高海拔寒冷的半干旱沙地,土壤温度相对更低,微生物活动能力和土壤中纤维素、木质素等降解酶的活性更低(Parton et al., 2007;秦艳等,2010;曲浩等,2010),因此分解速率更慢,所需时间更长。
4.3 初始元素含量对细根质量损失率的影响细根质量损失率受底物N含量的影响较大,底物N含量越大,分解速率越快(Parton et al., 2007;Raich et al., 2009;赖宗锐,2015),即C/N含量低的中间锦鸡儿分解速率大于柠条锦鸡儿。初始浓度高的元素易释放,而初始浓度低的元素易发生富集作用(Vogt et al., 1986)。
初始底物C/N、C/P和N/P能判断分解期的C、N、P、K的释放和富集情况,随细根直径增加,易分解的C组分比例降低,不利于微生物分解。随细根直径增大,C释放率逐渐降低,与径级间质量损失率变化模式基本相似,这可能是由于1~2 mm细根中结构性C物质较多(纤维素、木质素等),而<0.5 mm细根中较少。和7种亚热带常绿针阔树种细根分解规律一致(Lin et al., 2011)。
4.4 N释放率对细根分解速率的影响分解期内,中间锦鸡儿和柠条锦鸡儿的N释放率分别为75%和71%,该结果远远高于川西亚半湿润高山森林优势针阔叶树种(唐仕姗等, 2015)、三峡库区马尾松(Pinus massoniana)(王娜等,2017)、毛乌素沙地臭柏(Sabina vulgaris)和油蒿(Artemisia ordosica)根系(秦艳等,2010)。这可能是由于2种锦鸡儿属植物是豆科(Leguminosae)植物,根系上寄生根瘤菌,自身具有固氮作用,细根初始N含量高,其细根的N含量基本能满足土壤微生物分解活动,无需从外界环境吸收N进行细根分解,即表现为N释放特征(Manzoni et al., 2008;荣丽等,2009)。此外,细根中N含量度越高,微生物分解活动越剧烈,分解速率越快,N释放率越快(Tu et al., 2015)。
4.5 径级对细根分解的影响细根径级对质量损失率有显著影响。2种锦鸡儿分解速率和元素累积释放率总体表现为随细根直径增大而增大。细根直径越小,外生根瘤菌和其他菌根更易侵染细根,而菌根作用会极大改变细根自身物理、化学特性,形成相应的抗分解保护机制,降低细根分解和元素累积释放率(Langley et al., 2003;Sun et al., 2013)。然而有研究表明,根系分解速率随细根直径增大而减小(靳贝贝等,2013;唐仕姗等,2015;王娜等,2017),这可能一方面是由于随根系直径减小,细根C含量以糖和氨基酸等易于分解的小分子形式存在,使细根分解速率更快(Chapin et al., 2000),另一方面由于试验采用不同大小、不同孔径的尼龙网分解袋,尼龙网袋越大,孔径越大,细根分解更容易受到土壤动物的影响(张静等,2008)。不同埋置和取样方法、不同埋置深度的土壤环境因子对细根分解的影响作用不同,使根系分解呈现不同分解规律。细根分解过程中,P主要表现为释放特征,与四川亚热带苦竹(Pleioblastus amarus)(Tu et al., 2015)和7种亚热带常绿针阔树种细根分解规律一致(Lin et al., 2011)。这是由于细根初始浓度较高,且研究区域的环境土壤P含量低下,因此细根需要不断释放P以满足微生物分解活动。
5 结论中间锦鸡儿各径级细根的分解速率和元素累积释放率均大于柠条锦鸡儿,即中间锦鸡儿的细根,尤其是1~2 mm细根向土壤中释放化学元素(C、N、P和K)的速率更快,更有利于土壤有机碳循环和养分循环,对高寒沙地土壤改良效益更显著。因此,在高寒沙地应当选择中间锦鸡儿作为防风固沙、改良土壤的典型树种。
董光荣, 高尚玉. 1993. 青海共和盆地土地沙漠化与防治途径[M]. 北京: 科学出版社: 15-25. (Dong G R, Gao S Y. 1993. Land desertification and its remedial measures in the Gonghe Basin, Qinghai Province[M]. Beijing: Science Press: 15-25. [in Chinese]) |
靳贝贝, 国庆喜. 2013. 蒙古栎、白桦根系分解及养分动态[J]. 生态学报, 33(8): 2416-2424. (Jin B B, Guo Q X. 2013. Root decomposition and nutrient dynamics of Quercus mongolica and Betula platyphylla[J]. Aata Ecologica Sinica, 33(8): 2416-2424. [in Chinese]) |
刘丽颖, 贾志清, 朱雅娟, 等. 2012. 共和盆地中间锦鸡儿人工林根系的分布特征[J]. 中国沙漠, 32(6): 1626-1631. (Liu L Y, Jia Z Q, Zhu Y J, et al. 2012. Root system distribution of Caragana intermedia plantation in Gonghe Basin Qinghai Province[J]. Journal of Desert Research, 32(6): 1626-1631. [in Chinese]) |
秦艳, 胡永宁, 王林和, 等. 2010. 毛乌素沙地臭柏、油蒿细根分解过程中养分与能量的变化[J]. 中国沙漠, 30(6): 1341-1347. (Qin Y, Hu Y N, Wang L H, et al. 2010. Change of nutrient and energy in process of fine roots decomposition of Sabina vulgaris and Artemisia ordosica in Mu Us Sand land[J]. Journal of Desert Research, 30(6): 1341-1347. [in Chinese]) |
曲浩, 赵学勇, 赵哈林, 等. 2010. 科尔沁沙地3种灌木凋落物分解速率及其与关键气象因子的关系[J]. 中国沙漠, 30(4): 844-849. (Qu H, Zhao X Y, Zhao H L, et al. 2010. Litter decomposition rates of three shrub species in Horqin Sandy Land and their relationship with key meteorological factors[J]. Journal of Desert Research, 30(4): 844-849. [in Chinese]) |
荣丽, 李贤伟, 张健, 等. 2009. 4种退耕模式细根(草根)分解及N动态[J]. 林业科学, 45(8): 21-26. (Rong L, Li X W, Zhang J, et al. 2009. Fine root and grass root decomposition and N dynamics in four land use types of converting farmland to forest[J]. Scientia Silvae Sinicae, 45(8): 21-26. DOI:10.11707/j.1001-7488.20090804 [in Chinese]) |
石坤, 贾志清, 张洪江, 等. 2016. 青海共和盆地典型固沙植物根系分布特征[J]. 中国水土保持科学, 14(6): 78-85. (Shi K, Jia Z Q, Zhang H J, et al. 2016. Root distribution characteristics of typical sand-fixing plants in Gonghe Basin of Qinghai Province[J]. Science of Soil and Water Conservation, 14(6): 78-85. [in Chinese]) |
唐仕姗, 杨万勤, 王海鹏, 等. 2015. 川西亚高山3个优势树种不同径级根系分解特征[J]. 应用生态学报, 26(10): 2921-2927. (Tang S S, Yang W Q, Wang H P, et al. 2015. Decomposition and nutrient release of root with different diameters of three subalpine dominant trees in western area of Sichuan Province China[J]. Chinese Journal of Applied Ecology, 26(10): 2921-2927. [in Chinese]) |
王娜, 程瑞梅, 肖文发, 等. 2017. 三峡库区马尾松细根分解及其养分释放[J]. 林业科学研究, 30(1): 18-24. (Wang N, Cheng R M, Xiao W F, et al. 2017. Fine root decomposition and nutrient release of Pinus massonianain the Three Gorges Reservoir Area[J]. Forest Research, 30(1): 18-24. [in Chinese]) |
魏圆云, 武志超, 杨万勤, 等. 2013. 季节性冻融期亚高山/高山森林细根分解动态[J]. 林业科学, 49(8): 21-28. (Wei Y Y, Wu Z C, Yang W Q, et al. 2013. Fine root decomposition dynamics during freeze-thaw season in the subalpine/alpine forests[J]. Scientia Silvae Sinicae, 49(8): 21-28. DOI:10.11707/j.1001-7488.20130804 [in Chinese]) |
温达志, 魏平, 张佑昌, 等. 1998. 鼎湖山南亚热带森林细根分解干物质损失和元素动态[J]. 生态学杂志, 17(2): 1-6. (Wen D Z, Wei P, Zhang Y C, et al. 1998. Dry mass loss and chemical changes of the decomposed fine roots in three China south subtropical forests at Dinghushan[J]. Chinese Journal of Ecology, 17(2): 1-6. [in Chinese]) |
张登山, 高尚玉, 石蒙沂, 等. 2009. 青海高原土地沙漠化及其防治[M]. 北京: 科学出版社: 6-40. (Zhang D S, Gao S Y, Shi M Y, et al. 2009. Sandy desertification and it's control in the Qinghai Plateau[M]. Beijing: Science Press: 6-40. [in Chinese]) |
张静, 王邵军, 阮宏华. 2008. 土壤动物对森林凋落物分解的影响[J]. 南京林业大学学报:自然科学版, 32(5): 140-144. (Zhang J, Wang S J, Ruan H H. 2008. Effect of soil fauna plant litter decomposition in forests[J]. Journal of Nanjing Forestry University:Natural Science Edition, 32(5): 140-144. [in Chinese]) |
赵学春, 来利明, 朱林海, 等. 2014. 三工河流域两种琵琶柴群落细根生物量, 分解与周转[J]. 生态学报, 34(15): 4295-4303. (Zhao X C, Lai L M, Zhu L H, et al. 2014. Fine root biomass, decomposition and turnover of Reaumuria soongorica communities in the Sangong River Basin[J]. Acta Ecology Sinica, 34(15): 4295-4303. [in Chinese]) |
Burton A J, Pregitzer K S, Hendrick R L. 2000. Relationships between fine root dynamics and nitrogen availability in Michigan northern hardwood forests[J]. Oecologia, 125(3): 389-399. DOI:10.1007/s004420000455 |
Chapin Iii F S, Zavaleta E S, Eviner V T, et al. 2000. Consequences of changing biodiversity[J]. Nature, 405(6783): 234-242. DOI:10.1038/35012241 |
Ferguson S D, Nowak R S. 2011. Transitory effects of elevated atmospheric CO2 on fine root dynamics in an arid ecosystem do not increase long-term soil carbon input from fine root litter[J]. New Phytologist, 190(4): 953-967. DOI:10.1111/nph.2011.190.issue-4 |
Jia Z, Zhu Y, Liu L. 2012. Different water use strategies of juvenile and adult Caragana intermedia plantations in the Gonghe Basin, Tibet Plateau[J]. Plos One, 7(9): e45902. DOI:10.1371/journal.pone.0045902 |
Lai Z, Zhang Y, Liu J, et al. 2016. Fine-root distribution, production, decomposition, and effect on soil organic carbon of three revegetation shrub species in northwest China[J]. Forest Ecology and Management, 359: 381-388. DOI:10.1016/j.foreco.2015.04.025 |
Langley J A, Hungate B A. 2003. Mycorrhizal controls on belowground litter quality[J]. Ecology, 84(9): 2302-2312. DOI:10.1890/02-0282 |
Li Q, Jia Z, Zhu Y, et al. 2015. Spatial heterogeneity of soil nutrients after the establishment of Caragana intermedia plantation on sand dunes in Alpine Sandy Land of the Tibet Plateau[J]. Plos one, 10(5): e0124456. DOI:10.1371/journal.pone.0124456 |
Lin C, Yang Y, Guo J, et al. 2011. Fine root decomposition of evergreen broad leaved and coniferous tree species in mid-subtropical China:dynamics of dry mass, nutrient and organic fractions[J]. Plant and Soil, 338(1/2): 311-327. |
Manzoni S, Jackson R B, Trofymow J A, et al. 2008. The global stoichiometry of litter nitrogen mineralization[J]. Science, 321(5889): 684-686. DOI:10.1126/science.1159792 |
McCormack M L, Eissenstat D M, Prasad A M, et al. 2013. Regional scale patterns of fine root lifespan and turnover under current and future climate[J]. Global Change Biology, 19(6): 1697-1708. DOI:10.1111/gcb.12163 |
Olson J S. 1963. Energy storage and balance of producers and decomposers in ecological systems[J]. Ecology, 44(2): 322-331. DOI:10.2307/1932179 |
Parton W, Silver W L, Burke I C, et al. 2007. Global-scale similarities in nitrogen release patterns during long-term decomposition[J]. Science, 315(5810): 361-364. DOI:10.1126/science.1134853 |
Pregitzer K S, Hendrick R L, Fogel R. 1993. The demography of fine roots in response to patches of water and nitrogen[J]. New Phytologist, 125(3): 575-580. DOI:10.1111/nph.1993.125.issue-3 |
Raich J W, Russell A E, Valverde-Barrantes O. 2009. Fine root decay rates vary widely among lowland tropical tree species[J]. Oecologia, 161(2): 325-330. DOI:10.1007/s00442-009-1379-9 |
Sun T, Mao Z, Han Y. 2013. Slow decomposition of very fine roots and some factors controlling the process:a 4-year experiment in four temperate tree species[J]. Plant and soil, 372(1/2): 445-458. |
Tu L, Peng Y, Chen G, et al. 2015. Direct and indirect effects of nitrogen additions on fine root decomposition in a subtropical bamboo forest[J]. Plant and Soil, 389(1/2): 273-288. |
Vogt F D. 1986. Thermoregulation in bumblebee colonies.Ⅱ.Behavioral and demographic variation throughout the colony cycle[J]. Physiological Zoology, 59(1): 60-68. |
Yuan Z Y, Chen H Y H. 2010. Fine root biomass, production, turnover rates, and nutrient contents in boreal forest ecosystems in relation to species, climate, fertility, and stand age:literature review and meta-analyses[J]. Critical Reviews in Plant Sciences, 29(4): 204-221. DOI:10.1080/07352689.2010.483579 |
 2018, Vol. 54
2018, Vol. 54

