文章信息
- 苌姗姗, 石洋, 刘元, 胡进波
- Chang Shanshan, Shi Yang, Liu Yuan, Hu Jinbo
- 应拉木胶质层解剖结构及化学主成分结构特征
- Anatomical Structure and Structure Characteristic of Chemical Composition of Gelatinous Layer in Tension Wood
- 林业科学, 2018, 54(2): 153-161.
- Scientia Silvae Sinicae, 2018, 54(2): 153-161.
- DOI: 10.11707/j.1001-7488.20180218
-
文章历史
- 收稿日期:2016-06-03
- 修回日期:2017-01-18
-
作者相关文章
作为树木中的非正常木材组织,应拉木在解剖结构和物理力学特性等方面与正常木存在较大差异(Wardrop et al., 1948;1955),并被国际木材学界公认为是影响木材品质和加工利用的主要问题之一(Panshin et al., 1980;李坚,1995;Thibaut et al., 2001)。应拉木不仅出现在倾斜、弯曲的树干中,在人工林速生树种如杨树(Populus sp.)和桉树(Eucalyptus sp.)的垂直树干中也大量存在,且在其纤维腔壁内表面常具有特殊形态和化学组成的壁层——胶质层(Wardrop,1964)。因胶质层出现与应拉木高拉伸应力的产生直接相关(Clair et al., 2001),当胶质纤维集中时,木材在干燥和加工利用过程中易产生扭曲、开裂、夹锯和板面起毛等一系列问题,严重制约优质人工林的培育和木材的合理加工利用,造成了大量经济损失(Timell,1986)。因此,深入了解应拉木与正常木在结构和功能上的差异,特别是应拉木胶质层的特殊结构、化学成分与其生物学功能间的内在联系,对于减少因应拉木缺陷造成的损失、提高木材品质和利用率具有重要的理论意义和实际价值。
对应拉木胶质层的研究最早可以追溯到19世纪末期,Th. Hartig发现了胶质层的存在,并依据其组成成分、常常与相邻细胞壁层分离以及外形类似凝胶类物质等特征,又称其为纤维素层或黏附层(Clair et al., 2008),但当前科学领域仍普遍采用"胶质层"这个命名。胶质层(gelatinous layer,也简称G层)是木材对外界刺激反映在解剖形态上的表现,可发生在纤维次生壁形成的不同阶段,主要取决于形成层带细胞的分离和细胞的分裂速度(Wardrop et al., 1948;Gardiner et al., 2014)。本文对胶质纤维在应拉木中的分布特征、胶质层的解剖结构、孔隙结构和化学主成分等方面的主要研究现状进行归纳,旨在剖析应拉木胶质层的结构和特性及其在应拉木形成过程中的作用,为探究应拉木高拉伸应力形成机制提供基础数据,最终为高效高值利用我国现有人工林资源提供理论依据。
1 胶质纤维在应拉木中的分布树木由于斜坡、风力、雨雪和光照等外界环境产生向重力性和向光性的倾斜生长,为保持树干笔直或使树枝恢复到正常位置而产生生长应力,树木中具有这种应力的部位被称之为应力木(Timell,1986;Fournier et al., 2014)。阔叶树材倾斜或弯曲树干和枝条的上方受拉伸应力,受拉部位的木质部即为应拉木(Isebrands et al., 1972;Fisher et al., 1981;刘一星等,2012;Gardiner et al., 2014),具有胶质纤维是应拉木的典型特征。胶质纤维是指尚未木质化的、胞腔内壁呈胶质状的木纤维,即为次生壁呈胶质状态的韧型纤维或纤维状管胞(刘一星等,2012),可存在于多种植物如荆棘、藤蔓、乔木树干等细胞组织中,常见于被子植物产生的应拉木中。
胶质纤维存在的差异性主要表现在种源、种间和种内等方面。在温带树种的应拉木中,胶质纤维常常在早材纤维中出现,在晚材纤维中也有(Rao et al., 1983)。然而应拉木的形成并非总是伴随着胶质纤维的产生,一些热带树种和非热带原始被子植物的应拉木中往往缺失胶质纤维,但其纤维细胞相应壁层呈现出与胶质层相近的结构特性,仍具有很高的拉伸应力以维持树干或树枝定向生长(Onaka,1949;Clair et al., 2006;Ruelle et al., 2007a;2007b;Roussel et al., 2015)。Clair等(2006)对21个热带树种的生长应力指标进行测量后发现,仅7个树种(占研究树种的33%)的应拉木具有明显的胶质纤维;在346个日本阔叶树种应拉木中,仅40%的应拉木具有胶质纤维(Onaka,1949);Fisher等(1981)对122个树种的枝桠应拉木进行研究,也得到了相似结果,约46%的应拉木具有胶质纤维。
而在相近树种的应拉木以及同株应拉木树干的不同部位,胶质纤维的分布也常表现出差异。一些桉树如王桉(Eucalyptus regnans)、巨桉(E. grandis)和蓝桉(E. globulus)等应拉木中,存在典型的胶质纤维(Washusen et al., 2005;Toghraie et al., 2006),而亮果桉(E. nitens)枝桠材应拉木中,不具胶质纤维(Qiu et al., 2008)。Fang等(2007)对杨树(Populus cv. Ⅰ4551)应拉木的纵向生长应变进行测量,范围从100 με到2 275 με(绝对值,με=μm/m)不等,仅当生长应变高于610 με时存在胶质纤维。Clair等(2006)将胶质纤维在一个生长轮内的分布分为3种类型:1)几乎所有的木纤维为胶质纤维;2)胶质纤维呈团状聚集分布;3)胶质纤维零星分布,仅少量木纤维具有胶质层。因此,生长地、树种、树龄、不同部位、成熟材和幼龄材等生长条件的差异,都可能是造成胶质纤维在应拉木中分布差异的相关因素。
2 胶质层的解剖结构 2.1 胶质纤维壁层结构胶质层是纤维细胞特有壁层,未发现于其他细胞类型(Gorshkova et al., 2010)。纤维子细胞由形成层原始细胞分生后,最初形成的分隔区域为胞间层。在新生纤维细胞形体扩大阶段,胶体状胞间层两侧沉积的壁层为初生壁。在纤维细胞完成或接近完成形体增大后,初生壁上逐渐沉积次生壁外层(S1)、中层(S2)和内层(S3)(图 1a)。在纤维细胞壁形成的不同阶段,若树木生长受到外界刺激,在靠近胞腔一侧可形成胶质层,有些胶质层甚至可取代次生壁中的S3或S2层。事实上胶质纤维的壁层结构存在如下3种类型(Panshin et al., 1980):1)除已木质化的次生壁S1、S2和S3层外,次生壁内侧还具有胶质层(图 1b);2)胶质层取代次生壁S3层,而保留S1和S2层(图 1c);3)胶质层取代次生壁S2和S3层,与S1层构成胶质纤维的次生壁(图 1d)。第1种结构类型不常见,仅在白檀(Symplocos paniculata)等少数树种中出现,后2种类型比较普遍,尤为第3种类型最为常见(Onaka,1949)。由于胶质层的出现,以上3种结构类型的胶质纤维,无论哪一种类型,其胞壁厚度均大于正常材的纤维胞壁厚度(刘一星等,2012)。
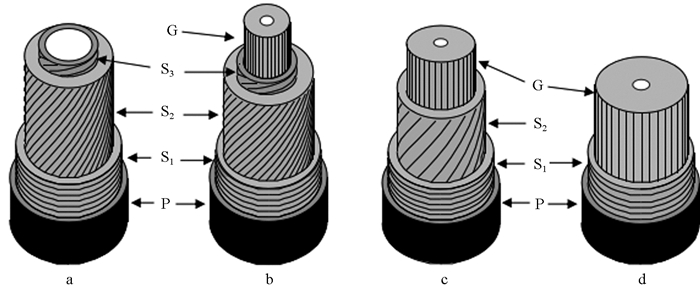
|
图 1 正常木和应拉木细胞壁层结构类型示意(Fang et al., 2007) Figure 1 A shematic illustration showing the different cell wall layers of normal (a) and tension wood (b, c, d) a:正常木纤维具有P+S1+S2+S3 结构 A normal wood fibre structure with P+S1+S2+S3;b:胶质纤维具有P+S1+S2+S3+G 结构 G-fibre structure with P+S1+S2+S3+G;c:胶质纤维具有P+S1+S2+S3+G 结构 G-fibre structure with P+S1+S2+G;d:胶质纤维具有P+S1+G 结构 G-fibre structure with P+S1+G; P:初生壁 Primary cell wall; S1、S2、S3:次生壁外层、中层和内层 Outer, middle and inner layers of the secondary wall; G:胶质层 Gelatinous layer. |
如图 2b、c所示,在木材横切面上观察,胶质层容易通过其松弛、胶状及与相邻壁层分离的形态特征而被识别。因其尚未木质化,胶质层往往似凝胶类物质附着或朝同一方向发生折皱而填充在胞腔内,有时甚至由胞腔中突出(Wardrop et al., 1955;Isebrands et al., 1972;Panshin et al., 1980)。在显微观察中,可依据胶质纤维细胞壁对不同染色剂的物理化学反应,通过双重染色技术,将胶质层与其他壁层区分开来(谭维,2012)。未木质化的胶质层易被固绿染料染成绿色或被星蓝染料染成蓝色,而木质化的细胞壁易被番红染成红色(图 2b、c)。观察染色后的胶质纤维,不同应拉木树种间胶质层厚度变异很大,从与正常纤维细胞厚度无异,不具胶质层(图 2a),到胶质层厚度与相邻壁层厚度相当(图 2b),再到厚壁的胶质层几乎完全充满胞腔(图 2c)均有报道(Clair et al., 2006;Ruelle et al., 2006;2007b;Chang et al., 2009)。胶质层在厚度上的变异可能与应拉木形成时细胞分化程度有关(Wardrop et al., 1948)。

|
图 2 经番红/固绿染色后的3种热带树种应拉木横切显微图像(箭头所示为胶质层,Chang et al., 2009) Figure 2 Transverse sections of three tropical tension wood stained with Safranin O/Fast green (arrows indicate the G-layer) |
利用胶质层膨松及易与相邻壁层分离的特征,Norberg等(1966)应用超声波处理技术从应拉木成熟材中分离出独立胶质层,而后这种物理分离方式被许多研究者(Nishikubo et al., 2007; Kaku et al., 2009; Chang,2014)采用,为精确研究胶质层的结构特性奠定了基础。然而有研究表明,胶质层的分离现象是由于传统显微切片制作过程引起的一种"边界效应"(Clair et al., 2005);若对包埋试样进行切片制作,在距离试样端部150 μm的超薄切片上几乎观察不到胶质层与胞壁分离的现象,即胶质层总是与相邻壁层紧密相连的,而对未包埋试样进行传统显微制片操作,胶质层与相邻壁层往往呈分离状。
2.3 胶质层微纤丝结构在所研究的应拉木树种中,胶质层微纤丝排列几乎与纤维长轴平行,微纤丝角较小,为0°~5°(Panshin et al., 1980;Clair et al., 2006;2011;Goswami et al., 2008),而相邻壁层微纤丝角较大,约为36°(Müller et al., 2006)。Gierlinger等(2006)通过拉曼图像也证实,胶质层微纤丝几乎沿细胞主轴排列,而相邻细胞壁层存在较大微纤丝角。对不同应拉木树种的胶质纤维和正常木纤维的微纤丝角进行对比,也得到相似结论,后者的微纤丝角(20°~30°)明显大于前者(0°~5°)(Onaka,1949)。应拉木的顺纹强度和杨氏模量通常较正常木大(Barnett et al., 2003),与胶质层较小的微纤丝角有关。
采用红外光谱和同步辐射微束X-射线对胶质层纤维素结晶区结构进行研究,发现胶质层纤维素的结晶区尺寸为6.5 nm,明显高于正常木纤维细胞次生壁S2层的结晶区尺寸3.1 nm(Washusen et al., 2001;Horikawa et al., 2009;Müller et al., 2006)。对不具胶质层的应拉木,其纤维细胞次生壁S2层也表现出类似胶质层的一些结构特征:微纤丝角较小、纤维素结晶区尺寸较大、结晶度增加等(Yoshida et al., 2002; Ruelle et al., 2006;2007b)。即无论是否具有胶质层,以上结构特征在应拉木中均普遍存在,可视为应拉木的共性。Müller等(2006)推测,胶质层中较高含量的纤维素合成酶以及较低含量的半纤维素,利于纤维素微纤丝聚集呈定向排列,从而增加纤维素结晶度。
3 胶质层的孔隙结构木材是一种具有多尺度分级结构的复杂天然高分子复合材料(赵广杰,2002;王哲等,2014),而富含果胶类物质的胶质层其孔隙结构更为丰富(Clair et al., 2008;苌姗姗等,2011a;2011b)。胶质层以纤维素作为"骨架",纤维素分子链平行排列形成高度定向和高度结晶的微纤丝,其宽度为3~4 nm(Fahlen et al., 2003)。在微纤丝之间和微纤丝非结晶区内存在着纳米级孔隙,半纤维素和(或)果胶类物质填充其中,缺乏木质素(Nishikubo et al., 2007; Bowling et al., 2008; Mellerowicz et al., 2008)。胶质层中丰富的孔隙结构可能存在于微纤丝间的间隙或微纤丝非结晶区内,因微纤丝的不规整排列和填充物的穿插而形成狭长裂口状或墨水瓶状孔隙。
Sachsse(1965)首次提出胶质层是蜂窝状多孔结构。Clair等(2008)通过CO2超临界干燥获取栗木(Castanea sativa)应拉木胶质层中的气凝胶结构,并通过氮气吸附法测量得到栗木应拉木中存在大量以7 nm为主的中孔孔隙,且孔比表面积是对应木的30多倍。苌姗姗等(2011b)采用氮气吸附法对杨木应拉木的孔隙结构进行表征,结果表明杨木应拉木具有完好的介孔特征(孔径2~50 nm),应拉木孔比表面积是对应木的13倍,孔径为4~7 nm的孔体积分布密度最大。相对于冷冻干燥和常规干燥,CO2超临界干燥能较好地保留应拉木的微细结构,是表征应拉木孔隙结构的一种有效干燥预处理方法(Clair et al., 2008;苌姗姗等,2011a)。
Chang等(2009)对6个热带树种应拉木的孔隙结构进行研究,发现孔径总是分布在6~12 nm之间,孔体积在不同树种间存在差异且与胶质层厚度存在一定关联:具有薄壁胶质层的应拉木存在一定量的中孔孔隙,但孔体积较低;具有厚壁胶质层的应拉木显示出大量的中孔孔隙,而不具胶质层的应拉木,其孔体积非常低,与对应木相差不大。即在具有胶质层的应拉木中观察到了大量中孔孔隙的存在,表明此孔隙主要来源于胶质层。因此,胶质层中大量的孔隙结构为水分子进出提供了空间,一方面赋予胶质层凝胶的外观形貌,另一方面高含水率使得胶质层具有横向干缩或湿胀能力,可能与应拉木胶质层高纵向干缩和拉伸应力的产生直接关联。
Chang(2014)采用超声波技术从杨木应拉木中分离出胶质层(图 3a),并对超临界干燥后的独立胶质层(图 3b)孔隙结构进行研究,结果表明,应拉木的中孔孔隙主要来源于胶质层,且超声振动时间、频率和功率等对应拉木胶质层的孔体积和孔比表面积等孔结构参数具有显著影响。

|
图 3 采用超声波技术从杨木应拉木中分离出的胶质层(Chang,2014) Figure 3 Isolated G-layer extracted from poplar tension wood by ultrasonic treatment a.饱水状态的胶质层 Isolated G-layers in water;b. CO2超临界干燥后的胶质层 The isolated G-layers after CO2 supercritical drying. |
通过超声波振动法将胶质层从胶质纤维细胞壁中分离出来(Norberg et al., 1966;Nishikubo et al., 2007;Kaku et al., 2009)发现,胶质层中缺乏木质素,主要以纤维素微纤丝的形态构成骨架结构,骨架间隙由多糖基质填充,且化学成分与相邻壁层存在很大差异。
4.1 纤维素早期研究(Norberg et al., 1966)表明,胶质层几乎全部由纤维素组成,由于此结论是基于胶质层水解产物单糖组成的分析推测,因此具有一定的局限性和不确定性(Pilate et al., 2004)。Kaku等(2009)应用KOH-苯酚-H2SO4溶解体系检测出胶质层中纤维素含量约为78%。许多研究表明,除纤维素外,胶质层还含有半纤维素/多糖类成分和少量其他化合物(Nishikubo et al., 2007;Bowling et al., 2008;Kaku et al., 2009)。在胶质层中,纤维素大分子以微纤丝形式聚集成束状,微纤丝排列接近轴向,并具有较高的结晶度(Washusen et al., 2001;Müller et al., 2006)。
4.2 半纤维素/多糖类木葡聚糖是胶质层中主要的非纤维素组分之一。Nishikubo等(2007)在胶质层中发现了木葡聚糖和木葡聚糖合成蛋白,并基于多糖成分和多糖结构分析推断出木葡聚糖含量为10%~15%,中性糖含量分别为葡萄糖88.6%、木糖5.6%、甘露糖2.1%、岩藻糖1.3%、半乳糖1.1%、阿拉伯糖0.7%和鼠李糖0.6%。Mellerowicz等(2008)对独立胶质层的分析也得到相似结论,并检测出木葡聚糖存在于胶质层的形成过程中,一部分木葡聚糖处于纤维素晶体中,可产生纵向拉应力;另一部分木葡聚糖存在于胶质层和相邻次生壁层之间,起黏接作用,使胶质层产生的拉应力传递至整个胶质纤维。
阿拉伯半乳聚糖蛋白(AGPs)为胶质层中另一类重要的化合物基质。不同研究者采用不同研究手段均检测出胶质层中存在AGPs,如有些研究者通过单糖结构分析发现胶质层中存在AGPs,含量约为2%(Nishikubo et al., 2007;Mellerowicz et al., 2008);有些研究者应用生物化学技术证实胶质层中存在AGPs(Lafarguette et al., 2004;Bowling et al., 2008;Kaku et al., 2009)。在不同树种应拉木中,AGPs在胶质层中的分布也存在差异,如在北美枫香(Liquidambar styraciflua)和美洲朴树(Celtis occidentalis)应拉木中,AGPs在整个胶质层中均有分布,但在远离胞腔一侧分布较多(Bowling et al., 2008);而杨木(Populus tremula×P. alba)应拉木中,AGPs在靠近胞腔一侧分布较多(Lafarguette et al., 2004)。
RG-Ⅰ型果胶为胶质层多糖基质中的一种酸性聚合物,最初由Wardrop等(1948)通过组织化学染色方法在王桉应拉木中发现,之后在其他树种应拉木中也发现其普遍存在(Furuya et al., 1970;Scurfield,1972;Bowling et al., 2008)。
胶质层中还存在少量的葡甘聚糖和木聚糖。葡甘聚糖最早由Nishikubo等(2007)从银白杨(Populus alba)应拉木分离出的胶质层中检测到。而对胶质层中是否含有木聚糖,不同研究者持有不同观点。Bowling等(2008)通过免疫细胞化学方法,在北美枫香和美洲朴树应拉木胶质纤维次生壁S1和S2层中发现木聚糖,而在胶质层和初生壁中未发现。Kim等(2012)应用免疫定位技术对欧洲山杨(Populus tremula)应拉木进行观察,证实胶质层中存在葡甘聚糖和少量的木聚糖,并从微观层面展示了葡甘聚糖和木聚糖在胶质层中的分布,但葡甘聚糖和木聚糖在胶质层中的作用尚不明确。
4.3 木质素应拉木纤维细胞的木质化程度低于正常木纤维,研究者将其归因于胶质层(Furuya et al., 1970;刘盛全等,1996;Pilate et al., 2004)。目前有关木质素在胶质层中的存在和分布争议较大,不同研究者对此持不同观点(Pilate et al., 2004)。有学者认为胶质层中不含木质素(Norberg et al., 1966;Nishikubo et al., 2007;Kaku et al., 2009),而有学者认为胶质层中存在极少量的木质素(Prodhan et al., 1995;Yoshida et al., 2002;Joseleau et al., 2004)。在某些应拉木树种中,部分胶质层可能局部木质化,尤其在正常木和应拉木的交界处,木质化现象较普遍(Scurfield et al., 1963;Yoshida et al., 2002)。这种分歧可能来自于研究方式带来的局限和样本选取部位的差异。对木质素在胶质层中的分布,不同研究者也持有不同观点。Yoshida等(2002)通过紫外分光光度法,发现木质素存在于整个胶质层中,Joseleau等(2004)应用免疫标记技术,认为木质素更多地分布在胶质层靠近胞腔一侧,而Prodhan等(1995)采用高锰酸钾对应拉木组织染色后于透射电子显微镜下观察发现,在胶质层邻近次生壁层一侧木质素分布较多。但对于胶质层中木质素的具体含量,当前仍缺乏明确的定量分析。
木质素在细胞壁中起硬固作用,由于胶质层中木质素含量较低,胶质层在形态上往往呈现柔软蓬松状,与相邻壁层的结合处属于薄弱区域,也是传统显微切片制作中最易分离的部位。当压缩应力作用于应拉木时,因胶质纤维木质化程度低,微纤丝间孔隙缺少木质素填充,长而细的纤维易发生弯曲,产生滑移或扭曲,致使抗压强度普遍较正常木低(Ruelle,2006)。
4.4 胶质层与相邻次生壁层的比较采用免疫组织化学技术(Bowling et al., 2008;Kim et al., 2012)和显微光谱技术(Gierlinger et al., 2008;Gorzsás et al., 2011)对应拉木胶质层的化学成分进行分析,结果发现其化学成分与相邻次生壁层间存在显著差异,如表 1所示(Timell,1967;Mellerowicz et al., 2001;2008;Joseleau et al., 2004;Gierlinger et al., 2006;Müller et al., 2006;Nishikubo et al., 2007;Lehringer et al., 2008;Baba et al., 2009;Kaku et al., 2009;Kim et al., 2012)。相比相邻次生壁层,胶质层中的纤维素含量显著增加,木质素含量显著降低,并含有一定量的RG-Ⅰ型果胶。胶质层与相邻次生壁层中的非纤维素多糖成分组成区别很大。胶质层中的非纤维素多糖以木葡聚糖为主,占10%~15%,此成分未发现于相邻次生壁层(Nishikubo et al., 2007;Mellerowicz et al., 2008;Kaku et al., 2009);而相邻次生壁层以木聚糖为主,仅少量存在于胶质层(Kim et al., 2012)。胶质层与相邻次生壁层化学成分的差异,可能是应拉木形成过程对其化学组分的合成路径及程度的影响作用(Kim et al., 2012)。
|
|
为适应环境变化并维持树木的定向生长,阔叶树材在树干一侧迅速生长,形成具有异常组织结构的应拉木。在天然阔叶林中,通常树木发生倾斜、弯曲和偏冠时才出现应拉木。然而在人工林速生树种的垂直树干中,特别是在速生杨树和桉树中,也大量存在应拉木,但其结构、性质与正常材差异很大,给木材加工利用带来了一系列问题。因此当前学术界和工业界亟需解决的是主要人工林树种中易形成应拉木的树种比率、应拉木中具有胶质纤维的树种比率及应拉木的形成原因等科学问题,这对如何高效高值利用我国现有人工林资源具有重要意义。其次,在对我国人工林树种进行研究的基础上,具体探索应拉木和胶质纤维的各项机制和特性,特别是其结构与其生物学功能间的关系。随着新的测试技术和研究方法的不断涌现和运用,对应拉木胶质层的细胞形态、化学成分和超微结构等方面研究取得了许多进展,研究报道明显增多,但仍然存在许多不足,主要表现在:
1) 目前针对应拉木胶质层的研究大多基于已成熟的应拉木胶质纤维,对其成熟过程中所伴随的结构和功能等方面的动态变化,尤其是不同发育阶段胶质层的结构、性质等动态变化分析很少涉及。随着细胞生物学研究的发展,木材细胞壁已不再被视为一种刚性的、无生命活力的机械支架,而逐渐被认为是一个动态的、参与了多种细胞活动(如生长、分化、识别、抗病等)的结构形式。胶质层主要由纤维素、半纤维素和果胶等成分组成,在细胞发育的不同阶段,这些组分如何相互联结和相互作用,以及在细胞受到内外环境刺激时如何产生与其生物学功能高度适应的分子结构等是应拉木胶质层研究的一个重要问题,同时对此方面的研究将有助于深入了解胶质层在应拉木高拉伸应力产生中的作用。
2) 应拉木胶质层的多孔结构是全面认识应拉木生物学功能和深入探究应拉木高拉伸应力产生机制的关键所在,但目前对胶质层多孔结构的表征方法较单一,无法真实反映胶质层的多尺度结构特征。对胶质层孔隙结构进行表征解析时,可参考多孔材料学理论与分形理论,通过二维和三维显微图像,将传统表征方法和新兴表征方法相结合,多方法、多角度对孔隙结构进行定性和定量表征,通过图像重构技术构建孔隙结构模型,对液体在应拉木孔隙间的渗透规律进行预测,以丰富应拉木和独立胶质层的生物结构基础理论知识,同时为定向制备高性能仿生新材料和生物模板等应用提供可靠的生物学基础和技术支持。
3) 对具有胶质层的应拉木研究较多,对不具胶质层的应拉木研究相对较少。胶质层是应拉木纤维细胞特有的壁层结构,但许多树种应拉木的纤维胞腔内往往不具胶质层,仍具有与胶质层相似的物理性质和功能。对缺失胶质层应拉木的相应细胞结构和化学成分变化进行研究,并与胶质层进行比较,无疑会更加丰富应拉木形成机制的理论基础。
4) 应拉木形成和发育调控机制方面的研究较少,特别是应拉木木质部细胞壁形成过程中遗传基因变化和激素调控等研究非常有限。从生物分子角度来看,应拉木胶质层的形成受植物内源激素的影响,今后可针对应拉木胶质层形成过程中内源激素的种类、含量、分布及其与微细构造演化规律间的关系进行研究,并对不同生长发育阶段进行微调控,这样可有效控制应拉木的产生,从而降低木材加工利用缺陷,提高木材价值和利用率。
苌姗姗, 胡进波, 赵广杰. 2011a. 不同干燥预处理对杨木应拉木孔隙结构的影响[J]. 北京林业大学学报, 33(2): 91-95. (Chang S S, Hu J B, Zhao G J. 2011a. Effects of different drying pretreatments on pore structure of poplar tension wood[J]. Journal of Beijing Forestry University, 33(2): 91-95. [in Chinese]) |
苌姗姗, 胡进波, ClairB, 等. 2011b. 氮气吸附法表征杨木应拉木的孔隙结构[J]. 林业科学, 47(10): 134-140. (Chang S S, Hu J B, Clair B, et al. 2011b. Pore structure characterization of poplar tension wood by nitrogen adsorption-desorption method[J]. Scientia Silvae Sinicae, 47(10): 134-140. [in Chinese]) |
李坚. 1995. 木材科学[M]. 哈尔滨: 东北林业大学出版社. (Li J. 1995. Wood science[M]. Harbin: Northeast Forestry University Press. [in Chinese]) |
刘盛全, 江泽慧. 1996. 刺楸木材应拉木材性研究[J]. 林业科学, 32(5): 470-475. (Liu S Q, Jiang Z H. 1996. Study on the properties of tension wood in Kalopanax septemlobus (Thunb.) Koidz[J]. Scientia Silvae Sinicae, 32(5): 470-475. [in Chinese]) |
刘一星, 赵广杰. 2012. 木材学[M]. 北京: 中国林业出版社: 143-148. (Liu Y X, Zhao G J. 2012. Wood science[M]. Beijing: China Forestry Publishing House: 143-148. [in Chinese]) |
谭维. 2012. 木材的宏观和微观识别[J]. 黑龙江科技信息, (18): 225. (Tan W. 2012. Macroscopic and microscopic identification of wood[J]. Heilongjiang Science and Technology Information. DOI:10.3969/j.issn.1673-1328.2012.18.247 [in Chinese]) |
王哲, 王喜明. 2014. 木材多尺度孔隙结构及表征方法研究进展[J]. 林业科学, 50(10): 123-133. (Wang Z, Wang X M. 2014. Research progress of multi-scale pore structure and characterization methods of wood[J]. Scientia Silvae Sinicae, 50(10): 123-133. [in Chinese]) |
赵广杰. 2002. 木材中的纳米尺度、纳米木材及木材-无机纳米复合材料[J]. 北京林业大学学报, 24(5/6): 204-207. (Zhao G J. 2002. Nano-dimensions in wood, nano-wood, wood and inorganic nano-composites[J]. Journal of Beijing Forestry University, 24(5/6): 204-207. [in Chinese]) |
Baba K, Park Y W, Kaku T, et al. 2009. Xyloglucan for generating tensile stress to bend tree stem[J]. Molecular Plant, 2(5): 893-903. DOI:10.1093/mp/ssp054 |
Barnett J R, Jeronimidis G. 2003. Reaction wood//Barnett J R, Jeronimidis G. Wood quality and its biological basis. Blackwell Publishing, 119-136.
|
Bowling A J, Vaughn K C. 2008. Immunocytochemical characterization of tension wood:gelatinous fibers contain more than just cellulose[J]. American Journal of Botany, 95(6): 655-663. DOI:10.3732/ajb.2007368 |
Chang S S. 2014. Study of macromolecular and structural modifications occurring during the building of the tension wood cell wall:a contribution to the understanding of the maturation stress generation in tree[J]. PhD thesis, University Montpellier Ⅱ, Montpellier, France. |
Chang S S, Clair B, Ruelle J, et al. 2009. Mesoporosity as a new parameter for understanding tension stress generation in trees[J]. Journal of Experimental Botany, 60(11): 3023-3030. DOI:10.1093/jxb/erp133 |
Clair B, Alméras T, Pilate G, et al. 2011. Maturation stress generation in poplar tension wood studied by synchrotron radiation microdiffraction[J]. Plant Physiology, 155: 562-570. DOI:10.1104/pp.110.167270 |
Clair B, Alméras T, Yamamoto H, et al. 2006. Mechanical state of native cellulose microfibrils in tension wood[J]. Biophysical Journal, 91(3): 1128-1135. DOI:10.1529/biophysj.105.078485 |
Clair B, Gril J, Di Renzo F, et al. 2008. Characterization of a gel in the cell wall to elucidate the paradoxical shrinkage of tension wood[J]. Biomacromolecules, 9(2): 494-498. DOI:10.1021/bm700987q |
Clair B, Thibault B. 2001. Shrinkage of the gelatinous layer of poplar and beech tension wood[J]. IAWA Journal, 22(2): 121-131. DOI:10.1163/22941932-90000273 |
Clair B, Thibaut B, Sugiyama J. 2005. On the detachment of the gelatinous layer in tension wood fiber[J]. Journal of Wood Science, 51(3): 218-221. DOI:10.1007/s10086-004-0648-9 |
Fahlen J, Salmen L. 2003. Cross-sectional structure of the secondary wall of wood fibers as affected by processing[J]. Journal of Materials Science, 38(1): 119-126. DOI:10.1023/A:1021174118468 |
Fang C H, Clair B, Gril J, et al. 2007. Transverse shrinkage in G-fibers as a function of cell wall layering and growth strain[J]. Wood Science and Technology, 41(8): 65-671. |
Fisher J B, Stevenson J W. 1981. Occurrence of reaction wood in branches of dicotyledons and its role in tree architecture[J]. Botanical Gazette, 142(1): 82-95. DOI:10.1086/337199 |
Fournier M, Alméras T, Clair B, et al. 2014. Biomechanical action and biological functions//Gardiner B, Barnett J, Saranpää P, et al. The biology of reaction wood. Springer Heidelberg, 139-169.
|
Furuya N, Takahashi S, Miyazaki M. 1970. The chemical composition of gelatinous layer from the tension wood of Populus euroamericana[J]. Journal of the Japanese Wood Research Society, 16(1): 26-30. |
Gardiner B, Barnett J, Saranpää P, Gril J. 2014. The biology of reaction wood[J]. Springer Series in Wood Science, Springer-Verlag Berlin Heidelberg. |
Gierlinger N, Sapei L, Paris O. 2008. Insights into the chemical composition of Equisetum hyemale by high resolution Raman imaging[J]. Planta, 227(5): 969-980. DOI:10.1007/s00425-007-0671-3 |
Gierlinger N, Schwanninger M. 2006. Chemical imaging of poplar wood cell walls by confocal Raman microscopy[J]. Plant Physiol, 140(4): 1246-1254. DOI:10.1104/pp.105.066993 |
Gorshkova T A, Gurjanov O P, Mikshina P V, et al. 2010. Specific type of secondary cell wall formed by plant fibers[J]. Russian Journal of Plant Physiology, 57(3): 328-341. DOI:10.1134/S1021443710030040 |
Gorzsás A, Stenlund H, Persson P, et al. 2011. Cell-specific chemotyping and multivariate imaging by combined FT-IR microspectroscopy and OPLS analysis reveals the chemical landscape of secondary xylem[J]. The Plant Journal, 66(5): 903-914. DOI:10.1111/j.1365-313X.2011.04542.x |
Goswami L, Dunlop J W, Jungnikl K, et al. 2008. Stress generation in the tension wood of poplar is based on the lateral swelling power of the G-layer[J]. The Plant Journal, 56(4): 531-538. DOI:10.1111/tpj.2008.56.issue-4 |
Horikawa Y, Clair B, Sugiyama J. 2009. Varietal difference in cellulose microfibril dimensions observed by infrared spectroscopy[J]. Cellulose, 16(1): 1-8. |
Isebrands J G, Bensend D W. 1972. Incidence and structure of gelatinous fibers within rapid-growing eastern cottonwood[J]. Wood and Fiber Science, 4(2): 61-71. |
Joseleau J P, Imai T, Kuroda K, et al. 2004. Detection in situ and characterization of lignin in the G-layer of tension wood fibres of Populus deltoids[J]. Planta, 219(2): 338-345. DOI:10.1007/s00425-004-1226-5 |
Kaku T, Serada S, Bada K, et al. 2009. Proteomic analysis of the G-layer in poplar tension wood[J]. Journal of Wood Science, 55(4): 250-257. DOI:10.1007/s10086-009-1032-6 |
Kim J S, Daniel G. 2012. Distribution of glucomannans and xylans in poplar xylem and their changes under tension stress[J]. Planta, 236(1): 35-50. DOI:10.1007/s00425-012-1588-z |
Lafarguette F, Leplé J C, Déjardin A, et al. 2004. Poplar genes encoding fasciclin-like arabinogalactan proteins are highly expressed in tension wood[J]. New Phytologist, 164(1): 107-121. DOI:10.1111/j.1469-8137.2004.01175.x |
Lehringer C, Gierlinger N, Koch G. 2008. Topochemical investigation on tension wood fibres of Acer spp., Fagus sylvatica L. and Quercus robur L[J]. Holzforschung, 62(3): 255-263. |
Mellerowicz E J, Baucher M, Sundberg B, et al. 2001. Unraveling cell wall formation in the woody dicot stem[J]. Plant Molecular Biology, 47: 239-274. DOI:10.1023/A:1010699919325 |
Mellerowicz E J, Immerzeel P, Hayashi T. 2008. Botanical briefing xyloglucan:the molecular muscle of trees[J]. Annals of Botany, 102(5): 659-665. DOI:10.1093/aob/mcn170 |
Müller M, Burghammer M, Sugiyama J. 2006. Direct investigation of the structural properties of tension wood cellulose microfibrils using microbeam X-ray fibre diffraction[J]. Holzforschung, 60(5): 474-479. |
Nishikubo N, Awano T, Banasiak A, et al. 2007. Xyloglucan endo-transglycosylase (XET) functions in gelatinous layers of tension wood fibers in poplar-a glimpse into the mechanism of the balancing act of trees[J]. Plant and Cell Physiology, 48(6): 843-855. DOI:10.1093/pcp/pcm055 |
Norberg H, Meier H. 1966. Physical and chemical properties of the gelatinous layer in tension wood fiber of aspen (Populus tremula L.)[J]. Holzforschung, 20(6): 174-178. DOI:10.1515/hfsg.1966.20.6.174 |
Onaka F. 1949. Studies of compression-and tension-wood[J]. Mokuzai Kenkyu, 24(3): 1-88. |
Panshin A J, de Zeeuw C. 1980. Textbook of Wood Technology[M]. New York: Mc Graw-Hill Book Co..
|
Pilate G, Chabbert B, Cathala B, et al. 2004. Lignification and tension wood[J]. Comptes Rendus Biologies, 327(9): 889-901. |
Prodhan A, Ohtani J, Funada R, et al. 1995. Ultrastructural investigation of tension wood fibre in Fraxinus mandshurica Rupr. var[J]. Japonica Maxim. Annals of Botany, 75(3): 311-317. |
Qiu D, Wilson I W, Gan S, et al. 2008. Gene expression in Eucalyptus branch wood with marked variation in cellulose microfibril orientation and lacking G-layers[J]. New Phytologist, 179(1): 94-103. DOI:10.1111/nph.2008.179.issue-1 |
Rao R V, Dayal R, Sharma B. 1983. Studies on the nature and pattern of distribution of tension wood in Hevea brasiliensis Muell[J]. Arg. (rubber wood). Indian Forester, 109(5): 286-291. |
Roussel J R, Clair B. 2015. Evidence of the late lignification of the G-layer in Simarouba tension wood, to assist understanding how non-G-layer species produce tensile stress[J]. Tree Physiology, 35(12): 1366-1377. DOI:10.1093/treephys/tpv082 |
Ruelle J. 2006. Analyse de la diversité du bois de tension de 3 espèces d'angiospermes de forêt tropicale humide de Guyane Française[J]. Thesis, Forest and wood science Université Antilles Guyane. Cayenne: 210. |
Ruelle J, Beauchene J, Thibaut A, et al. 2007a. Comparison of physical and mechanical properties of tension and opposite wood from ten tropical rainforest trees from different species[J]. Annals of Forest Science, 64(5): 503-510. DOI:10.1051/forest:2007027 |
Ruelle J, Clair B, Beauchene J, et al. 2006. Tension wood and opposite wood in 21 tropical rain forest species. 2[J]. Comparison of some anatomical and ultrastructural criteria. IAWA Journal, 27(4): 341-376. |
Ruelle J, Yamamoto H, Thibaut B. 2007b. Growth stresses and cellulose structural parameters in tension and normal wood from three tropical rainforest angiosperms species[J]. BioResources, 2(2): 235-251. |
Sachsse H. 1965. Untersuchungen uber eigenschaften und funktionsweise des zugholzes der laubbaume[J]. Schriftenreihe der Forstlichen Fakultat der Universitat Gottingen: 35. |
Scurfield G. 1972. Histochemistry of reaction wood cell walls in two species of Eucalyptus and in Triatania conferta R. BR[J]. American Journal of Botany, 20(1): 9-26. |
Scurfield G, Wardrop A B. 1963. The nature of reaction wood. Ⅶ. Lignification in reaction wood[J]. Australian Journal of Botany, 11(2): 107-116. DOI:10.1071/BT9630107 |
Thibaut B, Gril J, Fournier M. 2001. Mechanics of wood and trees:some new highlights for an old story[J]. Comptes Rendus de l'Academie des Sciences Series ⅡB-Mechanics, 329(9): 701-706. DOI:10.1016/S1620-7742(01)01380-0 |
Timell T E. 1967. Recent progress in the chemistry of wood hemicelluloses[J]. Wood Science and Technology, 1(1): 45-70. DOI:10.1007/BF00592255 |
Timell T E. 1986. Compression wood in gymnosperms. V.I.Bibliography, historical background, determination, structure, chemistry, topochemistry, physical properties, origins and formation of compression wood[J]. Springer, Heidelberg. |
Toghraie N D, Parsapajouh H, Ebrahimzadeh B, et al. 2006. Tension wood in eucalypt trees[J]. Journal of Science (University of Tehran), 32(1): 13-22. |
Wardrop A B. 1964. The reaction anatomy of arborescent angiosperms//Zimmermann M H. The formation of wood in forest tree. Academic, New York, 405-456.
|
Wardrop A B, Dadswell H E. 1948. The nature of reaction wood.1.The structure and properties of tension wood fibres[J]. Australian Journal of Scientific Research Series B-Biological Science, 1(1): 3-16. |
Wardrop A B, Dadswell H E. 1955. The nature of reaction wood. Ⅳ. Variations in cell wall organization of tension wood fibres[J]. Australian Journal of Botany, 3(2): 177-189. DOI:10.1071/BT9550177 |
Washusen R, Evans R. 2001. The association between cellulose crystallite width and tension wood occurrence in Eucalyptus globulus[J]. IAWA Journal, 22(3): 235-243. DOI:10.1163/22941932-90000281 |
Washusen R, Evans R, Southerton S. 2005. A study of Eucalyptus grandis and Eucalyptus globulus branch wood microstructure[J]. IAWA Journal, 26(2): 203-210. DOI:10.1163/22941932-90000112 |
Yoshida M, Ohta H, Yamamoto H, et al. 2002. Tensile growth stress and lignin distribution in the cell walls of yellow poplar, Liriodendron tulipifera Linn[J]. Trees, 16(7): 457-464. DOI:10.1007/s00468-002-0186-2 |
 2018, Vol. 54
2018, Vol. 54

