文章信息
- 魏永成, 刘青华, 周志春, 徐六一, 陈雪莲, 郝焰平
- Wei Yongcheng, Liu Qinghua, Zhou Zhichun, Xu Liuyi, Chen Xuelian, Hao Yanping
- 不同抗性马尾松接种松材线虫后针叶内化学信号物质的变化
- Changes of Chemical Signals in Needles of Pinus massoniana with Different Resistance after Inoculation of Pine Wood Nematode
- 林业科学, 2018, 54(2): 119-125.
- Scientia Silvae Sinicae, 2018, 54(2): 119-125.
- DOI: 10.11707/j.1001-7488.20180213
-
文章历史
- 收稿日期:2016-11-08
- 修回日期:2017-03-07
-
作者相关文章
2. 安徽省林业科学研究院 合肥 230031
2. Anhui Academy of Forestry Hefei 230031
松材线虫病(pine wilt disease)又称松树萎蔫病或松树枯萎病, 是由松材线虫(Bursaphelenchus xylophilus)寄生在松树体内引发的一种特大毁灭性森林病害, 该病蔓延速度快, 染病植株死亡率高, 被称为“森林癌症”, 严重危害着森林生态安全, 并给林业带来巨大经济损失(Wang et al., 2010; Vicente et al., 2012)。松属(Pinus)中被松材线虫危害过的植株并不会全部死亡, 即使在同一树种中也存在抗松材线虫病的基因型(杨宝君等, 1995), 利用抗病品种替代易感品种是防治森林病害最经济、最有效的途径。日本于1978年率先开始抗性育种, 通过一套完整的选育程序, 选育出208个日本赤松(P.densiflora)和110个日本黑松(P.thunbergii)抗性无性系, 死亡率较未选择林分分别提高16%和40%(Tada et al., 2004)。我国在20世纪90年代也开展了抗松材线虫育种, 目前已选出一批抗性种源、家系和无性系(刘伟等, 1995; 徐福元等, 1998; 杨宝君等, 1999; 章健等, 2012), 但对松树的抗性机制了解较少。
活性氧(ROS)作为一种重要信号分子在植物体生命活动的多方面发挥着关键作用(Barceló et al., 1970)。活性氧包括超氧阴离子(
马尾松(Pinus massoniana)速生、耐干旱瘠薄、适应性强, 是我国主要的速生丰产用材林和高产脂用林造林树种之一, 广泛分布于南方14个省(区、市), 依据第八次全国森林资源调查结果马尾松林分面积达1 001万hm2, 为松材线虫主要危害对象之一。因此, 本研究以通过2次强度接种选育出来的高抗和易感马尾松无性系为试验材料, 研究ROS、NO和Ca2+等多种防御信号转导分子在接种松材线虫后不同时间点的变化差异, 解析在防御反应中信号转导分子的动态变化特征, 为阐明马尾松的抗性机制提供理论依据。
1 材料与方法 1.1 试验地概况试验地选在安徽省林业科学研究院苗圃, 地理坐标为31°51′N, 117°10′E, 属亚热带湿润季风气候, 年均气温15.7 ℃左右, 年均日照时数2 100 h左右, 年均降水量1 000 mm左右, 全年无霜期228天左右, 四季分明, 自然条件优越。
1.2 供试植株和接种根据安徽省林业科学研究院选育出的马尾松松材线虫病抗性无性系抗性指数, 选择高抗无性系“休宁-5”、易感无性系“黄山-1”各30株, 皆为5年生。在天气晴好、气温维持在30 ℃左右时接种, 接种时间为2015年7月25日, 线虫为高致病性“广株3B”和“全4”混合株系。接种时采用斜切接种法:在当年生枝条结节下5 cm处, 沿枝干斜切入木质部, 切口深约1 mm、长约5 cm, 随后用锯齿在裸露的木质部上刮几下(模拟天牛咬食痕, 同时防止接入的悬浮液下滑), 迅速将线虫悬浮液200 μL(约含10 000头线虫)均匀注入切口处。对高抗和易感马尾松剩余的各15株注入等量蒸馏水, 作为接种松材线虫的对照。
1.3 取样及检测方法依据前期接种试验观察, 易感马尾松在接种后15天部分针叶开始出现变黄现象, 接种30天有接种枝条枯萎死亡, 接种后50天后会大部分死亡。为了检测不同时间松材线虫侵染情况, 在接种后第1、7、15、30、50天时截取接种口上方(靠近枝条顶端)2~7 cm茎段、下方(靠近树干方向)2~7 cm茎段和侧枝结节以上5 cm茎段, 剪碎后利用贝尔曼漏斗法分离松材线虫(Dai et al., 2014), 统计不同时间的松材线虫数量。
本试验依次在接种后第1、3、7、15、30天取距离接种口位置相同处的当年生嫩枝针叶, 每个时间点取同一无性系的3株作为生物学重复。采集的嫩叶立即投入液氮中, 置于-80 ℃冰箱中保存。
采用KI法测定马尾松叶片中H2O2含量, 羟氨氧化法测定超氧阴离子自由基(
采用SPSS19软件对数据进行方差分析及Ducan多重比较, 采用EXCEL 2007软件作图。
2 结果与分析 2.1 接种后松材线虫在不同抗性马尾松体内不同部位的分布接种松材线虫后, 不同抗性马尾松体内松材线虫数量差异显著。其中, 易感马尾松体内松材线虫数量在接种后1~15天时呈暴发式增长, 15天时达到最大值(5 173条), 随着针叶变黄枯萎程度加重, 存活的松材线虫数量降低; 而高抗马尾松在整个侵染过程中, 体内未检测到松材线虫或仅有未达到统计学意义的少量松材线虫存在(图 1)。
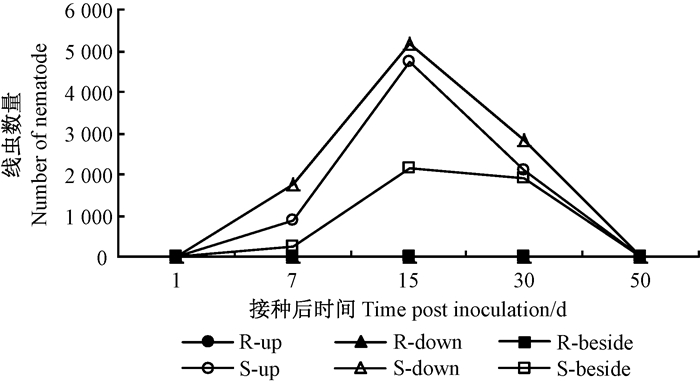
|
图 1 不同抗性马尾松体内松材线虫数量 Figure 1 Number of nematode in different resistant P.massoniana R.高抗无性系接种口 Inoculation spot in high resistant clones; S.易感无性系接口 Inoculation spot in susceptible clones. up.上方 Above the spot; down.下方 Below the spot; beside.侧枝 Lateral branch. |
在易感马尾松接种口上方、下方和侧枝均检测到松材线虫, 但不同部位的松材线虫数量存在较大差异。其中, 接种口下方茎段中松材线虫最多, 表明松材线虫首先沿成熟树脂道迅速侵袭树干并逐渐蔓延至其他部位。侵袭后期, 枝条逐渐枯萎死亡, 松材线虫迁移至其他部位, 数量降低。高抗马尾松接种口上方、下方和侧枝茎内均未检测到松材线虫。
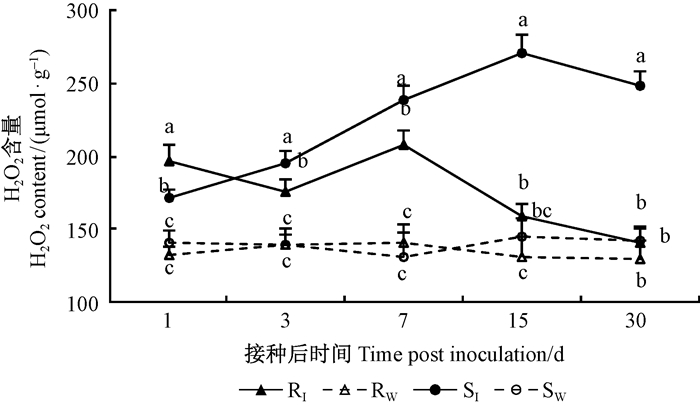
2.2 接种松材线虫后马尾松针叶内H2O2的动态变化对同一时间点不同处理间马尾松针叶内H2O2含量进行方差分析, 发现各时间点差异均达到显著或极显著水平(表 1)。在接种后第1天, 高抗马尾松(RI)和易感马尾松(SI)针叶内H2O2含量均显著升高, 约高于各自对照处理(Rw和Sw)的48.04%和21.70%, 且RI针叶内H2O2含量高于SI。随后SI针叶内H2O2含量继续升高, 在接种后第3、7、15和30天, H2O2含量均显著高于RI和SW, 且在第15天达到最高, 约为269.8 μmol·g-1。而RI针叶内H2O2含量虽然在接种后第1、3、7天显著高于其对照Rw, 但之后H2O2含量下降, 在接种后第15、30天, 针叶内H2O2含量已与Rw相近, 差异不显著(图 2)。该结果表明, 高抗马尾松对多余的H2O2具有更强的清除能力。
|
|
|
图 2 不同抗性马尾松针叶内H2O2含量的多重比较 Figure 2 Multiple comparison of H2O2 content at five time points in different resistant P.massoniana 字母表示同一时间点不同处理间的差异显著性(P < 0.05) The different letters showed significant difference between mean values (P < 0.05). RI、RW:高抗无性系及对照 High resistant clone and its CK. SI、SW:易感无性系及对照 Suceptible clone and its CK. |
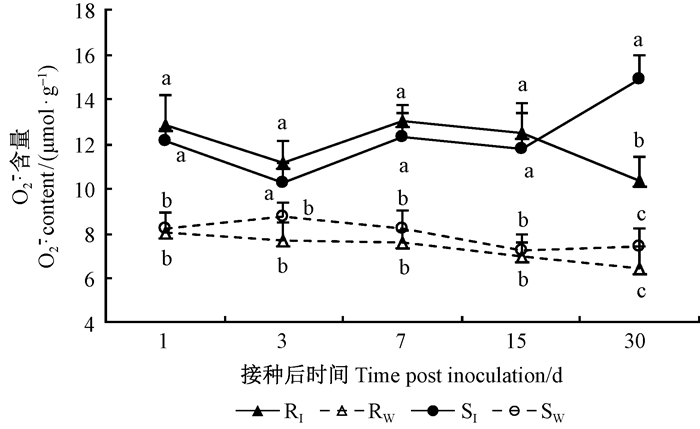
对同一时间点不同处理间马尾松针叶内
|
图 3 不同抗性马尾松针叶内 |
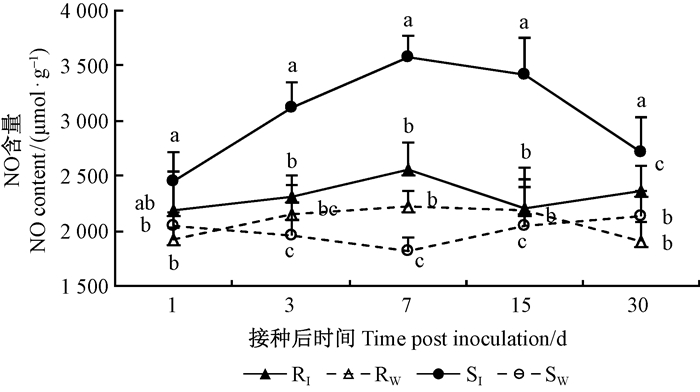
对同一时间点不同处理间马尾松针叶内NO含量进行方差分析, 发现各时间点差异也达到显著或极显著水平(表 1)。接种松材线虫后, SI针叶内NO含量显著升高, 其中在接种后第7天含量最高, 达3 468 μmol·g-1, 之后NO含量下降, 但仍显著高于Sw, 比对照高31.74%;RI针叶内NO含量虽有升高, 但除在接种后第30天RI显著高于Rw外, 其他时间点RI与Rw差异未达到显著水平。同时, SI针叶内NO含量始终高于RI, 在接种后1~30天, 含量为RI的11.91%~54.98%, 其中在接种后第15天SI与RI的差异达到最大(图 4)。
|
图 4 不同抗性马尾松针叶内NO含量的多重比较 Figure 4 Multiple comparison of NO content at five time points in different resistant P.massoniana |
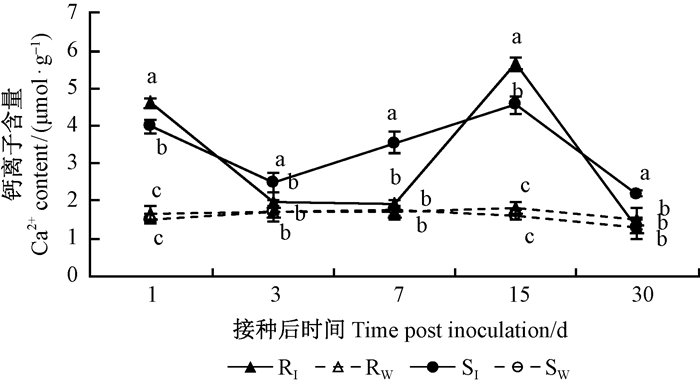
接种松材线虫后第1天, RI和SI针叶内Ca2+含量均显著升高, 分别是其对照的2.78和2.62倍(图 5)。相对于接种后第1天, RI内Ca2+含量在接种后第3天和第7天呈降低趋势, 与Rw差异不显著, 含量仅为1.17和1.74 μmol·g-1, 而在接种后第15天, Ca2+含量又迅速升高至最大值5.66 μmol·g-1, 至接种后第30天, RI针叶内Ca2+含量已恢复到Rw水平。而SI变化趋势与RI基本相似, 呈现“升-降-升-降”的趋势, 但在接种后各个时间点, SI针叶内Ca2+含量均高于SW。接种松材线虫后, RI与SI在各个时间点差异也较显著, 其中在接种后第1天和第15天, RI针叶内Ca2+含量显著高于SI, 但在接种后第3、7和30天, SI针叶内Ca2+含量显著高于RI。
|
图 5 不同抗性马尾松针叶内Ca2+含量的多重比较 Figure 5 Multiple comparison of Ca2+ content at five time points in different resistant P.massoniana |
松树的抗病性可能与其产生的次生代谢物质有直接关系, 作为传递植物受胁迫的信号分子, 如活性氧(ROS)、NO和Ca2+等受到越来越多的关注(Pereira et al., 2011; Hossain et al., 2014; Zhang et al., 2014)。俞禄珍等(2013)研究H2O2在黑松-松材线虫早期互作应答中的调控作用时发现, 黑松受到松材线虫侵染后, 体内产生大量的H2O2, 影响寄主体内抗氧化保护酶活性、苯丙烷代谢途径的表达, 加速感病症状。何龙喜等(2010)对不同抗性树种感染松材线虫后针叶内H2O2含量进行分析, 发现高度感病树种黑松和中度感病树种马尾松在接种后针叶内H2O2含量远高于高度抗病树种火炬松(Pinus taeda)。本研究表明, 马尾松接种松材线虫后, 体内活性氧(ROS)、NO和Ca2+含量均发生了显著变化, 其中高抗和易感马尾松在接种后初期, H2O2和
NO与ROS互作可以共同诱导细胞过敏性反应和细胞膜质过氧化, 这是植物抗病反应中的关键性生理生化过程(何龙喜, 2011)。Tada等(2004)研究发现, 细胞过敏反应从原发细胞向周围扩增过程中, 需要细胞间NO介导。NO浓度适量时会抑制过氧化物酶和过氧化氢酶的活性, 由此降低膜脂的过氧化, 对植物起到保护作用, 而高浓度的NO则会与ROS一起形成具有强氧化性的过氧亚硝酸, 对植物细胞具有毒害作用(Beligni et al., 1999)。本研究中易感马尾松接种松材线虫后, 针叶内NO即大量增加, 但高抗马尾松接种松材线虫后第1、3、7、15天, 其NO含量与对照差异不显著, 仅在接种后30天NO含量才显著高于对照, 但显著低于SI。何龙喜等(2012)对不同松树感染松材线虫后针叶内NO含量的变化进行了分析, 认为接种松材线虫后, 高度感病树种黑松针叶内NO平均积累量最高, 而高度抗病树种火炬松虽然针叶内NO含量也升高, 但与黑松相比, 其积累量较低, 与本研究结果基本一致。Garcia等(2006)研究发现, 在植物防御中, H2O2和NO协同作用参与植物对外界刺激的防御反应, 二者都可能参与了细胞的程序性死亡过程。因此可推测易感马尾松由于体内ROS和NO剧增, 对植物细胞造成伤害; 而高抗马尾松在松材线虫入侵后, 通过增加ROS和NO的浓度来激活防御反应, 且多余的ROS可被有效清除, 使马尾松的生理代谢保持在正常水平。
细胞内Ca2+浓度的升高多在瞬间完成, 信号传递后又迅速恢复到静息状态(钙稳态), 否则对细胞将造成严重伤害。这种伤害主要表现在2方面:一是可能会使细胞内其他信号的传递受阻, 造成细胞代谢过程发生障碍, 二是如果细胞内长时间保持较高浓度的Ca2+, 则容易与细胞代谢过程产生的磷酸根发生化学反应, 产生大量磷酸钙沉淀, 这对细胞结构和功能是极为不利的(陈斌等, 2015)。本研究中高抗马尾松受到侵袭后, 立即产生大量Ca2+, 之后Ca2+恢复到稳态, 接种后15天Ca2+再次激增, 但在接种后30天Ca2+再次趋于稳态, 植株体内生理生化过程基本恢复正常。易感马尾松接种松材线虫后, 针叶内Ca2+含量始终高于对照, 可能对植株的伤害不断加重, 最终导致植株枯萎死亡, 证实了了金钢等(2007)和和徐亮(2013)对黑松和马尾松的研究结果。在遭受外界刺激时, 能够迅速恢复其细胞内Ca2+稳态的植物, 通常有着更强的抵御环境胁迫能力(龙书生, 2011), 本研究中高抗马尾松针叶内Ca2+在迅速增加后立即恢复稳态, 其抵御松材线虫的能力要高于易感马尾松, 验证了植物快速恢复Ca2+稳态的重要性。综上, ROS、NO和Ca2+在马尾松对松材线虫侵染的防御反应中均具有至关重要的作用, 表明马尾松抗松材线虫病途径是一个相互交织、彼此关联的复杂网络。
4 结论接种松材线虫后, 高抗与易感马尾松针叶内H2O2、
陈斌, 鲜鹏杰, 乔梁, 等. 2015. 昆虫钠离子通道基因突变及其与杀虫剂抗性关系的研究进展[J]. 昆虫学报, 58(10): 1116-1125. (Chen B, Xian P J, Qiao L, et al. 2015. Research progress in sodium channel gene mutations and their association with insecticide resistance of insects[J]. Acta Entomologica Sinica, 58(10): 1116-1125. [in Chinese]) |
何龙喜, 吴小芹, 吉静, 等. 2012. 不同松树感染松材线虫后NO和核酸酶变化与其抗病性的关系[J]. 林业科学, 48(1): 109-114. (He L X, Wu X Q, Ji J, et al. 2012. Role of nitric oxide and nucleases in different pine species inoculated with a nematode (Bursaphelenchus xylophilus) in their resistance to the infection[J]. Scientia Silvae Sinicae, 48(1): 109-114. DOI:10.11707/j.1001-7488.20120118 [in Chinese]) |
何龙喜, 吴小芹, 俞禄珍, 等. 2010. 不同抗性松树与松材线虫互作中H2O2及其氧化酶活性的差异[J]. 南京林业大学学报:自然科学版, 34(6): 13-17. (He L X, Wu X Q, Yu L Z, et al. 2010. The difference of H2O2 and oxidative enzyme in the interaction of different resistance pines and Bursaphelenchus xylophilus[J]. Journal of Nanjing Forestry University Natural Science Edition, 34(6): 13-17. [in Chinese]) |
何龙喜, 吴小芹, 俞禄珍. 2011. 不同松树与松材线虫互作中超氧自由基差异与病变的关系[J]. 南京林业大学学报:自然科学版, 35(2): 25-30. (He L X, Wu X Q, Yu L Z. 2011. The relationship between difference of superoxide anion and lesion in the interaction of different varieties of pines and Bursaphelenchus xylophilus[J]. Journal of Nanjing Forestry University:Natural Science Edition, 35(2): 25-30. [in Chinese]) |
金钢, 叶建仁. 2007. 不同致病力线虫接种黑松后黑松的组织病理学变化[J]. 南京林业大学学报:自然科学版, 31(4): 115-120. (Jin G, Ye J R. 2007. Histopathological study on the nematode in seedling of Pinus thunbergii[J]. Journal of Nanjing Forestry University:Natural Science Edition, 31(4): 115-120. [in Chinese]) |
刘伟, 杨宝君. 1995. 松材线虫和拟松材线虫雄虫交合伞形状的比较[J]. 林业科学研究, 8(2): 223-225. (Liu W, Yang B J. 1995. Comparison on the shape of male spicules between Bursaphelenchus xylophilus and B.mucronatus[J]. Forest Research, 8(2): 223-225. [in Chinese]) |
龙书生. 2011. 活性氧、一氧化氮、细胞质游离钙离子和G蛋白在小麦对条锈菌过敏性坏死反应中的作用[J]. 杨凌:西北农林科技大学博士学位论文: 3-8. (Long S S. 2011. Roles of ROS, NO, cytoplasm Ca2+ and G-protein in the HR process of wheat to stripe rust[J]. Yangling:PhD thesis of Northwest A & F University: 3-8. [in Chinese]) |
王爱国, 罗广华. 1990. 植物的超氧物自由基与羟胺反应的定量关系[J]. 植物生理学通讯, (6): 55-57. (Wang A G, Luo G H. 1990. Quantitative relation between the reaction of hydroxylamine and superoxide anion radicals in plants[J]. Plant Physiology Communications, (6): 55-57. [in Chinese]) |
徐福元, 葛明宏, 汪企明, 等. 1998. 马尾松种源对松材线虫病的抗性[J]. 南京林业大学学报:自然科学版, 22(2): 29-33. (Xu F Y, Ge M H, Wang Q M, et al. 1998. Studies on the masson pine provenances resistance to pine wood nematode (PWN) disease in China[J]. Journal of Nanjing Forestry University:Natural Science Edition, 22(2): 29-33. [in Chinese]) |
徐亮. 2013. 马尾松响应松材线虫侵染的CaM和CaMBP钙信号转导特征[J]. 北京:北京林业大学博士学位论文: 15-28. (Xu L. 2013. Calcium signal transduction characteristics of CaM and CaMBP in interactions of Pinus massoniana and Bursaphelenchus xylophilus[J]. Beijing:PhD thesis of Beijing Forestry University: 15-28. [in Chinese]) |
杨宝君, 刘伟, 徐福元, 等. 1999. 松材线虫病树早期诊断的研究Ⅱ.松树品种、接种量及线虫来源对流胶法的影响[J]. 林业科学研究, 12(3): 251-255. (Yang B J, Liu W, Xu F Y, et al. 1999. Study on early diagnosis for pine wilt disease caused by Bursaphelenchus xylophilus Ⅱ.The eeffect of pine species, dose and nematode origin on oleoresin exudation method[J]. Froest Research, 12(3): 251-255. [in Chinese]) |
杨宝君, 朱克恭, 周元生, 等. 1995. 中国松材线虫病的流行与治理[M]. 北京: 中国林业出版社: 89-103. (Yang B J, Zhu K G, Zhou Y S, et al. 1995. The epidemic and control of pine wilt disease in China[M]. Beijing: China Forestry Publishing House: 89-103. [in Chinese]) |
俞禄珍, 吴小芹, 叶建仁, 等. 2013. H2O2在黑松-松材线虫早期互作应答中的调控作用[J]. 中国科学:生命科学, 43(4): 351-360. (Yu L Z, Wu X Q, Ye J R, et al. 2013. The role of hydrogen peroxide during the early interactions between Pinus thunbergii and Bursaphelenchus xylophilus[J]. Scientia Sinica Vitae, 43(4): 351-360. [in Chinese]) |
章健, 徐六一, 高景斌, 等. 2012. 抗松材线虫病马尾松无性系种子园营建技术[J]. 林业科技开发, 26(1): 82-85. (Zhang J, Xu L Y, Gao J B, et al. 2012. Technique on the establishment of a clonal seed orchard in Pinus massoniana for resistance to Bursaphelenchus xylophilus[J]. China Forestry Science and Technology, 26(1): 82-85. [in Chinese]) |
Barceló A R, Gomez R L V. 1970. Reactive oxygen species in plant cell walls[J]. Reactive Oxygen Species in Plant Signaling: 73-93. |
Beligni M V, Lamattina L. 1999. Is nitric oxide toxic or protective?[J]. Trend in Plant Science, 4: 299-300. DOI:10.1016/S1360-1385(99)01451-X |
Camejo D, Martí M C, Jiménez A, et al. 2011. Effect of oligogalacturonides on root length, extracellular alkalinization and |
Clark G, Wu M, Wat N, et al. 2010. Both the stimulation and inhibition of root hair growth induced by extracellular nucleotides in Arabidopsis are mediated by nitric oxide and reactive oxygen species[J]. Plant Mol Biol, 74(4/5): 423-435. |
Dai K, Yonemichi T, Inoue H, et al. 2014. Comparison of histological responses and tissue damage expansion between resistant and susceptible Pinus thunbergii, infected with pine wood nematode Bursaphelenchus xylophilus[J]. Journal of Forest Research, 19(2): 285-294. DOI:10.1007/s10310-013-0417-y |
Durner J, Wendehenne D, Klessig D F. 1998. Defense gene induction in tobacco by nitric oxide, cyclic GMP and cyclic ADP-ribose[J]. Proc Natl Acad Sci USA, 95(17): 10328-10333. DOI:10.1073/pnas.95.17.10328 |
Foyer C H, Noctor G. 2005. Oxidant and antioxidant signalling in plants:a re-evaluation of the concept of oxidative stress in a physiological context[J]. Plant Cell Environ, 28: 1056-1071. DOI:10.1111/pce.2005.28.issue-8 |
Garcia B A, Lamotte O, Vandelle E, et al. 2006. Early signaling events induced by elicitors of plant defenses[J]. Molecular Plant-Microbe Interactions, 19(7): 711-724. DOI:10.1094/MPMI-19-0711 |
Gouvea C M C P, Souza J F, Magelhaes M I S. 1997. NO-releasing substances that induce growth elongation in maize root segments[J]. Plant Growth Regul, 21(3): 183-187. DOI:10.1023/A:1005837012203 |
Hossain M A, Ye W, Munemasa S, et al. 2014. Cyclic adenosine 5'-diphosphoribose (cADPR) cyclic guanosine 3', 5'-monophosphate positively functionin Ca2+ elevation in methyl jasmonate-induced stomatal closure, cADPR is required for methyl jasmonate-induced ROS accumulation NO production in guard cells[J]. Plant Biol, 16(6): 1140-1144. |
Lamb C, Dixon R A. 1997. The oxidative burst in plant disease resistance[J]. Annu Rev Plant Physiol and Plant Mol Biol, 48: 251-275. DOI:10.1146/annurev.arplant.48.1.251 |
Miller B, Madilao L L, Ralph S, et al. 2005. Insect-induced conifer defense:white pine weevil and methyl jasmonate induce traumatic resinosis, de novo formed volatile emissions, and accumulation of terpenoid synthase and putative octadecanoid pathway transcript in Sitka spruce[J]. Plant Physiol, 137(1): 369-382. DOI:10.1104/pp.104.050187 |
Neill S J, Desikan R, Clarke A, et al. 2002. Hydrogen peroxide and nitric oxide as signalling molecules in plants[J]. J Exp Bot, 53(372): 1237-1247. DOI:10.1093/jexbot/53.372.1237 |
Pereira C S, Ribeiro J M L, Vatulescu A D, et al. 2011. Extensin network formation in Vitis vinifera callus cells in an essential and causal event in rapid H2O2-induced reduction in primary cell wall hydration[J]. BMC Plant Biol, 11(1): 106. DOI:10.1186/1471-2229-11-106 |
Tada Y, Mori T, Shinogi T, et al. 2004. Nitric oxide and reactive oxygen species do not elicit hypersensitive cell death but induce apoptosis in the adjacent cells during the defense response of oat[J]. Mol Plant Microbe Interact, 17(3): 245-253. DOI:10.1094/MPMI.2004.17.3.245 |
Vicente C S L, Nascimento F, Espada M, et al. 2012. Characterization of bacteria associated with pinewood nematode Bursaphelenchus xylophilus[J]. Plos One, 7(10): e46661. DOI:10.1371/journal.pone.0046661 |
Vivancos P D, Dong Y, Ziegler K, et al. 2010. Recruitment of glutathione into the nucleus during cell proliferation adjusts whole-cell redox homeostasis in Arabidopsis thaliana and lowers the oxidative defence shield[J]. Plant Journal, 64(5): 825-838. DOI:10.1111/tpj.2010.64.issue-5 |
Wang Z, Wang C Y, Fang Z M, et al. 2010. Advances in research of pathogenic mechanism of pine wilt disease[J]. Afr J Microbiol Res, 4(6): 437-442. |
Zhang X, Zhu Z, An F, et al. 2014. Jasmonate-activated MYC2 represses ETHYLENE INSENSITIVE3 activity to antagonize ethylene-promoted apical hook formation in Arabidopsis[J]. Plant Cell, 26(3): 1105-1117. DOI:10.1105/tpc.113.122002 |
 2018, Vol. 54
2018, Vol. 54

